È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
RNAi-mediato Knockdown Gene e
In questo articolo
Riepilogo
In questo protocollo si combinano RNAi-mediato silenziamento genico con un In vivo Test diuresi per studiare il colpo degli effetti dei geni di interesse ha sulla escrezione di liquidi zanzara.
Abstract
Questo protocollo video mostra una tecnica efficace per abbattere un particolare gene in un insetto e condurre un biotest romanzo per misurare il tasso di escrezione. Questo metodo può essere utilizzato per ottenere una migliore comprensione del processo di diuresi in insetti ed è particolarmente utile nello studio della diuresi nel sangue alimentazione artropodi in grado di raccogliere grandi quantità di liquido in un pasto di sangue singolo.
Questo RNAi-mediato knockdown gene combinato con un test in vivo diuresi è stato sviluppato dal laboratorio di Hansen per studiare gli effetti di RNAi-mediato knockdown di geni acquaporina sulla diuresi zanzara Aedes aegypti 1.
Il protocollo è configurato in due parti: la prima dimostrazione illustra come costruire un semplice dispositivo di iniezione zanzare e su come preparare ed iniettare dsRNA nel torace di zanzare per RNAi-mediato knockdown gene. La seconda dimostrazione illustra come determinaretassi di escrezione nelle zanzare utilizzando un saggio biologico in vivo.
Protocollo
Parte I - RNAi-mediato knockdown gene in adulti zanzare Aedes aegypti. Esperimento per una panoramica si veda la Figura 1.
1. dsRNA Sintesi
- Sintetizzare dsRNA specifici contro i geni di dsRNA di interesse e di controllo. Nota: Si consiglia di primer di sviluppo per frammenti PCR nell'intervallo di 300 a 500 coppie di basi situate all'estremità 3 'del cDNA specifico 2 e con la sequenza del primer T7 attaccata all'estremità 5' (5'-TAC TAA GAC TCA CTA TAG GG-3 '). Unicità dei frammenti deve essere confermata da analisi BLASTN 3.
- Utilizzare il Ambion Megascript T7 alta Kit Trascrizione Yield (Ambion, tabella dei reagenti) che utilizza T7 RNA polimerasi per la reazione di trascrizione di sintetizzare dsRNA. Nota: i reagenti e kit simili sono disponibili altrove.
- Per purificare dsRNA, precipitato con cloruro di litio seguendo le istruzioni fornite con il kit Megascript.
- Dopo purificatione, sciogliere il precipitato dsRNA in acqua sterile. Per assicurare un'adeguata viscosità per microiniezione, la concentrazione di dsRNA non deve superare 2 pg / pl.
2. Iniezione di preparazione
- Un semplice micro iniettore può essere costruito utilizzando tubi, forbici, un ago metallico, una siringa da 1 ml e 1 ml di plastica punta di pipetta (vedi Figura 2). Il tubo deve essere tagliato a ~ 40 cm di lunghezza. In alternativa, un sistema automatico micro iniettore può essere utilizzato come Drummond Nanojet II 4.
- Tagliare la punta della siringa (mozzo dell'ago) a segno 2 ml di scala e rimuovere la testa dello stantuffo di gomma lo stantuffo.
- Punch un buco con un ago metallico nella testa stantuffo in gomma e luogo la testa in gomma stantuffo nel mozzo dell'ago.
- Posizionare il mozzo dell'ago in un'estremità del tubo e inserire una punta di plastica 1 ml pipetta l'altra estremità, che verrà utilizzato come il boccaglio (in alternativa, uno ml 10 SYRinge può essere utilizzato per produrre la pressione necessaria per iniezione).
- Inserire un ago capillare di vetro nel foro nella testa gomma stantuffo e rompere la punta dell'ago off modo che la larghezza è abbastanza grande per liquido di fluire attraverso. Nota: La dimensione ottimale della punta dell'ago deve essere determinato empiricamente - se la larghezza dell'ago è troppo grande questo si tradurrà in trauma e un alto tasso di mortalità zanzara, se la larghezza è troppo piccola dell'ago, sarà impossibile penetrare l'esoscheletro zanzara.
- Immergere l'ago per iniezioni nel campione dsRNA preparato e prelevare il campione di liquido nella ago per l'iniezione aspirando il liquido con il boccaglio (o una siringa). Nota: Questo passo è identico per tutti i reagenti liquidi che vengono iniettate zanzare, compresi tampone PBS, che viene usato nel protocollo del test in vivo diuresi (vedi sotto).
3. Raccogliere e Anestetizzare zanzare
- Collect zanzare con un aspiratore a batteria in una fiala di raccolta. Mettere un coperchio sopra la fiala di raccolta e posizionare il flacone su una superficie pulita CO 2 pad per anestetizzare le zanzare. Nota: in alternativa le zanzare possono essere anestetizzati su ghiaccio.
4. Mosquito iniezione
- Aprire la fiala di raccolta e posizionare le zanzare direttamente sul CO 2 pad e attendere che le zanzare sono anestetizzati.
- Eliminare tutti i maschi.
- Allineare le zanzare sul lato per consentire un accesso più facile per l'iniezione.
- Prendete le zanzare per le gambe o le ali per evitare lesioni. È inoltre possibile utilizzare un pennello fine o piuma di manipolare le zanzare.
- Quando è possibile iniettare la zanzara prima, delicatamente sostenere un lato del torace con la pinza e inserire la punta dell'ago nell'altro lato del torace (Figura 2). E 'meglio iniettare in una porzione sottile della cuticola e non spingere l'agoO in profondità nel torace.
- Una volta che l'ago è in posizione, soffiare il liquido nella zanzara. La quantità desiderata può essere determinata monitorando il menisco del liquido in dell'ago. Il numero di millimetro necessarie per un volume specifico può essere determinata calcolando il volume del cilindro dell'ago capillare di vetro (πr 2 h). La quantità efficace di dsRNA che viene tipicamente utilizzato per l'iniezione è 1 ug.
- Una volta che il liquido viene iniettato in zanzara, accuratamente ritrarre l'ago. Se un grande forme liquide goccioline all'esterno del torace, la zanzara deve essere scartato. Poi, ripetere questo processo con la zanzara successiva.
5. Mosquito di recupero e conservazione
- Dopo l'iniezione, collocare le zanzare in un contenitore per la conservazione. Per esempio, una cera pinta allineati tazze di cartone (coppe zuppa) con maglia rivestimento fissato con il coperchio di cartone. Il coperchio ha una porzione ritagliata per la maglia che copre da esporre. Una volta che tutto il mosquitoes vengono inseriti nel contenitore, posizionare il contenitore in una camera ambiente controllato per incubazione e fornire le zanzare con una fonte di cibo, ad esempio 20% saccarosio batuffoli di cotone imbevuto poste sulla parte superiore del rivestimento maglia. Prima di eseguire il test in vivo diuresi, privare i dsRNA-iniettati zanzare di una sorgente di acqua per 12 ore per standardizzare lo stato di idratazione di ogni zanzara.
- L'efficienza di dsRNA-mediata knockdown gene può essere variabile. Silenziamento genico può iniziare 1 giorno dopo l'iniezione e potrebbe durare fino a 6 giorni dopo l'iniezione 4. Il tempo ottimale per raggiungere la massima knockdown gene deve essere determinati empiricamente per ogni gene utilizzato. In generale, noi aspettiamo 3 giorni dopo l'iniezione di dsRNA prima di procedere.
Parte II - In diuresi test in vivo in pazienti adulti zanzare Aedes aegypti
Nota: Questo protocollo è stato sviluppato dagli autori eutilizzato per la RNAi-mediato delle proteine knockdown acquaporina nella febbre gialla zanzara Aedes aegypti 1. Per evitare variabilità tra le singole zanzare, zanzare dovrebbero essere analizzati in gruppi. Per motivi tecnici, si consiglia di gruppi di 5 zanzare per il trattamento - non vi è una quantità limitata di tempo per eseguire la prima misurazione del peso prima di zanzare cominciano a espellere l'urina dopo l'iniezione.
6. Raccogliere e Anestetizzare zanzare
- Prima della raccolta delle zanzare, registrare il peso di una fiala di raccolta vuoto con un cappuccio con una bilancia analitica precisione. Questa fiala verrà utilizzato per tutte le misurazioni successive.
- Raccogli 5 zanzare femmine nella fiala di raccolta pesato con un aspiratore. Mettere il coperchio sopra la fiala di raccolta e lasciare riposare sul CO 2 pad per alcuni secondi per anestetizzare le zanzare.
7. Misurazione del peso iniziale
- Prendere tsi misura il peso iniziale delle zanzare 5 ponendo la provetta di raccolta contenente le zanzare con il tappo sulla bilancia di precisione.
- Calcolare il peso del gruppo di 5 zanzare prendendo il peso delle zanzare e la fiala di raccolta con tappo e sottraendo il peso del flacone con tappo insieme vuoto.
- Aprire la fiala di raccolta e posizionare le zanzare direttamente sul pad CO 2, dopo aver registrato il peso delle zanzare. Se le zanzare stanno cominciando a svegliarsi durante le misurazioni del peso, impostare la provetta sulla CO 2 pad per alcuni secondi prima di aprirlo e di immissione delle zanzare sul pad.
8. Iniezione di preparazione
- Impostare l'iniettore micro seguendo le istruzioni riportate nel protocollo di RNAi-mediato gene knockdown.
- Inserire un ago capillare di vetro nell'iniettore micro e rompere la punta dell'ago off modo che la larghezza è abbastanza grande per liquid a fluire attraverso.
- Immergere l'ago in tampone PBS e disegnare il buffer in l'ago di iniezione, l'importo desiderato da utilizzare per questo protocollo è di 1,25 microlitri di PBS per ogni zanzara. Nota: Questo importo imita la quantità media di plasma sanguigno, che è occupato da una zanzara femmina 5.
9. Mosquito iniezione
- Allineare le zanzare per consentire un più facile accesso con l'iniettore micro.
- Una volta che l'ago è a posto, soffiare tampone PBS nella zanzara.
- Una volta che il liquido viene iniettato nel zanzara, una gocciolina potrebbe formare all'esterno del torace. La goccia deve essere accuratamente rimossa prima del passaggio successivo.
- Ripetere questo processo di iniezione con la zanzara successiva. Con l'esperienza, il tasso di sopravvivenza zanzara sarà quasi del 100% dopo l'iniezione.
10. Le zanzare di pesatura
- Dopo l'iniezione, delicatamente posizionare le zanzare nella fiala di raccoltae cappuccio. Prendere la prima misurazione del peso dei 5 zanzare ponendo il flacone di raccolta contenente le zanzare con il tappo sulla bilancia di precisione.
- Calcolare il peso del gruppo di 5 zanzare prendendo il peso delle zanzare e la fiala di raccolta con tappo e sottrarre il peso del flacone con tappo insieme vuoto. Nota: le zanzare inizieranno a espellere urine entro 2 minuti dopo la rimozione dalla CO 2 pad l'anestesia, quindi è importante prendere la misura del peso prima di iniziare a espellere.
- Mettere le zanzare in un piccolo contenitore in cui cominceranno a espellere l'urina.
11. Misure secondo peso e successivi
Nota: Le misurazioni del peso delle zanzare dovrebbero essere prese in intervalli di 30 minuti, ma questo può essere regolato a intervalli più o meno lunghi a seconda del tassi di escrezione.
- Dopo 30 minuti, raccogliere il Group su 5 zanzare con un aspiratore nel flaconcino stessa collezione con tappo. Prendere la misura successiva peso delle zanzare ponendo il flacone di raccolta contenente le zanzare con il tappo sulla bilancia di precisione.
- Dopo la misurazione, posizionare le zanzare nel contenitore stessa azienda per i successivi 30 minuti.
- Ripetere questo processo per una quantità di tempo desiderato.
12. Determinazione Mosquito tasso di escrezione
- La quantità totale di liquido che è stato iniettato nel gruppo di 5 zanzare può essere calcolato sottraendo il peso iniziale delle zanzare dal peso immediatamente dopo l'iniezione.
- La quantità di urina che è stato espulso dal gruppo di zanzare in un punto temporale specifico può essere calcolato sottraendo il peso iniziale delle zanzare dal peso delle zanzare al punto temporale specifico.
- Il tasso di escrezione in un punto temporale specifico può essere calcolato dalla divisioneDing la quantità di urina escreta a questo punto tempo la quantità totale di liquido iniettato (Tabella 1).
13. Risultati rappresentativi
RNAi-mediato knockdown genica e la diuresi test in vivo sono stati utilizzati dal laboratorio di Hansen per studiare gli effetti di acquaporine della diuresi zanzara Aedes aegypti. Tre acquaporine che si esprimono in Aedes aegypti Malpighi tubuli sono stati abbattuti con effetti significativi sui tassi di escrezione rispetto al controllo delle zanzare 1. La figura 4 mostra i risultati rappresentativi di un esperimento in cui il test diuresi è stato utilizzato per confrontare i tassi di escrezione tra Aedes aegypti e Culex quinquefasciatus a temperature differenti.
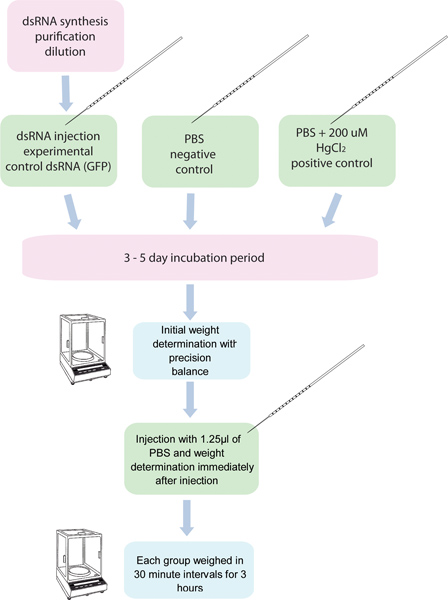
Figura 1. Diagramma di flusso del RNAi / diuresi test. 5 gruppi di 10 zanzare each sono iniettati con dsRNA per un gene specifico e altri cinque gruppi di dieci zanzare sono iniettati con controllo dsRNA. Un altro gruppo di zanzare iniettati con 200 pM in PBS HgCl 2 viene utilizzato come controllo positivo. Queste zanzare sono pesati prima dell'iniezione, e dopo l'iniezione in trenta intervalli di un minuto per 3 ore.
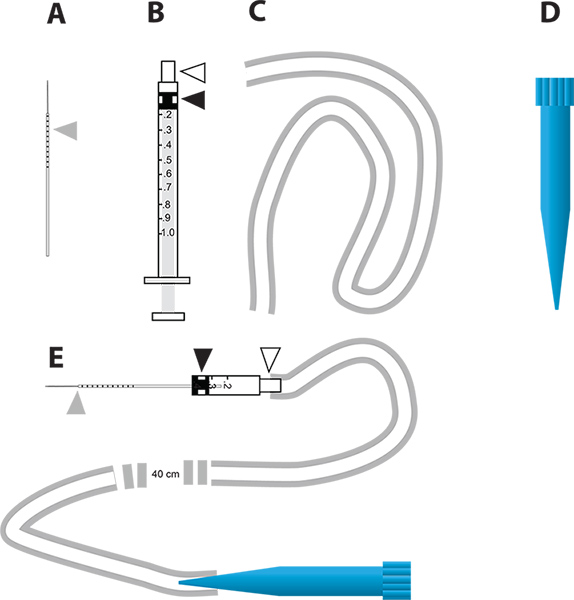
Figura 2. Un semplice dispositivo di iniezione micro per l'RNAi-mediato knockdown genica e test in vivo la diuresi. A. Gli aghi capillari di vetro utilizzato per l'iniezione. Il triangolo grigio rappresenta gli incrementi millimetri disegnati sull'ago per indicare la quantità di liquido iniettato nel zanzara. B. siringa da 1 ml utilizzato per costruire l'iniettore micro. Il triangolo bianco rappresenta il mozzo dell'ago e il triangolo nero rappresenta la testa dello stantuffo gomma attaccata allo stantuffo della siringa. C. Il tubo utilizzato per fissare il boccagliol'iniettore. D. 1 ml punta di pipetta monouso (punta blu) che viene utilizzato come il boccaglio del dispositivo microiniezione. E. Il dispositivo microiniezione che incorpora parti di AD. Clicca qui per ingrandire la figura .
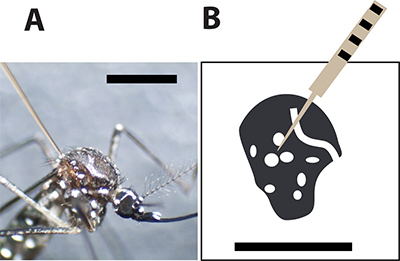
Figura 3. Ottimale al sito di iniezione zanzara. A. Female zanzara Aedes aegypti iniettato con un ago capillare di vetro tra le grandi scale sul torace. La barra nera indica 1 mm per comparazione delle taglie. B. Un disegno del torace zanzara femmina e le macchie bianche rappresentano le squame bianche l'esoscheletro zanzara. L'ago di iniezione deve perforare la zanzara tra i punti per ridurre al minimo tasso di mortalità durante l'iniezione.
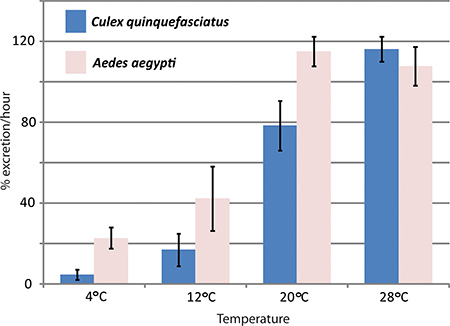
Figura 4. Effetti della temperatura su Culex quinquefasciatus e Aedes aegypti diuresi. diuresi Il saggio è stato eseguito con due specie di zanzare, Aedes aegypti e Culex quinquefasciatus, a diverse temperature. Il tasso di escrezione durante la prima ora dopo l'iniezione è data in percentuale.
| Gruppo | TARA (G) | non iniettato (G) | dopo l'iniezione (G) | 1h iniezione POST (G) | peso medio (mg) | quantità iniettata (Pl) | quantità escreta (Pl) | % Viene escreto |
| 1 | 7,5938 | 7,6057 | 7,6104 | 7,6096 | 2,38 | 0,94 | 0,16 | 17,0 |
| 2 | 7,8252 | 7,8349 | 7,8415 | 7,8403 | 1,94 | 1,32 | 0,24 | 18,2 |
| 3 | 7,8896 | 7,9026 | 7,9077 | 7,906 | 2,6 | 1,02 | 0,34 | 33,3 |
Tabella 1. Aedes aegypti nei risultati di test in vivo la diuresi. Dati grezzi dal test in vivo diuresi eseguito con le zanzare Aedes aegypti femmina a 4 ° C.
Discussione
Il protocollo utilizzato RNAi è stato sviluppato nel laboratorio di Alexander Raikhel presso la University of California Riverside 6,7 ed è simile a un protocollo pubblicato da Garver e Dimopoulos 4. L'approccio sperimentale mostrato in questo protocollo video possono essere utilizzati per studiare i geni coinvolti nella diuresi insetto in un ambiente in vivo. Gli organi escretori di insetti, i tubuli malpighiani, hanno attirato l'interesse di generazioni di ricercatori come un s...
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Gli autori ringraziano Victoria Carpenter per i suoi commenti critici di questo protocollo.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente o attrezzature | Azienda | Numero di catalogo | Comments |
| MEGAscript T7 Kit High Yield | Ambion, Inc. | AM1334 | |
| Tampone PBS | Sigma-Aldrich | P4417 | |
| Tubi in plastica | Rivenditore locale | PVC | |
| 1 ml di plastica della punta di pipetta | VWR | 83007-376 | Blu punta |
| 1 ml siringa | Becton, Dickinson and Company | 309602 | |
| Forbici | Rivenditore locale | ||
| Metallo ago | Carolina Biologicals | 654307 | Size 5 |
| Vola pad | Genesee Scientific | 789060 | |
| Alimentato a batteria Aspiratore w / collezione vial | Upma Labs | IPMM 2000 | |
| Pinza punta fine | Mondo Strumenti di precisione | 14095 | |
| Aghi di vetro capillari | Mondo Strumenti di precisione | 1B200-6 | |
| Dissezione microscopio stereo | Leica Microsystems | S6D | |
| Bilancia analitica di precisione | Mettler Toledo | AB54S | |
| Saccarosio | Sigma-Aldrich | 84097 | |
| Una pinta di cartone cerato tazze allineate | Rivenditore locale | Tazze di zuppa di Prodotto | |
| Delle maglie delle reti | Rivenditore locale | fly garza di plastica |
Riferimenti
- Drake, L. L., et al. The Aquaporin gene family of the yellow fever mosquito, Aedes aegypti. PloS one. 5, e15578 (2010).
- Shepard, A. R., Jacobson, N., Clark, A. F. Importance of quantitative PCR primer location for short interfering RNA efficacy determination. Analytical biochemistry. 344, 287-288 (2005).
- Altschul, S. F., et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic acids research. 25, 3389-3402 (1997).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A. gambiae). J. Vis. Exp. (5), e230 (2007).
- Clements, A. N. Volume 1 Development, Nutrition, and Reproduction. The Biology of Mosquitoes. 2, (1992).
- Hansen, I. A., Attardo, G. M., Park, J. H., Peng, Q., Raikhel, A. S. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny. Proceedings of the National Academy of Sciences of the United States of America. 101, 10626-10631 (2004).
- Hansen, I. A., Attardo, G. M., Roy, S. G., Raikhel, A. S. Target of rapamycin-dependent activation of S6 kinase is a central step in the transduction of nutritional signals during egg development in a mosquito. The Journal of biological chemistry. 280, 20565-20572 (2005).
- Pannabecker, T. Physiology of the Malpighian Tubule. Annual review of entomology. 40, 493-510 (1995).
- Dow, J. New insights into Malpighian tubule function from functional genomics. Comp Biochem Phys A. 150, S135 (2008).
- Dow, J. A. T. Insights into the Malpighian tubule from functional genomics. Journal of Experimental Biology. 212, 435-445 (2009).
- Lawson, D., et al. VectorBase: a data resource for invertebrate vector genomics. Nucleic acids research. 37, 583-587 (2009).
- Beyenbach, K. W. Transport mechanisms of diuresis in Malpighian tubules of insects. J. Exp. Biol. 206 (Pt 21), 3845-3856 (2003).
- Coast, G. M. Continuous recording of excretory water loss from Musca domestica using a flow-through humidity meter: hormonal control of diuresis. Journal of insect physiology. 50, 455-468 (2004).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585, 3507-3512 (2011).
- Hays, A. R., Raikhel, A. S. A novel protein produced by the vitellogenic fat body and accumulated in mosquito oocytes. Development Genes and Evolution. 199, 114-121 (1990).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon