È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento di cellule polmonari mouse dendritiche
In questo articolo
Riepilogo
Una preparazione altamente purificato di cellule dendritiche del polmone del mouse è descritto. Particolare enfasi è data l'isolamento delle tradizionali sottoinsieme delle cellule dendritiche.
Abstract
Le cellule dendritiche del polmone (DC) svolgono un ruolo fondamentale nel rilevamento invadendo 1,2 patogeni così come nel controllo della risposta tollerogeniche 3 nel tratto respiratorio. Almeno tre principali sottoinsiemi di cellule dendritiche del polmone sono stati descritti nei topi: convenzionale DC (CDC) 4, plasmacitoidi DC (PDC) 5 e la produzione di IFN-DC assassino (IKDC) 6,7. Il sottoinsieme CDC è il sottoinsieme DC più importanti nel polmone 8.
Il marcatore comune noto per identificare sottoinsiemi DC è CD11c, un tipo mi transmembrana integrina (β2), che si esprime anche sui monociti, macrofagi, neutrofili e alcune cellule B 9. In alcuni tessuti, utilizzando CD11c come marcatore per identificare il mouse DC è valido, come nella milza, dove la maggior parte delle cellule + CD11c rappresentano il sottoinsieme CDC che esprime alti livelli del complesso maggiore di istocompatibilità di classe II (MHC-II). Tuttavia, il polmone è un tessuto più eterogeneo dove esseresottoinsiemi lato DC, vi è un'alta percentuale di una popolazione di cellule distinte che esprime alti livelli di CD11c attacco bassi livelli di MHC-II. Sulla base della sua caratterizzazione e soprattutto sulla sua espressione di F4/80, un marcatore dei macrofagi della milza, il CD11c hi-MHC II popolazione di cellule del polmone lo è stato identificato come i macrofagi polmonari 10 e più recentemente, come un potenziale precursore DC 11.
In contrasto con il mouse pDC, lo studio del ruolo specifico del CDC nella risposta immunitaria polmonare è stata limitata a causa della mancanza di un marcatore specifico che potrebbe aiutare a l'isolamento di queste cellule. Pertanto, in questo lavoro, si descrive una procedura per isolare altamente purificato del mouse polmone CDC. L'isolamento di polmonare sottoinsiemi DC rappresenta uno strumento molto utile per acquisire conoscenze in funzione di queste cellule in risposta a patogeni respiratori così come i fattori ambientali che possono innescare la risposta immunitaria nei polmoni.
Protocollo
1. Perfusione polmonare e sospensione singola cellula
- Euthanize il mouse con un'iniezione intraperitoneale di ketamina / xylazina miscela anestetico (in mg / mouse ketamina 1,8, xilazina 0,19) e dissanguamento attraverso la vena femorale
- Esporre la cavità toracica da taglio e delicatamente tirando indietro la pelle esterna del peritoneo. Procedere per aprire il diaframma tagliando la gabbia toracica per esporre sia il cuore ei polmoni.
- Profumato delicatamente i polmoni usando una siringa da 5 ml riempito con EDTA-HBSS (1 mM EDTA di calcio / magnesio senza HBSS). Collegare un 25 ago G e inserire l'ago nel ventricolo destro. Per evitare perdite durante l'iniezione, fissare il tessuto miocardio intorno all'ago utilizzando pinze. Delicatamente iniettare la soluzione, pur mantenendo una pressione costante. Perfusione accurata si tradurrà in inflazione al polmone e un cambiamento di colore rosa / bianco.
- Rimuovere linfonodo drenante per eliminare qualsiasi potenziale contaminazione da questo tessuto.
- Raccoglieretessuto polmonare, trasferimento in una capsula di Petri sul ghiaccio, e tagliare a piccoli pezzi con una lama di rasoio.
- Trasferimento di tessuto a terra in un tubo gentleMACS C contenente 5 ml / polmone di soluzione collagenasi digestione (collagenasi tipo 1A 0,5 mg / ml, più di tipo IV bovina pancreatica DNasi 20 mg / ml in HBSS contenente il 5% FBS, 100 U / ml di penicillina e 100 mcg / ml streptomicina).
- Utilizzare il dissociatore gentleMACS per ottenere una sospensione singola cella. Scegli il programma: m_lung_01. Incubare campione a 37 ° C per 30 minuti. Agitare tubo ogni 5 minuti per risospendere frammenti di tessuto. Procedere con m_lung_02 programma.
- Trasferimento del campione ad un tubo da 15 ml e centrifugare per 10 minuti a 335 x g a 4 ° C. Dopo questo passo, conservare tutti i reagenti e centrifugazioni a 4 ° C per evitare una riduzione della vitalità delle cellule.
- Gettare il surnatante e lisare restanti globuli rossi con l'aggiunta di 2 ml di tampone di lisi ACK per 1 minuto a temperatura ambiente. Lavare le cellule con 13ml di BSA freddo PBS/0.5% e centrifugare per 10 minuti a 335 x g a 4 ° C.
- Gettare il surnatante, risospendere le cellule totale in 5 ml di BSA freddo PBS/0.5% e passare un approfondito e 100 mesh di nylon micron.
- Determinare il numero totale delle cellule utilizzando trypan esclusione colorante blu.
2. Isolamento magnetico e CD11c + arricchimento delle cellule
- Centrifugare sospensione singola cella per 10 minuti a 200 g a 4 ° C e scartare il surnatante.
- Risospendere il pellet cellulare in 400 ml di tampone di separazione (PBS, 0,5% di BSA, e 2 mM EDTA) per 10 8 cellule totali. Blocca Fc-mediata anticorpo aspecifico legame utilizzando anti-CD16/CD32 anticorpi (0.5μg / 10 6 celle) per 30 minuti a 4 ° C.
- Lavare le cellule con 10 ml di tampone di separazione a freddo e centrifugare per 10 minuti a 200 g a 4 ° C. Risospendere le cellule in 400 l di tampone di separazione.
- Aggiungere 100 ml di microsfere CD11c al 10 8 totale. Mescolare bene e incubare per 15 minuti in frigorifero (2-8 ° C).
- Lavare le cellule con 10 ml di tampone di separazione a freddo e centrifugare per 10 minuti a 200 g a 4 ° C e scartare il surnatante.
- Risospendere il pellet cellulare in 3 ml di tampone di separazione a freddo.
- Eseguire separazione magnetica utilizzando il autoMACS Pro separatore TM selezionando il posseld programma. Raccogliere la frazione positiva (0,5 ml).
3. Cellule dendritiche convenzionale (CDC) isolamento
- Incubare arricchito CD11c sospensione cellulare positivo con anti-CD11c PE-Cy7 e anti-IA/IE (MHC-II)-FITC anticorpi per 30 minuti a 4 ° C. Concentrazione ottimizzata di anticorpi è di 0,5 mcg / 10 6 delle cellule.
- Lavare le cellule con il freddo BSA PBS/0.5% e centrifugare per 10 minuti a 335 x g a 4 ° C. Risospendere le cellule in 0,5 ml di PBS/0.5% BSA e passarli attraverso una maglia di nylon 40 micron.
- Procedere allaordinare le celle utilizzando il FACS sorter Aria cellulare in modalità purezza. Aggiungere 100 ml di PBS/0.5% BSA ai tubi di raccolta al fine di prevenire i danni delle cellule purificate. Tenere le cellule ad una temperatura refrigerata per tutto il processo di separazione delle cellule.
4. Protocollo alternativo per ottenere una sospensione singola cellula e CD11c + arricchimento delle cellule
- In sostituzione del dissociatore gentleMACS, tessuto polmonare a terra a partire dal punto 1.5 può essere trasferito ad un tubo da 15 ml contenente 5 ml di soluzione di collagenasi al polmone e incubare per 1 ora a 37 ° C. Vortex cellule ogni 15 minuti per risospendere frammenti di tessuto. A distruggere il tessuto passando 6-8 volte il campione dentro e fuori attraverso una siringa da 3 ml, collegato ad un ago 20 G. Evitare di fare bolle durante il processo, altrimenti la vitalità cellulare sarà compromessa. Una volta sospensione singola cellula si ottiene, passare alla fase 1.8.
- In sostituzione del TM AutoMACSPro separazionetor, l'isolamento magnetico per l'arricchimento delle cellule CD11c, può essere eseguita anche facendo passare la sospensione cellulare manualmente attraverso due colonne MACS. La selezione delle colonne appropriato varia a seconda della dimensione del campione.
5. Rappresentante dei risultati:
Polmone CDC sono identificati come CD11c hi / MHC-II popolazione cellulare hi. Come mostrato in fig. 1, CDC rappresentano una percentuale minore del 1,4% rispetto ad alcuni altri tessuti come milza (4,8%). Tuttavia, a differenza di milza, polmone cellule CD11c positivo esprimere diverse quantità di MHC-II, tra cui una popolazione di cellule diverso da quello di CDC. Dopo la cella singola preparazione, la resa di cellule polmonari totale era di circa 3,0-3,8 x 10 7 cellule / polmonare con una vitalità del 60-70%, da cui poco più dell'1% rappresentato sottoinsieme CDC. Questa percentuale è aumentata dopo l'isolamento CD11c magnetico in cui è stato incrementato il totale del polmone CDC circa 10 tIME (> 16%) rispetto al preparato originale (Fig. 2A). Tuttavia, le cellule che esprimono CD11c basse quantità di MHC-II (CD11c hi / lo MHC-II, macrofagi) ha rappresentato una popolazione di cellule ad alta contaminazione (> 70%) che è stato mescolato con il sottoinsieme polmone CDC. Come mostrato in fig. 2B, queste cellule sono stati eliminati dopo la fase di separazione delle cellule quando la purezza CDC ha raggiunto> 96%. Il rendimento abituale di CDC, dopo l'intera procedura è stata di 5 x 10 4 cellule / polmone. Microfotografie mostrare caratteristiche morfologiche di CDC come cellule arrotondate con i dendriti tipico (pannello superiore). D'altra parte, CD11c hi / MHC-II lo ha rappresentato un sottoinsieme morfologicamente differente che mostra protuberanze cellulari che sono tipici di macrofagi (MΦ, pannello inferiore) 12.
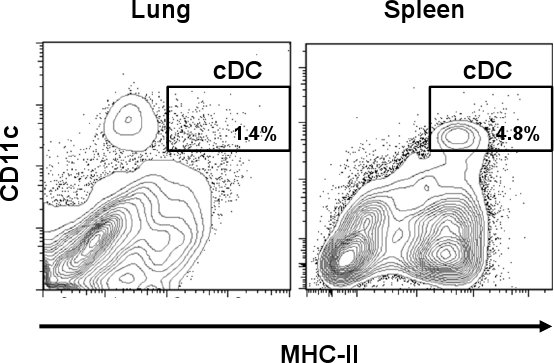
Figura 1. Differenziale frequenza DC nel polmone del mouse e della milza. Polmone unomilza tessuti da C57BL ° / 6 topi sono stati raccolti e trattati con collagenasi. A seguito di digestione collagenasi, le cellule sono state colorate con anticorpi anti-mouse CD11c-PE-Cy7 e anti-topo IA / IE-FITC. Rappresentante trame citometria a flusso mostrano percentuali di CDC (CD11c hi / MHC-II hi) nei polmoni e nella milza.
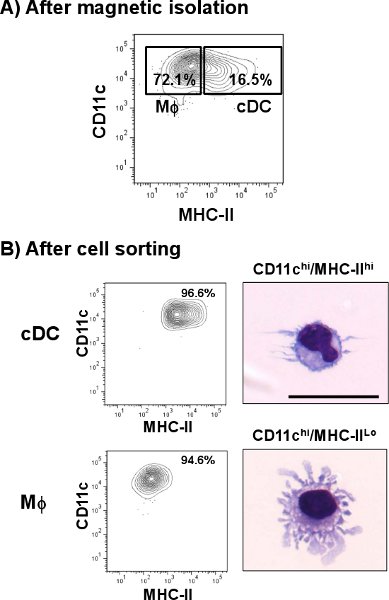
Figura 2. Isolamento di CDC dal polmone del mouse. Polmone del mouse sospensione cellulare è stato etichettato con anti-CD11c microsfere e passato attraverso un separatore cellulare automatico. A) Un grafico rappresentante mostra le percentuali di CDC (CD11c hi / MHC-II hi) e macrofagi (MΦ, CD11c hi / MHC-II lo) le popolazioni dopo arricchimento CD11c. Ulteriori colorazione della frazione arricchita seguita con anti-topo CD11c-PE-Cy7 e anti-topo IA / IE-FITC. Doppia cellule positive erano ordinati e analizzati mediante citometria a flusso. Aidentificare i loro morfologia, le cellule sono state cytospun e tinto con un Wright-Giemsa colorazione modificato. B) Rappresentante trame mostrano percentuali di CDC e MΦ dopo l'ordinamento delle cellule. Microfotografie mostrare una immagine rappresentativa del polmone CDC e MΦ polmone. Barra di scala = 20 micron.
Discussione
Isolamento dei polmonare topo DC è una tecnica importante per lo studio di una vasta gamma di stimoli respiratori. Il processo per ottenere queste cellule include passaggi critici che impediscono la perdita di cellule così come la vitalità cellulare e la purezza. Perfusione del polmone prima della raccolta contribuirà a eliminare eventuali cellule periferiche e ridurre eritrociti contaminante. L'utilizzo della dissociazione automatico può essere advanteogus quando un gran numero di polmoni vengono gestiti, altr...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare per Marilyn Dietrich presso l'impianto di core LSU Citometria a flusso per il suo aiuto con la separazione delle cellule e Peter Mottram per la sua assistenza con il microfotografie. Questo lavoro è stato finanziato dal Assistente di volo Medical Research Institute, l'LSU-competitivi Premio programma di ricerca, e il NIH / NIAID Borse P20 RR020159 e R03AI081171.
Materiali
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
| Lisi buffer di ACK | Invitrogen | D6-0005DG | |
| Anti-topo CD11c (HL3) | BD Pharmingen | 5580979 | PE-Cy7 coniugato |
| Anti-topo IA / IE (269) | BD-Pharmingen | 553623 | Coniugato con FITC |
| Collangenase tipo 1A | Sigma | 9891-500mg | |
| Cellula filtri | BD Falcon | 352340, 352360 | |
| CD11c (N418) microsfere | Miltenyi | 130-052-001 | |
| DNasi I | Sigma | D5025-150KU | |
| Sale di Hank soluzione equilibrata | Invitrogen | 14170 | |
| Hepes soluzione tampone | Invitrogen | 15630 | |
| Piastre di Petri 60 millimetri | BD Falcon | 351016 | |
| GentleMACS ™ C tubi | Miltenyi | 130-093-237 | |
| Gentle MACS dissociatore | Miltentyi | 130-093-235 | |
| AutoMACS-Pro ™ | Miltenyi | 130-092-545 | |
| FASCS Aria | BD |
Riferimenti
- Pulendran, B., Palucka, K., Banchereau, J. Sensing pathogens and tuning immune responses. Science. 293, 253-256 (2001).
- Banchereau, J. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Manicassamy, S., Pulendran, B. Dendritic cell control of tolerogenic responses. Immunol. Rev. 241, 206-227 (2011).
- Steinman, R. M., Cohn, Z. A. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J. Exp. Med. 137, 1142-1162 (1973).
- Asselin-Paturel, C. Mouse type I IFN-producing cells are immature APCs with plasmacytoid morphology. Nat. Immunol. 2, 1144-1150 (2001).
- Chan, C. W. Interferon-producing killer dendritic cells provide a link between innate and adaptive immunity. Nat. Med. 12, 207-213 (2006).
- Taieb, J. A novel dendritic cell subset involved in tumor immunosurveillance. Nat. Med. 12, 214-219 (2006).
- Guerrero-Plata, A., Kolli, D., Hong, C., Casola, A., Garofalo, R. P. Subversion of pulmonary dendritic cell function by paramyxovirus infections. Journal of Immunology. 182, 3072-3083 (2009).
- Larson, R. S., Springer, T. A. Structure and function of leukocyte integrins. Immunol. Rev. 114, 181-217 (1990).
- Sung, S. S. A major lung CD103 (alphaE)-beta7 integrin-positive epithelial dendritic cell population expressing Langerin and tight junction proteins. J. Immunol. 176, 2161-2172 (2006).
- Wang, H. Local CD11c+ MHC class II- precursors generate lung dendritic cells during respiratory viral infection, but are depleted in the process. J. Immunol. 177, 2536-2542 (2006).
- Bhatia, S. Rapid host defense against Aspergillus fumigatus involves alveolar macrophages with a predominance of alternatively activated phenotype. PLoS One. 6, e15943-e15943 (2011).
- Shao, Z., Makinde, T. O., McGee, H. S., Wang, X., Agrawal, D. K. Fms-like tyrosine kinase 3 ligand regulates migratory pattern and antigen uptake of lung dendritic cell subsets in a murine model of allergic airway inflammation. J. Immunol. 183, 7531-75381 (2009).
- Hao, X., Kim, T. S., Braciale, T. J. Differential response of respiratory dendritic cell subsets to influenza virus infection. J. Virol. 82, 4908-4919 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon