È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Metodi per lo studio della morfogenesi neuronale:
In questo articolo
Riepilogo
Per condurre una rapida valutazione della funzione dei geni nello sviluppo della corteccia cerebrale, si descrivono i metodi che comportano l' Ex vivo plasmidi di co-espressione inibitoria RNA (RNAi) e GFP in murino corteccia embrionale. Questo protocollo è suscettibile allo studio dei vari aspetti della sviluppo neurologico, quali la neurogenesi, la migrazione neuronale e la morfogenesi neuronale compresi dendrite e l'estensione assonale.
Abstract
La corteccia cerebrale dirige funzioni cognitive superiori. Questa sei struttura a strati è generata in un dentro-prima, fuori-ultimo modo, in cui i neuroni primi nati rimanere più vicino al ventricolo, mentre gli ultimi neuroni nati migrare passato i primi neuroni nati verso la superficie del cervello 1. Oltre alla migrazione neuronale 2, un processo chiave per la normale funzione corticale è la regolazione della morfogenesi neuronale 3. Mentre morfogenesi neuronale può essere studiato in vitro in colture primarie, c'è molto da imparare dal modo in cui questi processi sono regolati in ambienti tessuti.
Descriviamo le tecniche per analizzare la migrazione neuronale e / o morfogenesi in fette organotipiche della corteccia cerebrale 4,6. Un vettore pSilencer modificato viene utilizzato, che contiene sia un promotore U6 che guida l'RNA a doppio filamento tornanti e una cassetta di espressione separato che codifica la proteina GFP guidato bya CMV promoter 7-9. Il nostro approccio consente per la valutazione rapida dei difetti nella crescita dei neuriti su knockdown specifico di geni candidati ed è stato utilizzato con successo in uno schermo per i regolatori di crescita dei neuriti 8. Poiché soltanto un sottoinsieme di cellule esprimono i costrutti RNAi, le fette organotipiche permettere un'analisi mosaico dei fenotipi potenziali. Inoltre, poiché questa analisi è fatta in approssimazione nei pressi del ambiente in vivo, si fornisce un basso costo e rapida alternativa alla generazione di animali transgenici o knockout per geni di funzione sconosciuta corticale. Infine, in confronto con la tecnologia di elettroporazione in vivo, il successo di esperimenti ex vivo elettroporazione non dipende sviluppo abile capacità chirurgico e può essere eseguita con un tempo più breve di formazione e di abilità.
Protocollo
1. Preparazione Solutions cultura e dei media (non in video)
- Preparare 1 litro di soluzione salina equilibrata di Hank completa (HBSS) contenente HBSS 1x, 2,5 mM di HEPES (pH 7,4), 30 mM D-glucosio, 1 mM CaCl 2, 1 mM MgSO 4 e 4 mM NaHCO 3. Aggiungere acqua bidistillata (DDH 2 O). Filtrare sterilizzare con un filtro 0,2 micron e conservare a 4 ° C.
- Preparare terreno di coltura sezione utilizzando 35 ml di Basal Medio Aquila supporti, 12,9 ml di HBSS completi, 20 mM D-glucosio (1,35 mL di soluzione 1 M), 1 mM Glutamax (0,25 mL di una soluzione 200 mM), 0,5 ml di penicillina -streptomicina magazzino 100x. Filtrare sterilizzare con un filtro da 0,2 um-, quindi aggiungere inattivato al calore siero di cavallo ad una concentrazione finale del 5%.
- Preparare la soluzione laminina lavorare facendo un 1 mg / mL di soluzione stock Laminin con acqua distillata sterile deionizzata. Preparare aliquote di 100 microlitri di 0.5 ml provette Eppendorf e congelare a -80 ° C.
- Preparare Poly-L-lisina di lavoro cosìluzione aggiungendo 5 ml di H 2 O sterile a 5 mg di poli-L-lisina per fare un 1 mg / ml di soluzione concentrata. Preparare aliquote di 1 ml e congelare a -20 ° C.
- Preparare la soluzione di rivestimento diluendo 1 ml di poli-L-lisina e 100 pl di laminina ad un volume finale di 12 mL con acqua sterile. Rendere questa soluzione fresca ogni volta.
2. Preparazione Inserti Slice organotipiche (non in video)
- Preparare due a sei pozzetti con un inserto per la cultura e l'uso di pinze sterili. Aggiungere 2 ml di soluzione sterile ddh 2 O sotto gli inserti culturali.
- Aggiungere 1 mL della soluzione di rivestimento sulla parte superiore della membrana facendo attenzione a non forare la membrana. Incubare per una notte in un incubatore umidificato a 37 ° C e 5% CO 2.
- Rimuovere i supporti di rivestimento e lavare la membrana con sterili H 2 0 tre volte. Lasciate che inserisce a secco prima dell'uso. Aggiungere 1,8 mL di terreno fetta cultura e luogo nel 37 ° C incubatore. Avvolgere le piastre utilizzate con Parafilme conservare a 4 ° C per un massimo di 4 settimane.
3. Preparazione per l'elettroporazione (non in video)
- Preparare costrutti RNAi per l'elettroporazione. Doppia elica inserti forcina RNA sono stati clonati in un vettore pSilencer. Le Contiene plasmide: 1) un promotore che pilota l'U6 doppio filamento RNA generazione, e 2) una cassetta di espressione GFP guidata dal promotore CMV 8,9. Questo plasmide è stato precedentemente descritto da Konishi e colleghi 9 e altri 7,8. I plasmidi sono stati purificati utilizzando una maxi-prep kit Qiagen, e usato ad una concentrazione di 1 mg / mL.
- Al fine di visualizzare il DNA mentre iniettando, preparare una soluzione 0,5% veloce colorante verde e utilizzarlo a 1:20 con il DNA da iniettare (di solito 20 pl di DNA con 1 pl di verde veloce). Rimasto DNA-veloce miscela colorante verde può essere conservato a -20 ° C per una settimana.
- Dissezione Pulire l'area, dissectistrumenti ng e vasi vibratomo con il 70% di etanolo. Raffreddare HBSS completi in modo che sia ghiacciato. Freddo nave vibratomo da imballaggio ghiaccio intorno all'interno della vibratomo con un pò d'acqua per il raffreddamento rapido. Preparare 3% agarosio a basso punto di fusione con HBSS completi. Microonde per 1 min. Evitare di ebollizione. Conservare in un bagnomaria a 42 ° C fino al momento dell'uso.
- Parametri di elettroporazione sono fissati come segue. Per un embrione E15 uso 35 V, 5 impulsi di lunghezza, 100 ms, 900 ms intervallo tra gli impulsi. Per animali più vecchi, per garantire elettroporazione, utilizzare una tensione più elevata fino a 50 V o aumentare il numero di impulsi massimo di 8 impulsi. Per evitare di danneggiare il tessuto in animali giovani, utilizzare impulsi o meno o fino a 2 legumi e bassa tensione fino a 25 V. Questi parametri possono essere variati e determinata empiricamente in base all'età dell'animale.
4. Dissezione ed elettroporazione (in video)
- Dopo l'eutanasia una femmina incinta, sezionare embrioni fuori nel freddo ghiaccio HBSS completi. Keep ogni embrione nei loro sacchi individuali placentari.
- Dissect embrione fuori e tagliare la testa dopo la prima vertebra. Tenere in ghiaccio HBSS freddi completi.
- Per l'iniezione, posizionare la testa su un pezzo di Parafilm su una capsula di Petri. Utilizzando misura Hamilton siringa (vedi tabella I) iniettare circa 6 a 8 microlitri di DNA: veloce mix colorante verde attraverso il terzo ventricolo al fine di colmare in entrambi i ventricoli laterali nelle vescicole corticali. Alternativamente, l'iniezione può essere fatto direttamente in ciascun ventricolo laterale.
- Per l'elettroporazione in vivo ex, utilizzare BTX-pinzette elettrodi di platino. Posizionare l'elettrodo positivo verso il lato della corteccia che si desidera elettroporare all'inizio cioè della testa per corteccia dorsale.
- Dopo elettroporazione, incubare le teste sul ghiaccio per almeno 5 minuti prima dissezione.
- Dissect cervello in HBSSby ghiacciata una piccola incisione sul lato della testa e pelatura la pelle fuori dai lati della testa. Successivamente, conpinza sottile delicatezza staccarsi la pia dal cervello. Togliere il cervello intatto dal cranio, facendo attenzione a non danneggiare la corteccia.
5. Incorporare e sezionamento delle cortecce elettroporate (in video)
- Trasferire 3% agarosio a basso punto di fusione in uno stampo grande posti su ghiaccio. Il fondo dello stampo inizia a solidificare rapidamente che impedirà cervelli di affondare fino al fondo dello stampo. Delicatamente, trasferire il cervello con le pinze sottili ad uno ad uno dopo aver tolto il tampone in eccesso con un Kimwipe o carta da filtro. Utilizzare una punta di 10 microlitri pipetta a girare il cervello all'interno dello stampo per garantire la massima interfaccia tra il agarosio e tessuto cerebrale.
- Orientare i cervelli per garantire che tutti i cervelli sono nello stesso orientamento e circa allo stesso livello del agarosio. Lasciate che l'agarosio solidificare per circa 5 min. Utilizzare incollaggio (crazy colla) per fissare i blocchi di agarosio in modo che i bulbi olfattivi sono in piedi. Una volta che i blocchi sono collegati, subito aggiungere ice HBSS freddo e tagliare il agarosio per assicurarsi che le singole sezioni sono ottenuti per ogni cervello.
- Per tagliare i blocchi, impostare la velocità della vibratomo a una bassa velocità (circa la metà del massimo) e impostare la frequenza di vibrazione della lama alla massima regolazione. Genera fette spesse 250 micron coronali. Recuperare le fette con una spatola piegata fine e trasferirli ai pozzi dei tessuti con un pennello fine o forcipe.
- Nel cofano di coltura di tessuti, trasferire fette in inserti patinati. Aggiungere 500 microlitri di terreni di coltura porzione per ogni inserto per rendere il facile trasferimento. Fino a 5 fette possono essere inseriti per inserto. Rimuovere supporti in eccesso dalla parte superiore delle fette e incubare a 37 ° C in incubatore umidificato.
6. Cultura e Analisi delle fette organotipiche (in video)
- Per mantenere fette sani, mezzi freschi deve essere aggiunto almeno ogni altro giorno sotto la membrana sostituendo metà dei mezzi ogni volta.
- Per analizzare fette dopo la desired giorni in coltura, fissare le fette nella membrana. Lavare con 1x tampone fosfato salino (PBS) a 37 ° C per tre volte per 10 minuti ogni volta. Successivamente, fissare con 4% paraformaldeide (PFA) notte a 4 ° C o per 1 ora a temperatura ambiente.
- Fette possono essere analizzati con diversi marcatori cellulari o colorati con Hoechst solo per visualizzare cellule elettroporate e non elettroporata. Permeabile e bloccare fette per 2 ore a temperatura ambiente con siero di capra 10%, 0,1% Triton in PBS 1x con agitazione delicata.
- Colorazione con Hoechst per 1 ora a temperatura ambiente, lavate 3 volte con PBS 1x 10 minuti ogni volta con agitazione delicata.
- Per montare fette tagliare la membrana con un bisturi, e utilizzare una pinza sottile per trasferire la membrana contenente fette di un vetro smerigliato scorre in una camera d'acqua. Fino a 5 fette può essere posizionato per vetrino. Eliminare l'acqua in eccesso, e aggiungere una goccia di soluzione Flourmount ad ogni fetta cervello. Posizionare delicatamente un coprioggetto sopra le fettine di cervello e di rimuovere uny bolle d'aria. Analizzare fette utilizzando un microscopio confocale.
7. Paraffina Embedding Alternative di Slices organotipiche (non in video)
- Fette organotipiche può anche essere incorporato per paraffina per l'analisi morfologica più fine, a tal fine la membrana contenente le fette organotipiche possono essere fissati in 4% PFA come descritto sopra.
- Le fette fissi sono incorporati in% agarosio 1 (pre-riscaldato a 37 ° C), e solidificato in ghiaccio per 30 min. I blocchi di agarosio possono quindi essere post-fissate in PFA 4% a 4 ° C per 30 min.
- Il blocco agarosio contenente la fetta organotipica verrà quindi inclusi in paraffina e trattati per immunofluorescenza come descritto in precedenza 10.
8. Risultati rappresentativi
Una rappresentazione schematica del elettroporazione di corteccia murina e cultura di fette organotipiche è mostrato in Figura 1. Questo metodo è utile per una strategia rapid valutazione della funzione di geni coinvolti nello sviluppo neuronale 11. A seconda della quantità di DNA elettroporata e lo stadio embrionale elettroporazione, l'efficienza di transfezione varierà. Fette inizierà esprimere GFP almeno 8 ore post-elettroporazione e le cellule saranno sottoposti alla normale sequenza di eventi neurogenica (proliferazione, la migrazione, e all'inizio la differenziazione neuronale) nella cultura. La figura 2 mostra una fetta elettroporate cervello che sta esprimendo un controllo pSilencer-GFP vettoriale e si può osservare progenitori neuronali, i neuroni che migrano e neuroni differenziati in slice. Fette organotipiche mantengono la loro morfologia finché sono mantenute in un buon supporto aria interfaccia e le membrane possono essere utilizzate fino ad almeno 5 giorni di coltura.
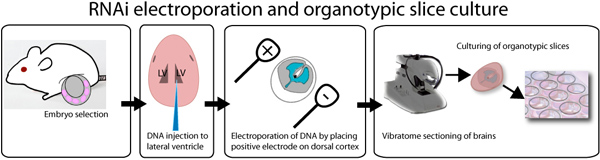
Figura 1. Illustrazione di elettroporazione in vivo e ex fetta organotipicala cultura del saggio. E14.5 embrioni sono sezionati, e individualmente iniettati con DNA mescolato con veloci colorante verde per visualizzare il sito di iniezione. Il DNA può essere iniettato in entrambi i ventricoli laterali come illustrato nella figura o nel terzo ventricolo per riempire i ventricoli laterali. Dopo l'iniezione, i cervelli sono elettroporate con un elettroporatore onda quadra, ponendo l'elettrodo positivo sul lato desiderato del cervello. Brains sono incorporati in 3 agarosio a basso punto di fusione% e sezionato usando un vibratomo. 250 fettine di cervello micron sono immessi sul inserti 0,4 micron e coltivati fino ad una settimana. GFP può essere osservato dopo 8 ore dopo la trasfezione.
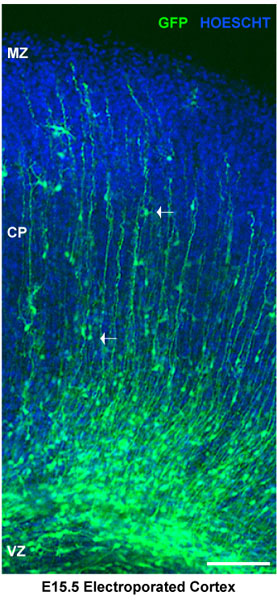
Figura 2. Analisi delle fettine di cervello elettroporate. Fettine di cervello elettroporate sono state colorate per Hoescht. Corteccia dorsale mostra elettroporate progenitori neuronali nella zona ventricolare (VZ). I neuroni in cortical piastra (cp) sono delimitate dalla zona marginale (MZ). Le frecce bianche indicano i neuroni che migrano. In questo caso, i cervelli sono stati iniettati a E15.5 e elettroporata con un vettore pSilencer controllo GFP. Le sezioni rappresentano espianti corticali 4 giorni dopo l'elettroporazione. Scale bar 100 micron.
Risoluzione dei problemi:
- Bassa efficienza di trasfezione: Regolare la concentrazione del DNA usato per almeno 1 mg / pl. Usare sempre il DNA molto pulito da una preparazione maxi se necessario utilizzare uno endo-free Quiagen kit per purificare il DNA.
- Cellule trasfettate in un'area del cervello diversa da quella desiderata: garantire che gli elettrodi siano posizionate correttamente con la posizione di elettrodo positivo verso il lato del cervello da elettroporazione.
- Fette organotipiche perdere morfologia: i media cambiano ogni giorno e assicurare le fette non sono galleggianti in media
- Fette staccarsi agarosio mentre vengono tagliati in vibratome: Assicurarsi che una buona interfaccia è fatto quando si incorpora i cervelli in agarosio a basso punto di fusione.
Access restricted. Please log in or start a trial to view this content.
Discussione
Questi metodi che comportano l'elettroporazione ex vivo di plasmidi che codificano RNA a doppio filamento tornanti 8 e cultura della organotipiche 4 fette di fornire diversi vantaggi. In primo luogo, questi metodi consentono una rapida valutazione di RNAi derivati fenotipi. L'inclusione di una codifica GFP cassetta di espressione nel vettore pSilencer stesso che contiene il promotore U6 che guida la forcina RNA a doppio filamento consente una rapida identificazione e caratter...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Ringraziamo il Dott. Shirin Bonni per la fornitura del pSil-GFP costrutto, Dr. Alper Uzun per l'illustrazione della figura 1, e la struttura Bioimmagini Leduc per la microscopia confocale. EMM è sostenuta dal Premio alla Carriera per la scienza medica dalla Burroughs Wellcome Fund, un NARSAD Premio Giovani Ricercatori e NIH NCRR COBRE RR018728 P20-01. SBL è supportato dal NIH NCRR COBRE RR018728 P20-01, ed ha ricevuto il sostegno PHS NRSA 5T32MH019118-20.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| Hamilton siringa | HAMILTON | 80008 | 31 gauge, 0,5 centimetri di lunghezza, PT-4 (livello di smussatura punto), volume 10 pl |
| Platinum tweezertrodes | BTX | 45-0489 | Size 5 millimetri |
| ECM830 elettroporatore | BTX | 45-0002 | |
| BTX Footswitch | BTX | 45-0208 | Per l'utilizzo con ECM830 elettroporatore |
| Vibrante microtomo blade | LEICA | VT1000 S | |
| 6 - piatto bene da utilizzare con inserti | FALCON | 353502 | Contiene tacche per adattarsi inserti |
| Coltura tissutale inserti | FALCON | 353090 | 0,4 micrometri |
| Fast Green | SIGMA | F7252 | |
| Bassa fusione Agarose | FISHER | BP165-25 | DNA grade |
| Laminina | Sigma-Aldrich | L2020 | |
| Poly-L-lisina | Sigma-Aldrich | P5899 | |
| Basale medio Aquila | Sigma Aldrich | B-1522 | |
| HBSS 10x senza Ca e Mg | GIBCO | 14180-046 | |
| HEPES acid-free | Sigma-Aldrich | H4034 |
Riferimenti
- Angevine, J. B. Jr, Sidman, R. L. Autoradiographic study of cell migration during histogenesis of cerebral cortex in the mouse. Nature. 192, 766-766 (1961).
- Kriegstein, A. R., Noctor, S. C. Patterns of neuronal migration in the embryonic cortex. Trends Neurosci. 27, 392-392 (2004).
- Barnes, A. P., Polleux, F. Establishment of axon-dendrite polarity in developing neurons. Annu. Rev. Neurosci. 32, 347-347 (2009).
- Haydar, T. F., Bambrick, L. L., Krueger, B. K., Rakic, P. Organotypic slice cultures for analysis of proliferation, cell death, and migration in the embryonic neocortex. Brain Res. Brain Res. Protoc. 4, 425-425 (1999).
- Polleux, F., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. 2002, pl9-pl9 (2002).
- Guerrier, S. The F-BAR domain of srGAP2 induces membrane protrusions required for neuronal migration and morphogenesis. Cell. 138, 990-990 (2009).
- Stegmuller, J. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-389 (2006).
- Sepp, K. J. Identification of neural outgrowth genes using genome-wide RNAi. PLoS Genet. 4, e1000111-e1000111 (2008).
- Konishi, Y. Cdh1-APC controls axonal growth and patterning in the mammalian brain. Science. 303, 1026-1026 (2004).
- Vankelecom, H. Fixation and paraffin-embedding of mouse tissues for GFP visualization. Cold Spring Harb Protoc. 2009, 5298-5298 (2009).
- Hand, R. Phosphorylation of Neurogenin2 specifies the migration properties and the dendritic morphology of pyramidal neurons in the neocortex. Neuron. 48, 45-45 (2005).
- Taniguchi, Y., Young-Pearse, T., Sawa, A., Kamiya, A. In Utero Electroporation as a Tool for Genetic Manipulation in Vivo to Study Psychiatric Disorders: From Genes to Circuits and Behaviors. Neuroscientist. 18, 169-179 (2012).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon