È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Costruire un idrogel collagene per la fornitura di Stem Cell-loaded Chitosan Microsfere
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Uno degli ostacoli principali nelle terapie attuali delle cellule staminali sta determinando il metodo più efficace per fornire queste cellule ai tessuti ospitanti. Qui, descriviamo uno a base di chitosano metodo di consegna che sia efficiente e semplice l'approccio, consentendo nel contempo derivate da tessuto adiposo cellule staminali per mantenere il loro multipotenza.
Abstract
Cellule staminali multipotenti hanno dimostrato di essere estremamente utile nel campo della medicina rigenerativa 1-3. Tuttavia, per utilizzare queste cellule efficace per la rigenerazione tissutale, un certo numero di variabili devono essere prese in considerazione. Queste variabili includono: il volume totale e la superficie del sito di impianto, le proprietà meccaniche del tessuto e il microambiente tessuto, che comprende la quantità di vascolarizzazione e dei componenti della matrice extracellulare. Pertanto, i materiali utilizzati per fornire queste cellule deve essere biocompatibile con una composizione chimica definita, pur mantenendo una resistenza meccanica che imita il tessuto ospite. Tali materiali devono anche essere permeabile all'ossigeno e nutrienti per fornire un microambiente favorevole per le cellule per attaccare e proliferare. Il chitosano, un polisaccaride cationico con biocompatibilità, possono essere facilmente modificati chimicamente ed ha una elevata affinità per legare in vivo con macromolecules 4-5. Chitosano imita la porzione glicosaminoglicano della matrice extracellulare, consentendogli di funzionare come un substrato per l'adesione cellulare, la migrazione e la proliferazione. In questo studio si utilizzano chitosano in forma di microsfere per fornire derivate da tessuto adiposo cellule staminali (ASC) in una base di collagene tridimensionale scaffold 6. Un ideale cellula-microsfere rapporto è stato determinato rispetto al tempo di incubazione e la densità delle cellule per ottenere massimo numero di celle che possono essere caricati. Una volta ASC sono seminate su microsfere chitosano (CSM), essi sono incorporati in un ponteggio collagene e possono essere mantenute in coltura per lunghi periodi. In sintesi, questo studio fornisce un metodo per fornire con precisione le cellule staminali all'interno di un biomateriale tridimensionale patibolo.
Protocollo
1. Isolanti derivate da tessuto adiposo cellule staminali (ASC)
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- Isolare adiposo perirenale e epididimale di ratto e lavare con soluzione salina sterile tamponata di Hank (HBSS) contenente 1% siero bovino fetale (FBS) come descritto in precedenza 6.
- Tritare il tessuto e trasferire 1-2 g in 25 ml di HBSS contenente 1% FBS in una provetta da 50 ml e centrifugare a 500 g per 8 minuti a temperatura ambiente.
- Raccogliere il fluttuante strato di tessuto adiposo e trasferimento pallone Erlenmeyer da 125 ml e trattare con 25 ml di collagenasi di tipo II (200 U / mL) in HBSS per 45 min a 37 ° C in un agitatore orbitale (125 rpm).
- Cautela rimuovere la frazione liquida (sotto olio e strato adiposo) e filtrare sequenzialmente attraverso un filtro di nylon da 100 um e 70 um-maglia. Centrifugare il filtrato a 500 g per 10 min a temperatura ambiente, aspirare il supernatant e lavare il pellet due volte con 25 ml di HBSS.
- Risospendere il pellet di cellule in 50 mL di mezzo di crescita (RS MesenPRO medio basale) supplementato con supplemento MesenPRO crescita RS, antibiotico-antimicotico (100 U / mL di penicillina G, 100 pg / mL di streptomicina solfato, e 0,25 mg / ml di anfotericina B) , e 2 mM L-glutammina e cellule pipettare in fiasche T75 2 (25 ml / beuta).
- La cultura il ASC in un 5% CO 2 incubatore umidificato a 37 ° C (Passaggio 2-4 sono utilizzati ASC per tutti gli esperimenti).
2. Preparazione Chitosan Microsfere (CSM)
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- CSM sono preparate da un acqua-in-olio processo di emulsionamento con una tecnica coacervazione ionico usando la nostra precedente protocollo 6. Emulsionare una soluzione acquosa di chitosano (6 mL del 3% w / v chitosano in 0,5 M acido acetico) in 100 ml di una miscela costituita fase olio di soiaolio, n-ottanolo (1:2 v / v) e il 5% sorbitan-monooleato (Span 80) emulsionante, usando testa (1700 rpm) e agitazione magnetica (1000 rpm) simultaneamente, in direzioni opposte. Questo metodo di duplice assicura la miscelazione che micelle formate presto prima reticolazione avviene può rimanere in soluzione e non si depositano sul fondo. Inoltre, l'agitazione magnetica bar aiuti in de-aggregazione chitosano durante la formazione delle micelle e rigidization.
- La miscela viene mantenuta sotto agitazione per circa 1 ora fino uno stabile acqua-in-olio è ottenuto. Reticolazione ionica è iniziata con l'aggiunta di 1,5 ml di 1% w / v di idrossido di potassio in n-ottanolo ogni 15 min per 4 h (24 mL totale).
- Dopo completamento della reazione di reticolazione, lentamente decantare la fase olio della miscela contenente CSM e aggiungere immediatamente le sfere a 100 mL di acetone. Lavare le sfere con acetone finché la fase olio viene completamente rimosso.
- Asciugare le sfere recuperate in un essiccatore a vuoto e analeyze senza ulteriori elaborazioni. La dimensione media delle particelle CSM, superficie per milligrammo e l'unità di volume cubico è stata determinata utilizzando dimensione analizzatore di particelle.
- Per gli esperimenti successivi, lavare CSM tre volte con acqua sterile per eliminare i sali residui e sterilizzare con alcool assoluto.
3. Determinazione del numero di gruppi amminici liberi in CSM
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- Determinare il numero di gruppi amminici liberi presenti nel CSM dopo la reticolazione ionica utilizzando il trinitro benzensolfonico (TNBS) dosaggio di acido Bubins e Ofner 7. Incubare 5 mg di microsfere con 1 mL di soluzione 0,5% TNBS in una provetta di vetro da 50 ml per 4 ore a 40 ° C e idrolizzare con l'aggiunta di 3 ml di HCl 6N a 60 ° C per 2h.
- Raffreddare i campioni a temperatura ambiente, ed estrarre i TNBS libere aggiungendo 5 ml di acqua deionizzata e 10 ml di etiletere.
- Riscaldare Un'aliquota di 5 ml della fase acquosa a 40 ° C a bagnomaria per 15 minuti per evaporare qualsiasi etere residuo, raffreddare a temperatura ambiente, e diluire con 15 ml di acqua.
- Misurare l'assorbanza a 345 nm con uno spettrofotometro con TNBS senza soluzione chitosano come vuoto e il chitosano utilizzata per la preparazione CSM per determinare il numero totale di gruppi amminici. Stimare il numero di gruppi amminici liberi del CSM rispetto al chitosano.
4. Caricamento in ASC CSM
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- Equilibrare 5 mg di CSM sterilizzato dalla sezione 2.5 in HBSS sterili durante la notte e aggiungere ad un inserto di 8 micron dimensione dei pori della membrana piastra di cultura (24 pozzetti).
- Dopo aver risolto il CSM sulla membrana, aspirare accuratamente le HBSS e aggiungere 300 ml di terreno di crescita all'interno dell'inserto e 700 microlitri di terreni di crescita per the fuori dell'inserto.
- Risospendere ASC alla concentrazione adeguata (1 x 10 4 a 4 x 10 4) in 200 pl di mezzo di crescita e seme sulla CSM all'interno dell'inserto piastra di coltura. Il volume finale del mezzo all'interno dell'inserto coltura, dopo la semina, è 500 pl.
- Incubare la testa di serie ASC sul CSM per 24 ore in un 5% di CO 2 incubatore umidificato a 37 ° C.
5. Determinazione della percentuale di caricamento ASC e la vitalità cellulare in CSM
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- Dopo l'incubazione, raccogliere le ASC-caricato CSM in un contenitore sterile da 1,5 ml provetta senza disturbare le cellule che sono migrate nella membrana di inserimento.
- Rimuovere il mezzo residuo e aggiungere 250 microlitri di terreno di crescita fresco al tubo.
- Per aggiungere ciascun tubo 25 pl MTT [3 - (4,5-dimethylthiozole-2-il) -2,5-difeniltetrazolio bromuro]soluzione di (5 mg / mL) e incubare per 4 h in un 5% CO 2 incubatore umidificato a 37 ° C.
- Dopo l'incubazione, rimuovere il supporto, si aggiungano 250 microlitri di dimetilsolfossido e miscelare l'impasto per 2-5 min per solubilizzare il complesso formazan.
- Centrifugare il CSM a 2700 g per 5 min, e determinare l'assorbanza supernatante misurata a 570 nm usando 630 nm come riferimento.
- Determinare il numero di cella associato con il CSM rispetto al valore di assorbanza ottenuto da un numero noto di vitale ASC.
6. Caratterizzare ASC-CSM-Embedded Collagen Gel
Nota: Tutte le procedure sono state eseguite a temperatura ambiente salvo diversamente indicato.
- Mix ASC-caricato CSM (5 mg contenente ≈ 2 x 10 4 cellule) con collagene di tipo 1 (7,5 mg / mL) estratto da tendine coda di ratto secondo il metodo di Bornstein 8 e fibrillano dopo aver regolato il pH a 6,8 con NaOH 2 N.
- Aggiungere il fibrillato collagene-ASC-CSM miscela a 12-pozzetti e incubare per 30 min in un 5% CO 2 incubatore umidificato a 37 ° C.
- Dopo completa fibrillazione, incubare le collagene-ASC-CSM gel fino a 14 giorni in un 5% CO 2 incubatore umidificato a 37 ° C.
- Rilascio e migrazione di cellule dal CSM nel gel sono state osservate usando tecniche di microscopia standard.
7. Risultati rappresentativi
In questo studio, abbiamo sviluppato una strategia in vitro per fornire cellule staminali da microsfere di chitosano (CSM) in un scaffold di collagene gel. CSM poroso di dimensioni uniformi (175-225 micron di diametro) e la composizione sono stati preparati e utilizzati come vettori cellulare (Figura 2). Dopo incubazione con il ASC CSM, le cellule attaccate ad una concentrazione di 2 x 10 4 cells/5mg di CSM. Le cellule erano in grado di diffondere sul microsfere, mentre si estende filopodianelle fessure porose della microsfera (Figura 3). Quando la cellula-caricato CSM sono stati miscelati con il gel di collagene, le cellule immediatamente cominciarono a migrare nei gel (Figura 4).
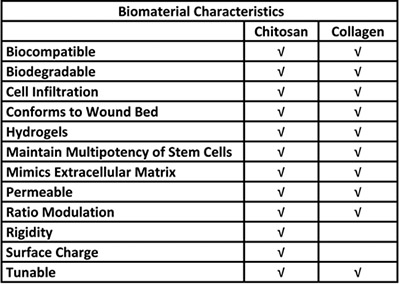
Tabella 1. Vantaggi biologici per l'uso di chitosano e collagene in un sistema di erogazione di cellule staminali.
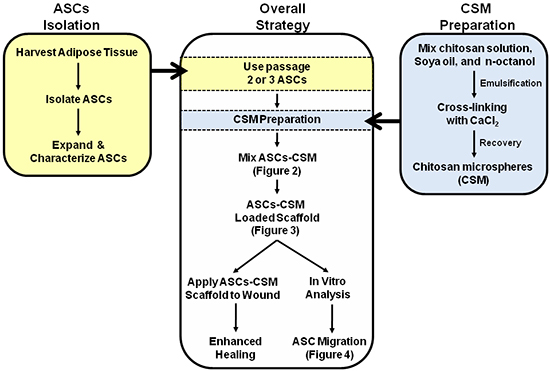
Figura 1. Schema raffigurante la strategia globale per il doppio uso di ASC-CSM scaffold di collagene caricati. Figure 2, 3 e 4 sono annotati entro lo schema di assistere con l'interpretazione delle immagini.
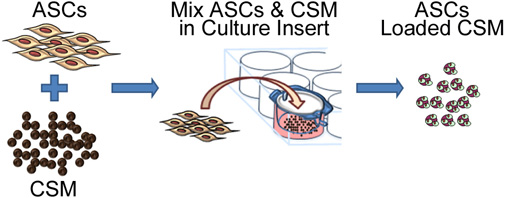
Figura 2. Rappresentazione schematica raffigurante il processo di seminare cellule staminali su microsfere di chitosano. Il process comporta co-coltura con ASC CSM in un 8 - micron dimensione dei pori della membrana inserto cultura piatto. Dopo 24 ore, le microsfere vengono rimossi dal dell'inserto e sono pronti per l'incorporamento in una matrice biomateriale.
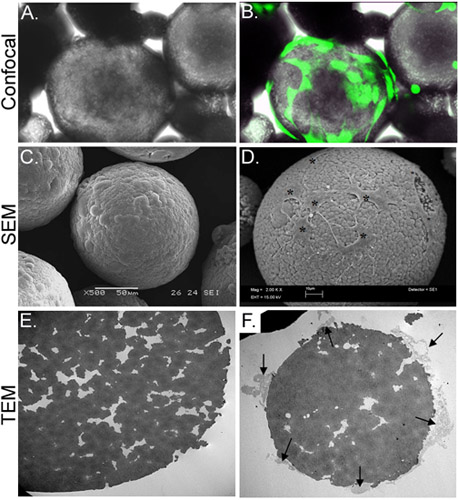
Figura 3. Caratterizzazione morfologica dei CSM-caricato con ASC. Pannello A raffigura una micrografia luce di ASC-caricato CSM, mentre il pannello B mostra lo stesso campo di vista con sovrapposta un'immagine ottenuta mediante microscopia confocale a fluorescenza. ASC sono stati precaricato con calceina AM (verde). Pannello C illustra un'immagine di un'immagine SEM di una microsfera scarico, mentre il pannello D mostra cellule caricati sul microsfera (asterischi). L'immagine TEM in E pannello mostra una sezione trasversale di una microsfera scarico. Una moltitudine di pori e fessure si trovano in tutta la microsfera. Pannello F mostra una sezionata microsfere con cellule (frecce) collegato e si estende filopodia nella creazionevizi. Ingrandimenti originali: A & B = 70X; C = 500x, D = 2.000 x; E & F = 2.500 x.

Figura 4. Migrazione del ASC dal CSM nel tridimensionale collagene scaffold. Pannelli A e B raffigurano il CSM, con cellule che migrano lontano da microsfere e nella matrice di collagene il giorno 3 (A, frecce). Panel B mostra una cultura simile dopo 12 giorni. Microscopia elettronica a trasmissione (TEM) le immagini sono raffigurati in C, D, E. e asterischi in C e D mostrano una microsfera che è stata sezionata con cellule abbandonando la microsfera (frecce). Ingrandimento superiore del pannello D è rappresentato nella E pannello, e mostra filopodia cella attaccati alle fibrille di collagene (inserto). Ingrandimento originale: A & B = 100x, C & D = 6.000 x, x E = 20.000, incasso 150.000 = x.
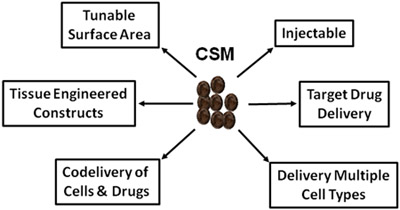
Figura 5.Schematico che illustra gli usi vaste CSM nella medicina rigenerativa e la consegna della droga.
Access restricted. Please log in or start a trial to view this content.
Discussione
Uno degli ostacoli principali delle cellule staminali in terapia a base di sta sviluppando metodi efficienti per la consegna delle cellule alle regioni determinate per la riparazione. Grazie al paziente a paziente variabilità, il tipo di tessuto, dimensioni e profondità lesione, la metodologia di cellule staminali che forniscono devono essere determinati caso per caso. Anche se l'incorporamento cellule staminali all'interno di una matrice e di consegnarli al sito della ferita sembra essere un approccio logico ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Nessun conflitto di interessi finanziari esistono.
Disclaimers
I pareri o le affermazioni contenute nel presente documento sono le opinioni personali degli autori e non devono essere interpretate come ufficiale o che riflette le opinioni del Dipartimento della Difesa o il Governo degli Stati Uniti. Gli autori sono dipendenti del governo degli Stati Uniti, e questo lavoro è stato preparato come parte delle loro funzioni ufficiali. Tutto il lavoro è stato sostenuto dalla US Army Medical Research e Materiel Command. Questo studio è stato condotto nell'ambito di un protocollo esaminato e approvato dalla US Army Medical Research e Materiel Command Institutional Review Board, e in conformità con il protocollo approvato.
Riconoscimenti
DOZ è supportata da una sovvenzione concessa dalla Fondazione di Ginevra. SN è stato sostenuto da una borsa post-dottorato dal Initiative Tissue Engineering Pittsburgh.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente / apparecchiatura | Azienda | Numero di catalogo | Comments |
| Hanks BalancedSalt Solution (HBSS) | Gibco | 14175 | Consumabili |
| Siero fetale bovino | Hyclone | SH30071.03 | Consumabili |
| Collagenasi di tipo II | Sigma-Aldrich | C6685 | Consumabili |
| 70-micron nylon filtro a rete | BD Biosciences | 352350 | Consumabili |
| 100-um nylon filtro a rete | BD Biosciences | 352360 | Consumabili |
| MesenPRO crescita media del sistema | Invitrogen | 12746-012 | Consumabili |
| L-glutammina | Gibco | 25030 | Consumabili |
| T75 Tissue Culture Flask | BD Biosciences | 137787 | Consumabili |
| Chitosan | Sigma-Aldrich | 448869 | Consumabili |
| Acido acetico | Sigma-Aldrich | 320099 | Consumabili |
| N-ottanolo | Acros Organics | 150630025 | Consumabili |
| Sorbitan-Mono-oleato | Sigma-Aldrich | S6760 | Consumabili |
| Idrossido di potassio | Sigma-Aldrich | P1767 | Consumabili |
| Acetone | Fisher Scientific | L-4859 | Consumabili |
| Etanolo | Sigma-Aldrich | 270741 | Consumabili |
| Trinitro benzensolfonico Acid | Sigma-Aldrich | P2297 | Consumabili |
| Acido cloridrico | Sigma-Aldrich | 320331 | Consumabili |
| Etere etilico | Sigma-Aldrich | 472-484 | Consumabili |
| 8-micron di tessuto coltura in piastra Inserti | BD Biosciences | 353097 | Consumabili |
| Microcentrifuga da 1,5 ml Tubes | Pescatore | 05-408-129 | Consumabili |
| MTT reagente | Invitrogen | M6494 | Consumabili |
| Dimetilsolfossido | Sigma-Aldrich | D8779 | Consumabili |
| Qtracker cellulare Labeling Kit (Q Tracker 655) | Sonde molecolari | Q2502PMP | Consumabili |
| Collagene di tipo 1 | Travigen | 3447-020-01 | Consumabili |
| Di sodio idrossido | Sigma-Aldrich | S8045 | Consumabili |
| 12-Well piastre di coltura dei tessuti | BD Biosciences | 353043 | Consumabili |
| Centrifuga | Eppendorf | 5417R | Attrezzatura |
| Orbital Shaker | New Brunswick Scienctific | C24 | Attrezzatura |
| Incubatore umidificato con Air-5% CO 2 | Thermo Scientific | Modello 370 | Attrezzatura |
| Agitatore | IKA | Visc6000 | Attrezzatura |
| Agitatore magnetico | Corning | PC-210 | Attrezzatura |
| Vacuum Essiccatore | - | - | Attrezzatura |
| Particle Size Analyzer | Malvern | STP2000 Spraytec | Attrezzatura |
| Water Bath | Fisher Scientific | Isotemp210 | Attrezzatura |
| Spettrofotometro | Beckman | Beckman Coulter Spettrofotometro DU800UV/Visible | Attrezzatura |
| Vortice | Diagger | 3030a | Attrezzatura |
| Microplate Reader | Molecular Devices | Spectramax M2 | Attrezzatura |
| Luce / microscopio a fluorescenza | Olimpo | IX71 | Attrezzatura |
| Microscopio confocale | Olimpo | FV-500 microscopio confocale a scansione laser | Attrezzatura |
| Microscopio Elettronico a Scansione | Carl Zeiss Micneuroimaging | Leo 435 VP | Attrezzatura |
| Microscopio elettronico a trasmissione | JEOL | JEOL 1230 | Attrezzatura |
Riferimenti
- Krampera, M. Mesenchymal stem cells for bone, cartilage, tendon and skeletal muscle repair. Bone. 39, 678-683 (2006).
- Patrick, C. W. Tissue engineering strategies for adipose tissue repair. Anat. Rec. 263, 361-366 (2001).
- Pountos, I., Giannoudis, P. V. Biology of mesenchymal stem cells. Injury. 36, Suppl 3. S8-S12 (2005).
- Kim, I. Y. Chitosan and its derivatives for tissue engineering applications. Biotechnol. Adv. 26, 1-21 (2008).
- Shi, C. Therapeutic potential of chitosan and its derivatives in regenerative medicine. J. Surg. Res. 133, 185-192 (2006).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part. A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, C. M. 3rd The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J. Biomed. Mater. Res. A. 81, 259-268 (2007).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Shanmuganathan, S. Preparation and characterization of chitosan microspheres for doxycycline delivery. Carbohydr. Polym. 73, 201-211 (2008).
- Haque, T., Chen, H., Ouyang, W., Martoni, C., Lawuyi, B., Urbanska, A., Prakash, S. Investigation of a new microcapsule membrane combining alginate, chitosan, polyethylene glycol and poly-L-lysine for cell transplantation applications. Int. J. Artif. Organs. 28, 631-637 (2005).
- Goren, A., Dahan, N., Goren, E., Baruch, L., Machluf, M. Encapsulated human mesenchymal stem cells: a unique hypoimmunogenic platform for long-term cellular therapy. FASEB J. 24, 22-31 (2010).
- Zielinski, B. A., Aebischer, P. Chitosan as a matrix for mammalian cell encapsulation. Biomaterials. 15, 1049-1056 (1994).
- Girandon, L., Kregar-Velikonja, N., Božikov, K., Barliç, A. In vitro Models for Adipose Tissue Engineering with Adipose-Derived Stem Cells Using Different Scaffolds of Natural Origin. Folia Biol. (Praha). 57, 47-56 (2011).
- Baruch, L., Machluf, M. Alginate-chitosan complex coacervation for cell encapsulation: effect on mechanical properties and on long-term viability. Biopolymers. 82, 570-579 (2006).
- Wei, Y., Gong, K., Zheng, Z., Wang, A., Ao, Q., Gong, Y., Zhang, X. Chitosan/silk fibroin-based tissue-engineered graft seeded with adipose-derived stem cells enhances nerve regeneration in a rat model. J. Mater. Sci. Mater. Med. , (2011).
- Wang, Q., Jamal, S., Detamore, M. S., Berkland, C. PLGA-chitosan/PLGA-alginate nanoparticle blends as biodegradable colloidal gels for seeding human umbilical cord mesenchymal stem cells. J. Biomed. Mater. Res. A. 96, 520-527 (2011).
- Alves da Silva, M. L., Martins, A., Costa-Pinto, A. R., Correlo, V. M., Sol, P., Bhattacharya, M., Faria, S., Reis, R. L., Neves, N. M. Chondrogenic differentiation of human bone marrow mesenchymal stem cells in chitosan-based scaffolds using a flow-perfusion bioreactor. J. Tissue Eng. Regen. Med. , (2010).
- Kang, Y. M., Lee, B. N., Ko, J. H., Kim, G. H., Kang, K. N., Kim da, Y., Kim, J. H., Park, Y. H., Chun, H. J., Kim, C. H., Kim, M. S. In vivo biocompatibility study of electrospun chitosan microfiber for tissue engineering. Int. J. Mol. Sci. 11, 4140-4148 (2010).
- Bozkurt, G., Mothe, A. J., Zahir, T., Kim, H., Shoichet, M. S., Tator, C. H. Chitosan channels containing spinal cord-derived stem/progenitor cells for repair of subacute spinal cord injury in the rat. Neurosurgery. 67, 1733-1744 (2010).
- Leipzig, N. D., Wylie, R. G., Kim, H., Shoichet, M. S. Differentiation of neural stem cells in three-dimensional growth factor-immobilized chitosan hydrogel scaffolds. Biomaterials. 32, 57-64 (2011).
- Altman, A. M., Gupta, V., RÃos, C. N., Alt, E. U., Mathur, A. B. Adhesion, migration and mechanics of human adipose-tissue-derived stem cells on silk fibroin-chitosan matrix. Acta Biomater. 6, 1388-1397 (2010).
- Altman, A. M., Yan, Y., Matthias, N., Bai, X., Rios, C., Mathur, A. B., Song, Y. H., Alt, E. U. IFATS collection: Human adipose-derived stem cells seeded on a silk fibroin-chitosan scaffold enhance wound repair in a murine soft tissue injury model. Stem Cells. 27, 250-258 (2009).
- Machado, C. B., Ventura, J. M., Lemos, A. F., Ferreira, J. M., Leite, M. F., Goes, A. M. 3D chitosan-gelatin-chondroitin porous scaffold improves osteogenic differentiation of mesenchymal stem cells. Biomed. Mater. 2, 124-131 (2007).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon