Method Article
Microarrays polimerici per Discovery High Throughput di Biomateriali
In questo articolo
Riepilogo
Una descrizione della formazione di un polimero microarray utilizzando un chip tecnica di fotopolimerizzazione. La caratterizzazione superficiale elevata velocità usando la microscopia a forza atomica, misure di angolo di contatto acqua, raggi X e spettroscopia di fotoelettroni tempo di spettrometria di massa di ioni secondari volo e un saggio di adesione cellulare è anche descritto.
Abstract
Miscelazione è una operazione unitaria che combina due o più componenti in una miscela omogenea. Questo lavoro comporta la miscelazione due flussi viscosi liquidi con un filtro in linea miscelatore statico. Il miscelatore è un disegno split-e-ricombinare che impiega flusso di taglio estensionale e per aumentare il contatto interfacciale tra i componenti. A split-e-ricombinare prototipo (SAR) mixer è stato costruito allineando una serie di sottili laser-cut poli (metilmetacrilato) (PMMA) piastre trattenuto in un tubo in PVC. Miscelazione in questo dispositivo è illustrato nella fotografia in Fig. 1. Colorante rosso è stato aggiunto ad una porzione del fluido di prova e usato come componente minore miscelate in principali (non colorato) componente. All'ingresso del mixer, lo strato di fluido iniettato tracciante è diviso in due strati che scorre attraverso la sezione di miscelazione. Su ciascuna sezione successiva miscelazione, il numero di strati orizzontali è duplicato. In ultima analisi, il singolo flusso di colorante sia uniformemente distribuito, throughout la sezione trasversale del dispositivo.
Utilizzo di un fluido non newtoniano prova del 0,2% Carbopol e un fluido tracciante drogato di composizione analoga, mescolando nell'unità viene visualizzato mediante risonanza magnetica (MRI). La risonanza magnetica è una sonda molto potente sperimentale di chimica molecolare e ambiente fisico così come la struttura del campione sulle scale di lunghezza da micron a centimetri. Questa sensibilità ha portato a un'ampia applicazione di queste tecniche per caratterizzare fisiche, chimiche e / o biologiche di materiali che vanno dagli umani agli alimenti al supporto poroso 1, 2. Le attrezzature e le condizioni usato qui sono adatte per liquidi immagini contengono quantità sostanziali di NMR mobile 1 H come l'acqua normale e liquidi organici compresi gli oli. Tradizionalmente MRI ha utilizzato magneti super-conduttori che non sono adatti per ambienti industriali e non trasferibili all'interno di un laboratorio (Fig. 2). I recenti progressin tecnologia dei magneti hanno permesso la costruzione di grande volume magneti industriali compatibili adatti per i flussi di processo di imaging. Qui, la RM fornisce concentrazioni di componenti spazialmente risolte nei diversi siti assiali durante il processo di miscelazione. Questo documento di lavoro in tempo reale la miscelazione dei fluidi ad alta viscosità con distributiva miscelazione con una domanda di prodotti per la cura personale.
Protocollo
1. Preparazione di bassa fouling sfondo
- Pesare 2 g di poli (idrossietil metacrilato) (pHEMA) (Sigma - coltura cellulare testato) in un tubo da centrifuga da 50 mL. Sciogliere in 50 ml di 95% (v / v) di etanolo in acqua. Ciò richiede in genere 24 ore di sonicazione.
- Dip-coat epossi-funzionale vetrino (Genetix) con la soluzione pHEMA. I gruppi epossidici si formerà rapidamente legami covalenti con il rivestimento pHEMA. Dip-coating si ottiene tenendo il vetrino con pinzette e immergendo il vetrino nella soluzione. Tipicamente di 5 mm dal vetrino non è rivestito, che è utile per l'orientamento del vetrino e può anche agire come un controllo positivo come superficie aderente. Il vetrino viene quindi ritirata dalla soluzione pHEMA per un periodo di 1 s, invertito e lasciato asciugare in posizione quasi orizzontale per 10 min prima di mettere in un portavetrini.
- I vetrini Phema rivestiti sono poi lasciati a condizioni atmosferiche per 1 settimana per permettere la completa evaporazione tegli solvente.
2. Preparazione della soluzione di monomero
- Pesare 120 mg del fotoiniziatore 2,2-dimetossi-2-fenil acetofenone e aggiungere 3 mL di dimetilformammide (DMF) per ottenere una soluzione fotoiniziatore 4% (w / v). Questo è fatto meglio fresco prima di ogni ciclo di stampa, per cui la massa e il volume della soluzione può essere fatta variare secondo la quantità di soluzione fotoiniziatore è richiesto. La soluzione è stabile fino a un mese.
- Soluzioni monomeriche sono create aggiungendo 1 parte della soluzione fotoiniziatore di 3 parti del monomero ordinata. Questo risultato è ottenuto pipettando 5 ml di soluzione di fotoiniziatore e 15 ml di monomero in una piastra a 384 fonte ben. Un volume totale di 20 microlitri è ideale per la formazione di spot. Maggiori volumi richiedono ulteriori blotting prima macchie uniformi può essere prodotta. Volumi più piccoli può causare caricamento incompleta del perno.
- Questo metodo è attualmente limitata all'uso di acrilato / metacrilato monomeri che sono solubili in DMF da virtue di questi che sono le uniche combinazioni che sono state esplorate; acrilammidi e altri solventi sono probabilmente riconducibili al processo di stampa. Per raggiungere la concentrazione di monomero suggerito (75% w / w) monomeri liquidi sono inoltre necessarie, anche se le concentrazioni di monomero inferiore può essere utilizzata per monomeri solidi (concentrazione monomerica ridotta non sembra alterare negativamente la chimica superficiale del polimero risultante è comunque probabile che il peso molecolare di transizione e vetro temperatura viene alterata). Monomeri altamente volatili sono anche difficili da utilizzare a causa della rapida evaporazione del monomero prima della fase di polimerizzazione UV durante la polimerizzazione. A seconda del numero di soluzioni monomeriche una corsa può richiedere fino a 6 ore e verso la fine dei monomeri volatili esecuzione sarà evaporato dalla piastra sorgente. Uso di monomeri volatili può essere ottenuto raffreddando la fase di stampa e con tirature solo.
- Con l'eccezione di alcuni monomeri altamente idrofilicome poli (etilene glicole) acrilato, la dissoluzione delle macchie polimero risultante in tamponi acquosi non è stata osservata, quindi, l'uso di un monomero di reticolazione non è richiesto, anche se non è esclusa.
3. Polymer microarray formazione
La procedura tipica per la formazione del polimero microarray è illustrato schematicamente nella figura 1.
- Formazione microarray è ottenuta utilizzando un robot contatto (Biodot) utilizzando una fase XYZ (Figura 2). Perni scanalati di 220 micron di diametro sono usati (Arrayit 96B). Tutti i perni devono essere puliti mediante sonicazione in diclorometano per 10 minuti prima di procedere alla stampa e allo stesso modo il supporto del perno dovrebbe essere pulito.
- Perni vengono caricati nel supporto, blotting e diapositive matrice vengono caricati e quindi l'intera camera viene riempita con argon per ridurre il livello di ossigeno al di sotto di 2000 ppm, che è sufficientemente basso per evitare quenching dei radicali polimerizzazione da ossigeno. L'umidità è maintained tra il 30-40%. Compresi umidità consente la pHEMA a gonfiarsi permettendo la polimero formato compenetrarsi strato pHEMA e diventare intrappolato fisicamente alla superficie 2.
- La tiratura è iniziata. Ogni esecuzione consiste di:
- Caricamento campione dal piatto di origine. I perni vengono calati nelle soluzioni ad una velocità di 25 mm / s, tenuto in soluzione per 2,5 s e poi ritirata ad una velocità di 25 mm / s (Figura 2).
- Pin devono essere cancellati prima della stampa per rimuovere la soluzione di monomero dall'esterno del perno. Successivamente erogazione del monomero avviene dalla parte quilled del perno per ottenere la formazione coerente spot. La sequenza di assorbente usato composto da 33 contatti con un vetrino pulito. Per i primi quattro posizioni il numero di contatti è 10, 5, 4 e 3 rispettivamente. I prossimi quattro posizioni 2 contatti sono fatti e negli ultimi 3 posizioni da 1 contatto. Tempo di contatto totale per ogni contatto è di 10 ms e l'approccio e la velocità di prelievo è di 175mm / s. Da questo punto le macchie formate dovrebbe avere una forma coerente e geometria. Il mancato a questo punto indica sugli immondi o contaminanti polvere nelle soluzioni di monomeri.
- Le soluzioni di monomeri vengono quindi stampati sui fogli PHEMA vetro rivestito (Figura 2). Un contatto è fatto per posto a un movimento di perno 175 mm / s ed il tempo di contatto di 10 ms, che in funzione della viscosità e tensione superficiale della soluzione di monomero dà un diametro medio di 400 micron posto. Tipicamente 3 array replicati vengono stampati su ogni vetrino e un totale di 10 vetrini sono stampati su una singola analisi. Ciò equivale a 30 punti per ciclo.
- Pins vengono lavati in DMF. 2,5 L di DMF fresco è prevista l'intera corsa di lavaggio. Perni vengono lavati in un bagno di flusso con agitazione.
- In concomitanza con il lavaggio, le diapositive appena stampati sono irradiati con raggi UV onde corte (365 nm) di origine ad una densità di 30 mV / cm 2 per la durata del periodo di lavaggio che dura 30 s.
- Laopo tutte le soluzioni di monomeri vengono stampati gli array vengono irradiate con raggi UV (365 nm) per altri 10 min.
- Gli array appena stampati vengono mantenuti a bassa pressione (<50 mTorr) per 1 settimana per rimuovere monomero non polimerizzato e solvente.
4. Elevata superficie di caratterizzazione throughput (HTSC)
Uno schema generale delle tecniche HTSC è mostrato in Figura 3. Centrale al automatizzato, approccio throughput elevato è l'allineamento del microarray polimero con l'apparato caratterizzazione. In tutti i casi, questo è realizzato utilizzando una telecamera che fornisce una vista dall'alto della matrice. Inizialmente, la matrice viene ruotata per allinearsi con il movimento XY della fase. Una macchia angolo della matrice viene quindi collocati e coordinate specifiche. La posizione di ciascun punto polimero può essere previsto utilizzando le dimensioni della matrice.
- Acqua angolo di contatto (WCA) misurazioni
- WCA misurazioni sono effettuate utilizzando il metodo goccia sessile su unautomatizzato Krüss DSA 100 strumento. Una goccia d'acqua con un volume di ~ 400 pL viene erogato mediante un piezo-driven testina di stampa su ciascun punto di polimero. Il diametro di un punto polimero è tipicamente 300 pm e il diametro di base della goccia d'acqua sul posto polimero è tipicamente 100 um, quindi, solo una misurazione può essere ottenuta per spot polimero.
- Uno stadio XY permette il posizionamento automatico di ogni macchia polimero sotto la testina di stampa 7. Ciò si ottiene mediante una telecamera situata sopra il campione, che fornisce una vista dall'alto della matrice. Inizialmente, la posizione della telecamera deve essere regolata per allineare l'erogazione delle goccioline al centro della vista della telecamera e quindi la matrice può essere allineato con la testina di stampa.
- Una telecamera ad alta velocità registra il profilo laterale della goccia sul colpisce la superficie di evaporazione e successivamente. La cornice che cattura l'impatto iniziale di goccia è utilizzato per misurare l'angolo di contatto. Un cerchio è montato sul profi gocciale e l'angolo di contatto successivamente determinato.
- Time-of-Flight Secondary Ion Mass Spectrometry (ToF-SIMS)
- Campione viene caricato sul palco. Si tratta in primo luogo allineando il palco con pulito foglio di alluminio, che contribuisce con compensazione di carica, e quindi si tiene la slitta in posizione mediante l'uso di schede di metallo a vite.
- Stadio campione è posto nella camera di trasferimento del ToF-SIMS e lasciata pompare fino a quando 1,6 × 10 -6 mbar. Il campione viene quindi trasferita alla camera di analisi, che tipicamente ha una pressione di vuoto di 1,0 × 10 -8 mbar.
- ToF-SIMS misurazioni sono effettuate utilizzando un ION-ToF strumento IV effettuati mediante monoisotopico Bi 3 + sorgente di ioni primaria funzionare a 25 kV in modalità "raggruppati". Impulsiva 1 fascio ionico pA primario rastered sopra l'area di analisi, con ioni secondari negativi e positivi raccolti da una zona × 100 100 um di ogni spot polimero nella microarray per un 10-seccondo tempo di acquisizione. Masse di ioni sono stati determinati utilizzando una ad alta risoluzione Time-of-Flight analizzatore che consente l'assegnazione precisa di massa. La risoluzione di massa tipico (a m / z 41) era poco più di 6000. Elettroni a bassa energia (20 eV) sono stati utilizzati per compensare la carica di superficie causati dal fascio primario di ioni caricati positivamente sulle superfici isolanti 8.
- Microscopia a forza atomica (AFM)
- Un grande stadio AFM con una fase automatizzato è necessaria per analizzare le matrici sul vetrino. Un microscopio Dimension o ICON è l'ideale per questo scopo.
- Campione viene posto sul palco e posizione fase è assegnato a in alto a destra della matrice.
- La posizione del vertice inferiore sinistro della matrice viene trovato, che consente la posizione di tutti gli altri punti da interpolare.
- Un elenco posizione viene generato e immessa in auto-campionatura funzione del software.
- Misure AFM sono prese con uno strumento 3000A Nanoscope in tapping mode. Punte di silicio con una frequenza di risonanza di circa 300 kHz e una forza costante di 40 N / m vengono utilizzati (Tap300Al, sensori di bilancio). Regioni micron 5x5 del polimero sono misurate 9.
- Il valore quadratico medio (RMS) rugosità è misurato in tutta la regione per ciascuna immagine utilizzando il software di elaborazione batch di SPIP. Ogni immagine è inizialmente appiattita prima misure di rugosità.
- Tutte le immagini richiedono una visita manuale per identificare i reperti di imaging che possono avere bisogno di essere rimosso da misure di rugosità. In questa fase le immagini possono anche essere classificati sulla base di caratteristiche di superficie comuni 9.
- A raggi X spettroscopia di fotoelettroni (XPS)
- Una diapositiva microarray è apposto su una barra campione utilizzando nastro biadesivo e successivamente caricati nell'apposita camera di un Kratos Ultra XPS strumento Axis.
- Entra nella camera del campione e attendere fino a raggiungere una pressione inferiore a 10 -8 Torr.
- Il funzionamento appropriatoparametri, come ad esempio un monochromated sorgente di raggi x (Al, 1486,6 eV), anodo potenziale e di corrente (10 kV e 15 mA), dimensione di apertura (110μm), l'energia passa (80 eV per la scansione di larghezza e 20 eV per la scansione ad alta risoluzione) sono selezionata. La sorgente di raggi X è focalizzata utilizzando due angoli opposti del microarray e ottimizzare il segnale ossigeno dal campione. Le posizioni x e y dei punti individuali è quindi determinato e registrato in un elenco di posizione.
- Un grafico programma è scritto e quindi eseguire per l'acquisizione di dati, comprese le scansioni ampie e scansioni ad alta risoluzione per elementi specifici.
- Spettroscopia Raman
- Spettri Raman sono prese per ciascuna macchia polimero utilizzando un microscopio Raman LabRAM HR (Horiba Jobin Yvon). Inizialmente, il segnale Raman è calibrato utilizzando un wafer di silicio e lo spostamento Raman di Si a 520,7 centimetri -1.
- Il campione viene poi posto sul palco e la messa a fuoco del laser (lunghezza d'onda = 523 nm) viene regolato per massimizzare lo spostamento Raman CHa 2950 cm -1.
- La posizione del centro del punto in alto a sinistra sul microarray viene quindi impostata come origine e una mappa del microarray è configurato utilizzando la funzione di matrice sul software labRAM HR.
- 10 spettri vengono acquisiti cumulativamente per ciascun campione con un tempo di irradiazione di 0,5 s.
5. Prova batterica
L'array può essere esposto a molti saggi biologici diversi tra cui l'attaccamento e la proliferazione delle cellule staminali, altri tipi di cellule e batteri 3,10,4. Qui descriviamo una prova batterica allegato, che è mostrato schematicamente in figura 4.
- Un ceppo batterico trasformato con GFP espresso plasmide viene coltivato durante la notte a 37 ° C in 10 ml di mezzo LB in una provetta da 50 ml falcon con agitazione a 200 rpm.
- L'OD 600 della coltura batterica viene misurata e sufficiente coltura overnight viene inoculato in 15 ml RPMI-1640 definiti ai risultatiin una finale di 0,01 OD 600.
- Gli array sono lavata sterilizzati acqua distillata per 10 minuti per rimuovere tutti i componenti solubili dagli array (monomero non polimerizzato, oligomeri e solvente)
- Vetrini matrice lavate sono posti in una capsula di Petri pulito e sterilizzato UV per 10 min.
- Un vetrino con l'array è posto in una capsula di Petri e 15 ml di inoculate RMPI-1640 viene aggiunto. Contemporaneamente un'altra diapositiva viene posto in una capsula di Petri e incubate con non-innoculatd RPMI-1640 come controllo.
- Vetrini vengono incubate a 37 ° C per 72 ore con agitazione a 60 rpm.
- Vetrini vengono lavati due volte con 15 ml di PBS sterile.
- Vetrini vengono lavati due volte con 15 mL di acqua distillata sterile.
- Vetrini sono dotate di aria secca.
- I vetrini vengono esposte con un caricatore automatico GenePix scanner 4200AL (Molecular Devices, USA) con un laser di eccitazione 488 nm e blu standard di emissione del filtro (510-560nm). Un rappresentante polimero immagine autofluorescenza èmostrato in Figura 2. Questo deve essere fatto il più presto possibile per evitare il decadimento della GFP. Se ciò non è possibile, le cellule devono essere sottoposti fissazione. Inoltre, l'inserimento di opportuni controlli positivi con risposta nota batterica è indispensabile per poter normalizzare i risultati e consentire esperimenti condotti in giorni diversi per essere quantitativamente comparabili. L'intensità di fluorescenza totale di macchie polimero viene eseguita utilizzando GenePix Pro 6 (Molecular Devices, USA). Questo viene fatto per due slitte incubate con batteri e solo media. Per trovare la fluorescenza dovuta alla crescita di batteri della fluorescenza del controllo multimediale viene sottratta dalla fluorescenza misurata sul vetrino incubate con batteri.
- Le diapositive possono anche essere colorati del 20 pM SYTO17 colorante acido nucleico (Invitrogen, UK) a temperatura ambiente per 30 minuti e ripreso con un obiettivo Carl Zeiss LSM 700 Microscopio scansione laser con ZEN 2009 il software di imaging (Carl Zeiss, Germania). La copertura di batterisulla superficie è determinata con aperta Fonte immagine J 1,44 software (National Institute of Health, USA).
6. Risultati rappresentativi
Le condizioni di stampa sono stati ottimizzati per stampare più alta qualità microarrays polimero. L'umidità deve essere mantenuta tra il 30-40%. La delaminazione di macchie di polimero in ambienti acquosi è stata osservata frequentemente per le matrici stampate con umidità inferiore al 30%, suggerendo che tale umidità è insufficiente a gonfiarsi strato pHEMA e consentire l'intrappolamento fisico del polimero al substrato. L'umidità può essere aumentata ulteriormente a modificare il diametro dei punti di polimero, ma questo dipende dalla chimica monomero. Per esempio, dove i volumi uguali di soluzione di polimerizzazione sono stati stampati e l'umidità è stata aumentata da 40 a 80% del diametro di punto diminuito da 430 micron a 370 micron per un monomero contenente idrofilo glicole etilenico pari frazione di volume, mentre per un monomer contenente una struttura di carbonio idrofobo alifatico l'anello del diametro dello spot è aumentato da 290 micron a 350 micron (Figura 5).
Il grado di polimerizzazione può essere monitorato usando spettroscopia Raman per misurare il C = spostamento Raman C che viene rilevato a 1.640 cm-1, che deve essere normalizzati con lo spostamento C = O Raman a 1720 cm -1. Gli spettri Raman è stata misurata per macchie polimero polimerizzate per esposizione UV varia (Figura 6). Il C = C: C = rapporto O diminuito esposizione UV aumentata da 0 a 50 s, dopo di alcun ulteriore riduzione del C = C: C = rapporto O è stato osservato con irradiazione UV ulteriormente (Figura 6). Spettri Raman sono stati misurati per macchie polimero polimerizzate vario livello di O 2 e la Figura 7A C = C spostamento Raman è stato osservato come il livello di O 2 è stato diminuito a 2000 ppm, tuttavia alcuna ulteriore riduzione è stata osservata per un livello 2 O sotto di questo ( ). Spettroscopia Raman anche dimostrato la capacità di estrazione s vuototep per rimuovere monomero non polimerizzato. Prima di aspirazione del C = C spostamento Raman era maggiore per il polimero polimerizzato a 3300 ppm rispetto al 2000 ppm (Figura 7A), tuttavia, dopo estrazione sotto vuoto l'altezza dello spostamento Raman è indistinguibile (Figura 7B), suggerendo tutte monomero non polimerizzato è stato rimosso durante la fase di aspirazione. Per riassumere, condizioni di polimerizzazione includono una umidità del 30-40%, esposizione UV maggiore di 50 s ad un livello 2 O inferiore a 2000 ppm, con un passo di estrazione a vuoto dopo la stampa per 7 giorni.
Dopo estrazione stampa e vuoto il successo della polimerizzazione di macchie polimero può essere valutata mediante microscopia ottica semplice per identificare e morfologie piatte anomale. Tipicamente, macchie dovrebbe apparire circolare uniforme, come mostrato nella Figura 8 sulla sinistra. La probabile causa di un cambiamento nella geometria è una spina danneggiata o sporca. Per un piccolo numero di combinazioni di monomero abbiamo osservato macchie deformi, e perSEMPIO un punto centrale con un satellite di piccole macchie, come mostrato nella figura 8 a destra, o una forma uovo fritto in cui vi è un punto centrale sulla parte superiore del grande, piatta spot. Questo può essere causato da una separazione di fase prima della stampa relative a differenze nella tensione viscosità, idrofilia, volatilità o superficie dei monomeri e suggerisce che la combinazione monomero non è compatibile con questo formato. Mappatura chimica supplementare di macchie polimero mediante tecniche come ToF-SIMS è anche un importante e talvolta necessario passo di controllo di qualità per determinare la distribuzione di chimiche dei materiali attraverso i punti e la matrice. Questa tecnica può identificare diffusione eccessiva di alcuni materiali non visibili al microscopio ottico e identificare separazione di fase entro macchie polimero individuali.

Figura 1. Schema raffigurante le varie fasi coinvolte nella formazione di un polymer posto.
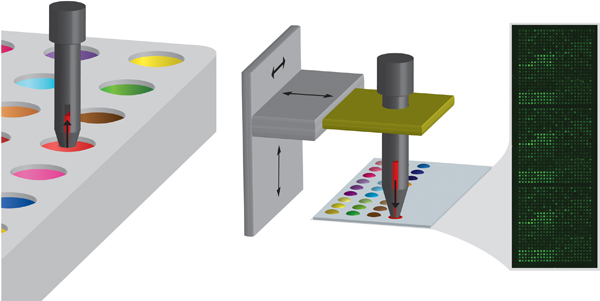
Figura 2. Schema della metodologia di stampa pin coinvolge inizialmente caricando il perno con monomero in una piastra sorgente e poi depositare il monomero su un substrato facendo contatto. Il perno è controllato da un braccio robotico XYZ. L'inserto mostra una tipica immagine di autofluorescenza di un array dopo la produzione.

Figura 3. Schema evidenziando le tecniche associate HTSC e anche biotest applicata allo studio di microarrays polimero.

Figura 4. Schema del dosaggio attacco batterico.
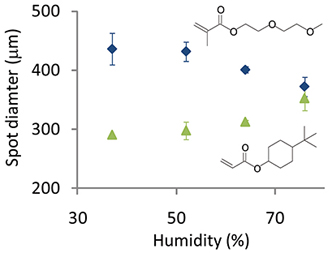
Figura 5. PDiametro punto olymer stampato umidità varia per due differenti monomeri: 4-tert-butilcicloesil acrilato e di (etilenglicole) metacrilato etere etilico.
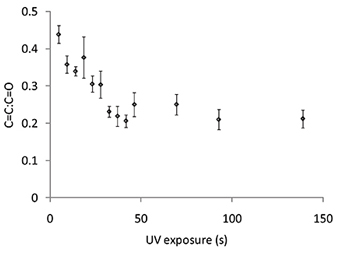
Figura 6. Il rapporto tra l'intensità Raman per il C = C spostamento Raman a 1.640 cm -1 e C = O spostamento Raman a 1720 cm -1 da macchie di polimero di acrilato di 4-tert-butilcicloesil con esposizione UV varia. Le barre di errore pari ad una deviazione standard (n = 3).
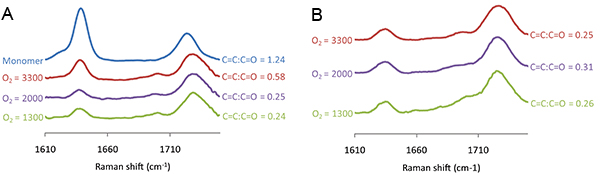
Figura 7. Gli spettri Raman misurata per macchie polimero di acrilato di 4-tert-butilcicloesil stampata a vari livelli di O 2, indicata a sinistra di ogni spettro, (A) prima e (B) dopo aspirazione. Il rapporto tra l'intensità Raman per il C = C spostamento Raman a 1.640 cm -1 e C = O spostamento Raman a 1720 cm -1 viene mostrato a destra di ciascuno spettro.

Figura 8. Un'immagine microscopio ottico di due macchie polimero. Posto a sinistra mostra un punto ben formato, mentre il punto sulla destra è un esempio di uno spot contenente una distribuzione molto uniforme di monomero. La barra della scala è di 500 micron.
Discussione
Microarrays polimeri sono stati utilizzati con successo per la scoperta di nuovi materiali da centinaia di screening del romanzo di polimero in un saggio biologico e di individuare "hit" materiali che possono successivamente essere scalata fino a dispositivi utili. In questo caso, la caratterizzazione superficiale descritto può essere impiegato dopo il saggio biologico ed esclusivamente sui "colpo" materiali per studiare tali materiali in dettaglio. Questa strategia può essere di interesse se HTSC non è disponibile per l'impiego di questo approccio sperimentale. Tuttavia, per utilizzare completamente microarrays polimeriche per studiare le interazioni materiale biologico-l'intera matrice di centinaia di materiali dovrebbero essere analizzati prima saggi biologici utilizzando metodologie HTSC, che possono successivamente essere utilizzati per osservare generali struttura-funzione tendenze.
Contatto stampa si basa sul perno metallico scorrevole su e giù liberamente nel supporto del perno. Supporto del perno e il perno la pulizia è fondamentale è garantire pTAMPA avviene con successo e deve essere rigorosamente effettuata. Prima di iniziare una stampa eseguire il movimento appropriato del perno all'interno del supporto del perno può essere testato eseguendo una corsa a secco, senza monomeri presenti. La fase di pulizia deve continuare fino a quando il perno di movimento si ottiene riproducibile.
Pensiero considerevole dovrebbe andare nella progettazione della miscela monomerica. Per produrre facilmente una libreria combinatoria di polimeri, centinaia di copolimeri sono formati mescolando un paio di monomeri in rapporti differenti. Tipicamente si producono 576 biblioteche come questa forma una matrice x 24 24, che è adatto per la geometria di un vetrino. Per produrre una libreria combinatoria che esplora lo spazio più combinatoria il modo più semplice per miscelare 24 monomeri a coppie in rapporto 2:1. In alternativa, l'inclusione di gradienti composizionali all'interno della matrice sono utili per consentire le osservazioni di tendenze, che consente composizioni monomeriche ottimali per essere dDeterminati. Come esempio di questo 22 monomeri possono essere usati come primo componente in un co-monomero miscela che viene sequenzialmente diluito con 1 di 6 secondi componenti. Se 5 diluizioni sono utilizzati, per esempio mescolando i componenti primo e secondo a rapporti di 90:10, 75:25, 50:50, 25:75 e 10:90, ciò comporterebbe 488 soluzioni copolimero uniche. Per portare il totale a 576, replicati dei omopolimeri dei monomeri utilizzati possono essere introdotte, che spesso è un campione di riferimento importante. 576 soluzioni di monomeri devono essere distribuiti in 2 384 pozzetti. Per la programmazione del robot è più facile avere due identiche piastre in termini di posizione dei monomeri, quindi, le soluzioni di monomero deve essere diviso equamente tra le due piastre.
Una quantità significativa di tempo può essere salvato nella preparazione delle piastre di origine con l'uso di pipette multicanale, e la progettazione di piastre sorgente deve essere determinata in modo da sfruttare l'uso delle pipette multicanale.
Per raggiungere HTSC automatizzata delle matrici posizione spot devono essere correttamente allineata con l'apparato caratterizzazione. In genere l'altezza di un array acrilato è di 500-1000 micron e il diametro dello spot polimero è di 300 micron. Fasi più XY hanno una risoluzione inferiore a 10 micron, quindi vi è la tolleranza adeguata per l'apparato caratterizzazione superficie di accedere correttamente le posizioni dell'array volta le dimensioni corrette sono state input al software di posizionamento del campione. La limitazione al posizionamento automatico è infatti la stampa accurata della matrice. Per garantire una stampa accurata è importante per impedire il movimento del substrato in fase di stampa sia con aspirazione sotto vuoto o morsetti a molla con diapositive dimensioni adeguate (si noti che sia una degli Stati Uniti e dimensioni delle diapositive standard europeo esiste).
ToF-SIMS è una tecnica estremamente sensibile superficie che si osservano qualsiasi contaminazione su campioni. Quindi, massima cura deve essere presaper evitare il contatto con la superficie. I campioni devono essere manipolato, ma la superficie di interesse non a contatto con, con i guanti puliti (preferibilmente in polietilene) e con una pinzetta appena puliti. Noi di solito lavare con cloroformio ed esano. Conservazione del campione prima della misura è fatto meglio in un porta-campioni che contiene le diapositive parte, ad esempio il 5 portavetrini o 20 portavetrini.
Gli array sono progettati specificamente per essere compatibile con molti formati di saggio biologico e display, che è il substrato utilizzato è un vetrino da microscopio ideale per scanner fluorescenza e microscopi luce. Questo significa che il formato è adatto a esplorare molti materiali biologici interazioni. Inoltre, il formato consente centinaia di materiali per essere proiettato in parallelo. In questo modo molti materiali più essere sottoposti a screening rispetto ai metodi tradizionali con cui viene proiettato ogni nuovo materiale chimica singolarmente. La maggiore portata di materiale biologico-interazioni permettonos per la delucidazione dei meccanismi di interazioni di superficie biologiche, oltre a trovare il materiale ottimale per una data applicazione.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Il finanziamento del Wellcome Trust è gentilmente riconosciuta (codice di autorizzazione del 085245/Z/08/Z). Nanotecnologie Nottingham e Centro nanoscienza è gentilmente riconosciuta per dare l'accesso al sistema Raman e per lo sviluppo Est Midlands Agenzia per il finanziamento di questa apparecchiatura.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente / attrezzature | Azienda | Catalogo / Numero del modello | |
| Epossidiche diapositive | Genetix | K2652 | |
| Contatto stampa | Biodot | XYZ3060 piattaforma | |
| Metallo perno | Arrayit | 946MP6B | |
| ToF-SIMS strumento | ION-TOF | ||
| XPS strumento | Kratos | ||
| WCA apparecchi | Krüss | DSA 100 | |
| AFM | Bruker | Dimension Icon | |
| RPMI-1640 coltura cellulare multimediale | Sigma-Aldrich | R0883 | |
| SYTO17 | Invitrogen | S-7579 |
Riferimenti
- Hook, A. L., Anderson, D. G., Langer, R., Williams, P., Davies, M. C., Alexander, M. R. High throughput methods applied in biomaterial development and discovery. Biomaterials. 31, 187-198 (2010).
- Anderson, D. G., Levenberg, S., Langer, R. Nanoliter-scale synthesis of arrayed biomaterials and application to human embryonic stem cells. Nature Biotechnology. 22, 863-866 (2004).
- Mei, Y., Saha, K., Bogatyrev, S. R., Yang, J., Hook, A. L., Kalcioglu, Z. I., Cho, S. W., Mitalipova, M., Pyzocha, N., Rojas, F., Van Vliet, K. J., Davies, M. C., Alexander, M. R., Langer, R., Jaenisch, R., Anderson, D. G. Combinatorial development of biomaterials for clonal growth of human pluripotent stem cells. Nature Materials. 9, 768-778 (2010).
- Pernagallo, S., Wu, M., Gallagher, M. P., Bradley, M. Colonising new frontiers-microarrays reveal biofilm modulating polymers. Journal of Materials Chemistry. 21, 96-101 (2011).
- Yang, J., Mei, Y., Hook, A. L., Taylor, M., Urquhart, A. J., Bogatyrev, S. R., Langer, R., Anderson, D. G., Davies, M. C., Alexander, M. R. Polymer surface functionalities that control human embryoid body cell adhesion revealed by high throughput surface characterization of combinatorial material microarrays. Biomaterials. 31, 8827-8838 (2010).
- Urquhart, A. J., Anderson, D. G., Taylor, M., Alexander, M. R., Langer, R., Davies, M. C. High throughput surface characterisation of a combinatorial material library. Advanced Materials. 19, 2486-2491 (2007).
- Taylor, M., Urquhart, A. J., Zelzer, M., Davies, M. C., Alexander, M. R. Picoliter water contact angle measurement on polymers. Langmuir. 23, 6875-6878 (2007).
- Urquhart, A. J., Taylor, M., Anderson, D. G., Langer, R., Davies, M. C., Alexander, M. R. TOF-SIMS analysis of a 576 micropatterned copolymer array to reveal surface moieties that control wettability. Analytical Chemistry. 80, 135-142 (2008).
- Hook, A. L., Yang, J., Chen, X., Roberts, C. J., Mei, Y., Anderson, D. G., Langer, R., Alexander, M. R., Davies, M. C. Acrylate polymers with hydro-responsive topography. Soft Matter. 7, 7194-9197 (2011).
- Pernagallo, S., Unciti-Broceta, A., Diaz-Mochon, J. J., Bradley, M. Deciphering cellular morphology and biocompatibility using polymer microarrays. Biomedical Materials. 3, (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon