È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Etichettatura immunoistologiche di microtubuli in Neuron dendriti sensoriali, trachee, e Muscoli in Drosophila Larva parete del corpo
In questo articolo
Riepilogo
Per capire come forme cellulari complessi, come dendriti neuronali, vengono raggiunti durante lo sviluppo, è importante essere in grado di accuratezza dell'organizzazione test microtubuli. Qui si descrive un metodo robusto etichettatura immunoistologiche di esaminare l'organizzazione dei microtubuli dei dendriti arborizzazione dendritica neurone sensoriale, trachea, dei muscoli, e gli altri Drosophila Larva tessuti parete del corpo.
Abstract
Per capire come le differenze nelle forme cellulari complessi siano raggiunti, è importante seguire con precisione l'organizzazione dei microtubuli. Il corpo Drosophila larvale parete contiene diversi tipi di cellule che sono modelli per lo studio delle cellule e la morfogenesi dei tessuti. Per esempio trachee sono utilizzati per esaminare la morfogenesi del tubo 1, e la arborizzazione dendritica (DA) neuroni sensoriali della larva di Drosophila sono diventate un sistema primario per la delucidazione dei generali e dei neuroni-classe-specifici meccanismi di 2-5 differenziazione dendritica e degenerazione 6 .
La forma di rami dendrite può variare notevolmente tra le classi di neuroni, e anche tra i diversi rami di un singolo neurone 7,8. Studi genetici nei neuroni DA suggeriscono che la differenza di organizzazione del citoscheletro possono essere alla base delle differenze morfologiche di forma ramo dendritiche 4,9-11. Forniamo un robusto metodo di etichettatura immunologico ad unssay nell'organizzazione dei microtubuli vivo nei neuroni sensoriali DA dendrite pergolato (Figure 1, 2, Movie 1). Questo protocollo illustra la dissezione e immunocolorazione della prima larva instar, una fase in cui attivo escrescenza dendriti dei neuroni sensoriali e organizzazione ramificazione sta avvenendo 12,13.
Oltre alla colorazione neuroni sensoriali, questo metodo ottiene l'etichettatura robusto di organizzazione dei microtubuli nei muscoli (Film 2, 3), trachea (Figura 3, Movie 3), e di altri tessuti parete del corpo. E 'utile per gli investigatori che desiderano analizzare l'organizzazione dei microtubuli in situ nella parete del corpo durante l'analisi dei meccanismi di controllo che il tessuto e la forma delle cellule.
Protocollo
1. Preparazione dei reagenti
Note prima di iniziare: Dissection e colorazione immunoistochimica si svolgono in una camera magnetica e la larva è immobilizzato mediante perni di insetti forma speciale. Istruzioni dettagliate per la costruzione di una camera magnetica, e la preparazione di questi pin possono essere trovati nei riferimenti relativi 14,15. In breve, un foro quadrato 1x1cm viene tagliato in un foglio magnetico e un copri apposta sul retro del foglio per fare una piccola camera. I lati della camera sono sigillati con la colla epossidica, dopo questa colla ha fissato la camera è lavato più volte con etanolo al 70% prima dell'uso. Perni insetti dissezione vengono preparate piegando secondo la forma desiderata e poi incollate su una scheda di metallo 14,15. In alternativa ad una linguetta di metallo, abbiamo usato una rovesciata a testa piatta puntina da disegno in acciaio con manico fatto da un cut-off punta gialla. Avvalersi di questa facoltà camera magnetica permette uno stretto controllo Over posizionamento pin e stiramento dei tessuti durante la dissezione.
Per guidare l'espressione genica giornalista in vari sottoinsiemi di neuroni DA investigatori possono utilizzare diverse GAL4 differenti linee (riassunto da Shimono e colleghi 16). Molte di queste linee sono disponibili presso i centri di magazzino pubblico. In questo protocollo rappresentante, effettuiamo immunocolorazione di una linea in cui due classi contrastanti DA neuroni sono co-marcato: il più semplice di classe I e più complessi di classe IV (P10-GAL4 17,18, UAS-mCD8:: Kusabira-Orange (KO)).
- Preparare Ca + +-libero HL3.1 salina
- In mM: 70 NaCl, 5 KCl, 20 MgCl 2, 10 NaHCO 3, 5 HEPES, 115 saccarosio, trealosio e 5; pH 7,2 19. Filtro-sterilizzare e conservare a 4 ° C. Nota: Ca + +-senza soluzione impedisce la contrazione muscolare durante la dissezione.
- Preparare 2x tampone PHEM
- In mM: 130 TUBI, 60 HEPES, 20 EGTA, 4 MgSO4; pH 7,0. Filtro-sterilizzare e conservare a 4 ° C.
Nota: Questi materiali non si dissolvono fino a quando il pH si avvicina 7.0.
- In mM: 130 TUBI, 60 HEPES, 20 EGTA, 4 MgSO4; pH 7,0. Filtro-sterilizzare e conservare a 4 ° C.
- Preparare il fissativo fresco immediatamente prima della fissazione.
- Al fine di preparare una soluzione da 25 ml, prima paraformaldeide 2g mix, 100μl di NaOH 1M e 10 ml di acqua in un tubo da 50 ml Falcon.
- Agitare fissativo in un bagno d'acqua ° 55 C con agitatore fino a quando la soluzione è limpida. (Volume totale sarà di circa 11,5 ml.)
- Fissativo raffreddare su ghiaccio.
- Aggiungi 12.5ml tampone 2x PHEM.
- Regolare il pH a 7,0 con HCl 1M.
- Riempire la soluzione con acqua fino a quando il volume è 25ml.
- Filtrare la soluzione con carta Whatman.
2. Dissezione larvale
Nota prima di iniziare: le reti di microtubuli, in particolare quella dendriti sensoriali, sarà guasto rapidamente dopo l'inizio della dissezione. Achieving dissezione veloce in meno di cinque minuti, seguita da fissazione immediata sono fattori chiave per il successo di questo protocollo.
- Lavare la larva in acqua e rapidamente muoversi in questa goccia utilizzando un ciclo di capelli.
- Orientare il lato alto larva dorsale ed il lato ventrale sul vetro. Nota: Questo orientamento è quello di esaminare i neuroni gruppo ventrale. Per esaminare i neuroni gruppo dorsale, invertire l'orientamento.
- Utilizzare il centro insetti pin to pin all'estremità anteriore vicino alla bocca ganci. Posizionare il perno vicino alla fine per i migliori risultati.
- Mettere una goccia di soluzione salina HL3.1 nella camera di dissezione.
- Tagliare la punta posteriore della larva fuori con microscissors. Nota: questo passaggio si apre un'apertura alla fine posteriore della larva che permetterà di accesso per il microscissors (punto 2.7).
- Prendete con le pinze la regione del budello che ora spunta fuori l'apertura alla fine posteriore della larva. Estrarre delicatamente l'intestino intero.
- Posizionare ilpunta di una lama di microscissors attraverso l'apertura e tagliare lungo la linea mediana ventrale verso l'anteriore.
- Utilizzando i perni d'angolo, pin agli angoli ora libero, posteriore, poi anteriore. Allo stesso tempo delicatamente tratto aperto il filetto larvale.
3. Fissazione, blocco, colorazione e montaggio di filetti larvale
Note prima di iniziare: tutte le fasi di fissazione e colorazione sono svolte nella camera di dissezione. Durante questo processo, fare attenzione a non urtare i perni tenendo la larva dell'insetto in quanto ciò potrebbe provocare danni tissutali. Per evitare che l'esperimento si secchi, fare tutti i passi colorazione in un piccolo contenitore Tupperware circondato da tessuti inumidito.
- Aspirare il Ca + +-libero HL3.1 buffer utilizzando una punta di giallo. Aggiungere immediatamente il fissativo utilizzando un altro pipetteman.
- Pipettare delicatamente su e giù per miscelare il fissativo con le restanti tracce di Ca + +-libero HL3.1 tamponenella camera. Immediatamente aspirato e quindi aggiungere fissativo fresco nella camera.
- Incubare a temperatura ambiente per 20 minuti.
- Lavare 10 minuti 6x in PBST (0,1% Triton X-100 in PBS).
- Blocco con siero di capra al 5% in PBST per 20 minuti a RT.
- Sostituire la soluzione di saturazione con anticorpi primari diluiti in siero di capra al 5% in PBST. Gli anticorpi primari utilizzati sono topo anti-α-tubulina (DM1A) e nel ratto anti-CD8 (5H10) sia diluito 1 / 1000.
Nota: L'investigatore può voler sostituire il mouse anti-α-tubulina (DM1A) con il mouse anti-Futsch (22C10) 20,21 diluito 1 / 1000 in alcune circostanze (vedi la discussione).
- Incubare per una notte (per almeno 16h) a 4 ° C.
- Lavare 10 minuti 6x in PBST.
- Aggiungere la soluzione secondaria di anticorpi nel siero di capra diluito al 5% in PBST. Gli anticorpi secondari utilizzati sono Alexa Fluor 488 capra anti-topo IgG e Cy3 asino anti-topo IgG. Conservare il campione coperto per evitare fluoroforofotometabolismo 22.
- Incubare sia a temperatura ambiente per due ore o una notte a 4 ° C seguita da un'ora a temperatura ambiente.
- Lavare 10 minuti 6x in PBST.
- Mettere il filetto di larve sul vetrino cuticola rivolto verso il basso, montare in 80% glicerolo, e sigillare i lati del coprioggetto con smalto per un monte 'veloce'.
Nota: Per una migliore compensazione dei tessuti, e un campione permanente stabile, montare in DPX come descritto in precedenza 23.
4. Rappresentante dei risultati:
Colorazione fluorescente è stato esaminato al microscopio confocale. Nelle figure 1-2, rami diversi all'interno di un pergolato dendrite hanno diverse organizzazione del citoscheletro. La figura 1 mostra una regione del pergolato di una IV classe DA neurone al 1 ° stadio larvale instar. Il pergolato tutto è contrassegnato da mCD8:: KO e individuata tramite un anticorpo anti-CD8 e fluorescenti secondario (Cy3). Tubulina viene rilevato utilizzando anticorpi anti α-tubulina anticorpo e fluoroescent secondaria (Alexa Fluor 488). I rami principali sono positivi per la tubulina, alcuni rami laterali sottili sono tubulina-negativi. Movie 1 è un insieme di sezioni seriali attraverso una colorazione simile di una classe I DA neurone. La Figura 2 mostra una regione del pergolato di una IV classe DA neuroni colorati con anticorpi contro Futsch e CD8 al 1 ° stadio larvale instar. I rami principali sono Futsch-positivi, alcuni rami laterali sottili sono Futsch-negativi. Figura 3. Trachee nella parete del corpo larvale mostrano una complessa organizzazione dei microtubuli. Film 2 e 3 mostrano sezioni seriali di colorazione attraverso muscoli della parete del corpo e della trachea.
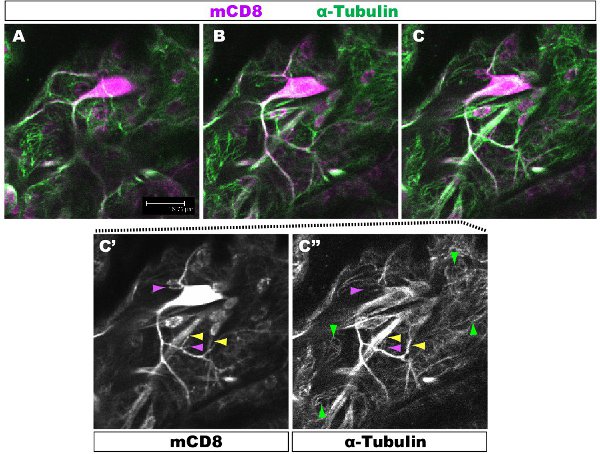
Figura 1. Fig. 1 mostra una regione del pergolato di una IV classe DA neurone al 1 ° stadio larvale instar. Il pergolato tutto è contrassegnato da mCD8:: KO e rilevati utilizzando anticorpi anti-CD8 e fluorescenti secondario (Cy3). Tubulina viene rilevato mediante anti-&-tubulin anticorpi e fluorescenti secondarie (Alexa 488). Pannelli AC sequenziale confocale z-sezioni (0.5μm), C 'C ", la colorazione degli anticorpi singolo pannello C. Esempio di rami con (freccia gialla) o senza (viola punta di freccia) microtubuli sono evidenziati. Red microtubuli evidenziano punte di freccia nel sottostante cellule epiteliali.
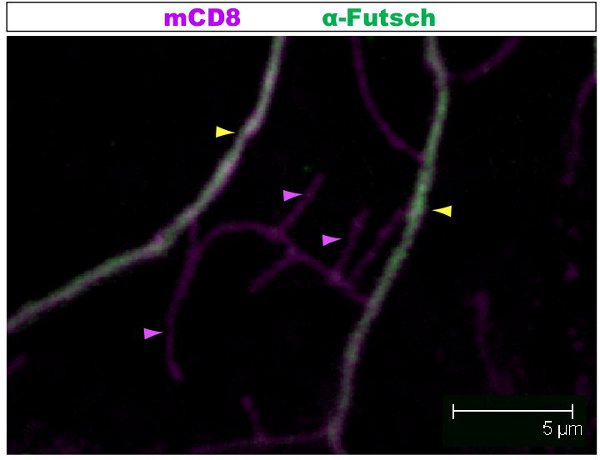
Figura 2. Fig. 2 mostra una regione simile del pergolato di una IV classe da neuroni colorati con anticorpi contro Futsch e CD8 al 1 ° stadio larvale instar. Il pergolato tutto è contrassegnato da mCD8:: KO e rilevati utilizzando anticorpi anti-CD8 e fluorescenti secondario (Cy3). Futsch viene rilevato utilizzando anticorpi anti-Futsch e fluorescenti secondarie (Alexa 488). I rami principali sono Futsch-positivi, alcuni rami laterali sottili sono Futsch-negativi. Esempio di rami con (freccia gialla) o senza (viola punta di freccia) Futsch sono evidenziati.
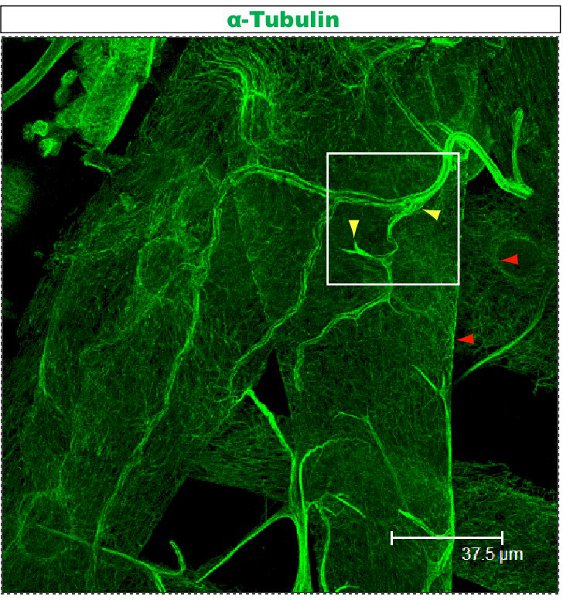
Figura 3. Trachea colorati con l'anti-tubulina protocollo sopra descritto. Questa larva è terzo instar e sezionato come descritto in precedenza 23,24. Movie 3 mostra allargata sezioni seriali dal campo contrassegnato da un quadrato.
Sezioni Movie 1. Serial tracciamento colorazione tubulina in tutto il pergolato dendritiche di una classe I neurone. Il pergolato tutto è contrassegnato da mCD8:: KO (Magenta) e rilevata con anticorpi anti-CD8 e fluorescenti secondario (Cy3). Tubulina (verde) viene rilevata con un anti-α-tubulina e anticorpi secondari fluorescenti (Alexa Fluor 488). Scala: da un lato dell'immagine video corrisponde alla 46.88μm nella sezione. Clicca qui per visualizzare il filmato.
Sezioni Movie 2. Serial tracciamento colorazione tubulina a body muscoli della parete di una larva di terzo stadio. Tubulina viene rilevato mediante anti-α-tubulina e anticorpi secondari fluorescenti (Alexa Fluor 488). Scala: da un lato dell'immagine video corrisponde alla 46.88μm nella sezione. Clicca qui per visualizzare il filmato.
Movie 3. Sezioni seriali tracciamento colorazione tubulina in un corpo trachea muro di una larva di terzo instar, contrassegnato con un quadrato in Figure.3. Tubulina viene rilevato mediante anti-α-tubulina e anticorpi secondari fluorescenti (Alexa Fluor 488). Scala: da un lato dell'immagine video corrisponde alla 46.88μm nella sezione. Clicca qui per visualizzare il filmato.
Discussione
Per capire come forme complesse cellule che sono raggiunto è importante essere in grado di accuratezza dell'organizzazione test microtubuli. Qui si descrive un metodo robusto etichettatura immunoistologiche all'organizzazione microtubuli dosaggio dei dendriti arborizzazione dendritica neurone sensoriale. Oltre alla colorazione neuroni sensoriali, questo metodo ottiene robusto colorazione immunoistologiche della trachea, dei muscoli e altri tessuti parete del corpo.
Noi utilizziamo q...
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Ringraziamo RIKEN per il finanziamento. P10-GAL4 è stato un gentile dono di Alain Vincent (Université Paul Sabatier di Tolosa, Francia).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Catalogo numero | Commenti (Opzionale) |
|---|---|---|---|
| Forcipe | Dumont | 11251-20 | |
| Microscissors | FST | 15000-08 | |
| Topo anti-α-tubulina (Clone: DM1A) | Sigma | T9026 | Diluizione 1 / 1000 |
| Topo anti-Futsch (Clone: 22C10), surnatante | Sviluppo Studi Ibridomi Banca | 22C10 | Diluizione 1 / 1000 |
| Rat anti-CD8 (Clone: 5H10) | Caltag | MCD0800 | Diluizione 1 / 1000 |
| Alexa Fluor 488 IgG anti-topo | Invitrogen | A-11001 | Diluizione 1 / 500 |
| Cy3 IgG anti-Rat | Jackson ImmunoResearch | 712-166-150 | Diluizione 1 / 200 |
Riferimenti
- Schottenfeld, J., Song, Y., Ghabrial, A. S. Tube continued: morphogenesis of the Drosophila tracheal system. Curr. Opin. Cell. Biol. 22, 633-639 (2010).
- Gao, F. B., Brenman, J. E., Jan, L. Y., Jan, Y. N. Genes regulating dendritic outgrowth, branching, and routing in Drosophila. Genes Dev. 13, 2549-2561 (1999).
- Corty, M. M., Matthews, B. J., Grueber, W. B. Molecules and mechanisms of dendrite development in Drosophila. Development. 136, 1049-1061 (2009).
- Moore, A. W. Intrinsic mechanisms to define neuron class-specific dendrite arbor morphology. Cell. Adh. Migr. 2, 81-82 (2008).
- Grueber, W. B., Jan, L. Y., Jan, Y. N. Tiling of the Drosophila epidermis by multidendritic sensory neurons. Development. 129, 2867-2878 (2002).
- Nishimura, Y. Selection of Behaviors and Segmental Coordination During Larval Locomotion Is Disrupted by Nuclear Polyglutamine Inclusions in a New Drosophila Huntington's Disease-Like Model. J. Neurogenet. 24, 194-206 (2010).
- Ramon y Cajal, S. . Histology of the nervous system of man and vertebrates, 1995 translation. , (1911).
- London, M., Hausser, M. Dendritic computation. Annu. Rev. Neurosci. 28, 503-532 (2005).
- Jinushi-Nakao, S. Knot/Collier and cut control different aspects of dendrite cytoskeleton and synergize to define final arbor shape. Neuron. 56, 963-978 (2007).
- Li, W., Gao, F. B. Actin filament-stabilizing protein tropomyosin regulates the size of dendritic fields. J. Neurosci. 23, 6171-6175 (2003).
- Ye, B. Differential regulation of dendritic and axonal development by the novel Kruppel-like factor Dar1. J. Neurosci. 31, 3309-3319 (2011).
- Parrish, J. Z., Xu, P., Kim, C. C., Jan, L. Y., Jan, Y. N. The microRNA bantam functions in epithelial cells to regulate scaling growth of dendrite arbors in drosophila sensory neurons. Neuron. 63, 788-802 (2009).
- Sugimura, K. Distinct developmental modes and lesion-induced reactions of dendrites of two classes of Drosophila sensory neurons. J. Neurosci. 23, 3752-3760 (2003).
- Budnik, V., Gorczyca, M., Prokop, A. Selected methods for the anatomical study of Drosophila embryonic and larval neuromuscular junctions. Int. Rev. Neurobiol. 75, 323-365 (2006).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila Protocols. , (2000).
- Shimono, K. Multidendritic sensory neurons in the adult Drosophila abdomen: origins, dendritic morphology, and segment- and age-dependent programmed cell death. Neural. Dev. 4, 37-37 (2009).
- Colomb, S., Joly, W., Bonneaud, N., Maschat, F. A concerted action of Engrailed and Gooseberry-Neuro in neuroblast 6-4 is triggering the formation of embryonic posterior commissure bundles. PLoS One. 3, 2197-2197 (2008).
- Dubois, L. Collier transcription in a single Drosophila muscle lineage: the combinatorial control of muscle identity. Development. 134, 4347-4355 (2007).
- Feng, Y., Ueda, A., Wu, C. F. A modified minimal hemolymph-like solution, HL3.1, for physiological recordings at the neuromuscular junctions of normal and mutant Drosophila larvae. J Neurogenet. 18, 377-402 (2004).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26, 357-370 (2000).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36, 15-26 (1984).
- Brent, J., Werner, K., McCabe, B. D. Drosophila Larval NMJ Immunohistochemistry. J. Vis. Exp. (25), e1108-e1108 (2009).
- Karim, M. R., Moore, A. W. Morphological Analysis of Drosophila Larval Peripheral Sensory Neuron Dendrites and Axons Using Genetic Mosaics. J. Vis. Exp. (57), e3111-e3111 (2011).
- Brent, J. R., Werner, K. M., McCabe, B. D. Drosophila Larval NMJ Dissection. J. Vis. Exp. (24), e1107-e1107 (2009).
- Tao, J., Rolls, M. M. Dendrites have a rapid program of injury-induced degeneration that is molecularly distinct from developmental pruning. J. Neurosci. 31, 5398-5405 (2011).
- Yamamoto, M., Ueda, R., Takahashi, K., Saigo, K., Uemura, T. Control of axonal sprouting and dendrite branching by the Nrg-Ank complex at the neuron-glia interface. Curr. Biol. 16, 1678-1683 (2006).
- Mattie, F. J. Directed microtubule growth, +TIPs, and kinesin-2 are required for uniform microtubule polarity in dendrites. Curr. Biol. 20, 2169-2177 (2010).
- Pawson, C., Eaton, B. A., Davis, G. W. Formin-dependent synaptic growth: evidence that Dlar signals via Diaphanous to modulate synaptic actin and dynamic pioneer microtubules. J. Neurosci. 28, 11111-11123 (2008).
- Williams, D. W., Tyrer, M., Shepherd, D. Tau and tau reporters disrupt central projections of sensory neurons in Drosophila. J. Comp. Neurol. 428, 630-640 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon