È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione del campione di
In questo articolo
Riepilogo
Il profilo metabolico di Mycobacterium tuberculosis È determinata dopo la crescita in colture in brodo. Le condizioni possono essere variate per testare gli effetti di integratori alimentari, ossidanti e anti-tubercolosi agenti sul profilo metabolico di questo microrganismo. Procedura per la preparazione estratto è applicabile sia per 1D 1 H e 2D 1 H- 13 C NMR.
Abstract
Mycobacterium tuberculosis è una delle principali cause di mortalità degli esseri umani su scala globale. L'emergere di due multi-(MDR) e estesamente-(XDR) ceppi farmaco-resistenti minaccia di far deragliare attuali sforzi di lotta contro la malattia. Pertanto, vi è una necessità urgente di sviluppare farmaci e vaccini che sono più efficaci di quelle attualmente disponibili. Il genoma di M. la tubercolosi è nota da più di 10 anni, ma ci sono importanti lacune nella nostra conoscenza della funzione genica e essenzialità. Molti studi hanno utilizzato da analisi di espressione genica sia a livello trascrittomica e proteomica per determinare gli effetti dei farmaci, ossidanti, e le condizioni di crescita sui modelli globali di espressione genica. In definitiva, la risposta finale di questi cambiamenti si riflette nella composizione metabolico del batterio comprendere alcune migliaia di sostanze a basso peso molecolare. Confrontando i profili metabolici di tipo selvatico e mutanti, sia trattata o treated con un particolare farmaco, può effettivamente permettere l'identificazione di destinazione e può portare allo sviluppo di nuovi inibitori con attività anti-tubercolare. Analogamente, gli effetti di due o più condizioni del metaboloma può anche essere valutato. Risonanza magnetica nucleare (NMR) è una tecnologia potente che viene utilizzato per identificare e quantificare intermedi metabolici. In questo protocollo, le procedure per la preparazione di M. tubercolosi estratti cellulari per l'analisi NMR metabolomica sono descritti. Colture di cellule vengono coltivate in condizioni appropriate e richiesto livello di biosicurezza 3 di contenimento 1, raccolte e sottoposte a lisi meccanica pur mantenendo basse temperature per massimizzare la conservazione dei metaboliti. Lisati cellulari sono recuperati, filtrati sterilizzato, e conservati a temperature bassissime. Aliquote di questi estratti di cellule sono piastrate su agar Middlebrook 7H9 per unità formanti colonia per verificare l'assenza di cellule vitali. Su due mesi di incubazione a 37 ° C, se non vicolonie capaci si osservano, i campioni vengono rimossi dalla struttura di contenimento per il trattamento a valle. Sono estratti liofilizzati, risospese in tampone deuterato e iniettato nello strumento NMR, catturando dati spettroscopici che viene poi sottoposto ad analisi statistica. Le procedure descritte possono essere applicate sia unidimensionale (1D) 1 H NMR e bidimensionale (2D) 1 H-13 C NMR. Questa metodologia fornisce più affidabile di identificazione piccolo peso molecolare metabolita e analisi quantitative più affidabili e sensibili di composizioni estratto cellulare metaboliche rispetto ai metodi cromatografici. Variazioni della procedura descritta in seguito alla fase di lisi cellulare può anche essere adattato per parallela analisi proteomica.
Protocollo
1. Protocollo di testo
Questo protocollo mette in evidenza l'adattamento della metodologia NMR a M. tubercolosi (Classe III agente). Pertanto, le pratiche di biosicurezza di livello 3 (BSL3) devono essere seguite per lo svolgimento di M. ricerca tubercolosi in un laboratorio certificato annualmente. L'esposizione al laboratorio generati aerosol è il pericolo più importante incontrato da personale che lavora con questi microrganismi. Le seguenti procedure si svolgono nel nostro istituto e possono variare in base alle raccomandazioni del Comitato Istituzionale biosicurezza. Personale comuni dispositivi di protezione consiste in un abito Tyvek, tappo bouffant, stivaletti, respiratore N95, protezione per gli occhi, maniche, e una doppia coppia di guanti in nitrile. Lavori comportanti M. culture tubercolosi e / o manipolazioni con aperto M. tubercolosi contenitori avviene nel tipo A2 o B2 cappa di sicurezza biologica. Plastica ricoperto di carta assorbente è posto sul wavorare superficie. Tutti i materiali / forniture da smaltire o rimuovere l'impianto deve essere posto in due sacchi a rischio biologico e decontaminati in autoclave. Le superfici di lavoro e le attrezzature utilizzate all'interno del cabinet (FastPrep-24 lisi omogeneizzatore, spettrofotometro, secchiello con ghiaccio, ecc) devono essere disinfettati dopo ogni sessione di lavoro con 1% Amphyl (tubercolicida, agente battericida, fungicida, virucida e). M. culture tubercolosi deve essere sottoposto a doppio contenimento per il trasporto di grandi attrezzature che si trovano al di fuori della cappa di sicurezza biologica, come congelatori, incubatori, centrifughe, e frigorifero. La centrifugazione è condotta con coppe di sicurezza chiusi e O-ring tubi con tappo a vite. Per ulteriori analisi fuori del laboratorio BSL3, estratti acellulari sono filtrati attraverso un filtro di 0,2 pm o microrganismi uccisi calore a 95 ° C per 15 min. Due campioni vengono piastrate per verificare l'assenza di unità formanti colonie prima di rimuoverla dal contenimento.
- Trasferire 110 ml di mezzi completi Middlebrook 7H9 contenente polisorbato 80 (Tween 80 per evitare grumi) brodo (mADC-TW) o di un mezzo adatto a una beuta da 250 ml. Colture in triplicato sono regolarmente coltivati a condizione quando si utilizza 13 C-metaboliti, e dieci culture identiche sono coltivate per 1D 1 profili H NMR. Per due condizioni (ad esempio, con e senza aggiunta di farmaci), volume doppio di cultura per replica possono essere coltivate e diviso in due culture identiche. Tutte le ricette reagenti e soluzioni sono forniti alla fine del protocollo.
- Inoculare brodo con 0,150 ml di M. tubercolosi stock in glicerolo 50% (permette di scongelare il ghiaccio). Vedere la nota 1 di seguito.
- Lasciate crescere la coltura a 37 ° C agitando a 100 rpm per circa 6 giorni (OD 600 0,6-0,8). Vedere la nota 2 di seguito.
- Se non antibiotici, aggiunte alternativi o altri trattamenti sono necessari, le culture sono pronte per essere raccolte. Se i trattamenti vengono utilizzati, continuaredirettamente al punto 5. Rimuovere da 0,5 ml di campione da ciascuna beuta, trasferire in una provetta e posto a 4 ° C per la titolazione di cultura e di controllo della qualità: test di contaminazione, analisi fenotipica, test PCR. Vedere la nota 3. A questo punto, passare al punto 6.
- Rimuovere staffe da shaker ed eseguire il trattamento desiderato (ad esempio, aggiungere farmaco o metabolita). Luogo boccette indietro nello shaker e incubare per un ulteriore periodo (ad esempio, 6-18 ore). Alla fine di questo tempo, prendere un'altra aliquota 1,0 ml e determinare OD 600. Rimuovere da 0,5 ml di campione da ciascuna beuta, trasferire in una provetta e posto a 4 ° C per la titolazione di cultura e di controllo della qualità.
- Luogo culture in ghiaccio per 5 min. Dopo questo passo, lasciare cellule in ghiaccio durante l'intero protocollo rimanente. Culture Harvest mediante centrifugazione a 2.000 xg e 4 ° C per 15 minuti in provette da 50 ml con una centrifuga da banco. Ogni cultura richiede quattro provette con 25 ml ciascuno (per un totale di 100 ml è necessaria per ottenere un adeguato rapporto segnale-rumore per 2D 1 H-13 C esperimenti NMR, in cui è richiesto solo 50 ml per la cultura per 1D 1 H esperimenti NMR).
- Lavare ciascun pellet cellulare due volte con ghiacciata DDH 2 O (circa 15 ml la prima volta e 10 ml la seconda volta) dai parametri di centrifugazione sopra descritti. Per il secondo lavaggio, combinare le aliquote da 10 ml nel tubo stesso prima della filatura. Risospendere il pellet di cellule in un volume finale di 1,0 ml DDH 2 O (necessario regolare il volume di pellet). Se una sospensione singola cella libera di aggregazione è desiderato in questa fase, le cellule possono essere brevemente sonicata e / o passare attraverso un ago calibro 27 per tre volte. In alternativa, il pellet cellulare può essere congelato a -80 ° C e conservato fino al procedimento successivo. In quest'ultimo caso, pellet congelati vengono scongelati in ghiaccio prima risospensione. Risospendere il pellet di cellule in un volume finale di 1,0 ml DDH 2 O come sopra indicato.
- Transfer la cella di 1,0 ml di sospensione in una provetta con tappo a vite contenente 2,0 ml lisi Matrix B (0,1 sfere di silice mm). Posizionare l'omogeneizzatore FastPrep-24 lisi all'interno dell'armadio biosicurezza. Mettere i campioni nel portacampioni, garantire il mantenimento parlato sulla piastra superiore del tubo. Elaborare i campioni per 60 sec in omogeneizzatore ad una impostazione velocità di 6 metri / sec.
- Centrifugare i campioni in una microcentrifuga a 15.000 xg e 4 ° C per 10 min a pellet cellulare detriti e cellule intatte.
- Rimuovere campione surnatante e passa attraverso un filtro siringa (0,2 micron) in una provetta sterile. Piastra 0,1 ml di campione (o una frazione rappresentativa del campione, come per esempio 10%) su agar MADC per verificare che non vi siano cellule vitali. Investigatori possono anche effettuare più di una fase di filtrazione e / o verificare la presenza di cellule vitali negli estratti usando live-morti procedure di colorazione in modo da prevenire o individuare eventuali problemi potenziali biosicurezza. Congelarli in un etanolo-bagno di ghiaccio secco per memorizzarea -80 ° C fino a quando non sono pronti per essere liofilizzate e trasformati in un impianto NMR.
- Dopo 2 mesi, controllare le piastre per verificare l'assenza di unità formanti colonia. Se non CFU sono trovati, possono essere prelevati campioni di laboratorio BSL3. Ulteriori analisi viene effettuata in una struttura NMR standard, che normalmente serve multiutente e opera in nessun esigenze specifiche di contenimento.
- Liofilizzare i campioni a secchezza, quindi risospendere in 0,7 ml di tampone NMR e trasferimento in una provetta da microcentrifuga. Centrifugare per 3 min a 13000 x g. Rimuovere 0,6 ml e trasferimento in un tubo NMR 5 mm. In alternativa, i campioni liofilizzati possono essere inviati a un impianto esterno di campioni regolari non a rischio biologico.
- NMR dati vengono raccolti immediatamente. Nonostante tutte le precauzioni, enzimi attivi può essere ancora presente e il campione non è tipicamente stabile per lunghi periodi di tempo. Cambiamenti nello spettro NMR è evidente quando i campioni vengono lasciate a temperatura ambiente oppure a 4 ° C per mminerale di 1 settimana. Inoltre, la raccolta dei dati NMR si alterna tra le colture trattate e non trattate di droga, in cui i campioni sono scelti a caso per ogni categoria. Questo impedisce di polarizzazione necessario perché una determinata categoria ha avuto un ritardo più lungo prima gli spettri NMR sono stati raccolti. Una polarizzazione nei dati avverrebbe se gli spettri NMR per tutti i campioni non trattati sono stati raccolti prima, e poi seguito dai campioni di farmaci trattati. Se i campioni non possono essere immediatamente analizzati mediante NMR, i campioni devono essere conservati in 1 ml provette Eppendorf a -80 ° C.
- Dopo aver inserito i campioni in un BACS-120 di campioni, la calibrazione degli strumenti, che coinvolge pochi passi di routine come la serratura, spessore, mettere a punto e ottimizzazione del 90 ° lunghezza di impulso, è necessaria per massimizzare la qualità dei risultati. Un solo campione viene utilizzato per calibrare il 90 ° lunghezza dell'impulso e accordare lo strumento per i campioni rimanenti. Di bloccaggio, spessoramento, e la raccolta di dati NMR per ogni campione è automatizzato using ICONNMR e gradshim.
- A 1D 1 H NMR vengono raccolti utilizzando il Bruker zgesgp sequenza di impulsi con soppressione dell'acqua utilizzando scultura di eccitazione. Un totale di 32k punti di dati con una larghezza di spazzata 5482.5Hz, 128 scansioni e 16 scansioni fittizie sono utilizzati. Un 2D 1 H-13 C spettro HSQC vengono raccolti utilizzando il Bruker hsqcetgp sequenza di impulsi. Un totale di 2048 punti dati con una larghezza di scansione di 5000,0 Hz viene raccolto lungo la diretta 1 dimensione H, e 64 punti di dati con una larghezza di scansione di 18864,9 Hz lungo la dimensione indiretta 13 C. Lo spettro viene raccolto con 128 scansioni e 16 scansioni fittizie per ottenere buon segnale al rumore.
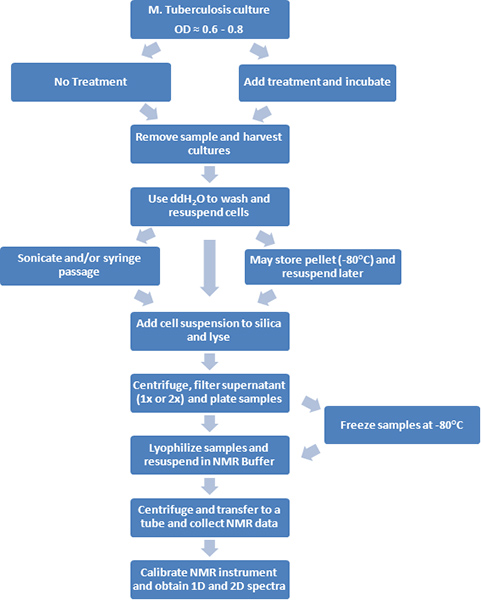
Figura 1. Un diagramma di flusso delle procedure sperimentali è raffigurato.
NMR del buffer
Soluzione madre di 50 appassionato mM fosfato di potassioer con 50 TMSP pM:
- 2.17 g K 2 HPO 4 (potassio fosfato bibasico)
- 1,70 g KH 2 PO 4 (potassio fosfato monobasico)
- 7,86 mg di sodio-3-Trimethylsilylpropionate (TMSP-2 ,2,3,3-D 4 (D, 98%))
- Sciogliere in 500 ml di "100%" D 2 O
- La soluzione finale è a pH 7,2 (non corretta)
MADC-TW o MOADC-TW (1 L)
- 4,7 g di brodo Middlebrook 7H9 di base
- 900 ml DDH 2 O
- 2 ml glicerolo
- Miscelare i componenti e autoclave per 25 min. Liquido freddo al tatto e aggiungere le seguenti soluzioni:
- 100 ml ADC durante la preparazione mADC o 100 ml per la preparazione OADC MOADC
- 2,5 ml 20% Tween 80 (in alternativa, 1 ml di non metabolizzabile tyloxapol 20%)
- 10 ml cicloeximide 1%
ADC (1 L)
- 20 g di D (+)-Glucosio
- 50 g BSA FrazioneV
- 8,5 g NaCl
- 800 ml DDH 2 O
- Sciogliere insieme, regolare il volume a 1 L e sterilizzare con 0,2 micron filtro. Conservare a 4 ° C.
In alternativa, per preparare OADC (1L), aggiungere tutti i componenti sopra elencati più 50 ml di acido oleico 1% (ricetta sotto fa un lotto 250 ml). Sciogliere insieme, regolare il volume a 1 L e sterilizzare con 0,2 micron filtro. Bottiglia ha bisogno di essere avvolti in un foglio di alluminio e conservare a 4 ° C.
- 2,5 g Acido oleico
- 250 ml di NaOH 0,2 M
- Thaw acido oleico (solidifica sulla refrigerazione) mediante riscaldamento a 55 ° C per 10 min e aggiungere soluzione di NaOH e calore con agitazione per 60 min. Conservare in bottiglie di vetro sterili che vengono avvolti in fogli di alluminio. Sigillare con parafilm bottiglie e conservare a 4 ° C.
Se si preferisce, è possibile acquistare commerciale BD BBL Middlebrook ADC o OADC con arricchimento catalasi.
1% cicloeximide (100ml)
- 1 g cicloeximide
- 100 ml DDH 2 O
Sciogliere e sterilizzare con 0,2 micron filtro. Conservare a 4 ° C. Attenzione: cicloeximide è tossica quindi maneggiare con estrema cura.
20% (v / v) Tween 80 (100ml)
- 20 ml di Tween 80
- 80 ml DDH 2 O
In alternativa, pesano 20 g di Tween 80 (circa 18,9 ml; densità 1,06 g / ml), per preparare 20% w / v soluzione. Calore soluzione a 55 ° C per 30 minuti per sciogliere e miscelare completamente. Sterilizzare liquido con un 0,2 micron filtro. Conservare la soluzione finale a temperatura ambiente.
20% (v / v) tyloxapol (100ml)
- 20 ml tyloxapol
- 80 ml DDH 2 O
In alternativa, pesano 20 g di tyloxapol (circa 18,2 ml; densità 1,1 g / ml), per preparare 20% w / v soluzione. Calore soluzione a 55 ° C per 30 min a dissolve, e mescolare completamente. Sterilizzare liquido con un 0,2 micron filtro. Conservare la soluzione finale a temperatura ambiente.
Nota 1: le scorte della glicerina della M. tuberculosis vengono preparati utilizzando il seguente protocollo.
Calza di M. tubercolosi
- Grow M. tubercolosi in 50 ml MADC a saturazione (OD 600 = 1,5 a 2,0) a 37 ° C in condizioni di agitazione (100 rpm). A seconda del ceppo, questo i 7-14 giorni.
- Spin campioni a 2.000 xg a 4 ° C per 15 minuti alla cultura pellet. Rimuovere il surnatante.
- Risospendere in 6 ml di glicerolo 50% sterile.
- Distribuire 1.5 ml in 4 Corning fiale criogeniche ed etichetta in modo appropriato.
- Immediatamente fiale freeze flash in etanolo / bagno di ghiaccio secco e conservare a -80 ° C.
Nota 2: inoculo ceppo H37Rv (-80 ° C disponibile fino a 1,5 anni) in 70 ml di mADC supporto produce un OD 600 </> Sub di circa 0,6 dopo 5 giorni di crescita a 37 ° C in condizioni di agitazione (100 rpm) a un Innova 40 Shaker.
Nota 3: Per verificare la contaminazione della cultura, gli investigatori potrebbero inoculare un'aliquota di cultura su guida standard medi ricchi e verificare l'assenza di crescita dopo incubazione per una notte. Di routine, le colture vengono piastrate su agar mADC per osservare la morfologia delle colonie ed esaminare in contrasto di fase microscopio. Se lo si desidera, le culture può essere verificata mediante PCR utilizzando primers IS 6110 come descritto 3.
2. Risultati rappresentativi
Un campione che è ben preparato produrrà uno spettro NMR simile a quello illustrato nella figura 2. Questo spettro è una rappresentazione del M. tubercolosi di tipo selvatico piscina metabolica. I metaboliti identificati sono direttamente o indirettamente associato al D-alanina pathway. Inoltre, la grandezza di intensità di picco è proporzionale alla concentrazione dei metaboliti presentarenell'estratto cella. Pertanto i cambiamenti di intensità di picco tra le culture non trattate, trattamento farmacologico, e ceppi mutanti può indicare perturbazioni in metaboliti e vie metaboliche. Il M. tuberculosis 1D 1 H NMR sono stati raccolti su un Bruker Avance 500 MHz spettrometro dotato tripla risonanza, asse Z cryoprobe gradiente. Lo spettro contiene ca. 400 cime, da cui è stato possibile identificare e quantificare 40-50 metaboliti, tra cui aminoacidi, precursori di nucleotidi, e intermedi e acido citrico e glicolitici. Un commutatore di BACS-120 campione con il software Bruker Icon è stato utilizzato per automatizzare la raccolta dei dati NMR. 1D 1 H NMR sono stati raccolti usando scolpire eccitazione 4 per rimuovere efficacemente il solvente e mantenere una linea di base piatta, eliminando la necessità di raccolta basale che possono indurre artefatti nella successiva analisi delle componenti principali (PCA) o ortogonali almeno parziale analisi discriminante quadrati (OPLS- DA). A 1D 1 H NMR sono raccolte a 25 ° C con una larghezza di spettro 5482,5 Hz e 32K punti dati. Un totale di 16 scansioni dummy e 128 scansioni sono state utilizzate per ottenere lo spettro. La 1D ACD Labs NMR software del processore è stato utilizzato per semi-automatico elaborare tutte le 1D 1 H NMR. Gli spettri sono stati trasformata di Fourier, graduale, e fa riferimento al picco TMSP (0,0 ppm). Il pacchetto software NMRpipe stato utilizzato per elaborare singolarmente il 2D 1 H-13 C NMR e analizzati con NMRDraw. Il Bruker FID file di dati era stato convertito in un formato di file riconoscibile da NMRpipe e lo spettro è stata trasformata di Fourier, correzione di fase, e zero riempito. I picchi NMR osservati nel 1D 1 H NMR 2D e 1 H-13 C NMR sono assegnate a specifici metaboliti mediante 1 H e 13 C Tolleranze di chemical shift di 0,05 e 0,50 ppm, rispettivamente, e il Madison Metabolomica Consorzio Database (MMCD ), 5 la BioMagResBank, 6 e il database umano metaboloma. 7 In particolare, gli spettri NMR 1D e 2D sono raccolte manualmente picco, dove la lista picco di NMR chemical shift viene poi caricato nel database umano metaboloma. I metaboliti identificati dal Database metaboloma umano sono assegnati allo spettro NMR basato sia massimizzare il numero delle corrispondenti risonanze NMR e appartenente ad una rete metabolica. Ogni composto o metabolita di solito ha più coppie CH e risonanze NMR corrispondentemente più. Così, più di queste risonanze NMR che si osservano nello spettro NMR sperimentale, più è probabile il metabolita è presente. Analogamente, identificando metaboliti multipli associati con lo stesso percorso aumenta la probabilità di assegnazioni corrette. La presenza di metaboliti e vie metaboliche sono verificati con l'Enciclopedia di Kyoto dei geni e genomi (KEGG) 8 ei database MetaCyc 9. Mycobacterium smegmATIS è un sistema modello utile per M. tubercolosi e altri patogeni micobatteriche. Come descritto altrove, campioni di M. smegmatis potrebbe anche essere interrotto da sonicazione 10.
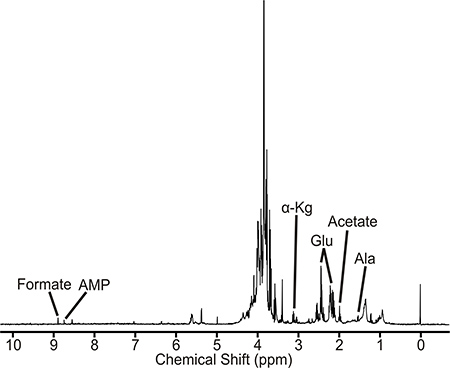
Figura 2. 1D 1 H NMR del estratto cellulare Mycobacterium tuberculosis. Picchi NMR associati metaboliti rappresentativi sono etichettati. Abbreviazioni sono le seguenti: AMP, adenosina fosfato mono; α-Kg, α-chetoglutarato, Glu, glutammato e Ala, alanina.
Discussione
Un numero significativo di studi ha analizzato i profili di trascrittomica e proteomica di M. tubercolosi sotto una varietà di in vitro e in vivo. 11-16 definitiva, cambiamenti nell'espressione genica e dell'attività enzimatica portare a variazioni nella concentrazione di piccole molecole di peso molecolare. La descrizione completa di questi composti costituisce il metaboloma. Pertanto, gli effetti delle droghe e delle condizioni di crescita variabile sulle vie metaboliche...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare tutti i membri dei laboratori del dottor Barletta e il Dott. Powers per gli utili commenti durante lo sviluppo del protocollo. Ringraziamo Wendy Austin per le discussioni utili e correzione di bozze del manoscritto. Il lavoro descritto in questo manoscritto è stato finanziato da borse di studio pilota di semi per ogni investigatore di cui sopra presso la University of Nebraska-Lincoln Center Biologia Redox (genitore sovvenzione # NCRR 2P20RR 017675, D. Becker, PI). Inoltre, ringraziamo il Dr. Ofelia Chacon per fornire fondi da lei R21 sovvenzioni (1R21AI087561-01A1) per le forniture di ricerca e di sostegno stipendio parziale signor Halouska di standardizzare le tecniche NMR riportati nella presente pubblicazione.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente / attrezzature | Azienda | Numero di catalogo | Commenti |
| ADC Arricchimento | BD BBL Middlebrook | 212352 | |
| BACS-120 Sample Changer | Bruker | ||
| Bruker Avance NMR | Bruker | 500 MHz | |
| Albumina di siero bovino | Fisher Scientific | BP1600-100 | Frazione V |
| Centrifuga | Beckman Coulter | Allegra X-15R | Da banco |
| Tubi per centrifuga | Corning | 430291 | 50 ml polipropilene sterile |
| Fiale criogeniche | Corning | 430488 | 2,0 ml in polipropilene sterile |
| Cycloheximide | AG scientifico | C-1189 | Tossico |
| D (+) - Glucosio | ACROS | 41095-0010 | |
| Ossido di deuterio | Sigma Aldrich | 617385 | |
| Beuta | VWR | 89095-266 | Sterile, base piatta, policarbonato, 0,22 micron membrana in PTFE tappo ventilato |
| Flash Freeze Flask | VWR | 82018-226 | 750 ml |
| Liofilizzatore | VWR | 82019-038 | 4.5 L da banco |
| Glicerina | GibcoBRL | 15514-029 | |
| Incubatrice | Nuovo Brunswick | Innova 40 | Agitatore da banco |
| Lisi Matrix B | MP Biomedicals | 6911-100 | |
| Lysis macchina | MP Biomedicals | FastPrep-24 | |
| Microcentrifuga | Eppendorf | 5415D | Da banco |
| Microcentrifuga | Beckman Coulter | Microcentrifuga 22R | Da banco |
| Brodo Middlebrook 7H9 | Difco | 271310 | |
| NMR tubi | Norell | ST500-7 | 5 mM |
| Arricchimento OADC | BD BBL Middlebrook | 212351 | |
| Acido oleico | Sigma | O1008 | |
| Fosfato di potassio bibasico | VWR | BDH0266 | |
| Potassio fosfato monobasico | VWR | BDH0268 | |
| Rotor - Microcentrifugare 22R | Beckman Coulter | F241.5P | Sigillata e polipropilene |
| Rotor - Allegra X-15R | Beckman Coulter | SX4750 | Con bio-certificati coperture |
| Cloruro di sodio | Fisher Scientific | S271-3 | |
| Sodio-3-trimethylsilylpropionate-2 ,2,3,3-D4 | Cambridge Isotope | DLM-48 | |
| Spettrofotometro | Beckman Coulter | DU-530 | |
| Spettrofotometro Cuvette | Sagola di salvataggio | LS-2410 | 1,5 ml in polistirolo, 2 lati trasparenti |
| Siringa | Becton Dickinson | 309585 | Sterile, 3 ml Luer-Lok |
| Siringa Filtro | Nalgene | 190-2520 | Acetato di 0,2 micron di cellulosa sterile |
| Tween 80 | Fisher Scientific | BP338-500 |
Riferimenti
- Larsen, M. H., Biermann, K., Tandberg, S., Hsu, T., Jacobs, W. R. Genetic Manipulation of Mycobacterium tuberculosis. Curr. Protoc. Microbiol. Chapter 10, 2 (2007).
- Larsen, M. H., Biermann, K., Jacobs, W. R. Laboratory Maintenance of Mycobacterium tuberculosis. Curr. Protoc. Microbiol. Chapter 10, 1 (2007).
- Clarridge, J. E., Shawar, R. M., Shinnick, T. M., Plikaytis, B. B. Large-scale use of polymerase chain reaction for detection of Mycobacterium tuberculosis in a routine mycobacteriology laboratory. J. Clin. Microbiol. 31, 2049-2056 (1993).
- Nguyen, B. D., Meng, X., Donovan, K. J., Shaka, A. J. SOGGY: solvent-optimized double gradient spectroscopy for water suppression. A comparison with some existing techniques. J. Magn. Reson. 184, 263-274 (2007).
- Cui, Q. Metabolite identification via the Madison Metabolomics Consortium Database. Nat. Biotechnol. 26, 162-164 (2008).
- Ulrich, E. L. BioMagResBank. Nucleic Acids Res. 36, 402-408 (2008).
- Wishart, D. S. HMDB: the Human Metabolome Database. Nucleic Acids Res. 35, 521-526 (2007).
- Kanehisa, M. KEGG for linking genomes to life and the environment. Nucleic Acids Res. 36, 480-484 (2008).
- Karp, P. D. Expansion of the BioCyc collection of pathway/genome databases to 160 genomes. Nucleic Acids Res. 33, 6083-6089 (2005).
- Halouska, S. Use of NMR metabolomics to analyze the targets of D-cycloserine in mycobacteria: role of D-alanine racemase. J. Proteome. Res. 6, 4608-4614 (2007).
- Boshoff, H. I. The transcriptional responses of Mycobacterium tuberculosis to inhibitors of metabolism: novel insights into drug mechanisms of action. J. Biol. Chem. 279, 40174-40184 (2004).
- Mehaffy, C. Descriptive proteomic analysis shows protein variability between closely related clinical isolates of Mycobacterium tuberculosis. Proteomics. 10, 1966-1984 (2010).
- Schnappinger, D. Transcriptional Adaptation of Mycobacterium tuberculosis within Macrophages: Insights into the Phagosomal Environment. J. Exp. Med. 198, 693-704 (2003).
- Schnappinger, D., Schoolnik, G. K., Ehrt, S. Expression profiling of host pathogen interactions: how Mycobacterium tuberculosis and the macrophage adapt to one another. Microbes. Infect. 8, 1132-1140 (2006).
- Shui, W. Quantitative proteomic profiling of host-pathogen interactions: the macrophage response to Mycobacterium tuberculosis lipids. J. Proteome. Res. 8, 282-289 (2009).
- Talaat, A. M., Lyons, R., Howard, S. T., Johnston, S. A. The temporal expression profile of Mycobacterium tuberculosis infection in mice. Proc. Natl. Acad. Sci. U.S.A. 101, 4602-4607 (2004).
- Forgue, P. NMR metabolic profiling of Aspergillus nidulans to monitor drug and protein activity. J. Proteome Res. 5, 1916-1923 (2006).
- Goodacre, R., Vaidyanathan, S., Dunn, W. B., Harrigan, G. G., Kell, D. B. Metabolomics by numbers: acquiring and understanding global metabolite data. Trends Biotechnol. 22, 245-252 (2004).
- Shin, J. H. NMR-based Metabolomic Profiling in Mice Infected with Mycobacterium tuberculosis. J. Proteome Res. 10, 2238-2247 (2011).
- Jaki, B. U., Franzblau, S. G., Cho, S. H., Pauli, G. F. Development of an extraction method for mycobacterial metabolome analysis. J. Pharm. Biomed. Anal. 41, 196-200 (2006).
- de Carvalho, L. P. Metabolomics of Mycobacterium tuberculosis reveals compartmentalized co-catabolism of carbon substrates. Chem. Biol. 17, 1122-1131 (2010).
- de Carvalho, L. P. Activity-based metabolomic profiling of enzymatic function: identification of Rv1248c as a mycobacterial 2-hydroxy-3-oxoadipate synthase. Chem. Biol. 17, 323-332 (2010).
- Marrero, J., Rhee, K. Y., Schnappinger, D., Pethe, K., Ehrt, S. Gluconeogenic carbon flow of tricarboxylic acid cycle intermediates is critical for Mycobacterium tuberculosis to establish and maintain infection. Proc. Natl. Acad. Sci. U.S.A. 107, 9819-9824 (2010).
- Tang, Y. J. Central metabolism in Mycobacterium smegmatis during the transition from O2-rich to O2-poor conditions as studied by isotopomer-assisted metabolite analysis. Biotechnol. Lett. 31, 1233-1240 (2009).
- Kweon, O. A polyomic approach to elucidate the fluoranthene-degradative pathway in Mycobacterium vanbaalenii PYR-1. J. Bacteriol. 189, 4635-4647 (2007).
- Hasan, M. R., Rahman, M., Jaques, S., Purwantini, E., Daniels, L. Glucose 6-phosphate accumulation in mycobacteria: implications for a novel F420-dependent anti-oxidant defense system. J. Biol. Chem. 285, 19135-19144 (2010).
- Soga, T. Quantitative metabolome analysis using capillary electrophoresis mass spectrometry. J. Proteome Res. 2, 488-494 (2003).
- Metz, T. O. The future of liquid chromatography-mass spectrometry (LC-MS) in metabolic profiling and metabolomic studies for biomarker discovery. Biomark Med. 1, 159-185 (2007).
- Ludwig, C., Viant, M. R. Two-dimensional J-resolved NMR spectroscopy: review of a key methodology in the metabolomics toolbox. Phytochem. Anal. 21, 22-32 (2010).
- Simpson, R. J., Inglis, J. . Proteins and Proteomics: A Laboratory Manual. , 425-595 (2003).
- Beste, D. J., McFadden, J. System-level strategies for studying the metabolism of Mycobacterium tuberculosis. Mol. Biosyst. 6, 2363-2372 (2010).
- Rhee, K. Y. Central carbon metabolism in Mycobacterium tuberculosis: an unexpected frontier. Trends Microbiol. , (2011).
- Who. Health Organization. Anti-tuberculosis Drug Resistance in the World: Report No. 4. , (2008).
- Jassal, M., Bishai, W. R. Extensively drug-resistant tuberculosis. Lancet Infect Dis. 9, 19-30 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon