Method Article
Visualizzazione dei Propriorecettori in
In questo articolo
Riepilogo
Un metodo per immunostain e visualizzare organi cordotonali in larve e delle pupe Drosophila melanogaster Descritto.
Abstract
La propriocezione è la capacità di percepire il movimento, o la posizione, di parti del corpo, rispondendo agli stimoli derivanti all'interno del corpo. In moscerini e altri insetti propriocezione è fornita da personale specializzato organi sensoriali chiamati organi cordotonali (c'os) 2. Come molti altri organi in Drosophila, Chos sviluppare due volte durante il ciclo di vita della mosca. In primo luogo, il Chos larve si sviluppano durante l'embriogenesi. Poi, i Chos adulti cominciare a sviluppare nei dischi immaginali larvali e continuano a differenziare durante la metamorfosi.
Lo sviluppo di Chos larvali durante l'embriogenesi è stata ampiamente studiata 10,11,13,15,16. Il fulcro di ogni Cho è una unità sensoriale composto da un neurone e una cellula scolopale. L'unità sensoriale è teso tra due tipi di cellule accessorie che si attaccano alla cuticola tramite cellule specializzate di attacco epidermiche 1,9,14. Quando una larva di mosca si muove, lo sfollamento e della relativacellule di fissaggio pidermal porta allo stiramento dell'unità sensoriale e la conseguente apertura specifici transitori recettore vanilloide potenziale (TRPV) canali al segmento esterno del dendrite 8,12. Il segnale suscitato viene poi trasferito al circuito generatore di modello di locomotore centrale nel sistema nervoso centrale.
Chos multiple sono state descritte nella mosca adulta 7. Questi sono situati vicino alle articolazioni delle appendici mosca adulta (gambe, ali e cavezze) e nel torace e nell'addome. Inoltre, diverse centinaia di Chos collettivamente formano l'organo di Johnston nel antenna adulto che trasducono acustica in energia meccanica 3,5,17,4.
In contrasto con la conoscenza approfondita sullo sviluppo di Chos in stadi embrionali, molto poco si sa circa la morfologia di questi organi durante le fasi larvali. Inoltre, ad eccezione di Chos femorale 18 e organo Johnston, il conoscenge sullo sviluppo e la struttura del Chos nella mosca adulta è molto frammentaria.
Qui si descrive un metodo per la colorazione e la visualizzazione chos in terza larve instar e pupe. Questo metodo può essere applicato con strumenti genetici per caratterizzare meglio comprendere la morfologia e lo sviluppo del C'os vari la mosca.
Protocollo
Prima di iniziare
- Far crescere le culture mosca desiderati. Tenere i flaconcini poco affollate (circa 30 mosche per flaconcino da 50 ml). Lasciate che le mosche depongono le uova per un solo giorno in ogni fiala. Ciò garantirà l'approvvigionamento alimentare sufficiente larve e permettere loro di raggiungere una dimensione massima prima di strisciare fuori dal cibo. Tenere i flaconcini di temperatura adeguata fino al terzo stadio le larve iniziano a vagare sulla parete flaconcino.
- Preparare un nuovo ceppo di tampone fosfato (PBS) e PBT (0,1% Tween in PBS). Mantenere 10 ml di PBS su ghiaccio.
- Preparare 1-5 ml di fissativo fresco (4% della formaldeide in PBT) e tenerlo in ghiaccio. Usiamo bottiglia di formaldeide 37-38% come soluzione stock.
1. Dissezione e fissazione del Terzo Larve Instar
- Scegli una larva vagante terzo stadio dalla parete del flaconcino e collocarlo in una diminuzione del 50 microlitri di PBS ghiacciato su un piatto dissezione Sylgard (in Sylgard 184 kit di silicone elastomero, Dow Corning Corporation in untessuto piatto di cultura).
- Tenere il lato dorsale larva alto, vicino ai ganci della bocca, con pinza sottile (Dumont # 5 pinza), bastone e un perno insetto (minutien, 0,1 mm, in acciaio inox) attraverso il cervello della larva.
- Afferra l'estremità posteriore della larva con la pinza, tirare delicatamente e allungare delicatamente la larva della lunghezza. Attaccare un altro pin insetto tra i due spiracoli posteriori.
- Molla con le forbici tagliare due incisioni orizzontali nella parete del corpo (perpendicolare alla asse anteriore-posteriore), vicino ai piedini anteriori e posteriori.
- Utilizzando le forbici molla tagliare la parete larvale corpo lungo la linea mediana dorsale dal anteriore alla posteriore incisione.
- Togliere gli organi interni (intestino, ghiandole salivari, Malpighi tubuli ecc) e la trachea utilizzando una pinza sottile. Lavare delicatamente una o due volte con PBS.
- Prendete i due lembi parete del corpo con le pinze, allungare fuori e li pin alla piastra con due pin di insetti per ogni lato.
- Rimuovere il PBS e aggiungere 50 ul di soluzione di fissaggio (4% formaldeide in PBT). Incubare 20 minuti a temperatura ambiente.
- Rimuovere il fissativo. Lavare due volte con PBS. Estrarre i perni di insetti. Molla con le forbici tagliare la testa larvale e la coda lasciando un filetto rettangolare. Trasferire il tessuto fissato ad un tubo Eppendorf refrigerati con PBS.
- Una volta che un numero sufficiente di larve sono fissati, si può continuare direttamente a colorazione anticorpale. Se la colorazione immediata non è desiderato, le larve fisso deve essere lavata 3 volte, 5 minuti ciascuno, con 95% etanolo e conservato in etanolo al 95% a -20 ° C.
2. Dissezione e fissazione di pupe
Parte I
- Partecipare alle fiale, come per la fissazione delle larve, le larve fino al terzo instar cominciano a pupariate. Esaminare i flaconi ogni ora larve e Mark che hanno pupariated. Lasciare che il pupe marcata a sviluppare 30-40 ore a 24 ° C o 24-27 ore a 29 ° C.
- Utilizzando una pinza sottile raccogliere 20-30 pupe di The l'età appropriata e metterli in un buio di porcellana multi-piatto e dissezione. Fare attenzione a non danneggiare i tessuti di interesse.
- Estrarre il pupe dal caso pupa. Iniziate staccando l'opercolo e continuare fino a quando la pupa è libero. Mettere la pupa in un pozzo pieno di PBT. Continua l'estrazione di tutte le pupe. Passi 2,4-2,6 dovrebbe essere fatto in piccoli lotti di cinque pupe alla volta.
- Posizionare cinque pupe su una superficie piana tra i pozzetti del piatto dissezione. Con un coltello micro dissezione tagliare la punta della testa e la punta posteriore dell'addome (in alternativa, è possibile utilizzare due coppie di pinze per forato ad entrambe le estremità della pupe).
- Tenere la pupa in posizione utilizzando una pinza sottile e usare una siringa da 1 ml per lavare gli organi interni della pupa, iniettando PBT attraverso l'apertura anteriore.
- Lavare brevemente sezionato pupa immergendolo in un pozzo riempito con PBS e spostarla nella fissativo freddo in un tubo Eppendorf mantenuto in ghiaccio.
- Incubare (ON) a 4 ° C.
Parte II
- Eliminare il fissativo e lavare le pupe per tre volte, a 5 minuti ciascuno, con PBT. Tenere il pupe lavato su ghiaccio.
- Riempire due pozzi del piatto con la dissezione PBT. Utilizzo di un polietilene Pasteur pupe trasferire più pipetta ad uno dei pozzetti.
- Spostare una pupa alla volta nel secondo pozzo. Utilizzando due coppie di pinze con punte affilate perfettamente allineati, staccare la cuticola trasparente pupa dell'ala: fissare il pupa al fondo del pozzetto usando una coppia di pinze, e delicatamente strappare la cuticola utilizzando la seconda coppia di pinze. Una volta che la cuticola è strappata, staccatelo l'ala. Fare attenzione a non staccare l'ala dalla pupa. Dopo aver tolto la cuticola dalla lama ala, continuano peeling la cuticola della cerniera ala (dove i c'os ala si trovano).
- Dopo aver tolto la cuticola dell'ala, si può tentare staccando la cuticola gamba in modo simile.Molte le gambe sono suscettibili di essere perso nel processo, ma nonostante la bassa resa, questo passaggio è altamente consigliata dato che migliora notevolmente la colorazione dei Chos gambe. I Chos del HALTERE e dell'addome possono essere visualizzati senza ulteriori staccando la cuticola.
- Posizionare il 'sfogliato' pupa in una provetta Eppendorf riempito con metanolo e mantenere a temperatura ambiente. Continua staccando la cuticola di tutti i pupe, e aggiungerli al tubo stesso. Almeno 10 le pupe ben pelati devono essere raccolti per ogni colorazione.
- Togliere il metanolo e lavare tre volte, a 5 minuti ciascuno, con il 95% di etanolo. Pupe fisso può essere conservati per lunghi periodi di tempo in 95% etanolo a -20 ° C.
3. Immunostaining di larve e pupe
- Lavare il tessuto fissato con PBT tre volte, 30 minuti ciascuna, a temperatura ambiente. Le larve possono essere lavati con agitando delicatamente su un piatto rotante. Pupe vengono lavati senza agitare.
- Sostituire il PBT con il tampone di bloccaggio (PBT + 5% nsiero di capra Ormal) e incubare ON a 4 ° C.
- Rimuovere il tampone bloccante e incubare con anticorpi primari (diluito in tampone di bloccaggio) ON a 4 ° C.
- Lavare quattro volte con PBT come descritto al punto 3.1.
- Rimuovere il PBT e incubare con anticorpi secondari (diluito in tampone di bloccaggio) ON a 4 ° C.
- Lavare due volte con PBT e una volta con PBS come descritto al punto 3.1.
- Sostituire il PBS con il mezzo di montaggio (Dako Medio fluorescente di montaggio (Cytomation Dako, Glostrup, Danimarca) e incubare a 4 ° C ON.
4. Montaggio di larve
- Le larve sono montati su un vetrino da microscopio in una goccia di mezzi di montaggio con la loro cuticola rivolto verso il basso e muscoli della parete del corpo rivolta verso l'alto. Metti una piccola goccia di mezzo di montaggio su un vetrino pulito e usarlo per coprire la preparazione. Non applicare alcuna pressione sulle larve montato.
5. Montaggio di Pupae
- Preparare due vetrini da microscopiocon una goccia di mezzo di fissaggio, uno per la dissezione e la seconda per il montaggio.
- Mettere pupe più su una delle diapositive.
- Molla con le forbici togliere la testa e la parte posteriore dell'addome.
- Separare la parte dorsale del torace dalla metà ventrale tagliando tra le ali e le gambe.
- Collocare le parti del corpo sezionati del pupa sul vetrino secondo una goccia di soluzione di montaggio. Assicurarsi che le ali e le gambe sono tese e cercare di ridurre al minimo la sovrapposizione dei tessuti, per quanto possibile.
- Mettere una goccia di mezzo di montaggio su un vetrino e collocarlo sul campione. Non applicare una pressione sul campione montato.
6. Risultati rappresentativi
Un esempio di immuno-macchiati c'os di larva terzo stadio è illustrato nella figura 1. Questo esempio mostra un segmento addominale ben tesa, in cui sette degli otto Chos sono chiaramente visibili. I neuroni sono labELED con MAb22C10 (1:20, ottenuto dalla Banca Developmental Studies Ibridoma presso la University of Iowa), il tappo, legamento, cap-attachment e le cellule di attacco dei legamenti vengono etichettati con anti-αTub85E (1:10, Klein et al,. 2010). Anticorpi secondari per la colorazione fluorescente erano Cy3 o Cy5-coniugato anti-mouse/rabbit (1:200, ImmunoResearch Jackson Laboratories). I campioni sono stati visualizzati mediante microscopia confocale (LSM 510, Zeiss).
Un gruppo di Chos ala al vena ventrale radiale di 35 hr-vecchio pupa è mostrato in Figura 2.

Figura 1 (A) Illustrazione schematica dei sei tipi di cellule che costituiscono un singolo organo: Ch. Attaccamento cap (CA), il tappo (C), scolopale (S), neurone (N), legamento (L) e di attaccamento legamento (LA ). Il LCh5 organo, in cui sono raggruppati cinque c'os, è teso il gruppo di muscoli laterali trasversali (LT1-4). Il muscolo laterale longitudinale (LL1), ventrali muscoli longitudinali (VL1-4) e laterale muscolo obliquo (LO1) sono anche illustrati. Cellule tendinee sono illustrati come sfere marroni (Tratto da Klein et al., 2010). (B) Un segmento addominale di una larva di terzo stadio visti con un ingrandimento 10X. Sette degli otto Chos presenti in ciascun segmento addominale sono evidenti: cinque organi laterali che formano l'organo pentascolopidial (LCh5), un unico organo laterale (LCh1) e uno dei due Chos ventrali (VChB). I neuroni (N) del C'os sono etichettati con il marcatore neuronale MAb 22C10 (rosso). Il legamento (L), il tappo (C) e le cellule di attacco (Los Angeles, CA) vengono etichettati con anti-αTub-85E (blu). Le cellule tappo e legamenti sono inoltre etichettati con un Cho-specifica reporter GFP ospitare un elemento normativo del locus dei (Nachman et al, dati non pubblicati).
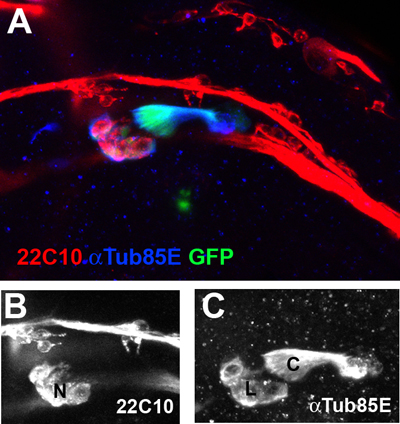
Figura 2. Gli organi ala cordotonali alla vena ventrale radiale sono visti con un ingrandimento 40X. I neuroni (N) sono contrassegnati con le 22C10 marcatori neuronali (Red, B). Il legamento (L) e il tappo (C), le cellule sono co-etichettati con anticorpi anti-αTub85E (Blu, C) e un Cho-specifica GFP giornalista transgene (Nachman et al, dati non pubblicati).
Discussione
Il protocollo descritto in questo video fornisce un modo per visualizzare Chos propriocettivi durante le fasi larvali e pupe. Gli studi sulla struttura e lo sviluppo di Chos propriocettivi sono stati finora limitati principalmente agli stadi embrionali e larvali dischi immaginali. Così, molti aspetti delle fasi successive di sviluppo, di Chos sia larvali e adulti, rimangono in gran parte sconosciuto. Il protocollo descritto, insieme con i comuni strumenti genetici in Drosophila, può essere utilizzato per identificare e studiare nuovi geni e le vie che giocano un ruolo nelle fasi successive di sviluppo Chos. Questo protocollo è stato ottimizzato per la visualizzazione di Cho, ma può essere adattato per la colorazione di tessuti, quali alette 6 pupa.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare la Banca Ibridoma Developmental Studies presso la University of Iowa per averci inviato anticorpi. Questo lavoro è stato sostenuto da una borsa di studio (n. 29/08) da The Israel Science Foundation. COME è anche supportato da un assegno di ricerca dal DFG (Deutsche Forschungsgemeinschaft).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente / strumento | Azienda | Numero di catalogo | Comments |
| Dumont # 5 (o # 55) pinza, Biologie punta | FST | 11252-20 o 11252-10 (Pinza o simili) | |
| Austerlitz inox perni in acciaio, insetti minutiens 0.1mm | Roboz Co strumento chirurgico | RS-6083-10 | |
| Sylgard 184 silicone kit elastomero | Dow Corning Corporation | 240.4019862 | |
| Vännäs forbici micro (dritto, 7,5 cm, lama 3 mm) | AS Mdeizintechnik GmbH | 11-590-00 | Forbici primavera Vännäs con specifiche identiche possono essere acquistati presso Instrument Co. Roboz chirurgico |
| Agitatore orbitale - Rotamax-120 | Heidolph | N / A | |
| Dako fluorescente Mezzo di montaggio | Cytomation Dako, Glostrup, Danimarca | DK-5302392 | |
| X10 PBS formulazione | 2 gr / lit KCl, 2 gr / lit KH 2 PO 4, 80 gr / lit NaCl, 21,7 gr / lit Na 2 HPO4.7H 2 O | La qualità di PBS è critico per il successo di questo protocollo | |
| PBT | X1 PBS + 0,1% Tween 20 | ||
Riferimenti
- Brewster, R., Bodmer, R. Origin and specification of type II sensory neurons in Drosophila. Development. 121, 2923-2936 (1995).
- Caldwell, J. C., Miller, M. M., Wing, S., Soll, D. R., Eberl, D. F. Dynamic analysis of larval locomotion in Drosophila chordotonal organ mutants. Proc. Natl. Acad. Sci. U.S.A. 100, 16053-16053 (2003).
- Eberl, D. F. Feeling the vibes: chordotonal mechanisms in insect hearing. Curr. Opin. Neurobiol. 9, 389-393 (1999).
- Eberl, D. F., Boekhoff-Falk, G. Development of Johnston's organ in Drosophila. Int. J. Dev. Biol. 51, 679-687 (2007).
- Eberl, D. F., Hardy, R. W., Kernan, M. J. Genetically similar transduction mechanisms for touch and hearing in Drosophila. J. Neurosci. 20, 5981-5988 (2000).
- Egoz-Matia, N., Nachman, A., Halachmi, N., Toder, M., Klein, Y., Salzberg, A. Spatial regulation of cell adhesion in the Drosophila wing is mediated by Delilah, a potent activator of βPS integrin expression. Dev Biol. 351, 99-109 (2011).
- Field, L. H., Matheson, T. Chordotonal organs of insects. Advances in Insect Physiology. 27, 1-228 (1998).
- Gong, Z., Son, W., Chung, Y. D., Kim, J., Shin, D. W., McClung, C. A., Lee, Y., Lee, H. W., Chang, D. J., Kaang, B. K. Two interdependent TRPV channel subunits, inactive and Nanchung, mediate hearing in Drosophila. J. Neurosci. 24, 9059-9066 (2004).
- Inbal, A., Volk, T., Salzberg, A. Recruitment of ectodermal attachment cells via an EGFR-dependent mechanism during the organogenesis of Drosophila proprioceptors. Dev. Cell. 7, 241-250 (2004).
- Jarman, A. P., Grau, Y., Jan, L. Y., Jan, Y. N. atonal is a proneural gene that directs chordotonal organ formation in the Drosophila peripheral nervous system. Cell. 73, 1307-1321 (1993).
- Jarman, A. P., Sun, Y., Jan, L. Y., Jan, Y. N. Role of the proneural gene, atonal, in formation of Drosophila chordotonal organs and photoreceptors. Development. 121, 2019-2030 (1995).
- Kim, J., Chung, Y. D., Park, D. Y., Choi, S., Shin, D. W., Soh, H., Lee, H. W., Son, W., Yim, J., Park, C. S. A TRPV family ion channel required for hearing in Drosophila. Nature. 424, 81-84 (2003).
- Klein, Y., Halachmi, N., Egoz-Matia, N., Toder, M., Salzberg, A. The proprioceptive and contractile systems in Drosophila are both patterned by the EGR family transcription factor Stripe. Dev. Biol. 337, 458-470 (2010).
- Matthews, K. A., Miller, D. F., Kaufman, T. C. Functional implications of the unusual spatial distribution of a minor alpha-tubulin isotype in Drosophila: a common thread among chordotonal ligaments, developing muscle, and testis cyst cells. Dev. Biol. 137, 171-183 (1990).
- Okabe, M., Okano, H. Two-step induction of chordotonal organ precursors in Drosophila embryogenesis. Development. 124, 1045-1053 (1997).
- Rusten, T. E., Cantera, R., Urban, J., Technau, G., Kafatos, F. C., Barrio, R. Spalt modifies EGFR-mediated induction of chordotonal precursors in the embryonic PNS of Drosophila promoting the development of oenocytes. Development. 128, 711-722 (2001).
- Todi, S. V., Sharma, Y., Eberl, D. F. Anatomical and molecular design of the Drosophila antenna as a flagellar auditory organ. Microsc. Res. Tech. 63, 388-399 (2004).
- zur Lage, P., Jarman, A. P. Antagonism of EGFR and notch signalling in the reiterative recruitment of Drosophila adult chordotonal sense organ precursors. Development. 126, 3149-3159 (1999).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon