È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In vitro test Clearance mesoteliali che modella i primi passi di metastasi del cancro ovarico
In questo articolo
Riepilogo
Il saggio di liquidazione mesoteliali qui descritto si avvale di cellule fluorescente e microscopia time-lapse video visualizzare e misurare quantitativamente le interazioni di sferoidi multicellulari di cancro ovarico e monostrati di cellule mesoteliali. Questo saggio modella i primi passi di metastasi del cancro ovarico.
Abstract
Il cancro ovarico è la quinta causa di decessi per cancro correlati negli Stati Uniti 1. Nonostante un iniziale risposta positiva alle terapie, da 70 a 90 per cento delle donne con tumore ovarico sviluppare nuove metastasi, e la ricorrenza è spesso fatale 2. Si tratta, quindi, necessario capire come metastasi secondarie sorgono al fine di sviluppare migliori trattamenti per il cancro fase intermedia e tardiva dell'ovaio. Metastasi del cancro ovarico si verifica quando le cellule maligne si staccano dal tumore primario e diffondere in tutta la cavità peritoneale. Le cellule diffusi possono formare aggregati multicellulari, o sferoidi, che uno rimanga unattached, o impianto sul organi all'interno della cavità peritoneale 3 (figura 1, film 1).
Tutti gli organi all'interno della cavità peritoneale sono rivestite con un unico strato continuo di cellule mesoteliali 4-6 (Figura 2). Tuttavia, le cellule mesoteliali sono assenti da sottomasse tumorali peritoneali, come rivelato dagli studi al microscopio elettronico di sezioni umani asportati 3,5-7 tessuto tumorale (Figura 2). Questo suggerisce che le cellule mesoteliali sono esclusi da sotto la massa tumorale da un processo sconosciuto.
Precedente esperimenti in vitro hanno dimostrato che cellule primarie di cancro ovarico collegare in modo più efficace matrice extracellulare che di cellule mesoteliali 8, e studi più recenti hanno dimostrato che le cellule primarie peritoneali mesoteliali in realtà costituiscono una barriera per l'adesione delle cellule del cancro ovarico e l'invasione (rispetto alla adesione e l'invasione su supporti che non sono stati coperti con le cellule mesoteliali) 9,10. Questo suggerisce che le cellule mesoteliali fungere da barriera contro il cancro ovarico metastasi. I meccanismi cellulari e molecolari con cui le cellule del cancro ovarico violare questa barriera, ed escludere il mesotelio hanno, fino a poco tempo, è rimasto sconosciuto.
Qui si descrive °metodologia e di un test in vitro che modella l'interazione tra sferoidi di cellule di cancro ovarico e cellule mesoteliali in vivo (figura 3, Movie 2). Il nostro protocollo è stato adattato da metodi descritti in precedenza per analizzare le interazioni delle cellule tumorali ovariche con monostrati mesoteliali 8-16, ed è stata descritta in un rapporto che mostra che le cellule tumorali ovariche utilizzano un integrina-dipendente l'attivazione della miosina e la forza di trazione per promuovere l'esclusione del cellule mesoteliali da sotto un tumore 17 sferoide. Questo modello si avvale di time-lapse microscopia a fluorescenza per monitorare le due popolazioni cellulari in tempo reale, fornendo informazioni spaziale e temporale sull'interazione. Le cellule del carcinoma ovarico esprimere la proteina fluorescente rossa (RFP), mentre le cellule mesoteliali esprimere la proteina fluorescente verde (GFP). RFP che esprimono sferoidi di cellule di cancro ovarico allegare alla GFP-esprimere monostrato mesoteliali. La diffusione sferoidi, invadere, eforzare le cellule mesoteliali parte creando un foro nel monostrato. Questo foro è visualizzato come lo spazio negativo (nero) nell'immagine GFP. L'area del foro può essere misurata per analizzare quantitativamente differenze di attività di gioco tra le popolazioni di controllo e sperimentali di cancro ovarico e / o cellule mesoteliali. Questo saggio necessita soltanto un piccolo numero di cellule di cancro ovarico (100 cellule per sferoidali X 20-30 sferoidi per condizione), quindi è possibile eseguire questo saggio con preziosi campioni di cellule del tumore primario. Inoltre, questa analisi può essere facilmente adattato per lo screening ad alto rendimento.
Protocollo
1. Ovarian Cancer Cell Formazione Spheroid
- RFP-esprimono cellule di cancro ovarico vengono coltivate in terreno di base 10% (una consuetudine mezzo di coltura cellulare contenente una miscela 50:50 di 199 e MCDB105, 10% siero fetale bovino inattivato e 1% pen-strep). Per esprimere RFP in cellule non marcate cancro ovarico, trasfettare le cellule con un plasmide contenente RFP e per selezionare cellule esprimenti RFP. In alternativa, vettori virali possono essere usati per esprimere transitoriamente proteine fluorescenti, o le cellule possono essere pre-incubare con fluorescente rossa cella inseguitore colorante (Invitrogen).
- Prima di formare sferoidi di cancro ovarico, è necessario preparare bassa aderenza e rotonde 96 piastre di coltura fondo. Per produrre i bassa aderenza piastre di coltura, 30μl poli-HEMA (6mg polyhydroxyethylmethacrylate in 1 ml di EtOH 95%) soluzione viene aggiunta a ciascun pozzetto di un pozzo 96 piatto di coltura cellulare Corning. Le piastre a 96 pozzetti vengono incubate a 37 ° C non incubatore umidificato per far evaporare l'etanolo, Leaving una pellicola di poli-HEMA in ciascun pozzetto. Questo poli-HEMA pellicola impedisce alle cellule di attaccarsi al fondo del pozzo, costringendo le cellule a crescere in sospensione 18. [In alternativa, Ultra-Low piastre di coltura Attachment (Corning) può essere usato al posto di piatti rivestiti poly-HEMA.]
- Dopo bassa aderenza piastre di coltura vengono preparati, Tripsinizzare una piastra di cellule tumorali ovariche, pellet delle cellule in una centrifuga da tavolo (Heraeus) a 900 RCF per 3 minuti, aspirare il supernatante e risospendere in terreno di base 10%.
- Contare le cellule utilizzando un emocitometro.
- Regolare la concentrazione di tali cellule che ci sono 100 cellule per 50 microlitri di terreno di base 10%.
- Aggiungere 50 microlitri della sospensione cellulare diluita uniformemente sospeso in ciascun pozzetto della piastra a 96 pozzetti poli-HEMA cultura rivestita.
- Incubare la piastra a 96 pozzetti a 37 ° C incubatore di coltura cellulare per 16 ore (tale quantità di tempo dovrebbe essere aumentata o diminuita a seconda della quantità di tempo necessario peruna linea cellulare particolare per formare sferoidi multicellulari o desiderati condizioni sperimentali) permettere alle cellule del carcinoma ovarico a raggrupparsi, formando un unico sferoide multicellulare in ciascun pozzetto. Alcune cellule tumorali possono apoptosi durante questo periodo, quindi è importante scegliere un momento prima della induzione di apoptosi.
2. Mesoteliali formazione di cellule monostrato
- In una cappa coltura cellulare, pre-rivestimento dei pozzetti di una ben 6 fondo di vetro piatto MatTek con fibronectina aggiungendo 2 ml di fibronectina 5μg / mL di soluzione salina in ogni pozzetto della piastra e incubando a temperatura ambiente per 30 minuti. La qualità ottica dei fondi di vetro in piatti MatTek consentono immagini ad alta risoluzione microscopico.
- GFP-esprimono cellule mesoteliali vengono coltivate in terreno di base 10%. Tripsinizzare un piatto di cellule mesoteliali, spin down in una centrifuga da tavolo (Heraeus) a 900RPM per 3 minuti, aspirare il surnatante, e risospendere in terreno di base del 10%. Ilcellule mesoteliali usati qui sono stati già esprimendo GFP quando sono stati ottenuti, ma non marcati cellule mesoteliali può essere prodotto da trasfezione con un plasmide contenente cDNA GFP, o preincubating le cellule in un verde fluorescente cella inseguitore colorante (Invitrogen).
- Dopo l'incubazione di 30 minuti fibronectina (in fase 2.1), lavare i pozzetti del piatto MatTek con 2 ml PBS.
- Aspirare il PBS e la piastra 6 x10 5 cellule mesoteliali per bene in ciascun pozzetto della piastra ben 6 MatTek. Incubare il piatto MatTek a 37 ° C incubatore per colture cellulare notte per consentire le cellule mesoteliali per collegare al piatto e formano un monostrato.
3. Mesoteliali cella Assay Clearance
- Utilizzare una pipetta per raccogliere gli sferoidi carcinoma ovarico da ben 96 poli-HEMA piastra rivestita.
- Aspirare il mezzo da un pozzetto della piastra ben 6 MatTek contenente un monostrato di cellule mesoteliali. Lavare una volta con 2 ml PBS. Aggiungere tutti gli sferoidi dal 96 pozzetti ptardi per un pozzetto della piastra MatTek (~ 3x il numero di sferoidi che stanno per essere ripreso in considerazione per l'atterraggio sferoidi parte del piatto che non può essere ripreso).
- Porre la capsula MatTek sul palco di un microscopio invertito widefield a fluorescenza in grado di eseguire time-lapse imaging per la durata di almeno 8 ore. Utilizzare uno stadio motorizzato a posizioni più immagini nel piatto, con più eventi di intercalazione sferoidali, in un singolo esperimento. Usiamo un Ti-E Nikon invertito motorizzato widefield fluorescenza time-lapse microscopio integrato con un sistema di messa a fuoco perfetta e bassa [20x-0.75 apertura numerica (NA)] ingrandimento / NA contrasto differenziale di interferenza (DIC) l'ottica, un transilluminatore alogena Nikon con 0,52 NA lunga distanza di lavoro (LWD) condensatore, Nikon veloce (<100 millisecondi tempo di commutazione), filtri di eccitazione e di emissione (GFP Ex 480/40, Em 525/50, RFP-mCherry Ex 575/50 Em 640/50), Sutter veloce trasmessi e epifluorescenza percorso Valvola luce intelligenteTERS, una lineare codificato Nikon stadio motorizzato, un ORCA Hamamatsu-AG raffreddato charge-coupled device (CCD), macchina fotografica, una custom-built camera di incubazione microscopio con la temperatura e CO 2 di controllo, Nikon NIS-Elements AR software versione 3, e un TMC vibrazioni tavolo isolamento.
- Gli sferoidi di cellule di cancro ovarico si depositerà sul fondo del piatto e allegare il monostrato cellulare mesoteliali. Raccogliere GFP, RFP e le immagini di fase di 20 + sferoidali / monostrato interazioni, ogni 10 minuti, per 8 ore.
- Le RFP che esprimono sferoidi di cellule di cancro ovarico si invadere la GFP che esprimono monostrato di cellule mesoteliali la creazione di un buco nel monostrato. Dopo 8 ore, misurare le dimensioni dei fori tracciando i buchi neri nelle immagini GFP usando software Elements (o un altro software adatto come immagine J). Normalizza le dimensioni del foro alla dimensione iniziale sferoide dividendo la dimensione del foro a 8 ore dalla dimensione dello sferoide nell'immagine RFP corrispondente al tempo zero. In questo exampio, la dimensione del foro è stata misurata una volta sola, ma può essere misurata più volte durante l'esperimento otto ore per comprendere meglio le dinamiche di intercalazione.
4. Risultati rappresentativi
In questo esempio, abbiamo confrontato la capacità mesoteliali liquidazione dei OVCA433 sferoidi di cellule di cancro ovarico che hanno attenuato l'espressione della Talin-1 per controllare OVCA433 sferoidi. OVCA433 sferoidi di ciascun gruppo sono stati aggiunti ad un piatto MatTek contenente ZT monostrati di cellule mesoteliali. Sei sferoidi di ogni gruppo sono stati ripresi ogni 10 minuti per otto ore (Figura 4, Movie 3, Movie 4). I fori prodotti nella monostrato dai sferoidi diffusione sono state misurate e sei posizioni di ciascun gruppo sono stati mediati. La figura 4 mostra che l'area di clearance media creato da Talin 1 sferoidi atterramento era significativamente più piccola rispetto alla superficie media creato da sferoidi di controllo, suggerendo che Talin è necessario per la loro liquidazione mesoteliali da OVCA433 carcinoma ovarico sferoidi.
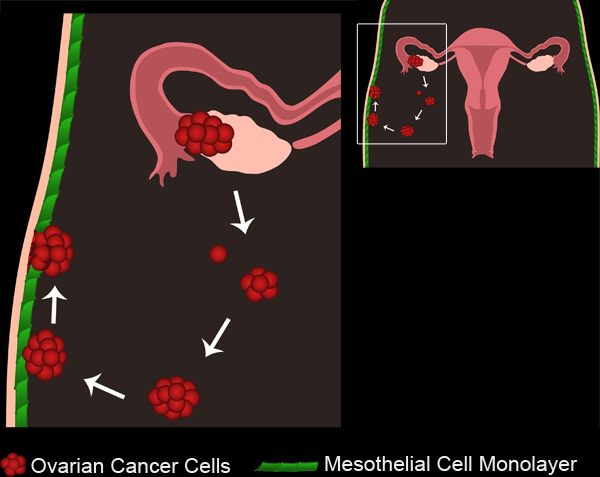
Figura 1. Cancer Metastasi ovarica. Tumori ovarici primari sviluppare sia dall'epitelio di superficie ovarico o tube di Falloppio. Le cellule tumorali / cluster staccarsi dal tumore primario e raccogliere nella cavità peritoneale. Le cellule tumorali possono quindi aggregare per formare sferoidi multicellulari. Sferoidi quindi allegare ai monostrati di cellule mesoteliali che rivestono la cavità peritoneale. Le cellule mesoteliali sono esclusi da sotto lo sferoide allegata cancro ovarico, consentendo gli sferoidi di accedere alla membrana basale sottostante.
Movie 1. Metastasi del cancro ovarico. Clicca qui per vedere il film .
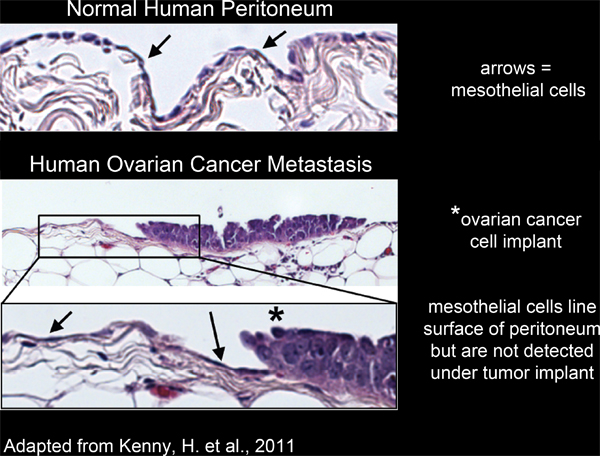
Figura 2. Linea mesoteliale cellule della superficie del tessuto umano peritoneale e sono esclusi da sotto gli impianti di cellule di cancro ovarico.
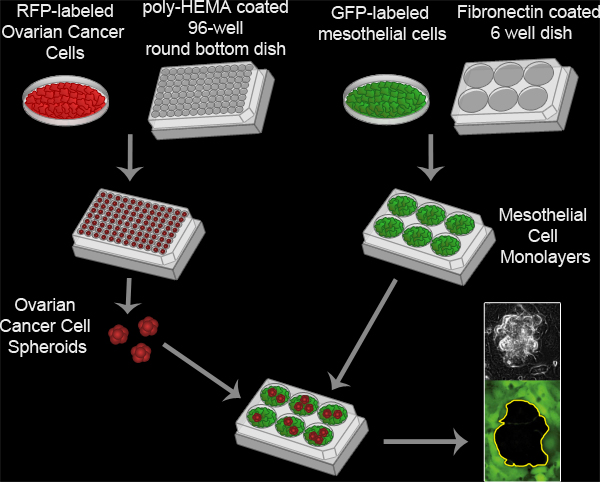
Figura 3. Assay Clearance mesoteliali. Sferoidi carcinoma ovarico formate incubando 100 RFP cellule esprimenti carcinoma ovarico per pozzetto in una poli-HEMA rivestita 96 piatto fondo del pozzetto rotondo coltura a 37 ° C per 16 ore. Poly-HEMA impedisce alle cellule di attaccarsi alla piastra di coltura, permettendo alle cellule di rimanere in sospensione e aderire l'una all'altra a formare un unico cluster per pozzetto. Monostrati di cellule mesoteliali sono preparati mediante placcatura 6x10 5 cellule mesoteliali per pozzetto in una fibronectina rivestito 6 ben piatto MatTek e incubando la piastra a 37 ° C per 16 ore. Gli sferoidi sono poi trasferiti al piatto MatTek con il monostrato mesoteliali e le due popolazioni cellulari vengono esposte ogni 10 minuti per 8 ore utilizzando un legame Ti-E Nikon Inverted motorizzato widefield fluorescenza time-lapse microscopio e software Elements.
Movie 2. Saggio Clearance mesoteliali. Clicca qui per vedere il film .
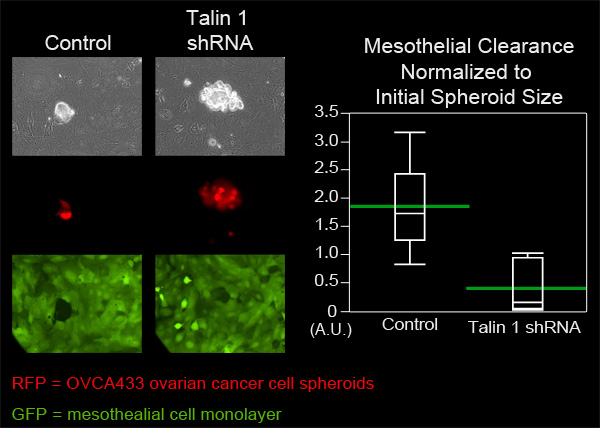
Attenuazione Figura 4. Di Talin uno espressione in OVCA433 sferoidi possono diminuire la capacità mesoteliali clearance. OVCA433 sferoidi (rosso) con e senza l'espressione attenuata di Talin 1 sono stati autorizzati a cui attaccarsi e invadere in un monostrato ZT mesoteliali (verde). Le due popolazioni cellulari sono stati ripresi ogni 10 minuti per 8 ore utilizzando una Ti-E Nikon invertito motorizzato widefield fluorescenza time-lapse microscopio e software elementi. Il grafico mostra che Talin 1 attenuazioneriduce significativamente la clearance delle cellule mesoteliali (plot Quantile con barre verdi i mezzi).
Movie 3. Controllo OVCA433 sferoidi (rosso) che invadono in un monostrato mesoteliali (verde). Clicca qui per vedere il film .
Attenuazione Movie 4. Di Talin uno espressione in OVCA433 sferoidi (rosso) diminuisce mesoteliali (verde) capacità di clearance. Clicca qui per vedere il film .
Discussione
Il "test Liquidazione mesoteliale" qui presentata usa microscopia time-lapse per monitorare le interazioni di sferoidi multicellulari di cancro ovarico e monostrati di cellule mesoteliali, in grande dettaglio spaziale e temporale. In precedenza, diversi gruppi 8-14 aveva usato saggi endpoint per dimostrare che le cellule tumorali ovariche attaccarsi e invadere monostrati di cellule mesoteliali. Questo saggio è unico in quanto utilizza celle fluorescente di distinguere le cellule tumorali da cellule...
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Vorremmo ringraziare la Nikon Imaging Center presso la Harvard Medical School, in particolare Jennifer Waters, Lara Petrak e salmone Wendy, per la formazione e l'uso delle loro microscopi timelapse. Vorremmo anche ringraziare Rosa Ng e Achim Besser per le discussioni importanti. Questo lavoro è stato supportato dal NIH di Grant 5695837 (da M. Iwanicki) e GM064346 di ACC, da una sovvenzione dal Dott. Miriam e Sheldon G. Adelson Medical Research Foundation (a JSB).
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente | Azienda | Numero di catalogo | Comments |
| OVCA433 Ovarian Cancer Cells | Regalo da Dr. Dennis Slamon | ||
| ZT cellule mesoteliali | Regalo da Dr. Tan Ince | ||
| Medium 199 | Gibco | 19950 | |
| MCDB105 | Cella Applications Inc. | 117-500 | |
| -FBS inattivato al calore | Gibco | 10082 | |
| Pen-Strep | Gibco | 15070 | |
| Piastre da 96 pozzetti | Corning Costar | 3799 | |
| Polyhydroxyethylmethacrylate (poly-HEMA) | Sigma Aldrich | 192066-25G | Per poli-HEMA soluzione sciogliere 6mg poli-HEMA polvere in 1 ml di 95% EtOH |
| EtOH | Pharmco-aaper | 111ACS200 | Diluire al 95% in DH 2 0 |
| Coltura cellulare cappuccio | Nuaire | NU-425-300 | |
| Tissue incubatore per colture | Thermo Scientific | 3110 | |
| incubatore di poly-HEMA piastre | Labline Instruments | Imperial III 305 | |
| Centrifuga da tavolo | Heraeus | 75003429/01 | |
| 6 pozzetti con fondo di vetro piatto | MatTek corp. | P06G-1.5-20-F | |
| Fibronectina | Sigma | F1141-1MG | |
| PBS | Cellgro | 21-040-CV | |
| Timelapse microscopio: | |||
| Microscopio | Nikon | Ti-E motorizzato invertito a fluorescenza time-lapse microscopio integrato con un sistema di messa a fuoco perfetta | |
| Lente | Nikon | 20X-0.75 apeture numerica | |
| Alogena transilluminatore | Nikon | 0,52 NA lunga distanza di lavoro del condensatore | |
| Eccitazione ed emissione filtri | Chroma filtri passa singoli Nikon custodia | GFP Ex 480/40, Em 525/50 RFP-mCherry Ex 575/50 Em 640/50 | |
| Trasmessi e Epifluoresce percorso della luce | Sutter | Persiane Smart | |
| Linear-encoded stage motorizzato | Nikon | ||
| Raffreddato charged-coupled fotocamera del dispositivo | Hamamatsu | ORCA-AG | |
| Microscopio camera di incubazione con la temperatura e CO 2 di controllo | custom-built | ||
| Isolamento delle vibrazioni tavolo | TMC | ||
| NIS-Elements software | Nikon | Versione 3 |
Riferimenti
- Jemal, A. . CA Cancer J. Clin. 59, 225-249 (2009).
- Ries, L. G., Melbert, D., Krapcho, M., Stinchcomb, D. G., Howlader, N., Horner, M. J., Mariotto, A., Miller, B. A. . SEER Cancer Statistics Review, 1975-2005. , (2007).
- Burleson, K. M. Ovarian carcinoma ascites spheroids adhere to extracellular matrix components and mesothelial cell monolayers. Gynecol. Oncol. 93, 170-181 (2004).
- Birbeck, M. S., Wheatley, D. N. An Electron Microscopic Study of the Invasion of Ascites Tumor Cells into the Abdominal Wall. Cancer Res. 25, 490-497 (1965).
- Witz, C. A., Monotoya-Rodriguez, I. A., Schenken, R. S. Whole explants of peritoneum and endometrium: a novel model of the early endometriosis lesion. Fertil. Steril. 71, 56-60 (1999).
- Zhang, X. Y. Characteristics and growth patterns of human peritoneal mesothelial cells: comparison between advanced epithelial ovarian cancer and non-ovarian cancer sources. J. Soc. Gynecol. Investig. 6, 333-340 (1999).
- Kenny, H. A., Nieman, K. M., Mitra, A. K., Lengyel, E. The First Line of Intra-abdominal Metastatic Attack: Breaching the Mesothelial Cell Layer. Cancer Discovery. 1, 100-102 (2011).
- Niedbala, M. J., Crickard, K., Bernacki, R. J. Interactions of human ovarian tumor cells with human mesothelial cells grown on extracellular matrix. An in vitro model system for studying tumor cell adhesion and invasion. Exp. Cell. Res. 160, 499-513 (1985).
- Kenny, H. A., Krausz, T., Yamada, S. D., Lengyel, E. Use of a novel 3D culture model to elucidate the role of mesothelial cells, fibroblasts and extra-cellular matrices on adhesion and invasion of ovarian cancer cells to the omentum. Int. J. Cancer. 121, 1463-1472 (2007).
- Ksiazek, K. Senescent peritoneal mesothelial cells promote ovarian cancer cell adhesion: the role of oxidative stress-induced fibronectin. Am. J. Pathol. 174, 1230-1240 (2009).
- Burleson, K. M., Boente, M. P., Pambuccian, S. E., Skubitz, A. P. Disaggregation and invasion of ovarian carcinoma ascites spheroids. J. Transl. Med. 4, 6-6 (2006).
- Heyman, L. Vitronectin and its receptors partly mediate adhesion of ovarian cancer cells to peritoneal mesothelium in vitro. Tumour. Biol. 29, 231-244 (2008).
- Heyman, L. Mesothelial vitronectin stimulates migration of ovarian cancer cells. Cell. Biol. Int. 34, 493-502 .
- Lessan, K., Aguiar, D. J., Oegema, T., Siebenson, L., Skubitz, A. P. CD44 and beta1 integrin mediate ovarian carcinoma cell adhesion to peritoneal mesothelial cells. Am. J. Pathol. 154, 1525-1537 (1999).
- Leroy-Dudal, J., Heyman, L., Gauduchon, P., Carreiras, F. Adhesion of human ovarian adenocarcinoma IGROV1 cells to endothelial cells is partly mediated by the alphav integrins-vitronectin adhesive system and induces an alteration of endothelial integrity. Cell. Biol. Int. 29, 482-488 (2005).
- Leroy-Dudal, J. Transmigration of human ovarian adenocarcinoma cells through endothelial extracellular matrix involves alphav integrins and the participation of MMP2. Int. J. Cancer. 114, 531-543 (2005).
- Iwanicki, M. Ovarian cancer spheroids use myosin-generated force to clear the mesothelium. Cancer Discovery. 1, 144-157 (2011).
- Folkman, J., Moscona, A. Role of cell shape in growth control. Nature. 273, 345-349 (1978).
- Gregoire, L., Munkarah, A., Rabah, R., Morris, R. T., Lancaster, W. D. Organotypic culture of human ovarian surface epithelial cells: a potential model for ovarian carcinogenesis. In Vitro Cell Dev. Biol. Anim. 34, 636-639 (1998).
- Roberts, P. C. Sequential molecular and cellular events during neoplastic progression: a mouse syngeneic ovarian cancer model. Neoplasia. 7, 944-956 (2005).
- Okada, T., Okuno, H., Mitsui, Y. A novel in vitro assay system for transendothelial tumor cell invasion: significance of E-selectin and alpha 3 integrin in the transendothelial invasion by HT1080 fibrosarcoma cells. Clin. Exp. Metastasis. 12, 305-314 (1994).
- Zervantonakis, I. K., Kothapalli, C. R., Chung, S., Sudo, R., Kamm, R. D. Microfluidic devices for studying heterotypic cell-cell interactions and tissue specimen cultures under controlled microenvironments. Biomicrofluidics. 5, 13406-1310 (2011).
- Brandt, B. 3D-extravasation model -- selection of highly motile and metastatic cancer cells. Semin. Cancer Biol. 15, 387-395 (2005).
- Condeelis, J., Segall, J. E. Intravital imaging of cell movement in tumours. Nat. Rev. Cancer. 3, 921-930 (2003).
- Dai, J., Ting-Beall, H. P., Hochmuth, R. M., Sheetz, M. P., Titus, M. A. Myosin I contributes to the generation of resting cortical tension. Biophys. J. 77, 1168-1176 (1999).
- Laferriere, J., Houle, F., Taher, M. M., Valerie, K., Huot, J. Transendothelial migration of colon carcinoma cells requires expression of E-selectin by endothelial cells and activation of stress-activated protein kinase-2 (SAPK2/p38) in the tumor cells. J. Biol. Chem. 276, 33762-33772 (2001).
- Dong, C., Slattery, M. J., Rank, B. M., You, J. In vitro characterization and micromechanics of tumor cell chemotactic protrusion, locomotion, and extravasation. Ann. Biomed. Eng. 30, 344-355 (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon