È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento e la coltura di cellule embrionali neuronali di ratto: un protocollo veloce
In questo articolo
Riepilogo
Noi descriviamo una metodologia rapida per isolare e cultura neuroni dell'ippocampo e corticale da embrioni di roditori. Questo protocollo permette di effettuare esperimenti in cui sono richieste colture neuronali quasi puri.
Abstract
Stiamo descrivendo un metodo rapido di dissociarsi e di cultura neuroni dell'ippocampo o corticale da E15-17 embrioni di ratto. La procedura può essere applicata con successo per l'isolamento del mouse e neuroni umani primari e progenitori neurali. Neuroni dissociati sono mantenuti in terreno privo di siero fino a diverse settimane. Queste colture possono essere utilizzati per nucleofection, immunocitochimica, acidi nucleici preparazione, nonché elettrofisiologia. Vecchi colture neuronali possono anche essere trasfettate con un tasso di buona efficienza di trasduzione lentivirale e, meno efficiente, con fosfato di calcio o base di lipidi metodi come lipofectamina.
Protocollo
1. Poly-D-lisina (PDL): Preparazione
- Aggiungere 5 ml di soluzione sterile ddh 2 O a 5 mg di PDL per ottenere una soluzione stock di 1 mg / ml.
- Mescolare soluzione madre pipettando più volte.
- Utilizzare immediatamente o memorizzare Poly-D-lisina soluzione a 2-8 ° C.
2. Poly-D-lisina (PDL): rivestimento in plastica Piatti di coltura cellulare
- Diluire la soluzione stock con PDL sterile ddh 2 O alla concentrazione finale di 10 mcg / ml.
- Pipettare soluzione sufficiente in piastre da 60 mm a coprire superficie cultura (3 ml per piastre da 60 mm).
- Oscillare delicatamente per assicurare anche il rivestimento della superficie di coltura.
- Incubare le piastre rivestite a temperatura ambiente (RT) per una notte.
- Il giorno successivo, di solito il giorno di dissezione, rimuovere il Poly-D-lisina soluzione mediante aspirazione e lavare brevemente con 3 ml di sterile ddh 2 O. Ripetere questo passaggio. Dopo il secondo lavaggio, rimuovere completamente l'acqua per aspirazione.
- Le piastre possono essere conservati a 4 ° C fino a tre settimane.
3. Poly-D-lisina (PDL) e laminina: Preparazione e rivestimento di vetro a due camere Slides
- Soluzioni madri Mix PDL (1 mg / ml) e laminina (1 mg / ml) in sterile ddh 2 O alla concentrazione finale di 10 e 5 pg / ml, rispettivamente.
- Pipettare soluzione sufficiente in pozzetti di un vetro a due camere di scorrimento per coprire la superficie coltura (1 ml per ogni pozzetto di un bicchiere 2 ben due camera di scorrimento).
- Oscillare delicatamente per assicurare anche il rivestimento della superficie di coltura.
- Incubare le piastre rivestite a temperatura ambiente tutta la notte.
- Il giorno successivo, rimuovere il Poly-D-lisina-laminina soluzione di rivestimento mediante aspirazione e lavare brevemente due volte con 1 ml di soluzione sterile ddh 2 O. Dopo il secondo lavaggio, rimuovere completamente l'acqua per aspirazione.
- Camera diapositive possono essere conservati a 4 ° C per un massimo di tre settimane.
Nota: qualsiasi diapositiva camera di vetro possono essere rivestiti following questo protocollo. Spesso utilizzare i due vetrini camera perché ogni vetrino fornisce il controllo test sperimentali impostazione (ad esempio non trattati rispetto trattati, non trasfettate rispetto trasfettate).
4. Dissezione neuronale e Cultura
- Riscaldare i seguenti reagenti in un bagno di acqua 37 ° C:
- Triplo espresso sulla sua natura originale flacone da 100 ml.
- Neurobasal/B27 terreno completo (vedi tabella I). Il volume riscaldato dipende dal numero di piatti per essere placcato (ad esempio 30 ml per dieci 60 piatti mm placcato).
- Aggiungere 3 ml di soluzione di Hibernate freddo E a quattro piatti da 60 mm e 13 ml di coltura in un tubo di 15 ml chiarezza BD polipropilene ad alta Falcon conica.
- Aggiungere 25-30 ml di mezzo di dissezione a freddo (vedi tabella II, il dottor Meucci Olimpia, comunicazione personale) a ciascuno dei tre piatti da 100 mm cultura. Queste lastre, contenenti un grande volume di terreno, saranno utilizzati per lavare gli embrioni immediatamente dopo la lorola rimozione dei sacchi amniotici (punti 4.7 e 4.8).
- Euthanize uno E17 femmine di ratto gravide a tempo di CO 2 in conformità con la Politica Servizi pubblici Salute sulle cure Humane ed uso di animali da laboratorio e sotto la cura degli animali istituzionalmente riconosciuto e usare il protocollo.
- Spruzzare basso addome con il 70% EtOH e tagliare medialmente attraverso la pelle ed i muscoli con un paio di forbici che espongono l'utero e gli embrioni.
- Rimuovere tutti i feti e metterli in un contenitore sterile da 100 mm piatto contenente un eccesso di media dissezione a freddo (25-30 ml, vedere il punto 4.3).
- Tagliare gli embrioni con un paio di piccole forbici dal sacco amniotico e metterli nella seconda 100-mm piatto contenente mezzo freddo dissezione.
- Lavare gli embrioni a temperatura ambiente con delicatezza inclinando il piatto da 100 mm per 5-10 secondi. Poi, trasferire gli embrioni lavati al terzo piatto 100 mm contenente medie dissezione. Due lavaggi in eccesso di terreno sono in genere sufficienti per rimuovere tutte le tracce di sangue. Tuttavia, se ncario, lavare ancora una volta con un nuovo 100-mm piatto contenente 25-30 ml di mezzo di dissezione a freddo.
- Utilizzando una pinza stereomicroscopio e curve, estrarre il cervello, ogni embrione di topo tirando la pelle e il cranio. Mettere intero cervello in uno dei 60 mm (in genere i piatti, con non più di 5 cervelli per piatto) con freddo Hibernate E. Tenere queste piastre su ghiaccio.
- Prendete un piatto alla volta e, sotto un microscopio da dissezione, separare gli emisferi e isolare le cortecce cerebrali rimozione del mesencefalo e meningi.
- Optional: cervelli taglio lungo la linea mediana, estrarre ippocampo, e seguire la procedura descritta di seguito per isolare i neuroni dell'ippocampo.
- Raccogli tutte le cortecce sezionato in 15 ml di tubo trasparente conica contenente 13 ml di freddo Hibernate E. Lasciare le cortecce cerebrali sul ghiaccio fino a quando tutte le dissezioni sono state completate. A causa delle dimensioni ridotte, sezionato ippocampi può essere raccolto in un 1,5 ml provetta Eppendorf invece di un 15-ml tubo. Se lo si desidera, a questo passo o cortecciaippocampi può essere collocato in una fiala cryotube contenente 1 ml di sospensione E + 2% B27 + gentamicina (50 ug / ml) + Fungizone (250 ng / ml) nella proporzione di 2-4 o 2-4 cortecce ippocampo per flacone. Tessuto cerebrale può essere conservato a 4 ° C al buio per una settimana (dopo tempi non sono ancora in prova). Quando necessario, utilizzare una pinza sottile per trasferire il tessuto cerebrale in una provetta contenente 15 ml E Hibernate e poi seguire il protocollo seguito per isolare i neuroni.
- Trasferire il tubo ad una cappa coltura tissutale. Lasciare le cortecce di depositarsi sul fondo della provetta e poi accuratamente rimuovere il supernatante.
- Aggiungere 13 ml di fresco E Hibernate a 15-ml tubo conico, consentono cortecce depositano sul fondo del tubo e rimuovere il supernatante. Ripetere questa operazione altre 2 volte e, dopo l'ultimo lavaggio, rimuovere con cura tutti i media.
- Enzimaticamente digerire cortecce cerebrali aggiungendo 1-2 ml (a seconda del numero delle cortecce, utilizzare meno per l'isolamento ippocampo) di Tr caldiypLE Express. Sigillare il tappo del tubo con parafilm e galleggiano la provetta in un bagno di acqua 37 ° C per 10 minuti.
- Spruzzare il tubo con etanolo al 70% prima di aprire il tappo e aggiungere 10 ml di Hibernate E. Lasciare le cortecce di stabilirsi sul fondo della provetta e rimuovere il surnatante. Ripetere questa operazione tre volte per lavare Triplo Express. In ultima fase, rimuovere con cura tutti i media.
- Delicatamente triturare (4-5 volte) le cortecce in 2 ml di mezzo completo Neurobasal/B27 utilizzando un fuoco vetro lucido Pasteur (circa 1 mm di diametro). Fare attenzione a evitare le bolle.
- Ripetere un'altra 4-5 volte con una soluzione sterile di vetro minore pipetta Pasteur di diametro (cioè una pipetta circa 1/2-3/4 millimetri di diametro). Non usare una pipetta Pasteur inferiore a questo o distrugge le cellule.
- Lasciare i pezzi rimanenti di tessuto (generalmente pochissimi, se del caso) per risolvere.
- Trasferire il superiore singola sospensione cellulare a un nuovo tubo da 15 ml, lasciando dietro di sé pezzi di tessuto si insediarono. Pellicciather diluire la sospensione cellulare fino a 10-12 ml con Neurobasal/B27 mezzo completo.
- Mescolare bene e diluire le cellule per il conteggio con l'aggiunta di 10 microlitri di sospensione cellulare a 490 ml di soluzione di conteggio 50x (vedi tabella III) in una provetta Eppendorf 1,5 ml.
- Cellule a piastre di PDL piastre rivestite alla densità di 5,0 x 10 4 / cm 2. Se nucleofection deve essere eseguita, si consiglia piastrando le cellule ad una concentrazione più elevata (8-10 x 10 4 / cm 2).
- Normalmente, sezionare 9-10 feti per esperimento, come circa 13 x 10 6 neuroni sono derivati da ogni feto E17. Se più embrioni sono necessari, assicurarsi che l'intera procedura non dura più di due ore.
- Se desiderato, 24 ore dopo l'isolamento, 10 pM di citosina-β-D-arabinofuranoside (AraC) può essere aggiunto a ogni piatto, al fine di prevenire la proliferazione gliale. Tuttavia, questo passaggio non è necessario dal momento che Neurobasal/B27 medie inibisce la proliferazione gliale, Secondo le raccomandazioni del produttore (Invitrogen / Gibco).
- I neuroni possono essere utilizzati per gli esperimenti successivi 4-5 giorni in vitro, anche se il tempo esatto dipende stadio di differenziazione desiderata. Abbiamo neuroni in coltura fino a 4 settimane senza una diminuzione significativa nella sopravvivenza (Figura 1).
- Per la coltura prolungata, sostituire la coltura media ogni settimana con preparata Neurobasal/B27 terreno completo.
5. Risultati rappresentativi
Neuroni coltivati su vetrini di vetro camera può essere sottoposto a immunocitochimica. Figura 1 mostra una tipica immagine di un neurone corticale fissata dopo cinque giorni in coltura e immunolabeled con anti-MAP-2 anticorpo per mostrare processi neuronali.
La figura 2 mostra un'immagine rappresentativa di un neurone dell'ippocampo ratto dopo 3 settimane in coltura. La morfologia neuronale di una cella completamente differenziata è evidenziata dal MAP-2 immunolabeling (MAP-2 marcatore neuronale, anticorpo monoclonale di topo clone AP-20, Gene Tex, Irvine, CA), a seguito di una procedura standard come descritto in precedenza 1. Le immagini sono state visualizzate con la Nikon Eclipse E400 microscopio a fluorescenza in posizione verticale dotato di fotocamera EXI aqua (Qimaging), motorizzato Z, e SlideBook5 acquisizione / deconvoluzione software (Intelligent Imaging Innovations, Inc., Denver, CO). Una serie di immagini tridimensionali di ogni singola foto sono state deconvoluted ad una immagine bidimensionale e risolto regolando il segnale di cut-off a vicino intensità massima per aumentare la risoluzione.
La figura 3 mostra la purezza di colture neuronali. Lisati sono stati ottenuti da proteine DIV7 colture neuronali di ratto (CTX) e da un caso di glioblastoma umano (GBM). Come previsto, il lisato neuronale è fortemente positiva per la proteina neuronale MAP-2 e negativo per la GFAP marcatore astrociti, mentre il lisato proteina GBM f è negativao MAP-2 e positiva per la GFAP.
Anche se nel nostro protocollo abbiamo usato Hibernate E per diversi anni come la dissezione e risciacquo media, di recente abbiamo esplorato un utilizzo ulteriore e molto pratico per conservare i tessuti cerebrali per un ulteriore uso. La figura 4 mostra un paio di giorni in vitro 5 (DIV5) cultura di neuroni corticali del ratto isolati da cortecce conservati a 4 ° C per una settimana in Hibernate E + B27 dopo la dissezione originale degli embrioni. I neuroni sono stati piastrati su un vetro due camera di scorrimento rivestito con PDL e laminina come precedentemente descritto. L'immagine è stata acquisita deconvoluted usando SlideBook5 acquisizione / software deconvoluzione come sopra descritto (Figura 2).

Figura 1. Immagine rappresentativa di un neurone corticale nucleofected con pmaxGFP (Amaxa, Lonza, Walkersville, MD) e immunolabeled con MAP-2 Anticorpi, in rosso. Ingrandimento originale 100x.
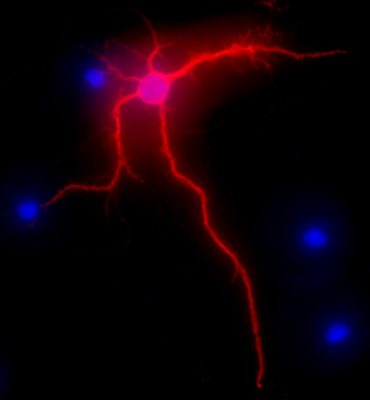
Figura 2. Immagine rappresentativa che mostra MAP-2 immunomarcatura, in rosso, dei neuroni dell'ippocampo dopo 3 settimane in coltura. Colorazione DAPI, in blu, presenta nuclei cellulari. Original ingrandimento 40x.

Figura 3. Western blot mostra la purezza di colture di cellule neuronali. 30 microgrammi di lisati GBM di ratto e umano proteine neuronali sono stati separati mediante elettroforesi e sottoposto ad analisi Western blot seguendo procedure standard 1. Anti-MAP-2 era un coniglio policlonale di segnalazione cellulare (Danvers, MA), anti-GFAP anticorpo monoclonale di topo era da Chemicon (Millipore, Billerica, MA), e l'anticorpo monoclonale murino anti-GRB2 anticorpo era da Transduction Laboratories (BD Sparks, MD). GRB2 è stato usato come controllo di caricamento.

Immagini rappresentative Figura 4. Di 5 giorni in vitro (DIV5) neuroni corticali del ratto ottenuti da cortecce lasciate in Hibernate E + B27 a 4 ° C per una settimana dopo la loro dissezione. A) Il contrasto di fase di neuroni coltivati su un vetro a due camere diapositiva. Original ingrandimento 20X. B) immunofluorescenza mostrano espressione di MAP-2 nei processi neuronali, in verde, la cultura era negativo per il marcatore astrociti GFAP. Colorazione DAPI, in blu, indica nuclei cellulari. Original ingrandimento 40x.
Discussione
Il metodo di dissezione e cultura di neuroni ippocampali di ratto e corticale qui descritto permette di eseguire esperimenti utilizzando colture neuronali quasi purezza coltivate in un mezzo chimicamente definito (Figura 3). Anche se i protocolli per i neuroni coltura quasi pura nel siero senza supporti sono stati precedentemente descritti 2,3,4, ci sono importanti cambiamenti nel nostro metodo. Diverso da protocolli tradizionali (vale a dire Banker et al.) 5, abbiamo sostituito tr...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Ringraziamo Jonna Ellis per l'assistenza editoriale. Il progetto descritto è stato sostenuto da Number Award R01MH079751 (PI: F. Peruzzi), dal National Institute of Mental Health. Il contenuto è di esclusiva responsabilità degli autori e non necessariamente rappresentano le opinioni ufficiali dell'Istituto Nazionale di Salute Mentale o il National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente | Concentrazione | ||
| Neurobasal | 98% | ||
| B27 | 2% | ||
| Glutamax | 0,5 mM |
Tabella I. Neurobasal/B27 mezzo completo.
| Reagente | Concentrazione |
| Glucosio | 16 mM |
| Saccarosio | 22 mm |
| HEPES | 10 mM |
| NaCl | 160 mM |
| KCl | 5 mM |
| Na 2 HPO 4 | 1 mM |
| KH 2 PO 2 | 0,22 mm |
| Gentamicina | 50 ug / ml |
| Fungizone | 250 ng / ml |
| pH | 7,4 |
| Osmolarità | 320-330 mOsm |
Tabella II. Dissezione mezzo.
| Reagente | Volume (pl) |
| Neurobasal/B27 terreno completo | 240 |
| Trypan Blue Stain 0,4% | 250 |
| Totale | 490 |
Tabella III. 50x conteggio soluzione.
| Reagente | Azienda | Cat. numero |
| E Hibernate | Brainbits | 767171 |
| Neurobasal | Gibco, Invitrogen | 21103-049 |
| B27 | Gibco, Invitrogen | 17504-044 |
| Fungizone | Gibco, Invitrogen | 15290-018 |
| Gentamicina solfato | Sigma Aldrich | G1264 |
| Glutamax 200 mM | Gibco, Invitrogen | 35050 |
| Triplo espresso w / o rosso fenolo | Gibco, Invitrogen | 12604 |
| Citosina-β-D-arabinofuranoside cloridrato | Sigma Aldrich | C6645 |
| Poly-D-lisina | Sigma Aldrich | P6407 |
| Laminina 1 mg / ml | Millipore | CC095 |
| HEPES | Sigma Aldrich | H3375 |
| Trypan Blue Stain 0,4% | Gibco, Invitrogen | 15250 |
Tabella IV. Reagenti specifici.
| Attrezzatura | Azienda | Cat. numero |
| Microscopio Stereo | Olimpo | SZ61 |
| Pinze di grandi dimensioni | FST | 11022-14 |
| Punta fine pinze | Moria | MC40B |
| Micro punta fine pinze | Moria | MC31 |
| Affilate le forbici | Roboz | RS-6820 |
| Micro forbici per dissezione | FST | 91460-11 |
| Micro dissezione forbici curve | FST | 14067-11 |
| Vetro 2-camera vetrini | Lab-Tek | 154461 |
| 60 piatti mm | BD Falcon | 353002 |
| Dischi da 100 mm | Corning | 430167 |
| 15 ml provette | BD Falcon | 352099 |
| 1,5 ml crio-tube vial | Nunc | 375353 |
Attrezzature Tabella V. specifico.
Riferimenti
- Aprea, S. Tubulin-mediated binding of human immunodeficiency virus-1 Tat to the cytoskeleton causes proteasomal-dependent degradation of microtubule-associated protein 2 and neuronal damage. J. Neurosci. 26, 4054-4062 (2006).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Serum-free culture of rat post-natal and fetal brainstem neurons. Brain Res. Dev. Brain Res. 120, 199-210 (2000).
- Kivell, B. M., McDonald, F. J., Miller, J. H. Method for serum-free culture of late fetal and early postnatal rat brainstem neurons. Brain Res. Brain Res. Protoc. 6, 91-99 (2001).
- Brewer, G. J. Serum-free B27/neurobasal medium supports differentiated growth of neurons from the striatum, substantia nigra, septum, cerebral cortex, cerebellum, and dentate gyrus. J. Neurosci. Res. 42, 674-683 (1995).
- Banker, G., Goslin, K. . Culturing nerve cells. , (1998).
- Eletto, D. Inhibition of SNAP25 expression by HIV-1 Tat involves the activity of mir-128a. J. Cell Physiol. 216, 764-770 (2008).
- Gualco, E. IGF-IR-dependent expression of Survivin is required for T-antigen-mediated protection from apoptosis and proliferation of neural progenitors. Cell Death Differ. 17, 439-451 (2010).
- Gage, F. H. Survival and differentiation of adult neuronal progenitor cells transplanted to the adult brain. Proc. Natl. Acad. Sci. U.S.A. 92, 11879-11883 (1995).
- Keyser, D. O., Pellmar, T. C. Synaptic transmission in the hippocampus: critical role for glial cells. Glia. 10, 237-243 (1994).
- Pfrieger, F. W., Barres, B. A. Synaptic efficacy enhanced by glial cells in vitro. Science. 277, 1684-1687 (1997).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon