È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In Elettroporazione vitro del labbro inferiore Rombico di embrioni di topo Midgestation
In questo articolo
Riepilogo
Questo studio descrive lo sviluppo di uno In vitro tecnica che permette la manipolazione di espressione genica nel labbro inferiore rombica di embrioni midgestation.
Abstract
Il labbro rombico è uno neuroepitelio embrionale situato nel rombencefalo alla giunzione tra il tubo neurale e la roofplate del quarto ventricolo (recensione in 1). Il labbro rombico può essere suddiviso nel labbro superiore romboidale (URL) che comprende rhombomere 1 (R1) e genera neuroni del cervelletto e il labbro inferiore romboidale (LRL) che dà luogo a diversi lignaggi tronco neuronali 2-4. LRL derivati comprendono i neuroni uditivi dei nuclei cocleari e quelle dei nuclei precerebellar che sono coinvolti nella regolazione dell'equilibrio e il controllo motorio 5-8. Neurogenesi dalla LRL si verifica su una grande finestra temporale che abbraccia giorni embrionali (E) 9,5-16,5 5, 9. Differenti linee neuronali emergono dal LRL come cellule postmitotico (o sono nati) durante il giorno di sviluppo distinti durante questa finestra neurogena.
Elettroporazione di costrutti di espressione genica può essere utilizzato permanipolare l'espressione genica in progenitori LRL e potenzialmente in grado di cambiare il destino dei neuroni ottenuti da questa regione 10-12. Alterare l'espressione genica dei progenitori LRL nel topo mediante elettroporazione in utero ha avuto molto successo per la manipolazione di lignaggi nati il giorno embrionale E12.5 o poi 10, 12-14. In elettroporazioni utero prima E12.5 non hanno avuto successo dovuto principalmente al mortalità associato con la puntura del roofplate quarto ventricolo, un passo necessario nella realizzazione di DNA esogeno che viene elettroporate nel LRL. Tuttavia, molti lignaggi LRL derivati nascono dalla LRL prima di E12.5 9. Questi lignaggi anteriore nati includono i neuroni che compongono il reticolare laterale, cuneate esterna e inferiore nuclei olivare del sistema precerebellar che funzionano per collegare gli ingressi dal midollo spinale e corteccia al cervelletto 5. Per manipolare espressione nel LRLdi embrioni con meno di E12.5, abbiamo sviluppato un sistema in vitro in cui si trovano gli embrioni nella cultura dopo l'elettroporazione.
Questo studio presenta un metodo efficiente ed efficace per manipolare l'espressione genica di progenitori LRL a E11.5. Gli embrioni elettroporate con la proteina fluorescente verde (GFP) guidato dal promotore CAG ampiamente attiva riproducibile espresso GFP dopo 24 ore di coltura. Un aspetto critico di questo saggio è che l'espressione genica è alterata solo per l'espressione del gene esogeno e non a causa di effetti secondari che derivano dalla elettroporazione e tecniche di coltura. E 'stato stabilito che i pattern di espressione dei geni endogeni restano indisturbati negli embrioni elettroporate e colta. Questo test può essere utilizzato per modificare il destino delle cellule che emergono dalla LRL di embrioni di età inferiore ai E12.5 attraverso l'introduzione di plasmidi per la sovraespressione o abbattere (tramite RNAi) di diverse pro-fattori di trascrizione neurali.
Protocollo
1. La preparazione prima Elettroporazione
- Amplificare il DNA per l'elettroporazione di un maxi prep (Prime-It or Qiagen). La concentrazione del DNA dovrebbe essere un minimo di 1 mg / ml per l'assorbimento efficiente.
- Rimuovere 495 pl di DNA e mescolare con 5 pl di 0,01% verde veloce in 1 x PBS (tampone fosfato salino) in una provetta da microcentrifuga.
2. Harvest embrionali
- Stabilire accoppiamenti cronometrati di topi CD-1 (Harlan). Verificare la presenza di tappi vaginali e considerano la data si osserva un tappo vaginale come il giorno embrionale (E) 0.5. Gli embrioni saranno raccolte 11 giorni dopo la visualizzazione spina (E11.5).
- Posizionare strumenti sterilizzati in etanolo 70%. Trattare una cappa a flusso laminare con luce UV per almeno un'ora prima dell'uso. Spray hood, vassoio di dissezione, e dissezione portata con il 70% di etanolo. Pre-calore 1 X PBS a 37 ° C.
- Sul E11.5 l'eutanasia della femmina in base alle condizioni approvate dal InstitutComitato ionale per la cura e l'uso degli animali (ICCUA). Mettere nel cassetto dissezione cappa a flusso laminare. Spruzzare verso il basso l'addome della femmina con il 70% di etanolo.
- Aprire la cavità peritoneale e appuntare le pareti al vassoio dissezione. Estrarre le corna uterine in modo che appoggi all'interno della cavità peritoneale.
- Tagliare con cautela aprire la parete della tromba uterina. Utilizzare un cucchiaio 20 mm (Belle Strumenti Scientifici) per rimuovere delicatamente l'embrione nel sacco vitellino lontano dalla placenta. Embrioni luogo in un piatto di coltura tissutale 100 millimetri pre-riempite con 10 ml di PBS sterile 1 X che è stato preriscaldato in 2.2.
- Ripetere l'operazione per tutti gli embrioni presenti.
3. Elettroporazione di embrioni E11.5 (figura 1)
- Utilizzo di un cucchiaio 20 mm, trasferire il primo embrione in un piatto 100 millimetri preriempita con 10 ml di 1XPBS sterili che è stato preriscaldato a 37 ° C.
- Utilizzare pinze cm 11 x 0,05 con una punta di 0,02 mm (Belle Strumenti Scientifici) di ri attenzionespostare ed eliminare il sacco vitellino.
- Embrione di posizione in modo che il suo lato dorsale è rivolto verso l'alto in modo che assomigli il cartone in Figura 1A. Utilizzare 7 pale elettrodi mm (Harvard Apparatus) a tenere delicatamente l'embrione. Gli elettrodi devono essere posizionati su entrambi i lati del tubo neurale a livello del ventricolo rombencefalo quarto. Il ventricolo è visibile ad occhio nudo, ma utilizzando un microscopio di dissezione può facilitare il posizionamento accurato paddle. Posizionamento delle palette è fondamentale per determinare la regione che riceve il DNA elettroporata. Se il labbro inferiore romboidale (LRL) del rombencefalo dorsale embrionale si desidera, pale deve essere posto in modo tale che essi sono direttamente fiancheggia la parte più larga dell'apertura quarto ventricolo.
- Utilizzare una siringa da 1 cc a redigere il DNA plasmidico miscelato con 0,01% Verde Fast. 500 pl della miscela deve essere sufficiente per l'elettroporazione di almeno 8-10 embrioni (cfr. 3.5).
- Delicatamente perforare la ov roofplateerlying quarto ventricolo con un ago 25G tubercolina 5/8 attaccato alla siringa 1 cc e iniettare il DNA-colorante miscela nel ventricolo. Iniezioni successo sono caratterizzate dal DNA-colorante miscela riempimento dell'intero sistema ventricolare (Figura 1C). La quantità di DNA-colorante miscela tipicamente iniettato è inferiore a 50 pl. Importi esatti sono variabili tra embrioni come una porzione della miscela tende a fuoriuscire dal ventricolo nel PBS che circonda l'embrione. Un mezzo alternativo di consegna del DNA-dye miscela sarebbe attraverso l'accesso al sistema ventricolare perforando il velo che ricopre il mesencefalo. Ancora, iniezioni di successo sono caratterizzati dal DNA-colorante miscela riempimento dell'intero sistema ventricolare.
- Consegnare cinque impulsi quadrati utilizzando un generatore di impulso elettrico (BTX) e 7 pale elettrodi mm. Ogni impulso è 50 V della durata di 5 ms per impulso con 500 ms tra ogni impulso. Il tessuto più vicino all'elettrodo caricata positivamente quindi take il plasmide.
4. Cultura di embrioni
- In una cappa a flusso laminare, riempire i pozzetti esterne di un 12-ben piatto di coltura con 2 mL di DMEM/F12 mezzo supplementato con 10% siero fetale bovino, 5% siero equino, 1% glutammina, 1% di penicillina / streptomicina che è stato preriscaldato a 37 ° C. Le condizioni di coltura sono stati adattati da de Diego e colleghi 15.
- In embrioni cappa a flusso laminare pizzico di midsection (sotto il cuore) con una pinza e rimuovere parte posteriore dell'embrione. Posizionare la porzione anteriore in uno dei pozzetti riempiti del 12-ben piatto di coltura.
- Ripetere l'operazione per tutti gli embrioni. Riempire solo i pozzi esterni del 12 pozzetti per evitare la contaminazione delle culture.
- Cultura embrioni in un incubatore a 37 ° C al 5% di CO 2. Espressione del plasmide elettroporate dovrebbe essere osservabile entro 24 ore.
- In caso di tempi più lunghi la cultura essere desiderata, riempire i pozzetti su un nuovo piatto ben 12 con 2 ml dii supporti utilizzati in 4.1. Con un cucchiaio sterilizzato trasferire gli embrioni a un pozzo nella nuova piastra. Mettere di nuovo nel 37 ° C incubatore. La cultura per un massimo di 48 ore è possibile.
- Quando il tempo di coltura desiderato viene raggiunto, fissare embrioni per analisi (vedi sotto).
5. Preparazione di embrioni per l'analisi
- Risciacquare embrioni in 1 x PBS a 4 ° C per cinque minuti. Ripeti.
- Fix embrioni per analisi in 2% paraformaldeide (PFA) in 1XPBS per 2 ore a 4 ° C.
- Risciacquare embrioni in 1 x PBS a 4 ° C per cinque minuti. Ripeti.
- Equilibrare embrioni in 30% saccarosio in 1 x PBS notte a 4 ° C.
- Incorpora embrioni in temperatura ottimale di taglio (OCT) composto con un ghiaccio secco / etanolo bagno. Gli embrioni possono essere conservati a -20 ° C.
- Embrioni sezione in un criostato (Leica), in 30 sezioni micron e montare su vetrini (VWR, Superfrost Plus). Conservare a -20 ° C.
6. ImmuAnalisi nohistochemistry
- L'immunoistochimica è stata eseguita come descritto in 16. Diluizioni degli anticorpi primari utilizzati per questo studio includono coniglio α-GFP (Invitrogen) 1:2500; del mouse α-Mash1 (BD Biosciences) 1:100; coniglio α-Ngn1 (Jane Johnson) 1:5000; coniglio α-Ptf1a (Jane Johnson ) 1:2500; coniglio Math1 (Jane Johnson) 1:100. Incubare guida piatta, lato campione su un vassoio di colorazione a 4 ° C per una notte.
- I vetrini sono stati analizzati su un microscopio composto (Olympus BX51).
7. Risultati rappresentativi
Uno schema in figura 1A mostra l'esperimento elettroporazione. Figura 1B mostra una vista sagittale di un embrione E11.5 prima della manipolazione. L'embrione stesso dopo l'iniezione del CAG plasmide contenente :: GFP in 0,01% verde rapido viene mostrato nella Figura 1C e rappresentante un embrione non fissata espositiva GFP unilateraleespressione nella dorsale rombencefalo 24 ore cultura seguente è mostrato nella figura 1D. L'estensione della zona del LRL che viene correttamente elettroporata è variabile e sembra essere fortemente dipendente posizionamento degli elettrodi. Nei nostri studi è stato trovato che 52 su 65 (80%) degli embrioni elettroporate espressi con successo GFP. Tessuto è stato considerato essere correttamente elettroporata se era positivo per GFP nelle regioni localizzate su varie sezioni successivo fissaggio e l'analisi immunoistochimica (vedi sotto). Gli embrioni che non hanno rispettato questi criteri sono stati segnati come tentativi falliti di elettroporazione.
Ulteriore valutazione dell'efficienza elettroporazione può essere accertata eseguendo immunoistochimica contro GFP su sezioni trasversali di embrioni elettroporate a livello del quarto ventricolo. Figura 2 mostra rappresentativi sezioni seriali da un embrione visualizzazione unilateraleEspressione di GFP. Figura 2A mostra uno schema idealizzato che illustra che il lato sinistro dell'embrione era verso l'elettrodo positivo. Sezioni trasversali (a livelli rappresentati dalla metà cartone di figura 2A) rivelare l'espressione localizzata GFP esclusivamente sul lato sinistro del tessuto rombencefalo (figure 2C e 2D). L'area elettroporata del LRL non estendere l'intero asse anteriore-posteriore del tubo neurale come esame di sezioni 300 um rostrali o superiore a quella mostrata in Figura 2C non esprime GFP (Figura 2B).
L'utilità di questo test di manipolazione genica dipende dalla stabilità dei domini di espressione per le proteine endogene. Il LRL è stato caratterizzato come in possesso di domini unico progenitore caratterizzate dalla espressione differenziale di fattori di trascrizione proneural (recensione in 1).Un sottoinsieme di questi fattori (Mash1, Math1, Ngn1 e Ptf1a) sono stati scelti per l'analisi a causa della loro proposta e / o ruoli caratterizzati nel disciplinare di precerebellar sottotipi neurali nel LRL, oggetto di studi futuri 16-18. Tutte e quattro le proteine hanno domini di espressione altamente caratteristici della rombencefalo caudale a E11.5 16-18. Abbiamo osservato che gli embrioni che sono stati collocati culture riuscito ad aumentare di dimensioni e inoltre non riesce a iniziare la produzione di epitelio plesso coroideo e invaginazione delle LRL e roofplate, eventi morfologici che si verificano tra E11.5 e E12.5 5. Sulla base di queste osservazioni è stato stabilito che il normale sviluppo di questi embrioni è stata interrotta o gravemente ritardata e il controllo comparabile per gli embrioni devono essere colte incolte embrioni a E11.5.
Per garantire che la cultura ed elettroporazione non disturbare i livelli di proteine endogene, abbiamo analizzato quattro diverse proteine da immunohistochemistry (IHC) in 34 embrioni differenti che sono state elettroporate e quindi coltivate per almeno 24 ore. Tabella I mostra il numero di embrioni analizzati per ciascun marcatore e la percentuale degli embrioni analizzato che mantiene livelli normali proteine. Figura 3 mostra i dati rappresentativi IHC da due delle proteine analizzati, Mash1 (Figure 3A e 3B) e Math1 (figure 3C e 3D). Abbiamo osservato che la maggior parte degli embrioni mantiene livelli normali di elettroporazione seguente espressione e cultura (figure 3b e 3d) rispetto agli embrioni di controllo a E11.5 (Figure 3A e 3C). È importante sottolineare che i domini di espressione caratteristici di queste proteine non sono stati perturbato.
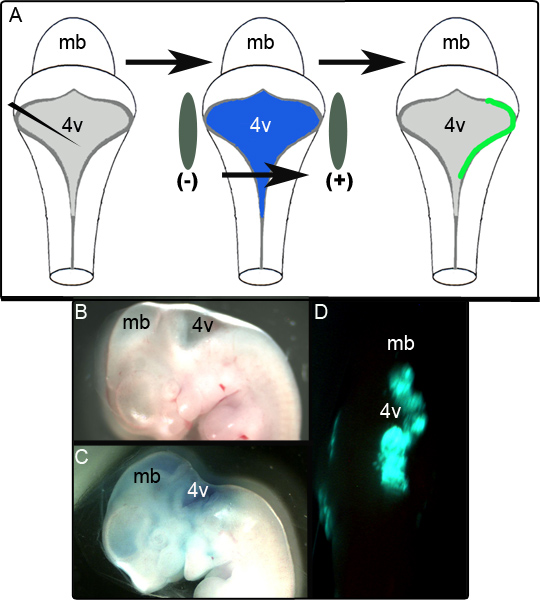
Figura 1. Elettroporazione di embrioni a E11.5. (A) Schema di The elettroporazione esperimento. Un embrione E11.5 è isolato e il plasmide di espressione in 0,01% verde rapido viene iniettato nel quarto ventricolo. L'embrione viene affiancata da pale elettrodi e sottoposto ad un impulso V 50 prima di essere messi in coltura (B) sagittale di un embrione E11.5 prima dell'iniezione. (C) L'embrione stesso E11.5 dopo l'iniezione del plasmide di 0,01% verde Fast. (D) espressione rombencefalo unilaterale della GFP osservato in embrioni E11.5 dopo 24 ore di cultura. mb-mesencefalo; 4V quarto ventricolo.
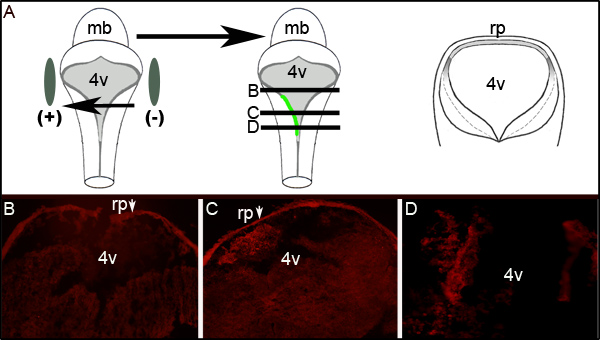
Figura 2. L'espressione di GFP in Tissue elettroporata. (A) Il cartone sulla sinistra rappresenta il posizionamento degli elettrodi attorno a un embrione E11.5. Cartone mediana mostra l'assorbimento e l'espressione di GFP plasmide codificante sul lato sinistro dell'embrione. Cartoon sulla destra è schematica di una sezione trasversale idealizzata presa attraverso l'embrione in levels contrassegnata da linee nere in mezzo fumetto. (B-D) per la GFP immunoistochimica su sezioni trasversali attraverso un embrione elettroporate E11.5 dopo 24 ore di cultura. Le frecce indicano la (rp) roofplate che intrappola l'anticorpo secondario. Le immagini sono prese a ingrandimento 10X. I livelli relativi delle sezioni mostrate sono rappresentati dalle linee orizzontali attraverso il cartone centrale in (A). mb-mesencefalo; l 4V quarto ventricolo; rp-roofplate.
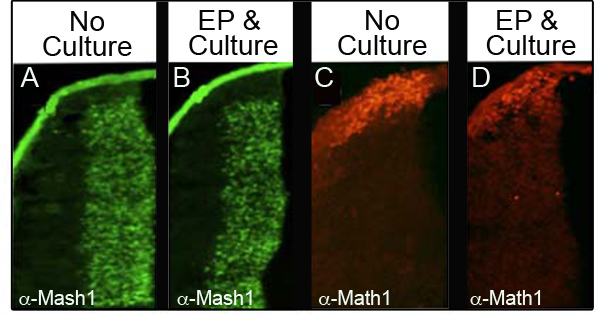
Figura 3. Espressione di proteine endogene nel labbro inferiore rombico immunoistochimica per Mash1 (A e B) o Math1 (C e D) confrontare sezioni trasversali di embrioni E11.5 che non erano coltivate (A, C) con embrioni sono state elettroporate con CAG.: : GFP e coltivate per 24 ore (B e D). Immagini prese con ingrandimento 10X.
| Proneural Transcriptisu fattori analizzati | Numero di embrioni analizzati | Percentuale ritenuta Patterns normale espressione |
| Math1 | 15 | 86,7% |
| Mash1 | 12 | 83,3% |
| Ngn1 | 7 | 71,4% |
| Ptf1a | 6 | 100% |
Tabella I. Percentuale di embrioni elettroporate e colto di contenimento normali Proneural Domini fattore di trascrizione nel LRL.
Discussione
La tecnica di elettroporazione in vitro presentato in questo studio è una nuova metodologia che può essere efficacemente utilizzata per manipolare l'espressione genica in embrioni di età inferiore ai 12 giorni di gestazione. Posizionamento degli embrioni in cultura permette l'espressione del gene introdotto e aggira la letalità osservata quando embrioni elettroporate possono rimanere in vivo. Questa tecnica permette la manipolazione di espressione genica in progenitori embrionali precedente...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare Jane Johnson per il Math1, Ngn1, e gli anticorpi Ptf1a e Connie Cepko per la pCAG :: GFP plasmide. Questo lavoro è stato finanziato dal NIH 1R15HD059922 R15-01.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Commenti (opzionale) |
| Criostato | Leica | CM-1850 | |
| Biologie punta Dumoxel trattati DUMONT forcipe | Belle Strumenti Scientifici | 11252-30 | |
| 20 millimetri MORIA cucchiaio forato | Belle Strumenti Scientifici | 10370-17 | |
| ECM 830 Onda quadra Generator Elettroporazione | BTX (VWR) | 47745-928 | |
| Harvard Apparatus Tweezertrodes 7 mm * Elettrodi | BTX (Fisher) | BTX450165 | |
| Fisher Isotemp CO 2 Incubator | Pescatore | 1325525 | |
| NAPCO CO 2 Gas Regulator | Pescatore | 15497020 | |
| 12 Bene piastre di coltura dei tessuti | BD Falcon (Fisher) | 877229 | |
| HyClone Liquid media DMEM/F-12 (1:1), con L-glutammina e HEPES; 500mL | Thermo Scientific (Fisher) | SH3002301 | |
| HyClone * Donor siero equino | Thermo Scientific (Fisher) | SH3007402 | |
| Siero fetale bovino, qualificato, inattivato al calore | Invitrogen | 16140-063 | |
| Cellgro * 10.000 UI di penicillina, 10.000 mg / ml di streptomicina | Mediatech (Fisher) | MT-30-002-CI | |
| HyClone * L-Glutamina L-Glutammina; 200 mm in NaCl 0,85% | Thermo Scientific (Fisher) | SH3003401 | |
| Fast-verde | Pescatore | AC41053-0250 | 0,01% |
Riferimenti
- Ray, R. S., Dymecki, S. M. Rautenlippe Redux -- toward a unified view of the precerebellar rhombic lip. Current opinion in cell biology. 21, 741-747 (2009).
- Machold, R., Fishell, G. Math1 is expressed in temporally discrete pools of cerebellar rhombic-lip neural progenitors. Neuron. 48, 17-24 (2005).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Wingate, R. J., Hatten, M. E. The role of the rhombic lip in avian cerebellum development. Development (Cambridge, England). 126, 4395-4404 (1999).
- Altman, J., Bayer, S. A. . Development of Cerebellar System: In relation to its evolution, structure, and function. , (1997).
- Farago, A. F., Awatramani, R. B., Dymecki, S. M. Assembly of the brainstem cochlear nuclear complex is revealed by intersectional and subtractive genetic fate maps. Neuron. 50, 205-218 (2006).
- Wang, V. Y., Rose, M. F., Zoghbi, H. Y. Math1 expression redefines the rhombic lip derivatives and reveals novel lineages within the brainstem and cerebellum. Neuron. 48, 31-43 (2005).
- Rodriguez, C. I., Dymecki, S. M. Origin of the precerebellar system. Neuron. 27, 475-486 (2000).
- Taber-Pierce, E. Histogenesis of the nuclei griseum ponitis, corporis pontobulbaris and reticularis tegmenti pontis (bechterew) in mouse. J. Comp. Neurol. 126, 219-240 (1966).
- Dipietrantonio, H. J., Dymecki, S. M. Zic1 levels regulate mossy fiber neuron position and axon laterality choice in the ventral brain stem. Neuroscience. 162, 560-573 (2009).
- Takahashi, M., Sato, K., Nomura, T., Osumi, N. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70, 155-162 (2002).
- Taniguchi, H., Kawauchi, D., Nishida, K., Murakami, F. Classic cadherins regulate tangential migration of precerebellar neurons in the caudal hindbrain. Development (Cambridge, England). 133, 1923-1931 (2006).
- Kawauchi, D., Taniguchi, H., Watanabe, H., Saito, T., Murakami, F. Direct visualization of nucleogenesis by precerebellar neurons: involvement of ventricle-directed, radial fibre-associated migration. Development (Cambridge, England). 133, 1113-1123 (2006).
- Okada, T., Keino-Masu, K., Masu, M. Migration and nucleogenesis of mouse precerebellar neurons visualized by in utero electroporation of a green fluorescent protein gene. Neuroscience research. 57, 40-49 (2007).
- de Diego, I., Kyriakopoulou, K., Karagogeos, D., Wassef, M. Multiple influences on the migration of precerebellar neurons in the caudal medulla. Development (Cambridge, England). 129, 297-306 (2002).
- Landsberg, R. L. Hindbrain rhombic lip is comprised of discrete progenitor cell populations allocated by Pax6. Neuron. 48, 933-947 (2005).
- Hoshino, M. Ptf1a, a bHLH transcriptional gene, defines GABAergic neuronal fates in cerebellum. Neuron. 47, 201-213 (2005).
- Yamada, M. Origin of climbing fiber neurons and their developmental dependence on. Ptf1a. J. Neurosci. 27, 10924-10934 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon