È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Produzione di vettori lentivirali per Celle di trasduzione del Sistema Nervoso Centrale
In questo articolo
Riepilogo
In questo protocollo si descrive la produzione, purificazione e titolazione di vettori lentivirali. Forniamo un esempio di vettori lentivirali mediata consegna gene in colture primarie neuroni ed astrociti. I nostri metodi possono valere anche per altri tipi di cellule In vitro E In vivo.
Abstract
La consegna del gene efficiente nel sistema nervoso centrale (SNC) è importante per studiare le funzioni dei geni, modellando le malattie neurologiche e lo sviluppo di approcci terapeutici. Vettori lentivirali sono strumenti interessanti nella trasduzione di neuroni e altri tipi di cellule nel sistema nervoso centrale come trasducono entrambe le cellule che si dividono e non dividere, espressione sostegno costante dei transgeni, e hanno capacità di confezionamento relativamente grande e bassa tossicità 1-3. Vettori lentivirali sono stati utilizzati con successo nella trasduzione molti tipi di cellule neurali in vitro e negli animali 4-6 7-10.
Notevoli sforzi sono stati fatti per sviluppare vettori lentivirali con una migliore biosicurezza ed efficienza per la consegna gene. Le correnti di terza generazione replicazione-difettosi e auto-inattivazione (SIN) vettori lentivirali sono rappresentati nella Figura 1. Gli elementi necessari per il confezionamento vector sono divisi in quattro plasmidi. Nel lentivirale transFer plasmide, la regione U3 lunga ripetizione terminale in 5 '(LTR) viene sostituito con un promotore forte da un altro virus. Questa modifica permette la trascrizione della sequenza vettore indipendente di HIV-1 Tat proteina che è normalmente richiesto per l'espressione genica HIV 11. Il segnale di imballaggio (Ψ) è essenziale per incapsidamento e l'elemento reagente Rev (RRE) è richiesto per produrre vettori alto titolo. Il tratto centrale polypurine (cPPT) è importante per l'importazione nucleare del DNA vettore, una caratteristica necessaria per trasduzione non-cellule che si dividono 12. Nella 3 'LTR, le sequenze cis-regolatori vengono completamente rimosso dalla regione U3. Questa soppressione è copiato 5 'LTR dopo la trascrizione inversa, con conseguente inattivazione trascrizionale di entrambi LTR. PMDLg plasmide / pRRE contiene HIV-1 gag / pol geni, che forniscono proteine strutturali e trascrittasi inversa. PRSV-Rev codifica Rev che si lega al RRE efficiente per l'esportazione di RNA dal nucleo. pCMV-G codificala glicoproteina virus della stomatite vescicolare (VSV-G) che sostituisce HIV-1 Env. VSV-G espande il tropismo dei vettori e permette di concentrarsi tramite ultracentrifugazione 13. Tutti i geni che codificano le proteine accessorie, tra Vif, Vpr, Vpu, e Nef sono esclusi nel sistema di imballaggio. La produzione e manipolazione dei vettori lentivirali deve essere effettuata secondo le linee guida per la ricerca NIH implicano il DNA ricombinante ( http://oba.od.nih.gov/oba/rac/Guidelines/NIH_Guidelines.pdf ). L'omologazione da individuo comitato istituzionale per la sicurezza biologica e chimica può essere richiesto prima di utilizzare vettori lentivirali. Vettori lentivirali sono comunemente prodotte da cellule 293T cotrasfezione con trasferimento lentivirale plasmide ed i plasmidi helper che codificano le proteine necessarie per il confezionamento vettore. Molti plasmidi trasferimento lentivirali e plasmidi helper possono essere ottenute da Addgene, non-Profit repository plasmide ( http://www.addgene.org/~~V ). Alcuni stabili linee cellulari di confezionamento sono state sviluppate, ma questi sistemi offrono minore flessibilità e l'efficienza imballaggio diminuisce generalmente nel tempo 14, 15. Kit di transfezione disponibili in commercio possono supportare elevata efficienza di trasfezione 16, ma possono essere molto costoso per preparazioni di grandi dimensioni vettore. Metodi di precipitazione di fosfato di calcio fornire trasfezione molto efficiente di cellule 293T e fornire così un approccio affidabile e conveniente per la produzione di vettori lentivirali.
In questo protocollo, si produrre vettori lentivirali per cotrasfezione di cellule 293T con quattro plasmidi basati sul principio di precipitazione con fosfato di calcio, seguito da purificazione e concentrazione con ultracentrifugazione attraverso un cuscino di saccarosio 20%. I titoli vettore sono determinate da fluorescenza selezione delle cellule attivate (FACS) analelisi o qPCR in tempo reale. La produzione e la titolazione dei vettori lentivirali di questo protocollo può essere rifinito con 9 giorni. Forniamo un esempio di trasduzione questi vettori in murini culture neocorticali contenenti sia i neuroni e astrociti. Dimostriamo che i vettori lentivirali sostenere ad alta efficienza di trasduzione e delle cellule tipo-specifica espressione genica nelle cellule primarie in coltura da CNS.
Protocollo
1. Packaging di vettori lentivirali
Vettori lentivirali sono prodotte da cotrasfezione di un vettore di trasferimento lentivirale ed altri plasmidi necessari per il confezionamento in cellule 293T secondo il metodo trasfezione fosfato di calcio. Usiamo 10 da 100 mm, piatti di coltura di tessuto di questo protocollo. Esso può essere aumentato o basso a seconda delle applicazioni. La linea cellulare 293T viene mantenuta in modificato da Dulbecco (DMEM) con glucosio (4500 mg / L), integrato con 10% siero fetale bovino (FBS), 100 unità / ml di penicillina, 100 pg / ml di streptomicina a 37 ° C incubatore con il 5% di CO 2.
- Seed 293T cellule a confluenza del 30-40% a 10 piatti di tessuto da 100 mm Cultura (3 x 10 6 cellule / piatto) in terreno di coltura. Riportare le cellule incubatrice.
- Dopo 20-24 cultura h, controllare la densità delle cellule. Le cellule devono essere circa 80% di confluenza al momento della transfezione.
- Preparare una provetta da 50 ml. Aggiungere 4,4 ml TE79/10 (1 mM TrisHCl, 0,1 mMEDTA, pH 7,9) meno il volume totale del seguente DNA plasmidico. Aggiungere 100 pg trasferimento lentivirale plasmide (figura 1), 58 mg pMDLg / pRRE, 31 pg pCMV-G, 25 pg PRSV-Rev, 600 microlitri 2M CaCl 2. Mescolare delicatamente.
- Preparare un altro tubo da 50 ml. Aggiungere 5 ml 2x HBS (HEPES 0,05 M, 0,28 M NaCl, 1,5 mM Na 2 HPO 4, pH 7,12).
- Prendere la DNA-CaCl 2 miscela di 10-ml pipetta e aggiungere al tubo contenente 2 x HBS, goccia a goccia mentre il tubo vortex.
- Mantenere la reazione di precipitazione a temperatura ambiente (RT) per 30 min.
- Rimuovere le piastre di coltura da incubatrice. Mescolare la reazione di precipitazione bene nel vortex. Aggiungere 1 ml di sospensione per ogni 100 mm di cellule contenenti piatto. La sospensione deve essere aggiunto lentamente, goccia a goccia mentre delicatamente il mezzo nel piatto. Torna questi piatti per l'incubatore e lasciare per 5 ore.
- Rimuovere il terreno dalla coltura. Aggiungere 6 ml di mezzo di coltura fresco contenente 6 mM di sodio butyrate ad ogni piatto. Riportare le culture di incubatore. Dopo la coltura di una notte, se vi è un reporter fluorescente nel costrutto, controllare l'espressione del gene reporter sotto microscopio a fluorescenza. Solitamente, oltre l'80% delle cellule esprimono il gene reporter se è guidata da un promotore ubiquitario (ad esempio promotore CMV).
- Due giorni (40-44 h) dopo la transfezione, raccogliere il supernatante da 10 piatti in 2 ml 50-provette (circa 30 ml ciascuna provetta). Congelare il surnatante in freezer -80 ° C o andare al passaggio successivo.
2. Concentrazione e purificazione dei vettori
- Centrifugare il raccolto di fresco o congelato surnatante a 900 g (circa 2000 rpm) per 10 minuti per rimuovere i detriti cellulari nel supernatante.
- Collegare una siringa da 60 ml ad un 0,2 micron filtro SFCA siringa. Trasferire il supernatante da 50-ml provetta alla siringa. Filtrare il surnatante in una provetta da centrifuga polyallomer.
- Take 5 ml di saccarosio 20% (preparato in PBS) in una pipetta da 5 ml. Inserirela pipetta al fondo della provetta contenente supernatante. Aggiungere lentamente la soluzione di saccarosio sotto il surnatante vettore. Ripetere questi passaggi per il surnatante da un altro tubo.
- Centrifugare il surnatante a 11000 giri al minuto e 4 ° C per 4 h con Beckman SW28 rotore swing.
- Rimuovere il surnatante. Aggiungere 150 ul Lattosio 4% (preparato in PBS) a ciascuna provetta. Risospendere il pellet.
- Trasferire il vettore concentrato da tutte le provette da centrifuga a 1,5 ml provetta. Lasciare la provetta in ghiaccio per 15 min.
- Mescolare la sospensione vettore pipettando. Spin con microcentrifuga a piena velocità (circa 16000 g) per 1 min.
- Trasferire il surnatante in un nuovo tubo da 1,5 ml. Dividere il campione finale in 20 aliquote pl e conservati in congelatore -80 ° C.
3. Titolazione dei vettori
- Seme 5 x 10 4 / pozzetto di HT1080 cellule in 12-pozzetti in 1 ml di terreno DMEM supplementato con 10% FBS.
- Dopo overnigcultura ht, contare le celle da un bene e segnare il numero di cellulare.
- Effettuare 5-volte diluizione seriale (1:5, 1: 25; 1:125, e 1:625) del vettore concentrato con mezzo di coltura. Aggiungi I ul di ciascun vettore diluito in pozzetti separati. I campioni possono essere duplicati per aumentare la precisione.
- Aggiungere 1 pl 4 mg / ml Polybrene (Hexadimethrine bromuro) in ciascun pozzetto contenente vettore e in un pozzo senza vettore. Mescolare agitando delicatamente la piastra. Torna a incubatore per 48 ore.
- Rimuovere media da pozzi di coltura cellulare. Lavare ogni pozzetto con PBS. Aggiungere 250 pl 1x tripsina-EDTA soluzione alle cellule. Quando le cellule vengono staccate (3-5 min), aggiungere 1 ml di mezzo di coltura. Risospendere le cellule pipettando. Trasferimento sospensione di cellule in provette ml 1,5 centrifuga.
- Centrifugare a 900 g per 6 min. Per i vettori con un gene reporter fluorescente (GFP per esempio), passare al punto 3.7 per l'analisi FACS. Per i vettori che non un giornalista, andare al punto 3.8 per qPCR in tempo reale.
- Per vettori contenenti un fluogene reporter fluorescente, rimuovere il supernatante e risospendere il pellet con 300 ml di 3,7% di formaldeide in PBS. Determinare la percentuale di cellule positive del reporter mediante analisi FACS. Il titolo sarà rappresentato come unità di trasduzione per millilitro concentrato vettore (TU / ml).
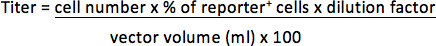
Ad esempio, se 1 x 10 5 cellule è stato trasdotto con pl 1/25 (0,04 pl) vettore e 30% di cellule positive sono giornalista, il titolo sarà:
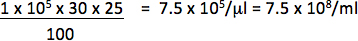
Utilizzare solo le diluizioni cadono in una relazione lineare tra la percentuale di cellule positive e la quantità di vettore aggiunto per calcolare titolo. Il titolo finale dovrebbe essere una media dei titoli ottenuti da trasduzioni di almeno 2 diverse quantità del vettore.
- Per vettori senzagene reporter fluorescente, estrarre il DNA genomico da HT1080 cellule usando QIAamp DNA Mini Kit (Qiagen) secondo il protocollo del produttore. Amplificazione sequenza di vettore nel DNA genomico utilizzando ABI Prism 7000 Sequence Detection System (Applied Biosystems) con inneschi (in HIV-1 PBS / psi regione 17) 5'-CCGTTGTCAGGCAACGTG-3 'e 5'-AGCTGACAGGTGGTGGCAAT-3', e TaqMan sonda 5 '-FAM-AGCTCTCTCGACGCAGGACTCGGC-TAMRA-3'. Gene albumina che è una sola copia del gene nel genoma (2 copie per cellula) è stato amplificato con i primer 5'-TGAAACATACGTTCCCAAAGAGTTT-3 'e 5'-CTCTCCTTCTCAGAAAGTGTGCATAT-3' e 5'-probe-TGCTGAAACATTCACCTTCCATGCAGA FAM-TAMRA-3 'come controllo interno. Determinare i numeri di copie di vettore e di albumina da PCR in piastra a 96 pozzetti secondo le istruzioni del fabbricazione con il seguente programma: 50 ° C per 2 min, 95 ° C per 10 minuti, e 35 cicli di 95 ° C per 15 sec e 60 ° C per 2 min. Diluizioni seriali di dieci volte di plasmidi di concentrazione nota (rappresentato come copianumero) contenente le sequenze modello dovrebbe essere amplificato per creare una curva standard per la quantificazione di campioni sconosciuti. Il titolo sarà rappresentato come unità di integrazione per millilitro concentrato vettore (UI / ml).
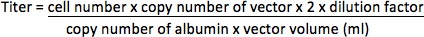
4. Trasduzione delle Culture neocorticale
Culture neocorticale contenenti sia neuroni e glia sono preparati da corteccia di topo usando una procedura in due fasi placcatura come descritto in precedenza 18. Neocortices ottenuti da topi fetale a 14-16 giorni di gestazione vengono piastrati su un monostrato precedentemente stabilito gliale in MEM additivato con il 10% FBS, 20 mM di glucosio e glutammina 2 mM a 24-pozzetti di coltura tissutale.
- Dopo 5 giorni in vitro, aggiungere 10 pM citosina arabinoside (Ara-C) in CENALcultura ortical per inibire non neuronali divisione cellulare. Continua a coltura le cellule per 2 giorni.
- Mezzo di coltura caldo 37 ° C in bagno d'acqua per 5-10 min. Sostituire Ara-C contenente il mezzo con terreno di coltura fresco (500 pl / pozzetto).
- Aggiungere vettore con desiderata MOI (molteplicità di infezione, il rapporto tra il numero di particelle vettore per il numero di cellule bersaglio) alla cultura. Continua coltura per 24 h. Usiamo MOI di 1-10 (di solito 5) in colture primarie corticali.
- Sostituire terreno di coltura con terreno fresco. Continua la cultura. Se c'è un gene reporter nel costrutto vettore, controllare le cellule sotto microscopio fluorescente 2 giorni dopo trasduzione. Espressione del gene reporter sarà visibile in neuroni 2-7 dopo trasduzione, a seconda del design vettore e la dose usata.
5. Risultati rappresentativi
I titoli dei vettori lentivirali prodotti con questa gamma di protocollo 10 8 -10 10 IU / ml el'elevatoh sono adatti per la trasduzione di una varietà di tipi di cellule del CNS sia in vitro che in vivo. Tabella 1 e la figura 2 mostra un risultato rappresentativo con i vettori prodotti da questo protocollo. Noi trasdotte murini culture neocorticali con vettori lentivirali esprimenti proteina verde fluorescente (GFP), controllata da sinapsina (SYN) promotore o proteina acidica fibrillare gliale (GFAP) promotore. Sette giorni dopo la trasduzione, abbiamo effettuato immunocolorazione di neuroni etichette ed astrociti con anticorpi anti-NeuN e anti-GFAP, rispettivamente. Come mostrato nella tabella 1 e Fig. 2A, dopo trasduzione con il vettore che porta il promotore sinapsina, oltre il 90% dei neuroni (cellule NeuN +) esprimono GFP e non astrociti (GFAP + cellule) esprimono questo gene reporter. Quando promotore GFAP è utilizzata nel costrutto vettore (Fig. 2B), circa 80% di astrociti (GFAP + cellule) espressiones GFP; tutte le cellule GFP + astrociti sono come confermato dalla colocalizzazione con GFAP e l'assenza di espressione di GFP in cellule NeuN-etichettati. Questi risultati dimostrano che vettori lentivirali sono molto efficaci per fornire transgeni alle cellule del CNS e cellula-specifici espressione genica può essere raggiunta quando vengono utilizzati promotori appropriati.
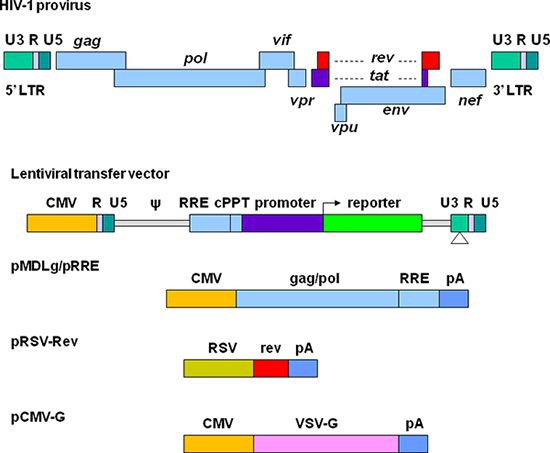
Figura 1. Rappresentazione schematica di vettori lentivirali dell'HIV basati ed i plasmidi confezionamento. La provirus HIV-1 è mostrata in alto. Gli elementi di vettore di produzione sono separati in quattro differenti plasmidi. Il trasferimento lentivirale plasmide contiene un ibrido 5 'LTR in cui viene sostituita con la regione U3 del citomegalovirus (CMV), il segnale di imballaggio (ψ), la sequenza di RRE, il tratto polypurine centrale (cPPT), un gene di interesse (ad es un reporter fluorescente) insieme con un promotore di scelta, e il 3 'LTR in cui lasequenze cis regolazione sono completamente rimosso dalla regione U3. pMDLg / pRRE contiene geni gag e pol ed sequenza RRE da HIV-1 sotto il controllo del promotore CMV. PRSV-Rev contiene la sequenza codificante di Rev guidata dal promotore RSV. pCMV-G VSV contiene il gene della proteina-G sotto il controllo del promotore CMV. PA indica il segnale di poliadenilazione da umano β-globina.
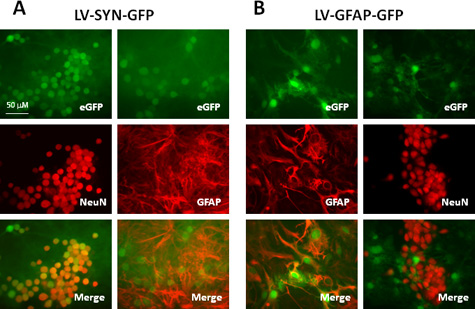
Figura 2. Espressione dei geni reporter in coltura mista topo neocorticale trasdotte con vettori lentivirali trasportano cellulari tipo-specifici promotori. Le colture sono state transdotte con LV-SYN-GFP (A) o LV-GFAP-GFP vettori (B) ad una MOI di 5. Sette giorni dopo la trasduzione, le cellule sono state immunomacchiate con anticorpo anti-NeuN o anti-GFAP. I pannelli superiori mostrano fluorescenza GFP, pannelli centrali mostrano immunostaining e pannelli inferiori sono uniti immagini (GFP: verde; NeuN o GFAP: rosso).
| Vettore | GFP + cellule in neuroni | + GFP negli astrociti |
| LV-SYN-GFP | 92,2 ± 7,3 | 0 |
| LV-GFAP-GFP | 0 | 78,3 ± 11,5 |
Tabella 1. Confronto di espressione GFP in culture neocorticali murine trasdotte con vettori lentivirali che trasportano promotori diversi a.
un colture murini neocorticali (5 x 10 5 / pozzetto in 24-pozzetti) sono state transdotte con LV-SYN-GFP o LV-GFAP-GFP ad una MOI di 5. Sette giorni dopo la trasduzione, le culture sono stati fissati e immunomacchiate per NeuN o GFAP. Il numero di cellule GFP e NeuN / GFAP che esprimono sono stati contati in immagini da 10 campi per ogni condizione sperimentale. I valori rappresentano la percentuale di neuroni (NeuN + cellule) oastrociti (GFAP + cellule), che ha inoltre espresso il gene reporter GFP. I valori riportati sono medie ± SD di tre esperimenti indipendenti.
Discussione
In questo protocollo, abbiamo dimostrato la produzione di vettori lentivirali e l'applicazione di questi vettori nelle culture neocorticali. Abbiamo dimostrato efficace e cellula-specifico tipo trasduzione con i vettori prodotti da questi metodi. Quando il promotore sinapsina viene utilizzata, l'espressione della GFP è strettamente neurone specifico. Quando il promotore GFAP viene utilizzata, l'espressione della GFP è esclusivamente in astrociti. Se nessun tipo-specifico espressione cellulare è richiesto,...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Questo lavoro è stato supportato dal NIH Neuroscience Blueprint Nucleo di assegnazione (P30 NS057105, BJS) per Washington University, programma di progetto di Grant NS032636 (BJS) e dal Centro Hope for Neurological Disorders.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | |
| DMEM | Sigma-Aldrich | D5796 | |
| MEM | Invitrogen | 11090-081 | |
| Siero fetale bovino | Hyclone | SV3001403 | |
| PBS | Mediatech | 21-040-CM | |
| Tripsina-EDTA | Sigma-Aldrich | T3924 | |
| Butirrato di sodio | Sigma-Aldrich | B5887 | |
| Hexadimethrine bromuro (Polybrene) | Sigma-Aldrich | H9268 | |
| Cellule 293T | ATCC | CRL-11268 | |
| HT1080 cellule | ATCC | CCL-121 | |
| Falcon 100 x 20 mm del tessuto culture piatto | BD Biosciences | 353003 | |
| 1 x 3 ½ in provetta polyallomoer | Beckman-Coulter | 326823 | |
| 0,2-micron filtro a siringa | Corning | 431219 | |
| QIAamp DNA Mini Kit | Qiagen | 51304 |
Riferimenti
- Naldini, L. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science. 272, 263-267 (1996).
- Zufferey, R. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J. Virol. 72, 9873-9880 (1998).
- Davidson, B. L., Breakefield, X. O. Viral vectors for gene delivery to the nervous system. Nat. Rev. Neurosci. 4, 353-364 (2003).
- Gascon, S., Paez-Gomez, J. A., Diaz-Guerra, M., Scheiffele, P., Scholl, F. G. Dual-promoter lentiviral vectors for constitutive and regulated gene expression in neurons. J. Neurosci. Methods. 168, 104-1012 (2008).
- Hioki, H. Efficient gene transduction of neurons by lentivirus with enhanced neuron-specific promoters. Gene Ther. 14, 872-882 (2007).
- Li, M. Optimal promoter usage for lentiviral vector-mediated transduction of cultured central nervous system cells. J. Neurosci. Methods. 189, 56-64 (2010).
- Naldini, L., Blomer, U., Gage, F. H., Trono, D., Verma, I. M. Efficient transfer, integration, and sustained long-term expression of the transgene in adult rat brains injected with a lentiviral vector. Proc. Natl. Acad. Sci. U.S.A. 93, 11382-11388 (1996).
- Blomer, U. Highly efficient and sustained gene transfer in adult neurons with a lentivirus vector. J. Virol. 71, 6641-6649 (1997).
- Consiglio, A. Robust in vivo gene transfer into adult mammalian neural stem cells by lentiviral vectors. Proc. Natl. Acad. Sci. U.S.A. 101, 14835-14840 (2004).
- Jakobsson, J., Ericson, C., Jansson, M., Bjork, E., Lundberg, C. Targeted transgene expression in rat brain using lentiviral vectors. J. Neurosci. Res. 73, 876-885 (2003).
- Arya, S. K., Guo, C., Josephs, S. F., Wong-Staal, F. Trans-activator gene of human T-lymphotropic virus type III (HTLV-III). Science. 229, 69-73 (1985).
- Sirven, A. The human immunodeficiency virus type-1 central DNA flap is a crucial determinant for lentiviral vector nuclear import and gene transduction of human hematopoietic stem cells. Blood. 96, 4103-4110 (2000).
- Burns, J. C., Friedmann, T., Driever, W., Burrascano, M., Yee, J. K. Vesicular stomatitis virus G glycoprotein pseudotyped retroviral vectors: concentration to very high titer and efficient gene transfer into mammalian and nonmammalian cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8033-8037 (1993).
- Farson, D. A new-generation stable inducible packaging cell line for lentiviral vectors. Hum. Gene Ther. 12, 981-997 (2001).
- Broussau, S. Inducible packaging cells for large-scale production of lentiviral vectors in serum-free suspension culture. Mol. Ther. 16, 500-507 (2008).
- Wang, X., McManus, M. Lentivirus production. J. Vis. Exp. (32), e1499 (2009).
- Sastry, L., Johnson, T., Hobson, M. J., Smucker, B., Cornetta, K. Titering lentiviral vectors: comparison of DNA, RNA and marker expression methods. Gene Ther. 9, 1155-1162 (2002).
- Snider, B. J., Lobner, D., Yamada, K. A., Choi, D. W. Conditioning heat stress reduces excitotoxic and apoptotic components of oxygen-glucose deprivation-induced neuronal death in vitro. J. Neurochem. 70, 120-129 (1998).
- Mazarakis, N. D. Rabies virus glycoprotein pseudotyping of lentiviral vectors enables retrograde axonal transport and access to the nervous system after peripheral delivery. Hum. Mol. Genet. 10, 2109-2121 (2001).
- Kato, S. Neuron-specific gene transfer through retrograde transport of lentiviral vector pseudotyped with a novel type of fusion envelope glycoprotein. Hum. Gene Ther. 22, 1511-1523 (2011).
- Segura, M. M., Garnier, A., Durocher, Y., Ansorge, S., Kamen, A. New protocol for lentiviral vector mass production. Methods Mol. Biol. 614, 39-52 (2010).
- Kutner, R. H., Puthli, S., Marino, M. P., Reiser, J. Simplified production and concentration of HIV-1-based lentiviral vectors using HYPERFlask vessels and anion exchange membrane chromatography. BMC Biotechnol. 9, 10 (2009).
- Laughlin, M. A., Chang, G. Y., Oakes, J. W., Gonzalez-Scarano, F., Pomerantz, R. J. Sodium butyrate stimulation of HIV-1 gene expression: a novel mechanism of induction independent of NF-kappa B. J Acquir Immune Defic Syndr Hum Retrovirol. 9, 332-339 (1995).
- Gasmi, M. Requirements for efficient production and transduction of human immunodeficiency virus type 1-based vectors. J. Virol. 73, 1828-1834 (1999).
- Palsson, B., Andreadis, S. The physico-chemical factors that govern retrovirus-mediated gene transfer. Exp. Hematol. 25, 94-102 (1997).
- Lizee, G. Real-time quantitative reverse transcriptase-polymerase chain reaction as a method for determining lentiviral vector titers and measuring transgene expression. Hum. Gene Ther. 14, 497-507 (2003).
- Lee, J. K., Chung, J., McAlpine, F. E., Tansey, M. G. Regulator of G-Protein Signaling-10 Negatively Regulates NF-{kappa}B in Microglia and Neuroprotects Dopaminergic Neurons in Hemiparkinsonian Rats. J. Neurosci. 31, 11879-11888 (2011).
- Shevtsova, Z., Malik, J. M., Michel, U., Bahr, M., Kugler, S. Promoters and serotypes: targeting of adeno-associated virus vectors for gene transfer in the rat central nervous system in vitro and in vivo. Exp. Physiol. 90, 53-59 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon