È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Non invasiva Imaging di candidosi disseminata nelle larve Zebrafish
In questo articolo
Riepilogo
Il rapido sviluppo, di piccola dimensione e la trasparenza delle zebrafish sono vantaggi enormi per lo studio del sistema immunitario innato il controllo delle infezioni 1-4. Qui mostriamo le tecniche per infettare le larve di zebrafish con il patogeno fungino Candida albicans Con microiniezione, la metodologia recentemente utilizzata per coinvolgere fagocita l'attività NADPH ossidasi nel controllo del dimorfismo fungino 5.
Abstract
Candidiasi disseminata causata dal patogeno Candida albicans è un problema importante negli individui clinicamente ospedalizzati e viene associato ad una mortalità 30 al 40% attribuibile 6. Candidosi sistemica è normalmente controllata da immunità innata, e gli individui con difetti genetici in cellule immunitarie innate componenti come NADPH ossidasi dei fagociti sono più sensibili alla candidemia 7-9. Molto poco si sa circa la dinamica di C. l'interazione con le innate albicans cellule immunitarie in vivo. Ampia studi in vitro hanno stabilito che al di fuori dello Stato membro ospitante C. albicans germina all'interno dei macrofagi, ed è rapidamente distrutto da neutrofili 10-14. Gli studi in vitro, anche se utile, non può ricapitolare il complesso in un ambiente vivo, che include dipendenti dal tempo la dinamica dei livelli di citochine, gli allegati della matrice extracellulare, e contatti intercellulari 10, 15-18 La larva zebrafish offre un ospite vertebrato unico e versatile per lo studio di infezione. Per i primi 30 giorni di larve di sviluppo zebrafish hanno solo le difese immunitarie innate 2, 19-21, semplificando lo studio di malattie come la candidosi disseminata, che sono altamente dipendenti sull'immunità innata. Le dimensioni ridotte e la trasparenza delle larve zebrafish consentire l'imaging delle dinamiche dell'infezione a livello cellulare sia per ospite e patogeno. Larve transgenica con fluorescenti innate cellule immunitarie possono essere utilizzate per identificare specifici tipi di cellule coinvolte nella infezione 22-24. Modificati oligonucleotidi antisenso (Morpholinos) possono essere utilizzati per abbattere i vari componenti del sistema immunitario come NADPH ossidasi dei fagociti e di studiare i cambiamenti in risposta a Fungal infezione 5. Oltre ai vantaggi etici e pratici di utilizzo di un piccolo vertebrato inferiore, le larve zebrafish offre la possibilità unica di immagine la battaglia campale tra patogeno e ospite sia intravitally e nel colore.
Il pesce zebra è stato utilizzato per l'infezione modello per un numero di batteri patogeni umani, e ha contribuito a notevoli progressi nella nostra comprensione delle infezioni da micobatteri 3, 25. Tuttavia, solo recentemente sono molto più grandi patogeni quali funghi stati utilizzati per infettare larva 5, 23, 26, e ad oggi non c'è stata una descrizione dettagliata visiva della metodologia infezione. Qui vi presentiamo le nostre tecniche di microiniezione ventricolo rombencefalo di prim 25 zebrafish, comprese le nostre modifiche ai protocolli precedenti. I nostri risultati con il modello larvale zebrafish per infezione fungina divergono da studi in vitro e rafforzare la necessità di esaminare l'ospite-patogeno Interaazione nel complesso contesto del paese ospitante, piuttosto che il sistema semplificato del piatto Petri 5.
Protocollo
Tutti i protocolli di cura zebrafish ed esperimenti sono stati eseguiti sotto la cura degli animali e del Comitato Istituzionale uso (IACUC) protocollo A2009-11-01.
1. Morfolino e Piatti iniezione larvali
Sperimentale durata: * (10-15 minuti)
Grado di difficoltà: *
- Per le iniezioni a base di uova, preparare una soluzione al 2% di agarosio in acqua sterile e forno a microonde. Quando la soluzione si è raffreddata versare una parte in un extra piatto fondo Petri (Fisher Scientific) fino a quando non è mezzo pieno. Raffreddare su ghiaccio e assicurarsi che la piastra sia a livello.
- Una volta che il piatto è raffreddato, versare uno strato 15 mL superiore del 2% agarosio. Spruzzare una iniezione uovo scanalato stampi in plastica (Adaptive Tools Scienza) con acqua sterile da una bottiglia a spruzzo. Disporre con attenzione il solco stampo giù nel caldo agarosio. Quando l'agarosio si è raffreddato, usare una spatola metallica piana (VWR Scientific) di dissociare lo stampo dal agarosa. Rimuovere lentamente la griglia dal agarosio. Avvolgere i piatti embrioni iniezione in Parafilm (VWR Scientific) e conservare invertito a 4 ° C.
- Per iniezioni larvali di pesce, preparare una soluzione al 2% agarosio come descritto. Versare la soluzione in una capsula Petri di dimensioni standard (VWR Scientific) e mettere da parte fino a quando non si solidifica. Piatti di iniezione Wrap larvali in Parafilm e conservare invertita a 4 ° C.
2. Cultura Preparazione funghi
Sperimentale durata: ** (30 minuti)
Grado di difficoltà: **
- Preparare estratto di lievito, peptone-destrosio (YPD) piastre di agar: 10 g / litro di estratto di lievito, 20 g / litro peptone, 20 g / litro destrosio, e 20 g / litro di agar e in autoclave. Per preparare liquido YPD 10 g / litro di estratto di lievito, 20 g / litro peptone, 20 g / litro e destrosio autoclave 20-30 minuti a 121 ° C.
- Due giorni prima infezioni preparare un piatto di pesce striscia da congelatole scorte di Candida albicans culture su agar YPD per ottenere singole colonie.
- Incubare a 37 ° C per una notte.
- Mettere 5 ml di brodo YPD in 16 tubi di diametro da 150 x cultura (VWR Scientific).
- Il giorno prima che le infezioni dei pesci prendere 1 piccola colonia in agar YPD con un tassello di legno (VWR Scientific). Mettere il bastone nel tubo cultura e turbinano attorno al risospendere colonia nel liquido YPD.
- Grow notte a 37 ° C su un tamburo Culture TC-7 Roller tessuto dotato di un 14-pollici ruota provetta (New Brunswick Scientific).
- Il giorno successivo, spin down 1 ml di cultura a 14000x g per 1 minuto in una provetta da 1,7 mL (Axygen). Rimuovere il surnatante e risospendere il pellet in liquido residuo con vortex (VWR Scientific).
- Aggiungere 1 ml 1x tampone fosfato isotonico (VWR Scientific) e far girare come descritto in precedenza.
- Ripetere il lavaggio PBS 3 volte.
- Diluire diluizione 1:100 in 1x PBS (10 microlitri di C. albicans lavato in 990 microlitri 1x PBS).
- Conta su un emocitometro (VWR Scientific).
- Diluire a 10 7 cellule / ml.
3. Infezioni zebrafish
Sperimentale durata: **** (1-3 ore)
Grado di difficoltà: ****
- Raccogliere embrioni conformemente al punto 5 e conservare in uova-acqua, 60 mg / L sali Instant Ocean (Fisher Scientific) in acqua deionizzata sterile.
- Utilizzando un microscopio da dissezione come il SZ61 Olympus (Olympus), embrioni dechorionate il giorno infezione. Utilizzare le pinzette Dumont Dumoxel (VWR Scientific) per tirare il corion 27 parte come aprire un sacchetto di patatine, o delicatamente colpire le pinzette in posizione chiusa nel corion e poi lentamente aprirli. Il pesce dovrebbe comparire a destra, fuori del corion.
- Agitare il piatto più profonda Petri con il coperchio per spostare pesci al centro del piatto. Trasferire il pesce al coperchio del piatto. Rimuovere l'acqua e uovasostituire con mezzi freschi. Aggiungere il pesce alla media.
- Piatti caldi di iniezione larvali in un incubatore a 28 ° C. Preparare tricaine metano solfonato (Western Chemical Inc.) diluizione a 200 ug / mL per anestetizzare i pesci.
- Contare il numero desiderato di larve per infezione (20-50 pesce). Mettere il pesce in soluzione metano solfonato tricaine e attendere 1-2 minuti fino a quando non smettono di muoversi.
- Accendere l'unità MPPI-3 ad iniezione (Applied Scientific Instruments). Accertarsi che il pressostato è su "pulse" e la "durata dell'impulso" è impostato su 9 con 3 PSI per l'unità contropressione. Aprire la valvola al serbatoio di azoto fino a quando la pressione sul gruppo di iniezione legge 30 PSI.
- Caricare un tirato micropipetta 28 con 5 pl di vortexata Candida albicans ad una concentrazione di 1x10 7 cellule / ml. Posizionare la micropipetta nel supporto micropipetta (Applied Scientific Instruments). Riempire un vuoto capsula Petri più profonda con l'acqua. Spostare la micropipetta finché la punta is all'interno di vista sfiora la superficie dell'acqua tramite microscopio a dissezione e l'uso delle pinzette Dumont Dumoxel (VWR Scientific) per tagliare l'ago di circa 3 mm dalla punta della pipetta tirato.
- Premete l'interruttore a pedale (Applied Scientific Instruments) per verificare che l'ago è stato ritagliato. Si dovrebbe vedere il liquido si disperdono se hanno avuto successo. Il diametro del bolo liquido dovrebbe essere non più grande del diametro della pupilla di prim 25 larva zebrafish (0,21 mm, ottenendo una sfera di 4,9 nL in volume). Regolare la pressione di conseguenza se il bolo liquido è troppo grande o troppo piccolo.
- Anestetizzare la pesce in metano solfonato tricaine (200 pg / mL). Una volta che il pesce ha smesso di muoversi, agitare il piatto con il coperchio fino a quando i pesci sono nel centro. Raccogliere 50 pesci usando una pipetta di trasferimento (Fisher Scientific). Toccare il lato della pipetta per risolvere il pesce verso la punta. Pipettare delicatamente pesce sul piatto larvale agarosio utilizzando come liquido meno possibile.
- Linea il pesce con una bacchetta di vetro liscio (attenzione a non schiacciarli!). Aspirare quanto più liquido possibile, fuori del piatto. Utilizzare un Kimwipe ad evacuare l'umidità.
- Posizionare il piatto delle larve di agarosio con il pesce sotto il microscopio fino ad ottenere una buona vista del pesce e l'ago allo stesso tempo. Spostare l'ago di vetro verso il pesce. Zoom sia il pesce e l'ago, come si posiziona l'ago verso il pesce. Con attenzione spostare l'ago di vetro nella vescicola otica 27, 29 (orecchio) del primo pesce. Saprete una volta che hai spostato l'ago nel pesce perché quando si preme l'interruttore a pedale (Applied Scientific Instruments), il ventricolo rombencefalo si solleva leggermente.
- Premete l'interruttore a pedale (Applied Scientific Instruments) e guardare il liquido si disperdono all'interno rombencefalo del pesce ventricolo 27. Ritrarre l'ago dal pesce e passare al pesce successivo. Ripetere la procedura fino a quando è stata iniettata tutti i pesci nel piatto. Rimuovere qualsiasi dead pesce e iniettare sostituzioni per mantenere il numero corretto (50 pesci). Per ogni gruppo di 50 pesci iniettato un ago microiniezione nuova deve essere preparato, o C. albicans si deposita nella parte inferiore dell'ago e zoccoli, o getta via la concentrazione iniettato.
- Lavare il pesce fuori del piatto inclinando il piatto e spruzzare uovo acqua sul pesce in un piatto fondo più pulito Petri contenente 60 mL di uova acqua. E 'importante non lasciare il pesce sul agarosio per più di 15-20 minuti o si seccano e muoiono.
- Ripetere l'intero processo di iniezione fino al termine. Non dimenticare PBS e non patogeni iniettati controlli.
- Al termine, tenere il pesce a 28 ° C.
- Chiudere il rubinetto della bombola di azoto. Spostare l'interruttore unità di iniezione da "impulso" al "continuo" per alleviare la pressione nella linea del serbatoio, la pressione dovrebbe scendere a zero a questo punto. Passare unità di iniezione torna a "impulsi". Spegnere l'unità di iniezione e ripulire l'area di lavoro.
4. Preparazione del Pesce per l'imaging
Sperimentale durata: ** (30 minuti)
Grado di difficoltà: **
- Preparare la soluzione metano solfonato tricaine come prima (200 pg / mL). Esca pesce infetto, e trasferirli in tricaine.
- Preparare 47,9 mL 0,4% agarosio low-melt (VWR scientifica) in uova acqua. Riscaldare la soluzione da microonde. Raffreddare a 37 ° C e aggiungere metano solfonato tricaine (200 pg / mL) alla miscela
- Una volta che i pesci sono immobilizzati in metano solfonato tricaine, pesce pipetta individuo in una piastra di Petri (VWR scientifica) contenente 0,4% agarosio a basso punto di fusione (VWR Scientific).
- Quindi, spostare i pesci dal basso punto di fusione di agarosio in singoli pozzetti di un piatto fondo di vetro (MatTek Corporation) per l'imaging. Uso come poco bassa temperatura di fusione agarosio possibile così il pesce giace piatto sul fondo del piatto. Utilizzare solo abbastanza del tricaine-agarosio per riempire il incerchi ner del piatto fondo di vetro.
5. Modifiche relative a Giove protocolli
Micropipette per Microiniezione
Sperimentale durata: * (10-15 minuti)
Grado di difficoltà: *
- Tirare canne cave di vetro BF120-69-10 (Strumenti Sutter) con un Flaming Brown Micropipetta Estrattore modello P-97 (Sutter Instruments) a seconda Yuan et al. 30. Scegliere il programma # 7 con il calore seguenti condizioni = 470, Velocità = 120, Time = 200. L'ago risultante è di 8 mm da punta a smusso e, una volta tagliati a 3 mm sopra la punta ha un diametro di circa 10 pm.
- Caricare una micropipetta di vetro nelle staffe. Selezionare "Pull". Il filamento di riscaldamento riscalda l'ago secondo i parametri del programma e la lastra di vetro si separerà in due micropipette tirato. Micropipette Conservare in un contenitore pipetta (Suttstrumenti er).
Di raccolta degli embrioni, iniezione Morpholino e manutenzione
Durata sperimentale: *** (1-2 ore)
Grado di difficoltà: ***
- Raccogliere embrioni secondo i metodi di Rosen et al. 31. Utilizzare un setaccio di plastica (Wares di Knutsford) per raccogliere le uova dal serbatoio deposizione delle uova (ambienti acquatici). Tenere il setaccio a testa in giù sopra un piatto di Petri più profondo e risciacquare con acqua vasca di raccolta delle uova.
- Per la preparazione morfolino, aggiungere 300 microlitri di acqua sterile a 300 nanomoli di morfolino (GeneTools, LLC). Questo dà uno stock di lavoro di 1,0 mm.
- Controllare la concentrazione del morfolino utilizzando un NanoDrop (Thermo Scientific). Selezionare "acido nucleico e cambiare il tipo di campione di" altro "e lunghezza d'onda a 265. Inserire la costante moltiplicando il peso molecolare del morfolino da 1000 diviso il absorptivity coefficiente di figurare nella scheda di morfolino proprietà oligo.
- Bianche il NanoDrop con 2 pl 0,1 N HCl. Diluire 5 pl della soluzione morfolino in 95 pl di HCl 0,1 N (20x diluizione). Mettere 2 microlitri della diluizione sul piedistallo NanoDrop e misura click. Moltiplicare la concentrazione per il fattore di diluizione (20). Questo dà una concentrazione operativa di morfolino. Per calcolare la concentrazione millimolare dividere la concentrazione ottenuta dal peso molecolare del morfolino.
- Preparare una stock di lavoro di morfolino Danieau in tampone (58 mM NaCl, 0,7 mM KCl, 0,4 mM MgSO 4, 0,6 mM Ca (NO 3) 2, 5.0 mM di HEPES, pH 7,6) e 0,01% di rosso fenolo (VWR Scientific).
- Per lavoro iniezione morfolino seguire il protocollo secondo Rosen et al. 31 e Yuan et al. 30. Lavare i piatti di iniezione morpholino con uovo e acqua calda a 28 ° C per 15 minuti. Rimuovere l'acqua dai piatti di iniezione e line-up one-cstadio embrioni ell nelle scanalature del piatto di iniezione (preparato dalla sezione 1) con una pipetta di trasferimento. Ogni piastra grado di contenere circa 250 uova. Iniettare 1-2 embrioni allo stadio di cellule con morfolino. Uova rimarrà in uno stadio di cellule per 15 minuti 27.
- Lavare le uova iniettate con uovo-acqua quando finiti (acqua deionizzata sterile con 60 mg / L sali Instant Ocean) e porlo in 60 mL di uova in acqua supplementare piastre di Petri profonde. Piatti di iniezione Morpholino può essere riutilizzato. Risciacquare con acqua uovo quando hai finito e memorizzare invertita a 4 ° C.
- Per la conservazione di embrioni aggiungere 60 ml di acqua uova al piatto. Contare i 110 embrioni con una pipetta di trasferimento in diverse capsule di Petri profonde supplementari con 60 mL uovo d'acqua. Aggiungi 0,00003% blu di metilene per prevenire la crescita microbica e embrioni incubare a 28 ° C.
- Per accelerare lo sviluppo di embrioni embrioni mantenere i piatti a 33 ° C per 24 ore e stage secondo Kimmel et al. 27, consentendo di sviluppare embrioni ad una testaAngolo del tronco di 75 ° (Prim 25 stage 27).
- Per il lavoro l'infezione larvale tenere embrioni a 28 ° C dopo l'iniezione con il C. albicans.
- Ogni giorno sostituire i piatti embrione con 60 ml di acqua fresca all'uovo.
Imaging
Sperimentale durata: ***** (1-5 ore)
Grado di difficoltà: ***
- Preparare il pesce in basso punto di fusione di agarosio (secondo il punto 4.2) con tricaine in piatti a base di imaging fondo di vetro (MatTek Corporation) come descritto in precedenza. Porre la capsula in un IX-81 Olympus (Olympus) stage microscopio invertito. Portare il pesce a fuoco con un ingrandimento di 4x in contrasto interferenziale differenziale (DIC) della luce. Le immagini possono essere catturate a 4x, 20x e 40x di ingrandimento in DIC, TRITC (isotiocianato rodamina tetrametil) e FITC (isotiocianato di fluorescina), impostazioni del filtro.
- Utilizzare un Olympus IX-81 microscopio invertito con un FV-1000 sistema di scansione laser confocale secondo Ariga et al. 32. Condurre corsi a tempo con ingrandimento 40x impostando Z-stack con fette di 1-1,5 micron ogni ora di infezione.
- Per l'imaging lungo andamento nel tempo di 2 ore o più, disporre uno strato di agarosio a bassa fusione sulla parte superiore del pesce nel piatto di imaging ogni 2-3 ore. Questo impedisce l'agarosio si secchi e la frantumazione il pesce mentre viene ripreso. Per i corsi di tempo lunghi con un piccolo numero di pesci, utilizzare una fase riscaldato (Bioptechs Inc.) per mantenere 28 ° C durante infezioni.
6. Risultati rappresentativi
Un esempio di un successo rombencefalo ventricolo C. infezione albicans in una larva zebrafish a 5 ore dopo l'infezione (IPU) e 24 HPI è illustrato nella (Figura 1). Macrofagi come cellule con inghiottito C. albicans si vedono nel ventricolo rombencefalo a 5 HPI. Entro il 24 HPI, C. albicans si trova all'interno dei macrofagi-like cells nel tessuto coda dorsale indicativa della candidosi disseminata. Questo risultato infezione è altamente dipendente da una precisa iniezione di 10-15 lievito forma C. albicans nel ventricolo rombencefalo. Proiezione di pesci infetti immediatamente post-iniezione può garantire questo.
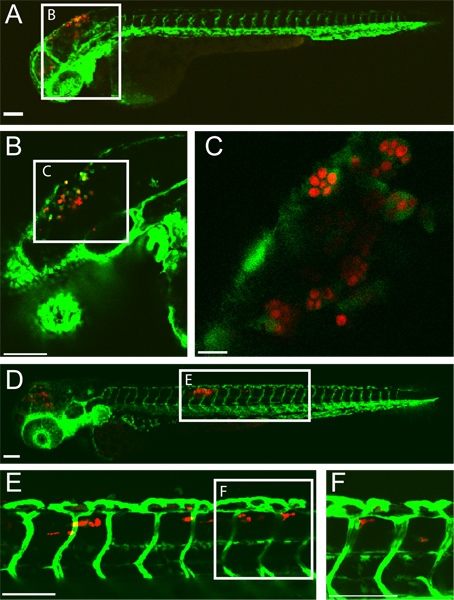
Figura 1 transgenico fli1:. EGFP 22, 33 larva infettati con CaF2-yCherry Candida albicans e ripreso intravitally mediante microscopia confocale. (AC) 5 ore post-infezione (A) larva Infected con EGFP che esprimono macrofago-come le cellule nel sito di infezione (rombencefalo ventricolo) bar Scala = 100 micron. (B e C) le immagini ingrandimento maggiore di pesce stesso, mostrando C. albicans all'interno fagociti. Barra della scala = 100 micron per B e 10 micron per C. (DF) 24 ore post-infezione (D) larva infetta con candidosi disseminata, con CaF2-yCherry C. albicans all'interno EGFP macrophage cellule simili nel tessuto coda dorsale. Scala bar = 100 micron. (E e F) immagini forti ingrandimenti di pesce stesso, mostrando C. albicans nei tessuti della coda. Scala bar = 100 micron.
Discussione
Il metodo di microiniezione zebrafish qui presentata si differenzia da Gutzman et al. In 34 che qui si dimostra l'iniezione attraverso la vescicola otica nel ventricolo rombencefalo di 36-48 larve HPF. Il metodo che permette di descrivere l'iniezione costante del 10-15 lievito nel ventricolo rombencefalo con danno tissutale ridotta. Questo protocollo produce inizialmente una infezione locale che si propaga attraverso il corpo da 24 HPI (figura 1) e determina letalità signifi...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Gli autori desiderano ringraziare il laboratorio del Dr. Carol Kim per la formazione microiniezione, Clarissa Henry per un consiglio per l'accelerazione dello sviluppo embrionale e l'uso di attrezzature e Nathan Lawson per contribuire fli1: pesce EGFP. Ringraziamo i membri del laboratorio di Wheeler e Shawn Mura per la lettura critica del manoscritto. Vorremmo anche ringraziare Mark Nilan per la cura dei pesci e consiglio, e Ryan Phennicie e Kristin Gabor per un parere tecnico su questo progetto. Questo lavoro è stato finanziato da un assistente di ricerca MAFES ai fratelli K., un MAFES Hatch sovvenzione E08913-08, e un premio NIH NCRR P20RR016463 a R. Wheeler.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Commenti (opzionale) |
| Vasche di deposizione | Habitat acquatici | 2L | |
| 1,7 ml provette | Axygen | MCT-175-C | |
| Istantanea Ocean | Fisher Scientific | S17957C | |
| Extra piastre di Petri profonde | Fisher Scientific | 08-757-11Z | |
| Standard Scatole Petri | VWR Scientific | 25384-302 | |
| Pipette di trasferimento | Fisher Scientific | 13-711-7M | |
| Estratto di lievito | VWR Scientificafic | 90000-726 | |
| Peptone | VWR Scientific | 90000-264 | |
| Destrosio | Fisher Scientific | D16-1 | |
| Agar | VWR Scientific | 90000-760 | |
| Emocitometro monouso | VWR Scientific | 82030-468 | |
| Soluzione tampone fosfato | VWR Scientific | 12001-986 | |
| Dumont Dumoxel Pinzetta | VWR Scientific | 100501-806 | |
| Tasselli di legno | VWR Scientific | 10805-018 | |
| Kimwipes | VWR Scientific | 300053-964 | |
| Low MeltAgarosio | VWR Scientific | 12001-722 | |
| Agarosio per i piatti di iniezione | VWR Scientific | 12002-102 | |
| Flaming Brown Micropipetta Puller | Sutter Instruments | P-97 | |
| Bacchette di vetro Hollow | Sutter Instruments | BF120-69-10 | Per le canne di vetro vetro liscio dal riscaldamento sopra becco Bunsen |
| Pipettare Scatola | Sutter Instruments | BX10 | |
| MPPI-3 Sistema di iniezione | Applicata strumentazione scientifica | MPPI-3 | |
| Unità di pressione Indietro | Applicata strumentazione scientifica | BPU | |
| Micropipetta Holder Kit | AppliStrumentazione scientifica ed | MPIP | |
| Foot Switch | Applicata strumentazione scientifica | FSW | |
| Micromanipolatore | Applicata strumentazione scientifica | MM33 | |
| Base magnetica | Applicata strumentazione scientifica | Base magnetica | |
| Tricaine metano solfonato | Occidentale Chemical Inc. | MS-222 | |
| Dissezione Scope | Olimpo | SZ61 top SZX-ILLB2-100 di base | |
| Microscopio confocale | Olimpo | IX-81 con la FV-1000 sistema di scansione laser confocale | |
| TC-7 Roller Tissue Culture tamburo della ruota con il 14 pollici provetta | New Brunswick Scientific | TC-7 | |
| Imaging Piatti | MatTek Corporation | P24G-1.0-10-F | |
| Puntali per il caricamento di aghi | Eppendorf | 930001007 | |
| Griglie piastra colata | Adaptive Scienza Tools | TU-1 | |
| Fase riscaldata | Bioptechs Inc. | Delta T-5 | |
| Spatola piatta | VWR Scientific | 82027-486 | |
| Setacci di plastica | Wares di Knutsford online | 12 cm | |
| Parafilm | VWR Scientific | 52858-000 | |
| Vortex Genie | VWR Scientific | 14216-184 | |
| 16 x 150 mm Cultura tubi | VWR Scientific | 60825-435 | |
| NanoDrop | Thermo Scientific | ND 2000 | |
| Rosso fenolo | VWR Scientific | 97062-478 | |
| HCl | VWR Scientific | 87003-216 | |
| NaCl | VWR Scientific | BDH4534-500GP | |
| KCl | VWR Scientific | BDH4532-500GP | |
| MgSO 4 | VWR Scientific | BDH0246-500GP | |
| Ca (NO 3) 2 | VWR Scientific | BDH0226-500GP | |
| HEPES | VWR Scientific | BDH4520-500GP | |
| Morpholinos | GeneTools, LLC |
Riferimenti
- Trede, N. S., Langenau, D. M., Traver, D., Look, A. T., Zon, L. I. The use of zebrafish to understand immunity. Immunity. 20, 367-379 (2004).
- Kanther, M., Rawls, J. F. Host-microbe interactions in the developing zebrafish. Curr. Opin. Immunol. 22, 10-19 (2010).
- Meeker, N. D., Trede, N. S. Immunology and zebrafish: spawning new models of human disease. Dev Comp Immunol. 32, 745-757 (2008).
- Tobin, D., May, R. C., Wheeler, R. T. Zebrafish: a see-through host and fluorescent toolbox to probe host-pathogen interaction. PLoS Pathog. , (2011).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryot. Cell. 10, 932-944 (2011).
- Pfaller, M. A., Diekema, D. J. Epidemiology of invasive candidiasis: a persistent public health problem. Clin. Microbiol. Rev. 20, 133-163 (2007).
- Ashman, R. B. Innate versus adaptive immunity in Candida albicans infection. Immunol. Cell Biol. 82, 196-204 (2004).
- de Repentigny, L. Animal models in the analysis of Candida host-pathogen interactions. Curr. Opin. Microbiol. 7, 324-329 (2004).
- Rogers, T. J., Balish, E. Immunity to Candida albicans. Microbiol. Rev. 44, 660-682 (1980).
- Calderone, R., Sturtevant, J. Macrophage interactions with Candida. Immunol. Ser. 60, 505-515 (1994).
- Frohner, I. E., Bourgeois, C., Yatsyk, K., Majer, O., Kuchler, K. Candida albicans cell surface superoxide dismutases degrade host-derived reactive oxygen species to escape innate immune surveillance. Mol. Microbiol. 71, 240-252 (2009).
- Kumamoto, C. A., Vinces, M. D. Contributions of hyphae and hypha-co-regulated genes to Candida albicans virulence. Cell Microbiol. 7, 1546-1554 (2005).
- Lorenz, M. C., Bender, J. A., Fink, G. R. Transcriptional response of Candida albicans upon internalization by macrophages. Eukaryot. Cell. 3, 1076-1087 (2004).
- Rubin-Bejerano, I., Fraser, I., Grisafi, P., Fink, G. R. Phagocytosis by neutrophils induces an amino acid deprivation response in Saccharomyces cerevisiae and Candida albicans. Proc. Natl. Acad. Sci. U. S. A. 100, 11007-11012 (2003).
- Behnsen, J. Environmental dimensionality controls the interaction of phagocytes with the pathogenic fungi Aspergillus fumigatus and Candida albicans. PLoS Pathog. 3, e13 (2007).
- Lavigne, L. M. Integrin engagement mediates the human polymorphonuclear leukocyte response to a fungal pathogen-associated molecular pattern. J. Immunol. 178, 7276-7282 (2007).
- Newman, S. L., Bhugra, B., Holly, A., Morris, R. E. Enhanced killing of Candida albicans by human macrophages adherent to type 1 collagen matrices via induction of phagolysosomal fusion. Infect. Immun. 73, 770-777 (2005).
- Netea, M. G., Brown, G. D., Kullberg, B. J., Gow, N. A. An integrated model of the recognition of Candida albicans by the innate immune system. Nat. Rev. Microbiol. 6, 67-78 (2008).
- Lam, S. H., Chua, H. L., Gong, Z., Lam, T. J., Sin, Y. M. Development and maturation of the immune system in zebrafish, Danio rerio: a gene expression profiling, in situ hybridization and immunological study. Dev. Comp. Immunol. 28, 9-28 (2004).
- Magnadottir, B. Innate immunity of fish (overview). Fish Shellfish Immunol. 20, 137-151 (2006).
- Sullivan, C., Kim, C. H. Zebrafish as a model for infectious disease and immune function. Fish Shellfish Immunol. 25, 341-350 (2008).
- Lawson, N. D., Weinstein, B. M. In vivo imaging of embryonic vascular development using transgenic zebrafish. Dev. Biol. 248, 307-318 (2002).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117, e49-e56 (2011).
- Renshaw, S. A. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108, 3976-3978 (2006).
- Lesley, R., Ramakrishnan, L. Insights into early mycobacterial pathogenesis from the zebrafish. Curr Opin. Microbiol. 11, 277-283 (2008).
- Chao, C. C. Zebrafish as a model host for Candida albicans infection. Infect. Immun. 78, 2512-2521 (2010).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. , 203-253 (1995).
- Cianciolo Cosentino, C., Roman, B. L., Drummond, I. A., Hukriede, N. A. Intravenous Microinjections of Zebrafish Larvae to Study Acute Kidney Injury. J. Vis. Exp. (42), e2079 (2010).
- Haddon, C., Lewis, J. Early ear development in the embryo of the zebrafish, Danio rerio. J. Comp. Neurol. 365, 113-128 (1996).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113 (2009).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of Zebrafish Embryos to Analyze Gene Function. J. Vis. Exp. (25), e1115 (2009).
- Ariga, J., Walker, S. L., Mumm, J. S. Multicolor Time-lapse Imaging of Transgenic Zebrafish: Visualizing Retinal Stem Cells Activated by Targeted Neuronal Cell Ablation. J. Vis. Exp. (43), e2093 (2010).
- Redd, M. J., Kelly, G., Dunn, G., Way, M., Martin, P. Imaging macrophage chemotaxis in vivo: studies of microtubule function in zebrafish wound inflammation. Cell Motil. Cytoskeleton. 63, 415-422 (2006).
- Gutzman, J. H., Sive, H. Zebrafish Brain Ventricle Injection. J. Vis. Exp. (26), e1218 (2009).
- Davis, J. M. Real-time visualization of mycobacterium-macrophage interactions leading to initiation of granuloma formation in zebrafish embryos. Immunity. 17, 693-702 (2002).
- Meijer, A. H. Identification and real-time imaging of a myc-expressing neutrophil population involved in inflammation and mycobacterial granuloma formation in zebrafish. Dev. Comp. Immunol. 32, 36-49 (2008).
- Mathias, J. R. Live imaging of chronic inflammation caused by mutation of zebrafish Hai1. J. Cell Sci. 120, 3372-3383 (2007).
- Hall, C., Flores, M. V., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Dev. Biol. 7, 42 (2007).
- Vergunst, A. C., Meijer, A. H., Renshaw, S. A., O'Callaghan, D. Burkholderia cenocepacia creates an intramacrophage replication niche in zebrafish embryos, followed by bacterial dissemination and establishment of systemic infection. Infect Immun. 78, 1495-1508 (2010).
- Le Guyader, D. Origins and unconventional behavior of neutrophils in developing zebrafish. Blood. 111, 132-141 (2008).
- Clatworthy, A. E. Pseudomonas aeruginosa infection of zebrafish involves both host and pathogen determinants. Infect. Immun. 77, 1293-1303 (2009).
- Brannon, M. K. Pseudomonas aeruginosa Type III secretion system interacts with phagocytes to modulate systemic infection of zebrafish embryos. Cell Microbiol. 11, 755-768 (2009).
- Levraud, J. P. Real-time observation of listeria monocytogenes-phagocyte interactions in living zebrafish larvae. Infect. Immun. 77, 3651-3660 (2009).
- van der Sar, A. M. Zebrafish embryos as a model host for the real time analysis of Salmonella typhimurium infections. Cell Microbiol. 5, 601-611 (2003).
- Phennicie, R. T., Sullivan, M. J., Singer, J. T., Yoder, J. A., Kim, C. H. Specific resistance to Pseudomonas aeruginosa infection in zebrafish is mediated by the cystic fibrosis transmembrane conductance regulator. Infect Immun. 78, 4542-4550 (2010).
- Prajsnar, T. K., Cunliffe, V. T., Foster, S. J., Renshaw, S. A. A novel vertebrate model of Staphylococcus aureus infection reveals phagocyte-dependent resistance of zebrafish to non-host specialized pathogens. Cell Microbiol. 10, 2312-2325 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon