È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolotti roditori Valutazione di replica e la funzione delle cellule beta in Adenovirally-trasdotte Isolati
In questo articolo
Riepilogo
Questo protocollo permette di identificare fattori che modulano funzionale massa delle cellule beta per trovare potenziali bersagli terapeutici per il trattamento del diabete. Il protocollo consiste in un metodo semplificato per valutare la replicazione delle isole e la funzione delle cellule beta in isole di ratto isolati dopo manipolazione genica con adenovirus.
Abstract
Omeostasi del glucosio è principalmente controllata dal sistema endocrino gli ormoni insulina e glucagone, secreto dal pancreas beta e le cellule alfa, rispettivamente. Functional massa di cellule beta è determinata dalla massa anatomica cellule beta così come la capacità delle cellule beta per rispondere a un carico di nutrienti. Una perdita di massa funzionale delle cellule beta è fondamentale per entrambe le forme principali di diabete 1-3. Considerando che i risultati in declino funzionale massa di cellule beta da un attacco autoimmune nel diabete tipo 1, diabete di tipo 2, questo decremento si sviluppa sia da una incapacità delle cellule beta di secernere insulina in modo appropriato e la distruzione delle cellule beta da una squadra di meccanismi. Pertanto, gli sforzi per ristabilire la massa funzionale delle cellule beta sono di primaria importanza al trattamento migliore e potenziali cure per il diabete.
Gli sforzi sono in corso per identificare i meccanismi molecolari che possono essere sfruttate per stimolare la replicazione e migliorare la funzione delle cellule beta.Idealmente, gli obiettivi terapeutici potrebbe migliorare sia la crescita e la funzione delle cellule beta. Forse ancora più importante però è quello di identificare se una strategia che stimola la crescita delle cellule beta arriva al costo di compromettere la funzione delle cellule beta (come nel caso di alcuni oncogeni) e viceversa.
Sistematicamente la soppressione o sovraespressione l'espressione di geni bersaglio in isole isolate di ratto, si possono identificare potenziali bersagli terapeutici per aumentare la massa funzionale delle cellule beta 4-6. I vettori adenovirali possono essere impiegati per proteine efficiente esprimono molti o smontabile in isole di ratto isolati 4,7-15. Qui, presentiamo un metodo per modificare l'espressione genica utilizzando trasduzione adenovirale e valutare la replicazione e la funzione delle cellule insulari beta in isole di ratto isolati (Figura 1). Questo metodo è stato utilizzato in precedenza per identificare nuovi bersagli che modulano la replicazione delle cellule beta o una funzione 5,6,8,9,16,17.
Protocollo
1. Trasduzione adenovirale e la coltura di isole di ratto
- Preparare una ben 6-non-tessuto piastra rivestita coltura aggiungendo 2 ml di mezzo (RPMI 1640 contenente 8 mM di glucosio, 10% di siero fetale bovino, 50 unità / ml di penicillina, e 50 ug / ml di streptomicina) al numero richiesto di pozzi. Ad esempio, un tipico esperimento può richiedere tre pozzetti, uno per ogni mancato controllo virus, un controllo virus (ad esempio, GFP-esprimono adenovirus), e il gruppo sperimentale.
- Riscaldare la piastra a 37 ° C ponendo in un incubatore di coltura tissutale per almeno 30 min.
- Immediatamente dopo isolotto isolamento ratto 18,19, posto 100-200 isolotti in pozzetti individuali della ben 6-non-tessuto rivestito piastra di coltura. Sessanta isolotti sono necessarie per la secrezione di insulina e saggi di incorporazione di timidina. Gli isolotti rimanenti possono essere usati per l'isolamento di RNA per studi di espressione genica o isolamento di proteine per immunoblotting.
[Nota: Da questo punto in avanti, si prega di seguire i protocolli istituzionali per la manipolazione, l'uso e lo smaltimento dei materiali a rischio biologico.]
- Delicatamente il piastra per portare le isolette al centro del pozzo.
- Pipettare l'adenovirus direttamente sulle isole nel centro del piatto. Utilizzare 100-500 molteplicità di infezione (MOI, il rapporto di cellule bersaglio per virali unità formanti placca).
- Lasciare riposare per 5 minuti isolotti.
- Porre la piastra in tessuto incubatore (37 ° C, 5% CO 2).
- Dopo 24 h, roteare delicatamente la piastra per portare le isolette ai centri dei pozzetti e trasferire gli isolotti utilizzando una micropipetta P200 in un pozzetto contenente mezzi freschi. Se le isolette si attaccano alla piastra, possono essere sloggiato delicatamente con la punta della pipetta.
[Nota: per verificare efficienze adeguate trasduzioneCY, l'uso di un virus di controllo che esprime GFP è vantaggiosa, in quanto isolotti può quindi essere rappresentata mediante microscopia confocale per verificare la penetrazione del adenovirus nel nucleo isolotto.]
- Cultura le isolette per un ulteriore 24-72 ore, a seconda della temporizzazione desiderata dell'esperimento da studi pilota di ottimizzazione. Ad esempio, l'induzione di una risposta proliferativa può richiedere tempi compresi fra 24-72 ore o knockdown del gene di interesse può richiedere 48 o 72 ore. Trasferire le isolette di mezzi freschi ogni giorno.
- Per la finale 24 ore dell'esperimento, la cultura delle isole in un mezzo contenente 1 microCi [metil-3 H] -thymidine/ml media (in genere 1 pl timidina / ml media).
[Nota: Da questo punto in avanti, si prega di seguire i protocolli istituzionali per la manipolazione, l'uso e lo smaltimento dei materiali radioattivi.]
2. Secrezione insulinica test
- Preparare ilsecrezione tampone di saggio (SAB) soluzione madre 10X (1,14 M NaCl, 47 mM KCl, 12 mM KH 2 PO 4, 11,6 mM MgSO 4) e la soluzione di CaCl 2 magazzino 100X (0,25 M CaCl 2). Queste soluzioni fotografici possono essere preparate in anticipo e conservato a temperatura ambiente.
- Appena preparare 50 ml della BRS di lavoro (5 mL di 10X SAB, 1 ml di 1 M HEPES, 0,5 ml di 100X CaCl 2, 0,28 ml di 35% BSA, 0,11 g NaHCO 3, e acqua sterile per 50 ml) in un 50 ml tubo e calda a 37 ° C introducendo in un 37 ° C a bagno-maria.
- Pipettare 10 ml del SAB lavorazione in un 15-ml provetta conica e aggiungere 66,8 pl di 2,5 M D-glucosio per preparare il glucosio (16,7 mM) SAB.
- Aggiungere 44,8 pl di 2,5 M D-glucosio per il restante 40 ml di lavoro SAB per preparare il glucosio bassa (2,8 mM) SAB.
- Label tre 1,7 ml microprovette per ciascun pozzetto della piastra da 6 pozzetti e aggiungere 1 ml di tampone fosfato salino (PBS).
[Nota: Poiché le isole sono radioattivi, si prega di seguire i protocolli istituzionali per la manipolazione, l'uso e lo smaltimento dei materiali radioattivi.]
- Mettere 20 isolotti in ogni provetta. Fate ogni tentativo di aggiungere isolette di dimensioni relativamente a ciascuna provetta. Ad esempio, ciascun tubo 5 può contenere piccole, medie 10, e 5 grandi dimensioni isolette (vedi Figura 1).
[Nota: Le isole possono essere visualizzate utilizzando uno stereoscopio dissezione o un microscopio standard.]
- Dopo che le isolette hanno scelto di fondo della provetta per gravità (~ 2 min), aspirare il PBS con una micropipetta e scartare.
[Nota: In alternativa alla sedimentazione per gravità, i tubi possono essere centrifugate a 300 xg per 1 min.]
- Per la pre-incubazione, aggiungere 400 microlitri della bassa gluglucosio SAB, posizionare i tubi (con i tappi aperto) nel tessuto incubatore (37 ° C, 5% CO 2), e pre-incubare per 60 min. Aspirare il pre-incubazione di glucosio basso SAB ed eliminarla.
- Per la secrezione di insulina basale, aggiungere 400 microlitri del glucosio SAB basso, posizionare i tubi (con i tappi aperto) nel tessuto incubatore (37 ° C, 5% CO 2), e incubare per 60 min. Raccogliere il basso di glucosio SAB e risparmiare per il dosaggio radioimmunologico dell'insulina.
- Per la secrezione di insulina stimolata, aggiungere 400 microlitri del glucosio SAB alto, posizionare i tubi (con i tappi aperto) nel tessuto incubatore (37 ° C, 5% CO 2), e incubare per 60 min. Raccogliere l'alto glucosio SAB e risparmiare per il dosaggio radioimmunologico dell'insulina.
3. Timidina Assay
- Aggiungere 1 ml di PBS, dopo le isolette hanno scelto di fondo della provetta per gravità, aspirare il PBS con una micropipetta, scartare, e ripetere questapasso una volta.
- Aggiungere 500 pl acido ghiacciata tricloroacetico (TCA, 10% w / v) e incubare su ghiaccio per 30 min.
- Centrifugare le provette a 16 000 xg per 3 min a 4 ° C.
- Aspirare il TCA, aggiungere 80 ul di NaOH 0,3 N, e incubare per 30 min a temperatura ambiente. Durante questo tempo, vigorosamente vortici i campioni per 5-10 s ogni 10 min.
- Aggiungere 4 ml di Econo-safe cocktail contare fino a 7 tubi ml di liquido di scintillazione di conteggio.
- Aggiungere 50 pl di campione al tubo scintillazione, chiudere il tubo, agitare, e conteggio in un contatore a scintillazione liquida.
- Misurare la concentrazione di proteina usando l'acido bicinconinico (BCA) saggio e 10 pl di campione secondo il protocollo del produttore.
4. Analisi dei dati
- Eseguire il dosaggio radioimmunologico dell'insulina seguendo il protocollo del produttore.
- Normalizza la secrezione di insulina e di dati timidina con il Concentration.
5. Risultati rappresentativi
Un esempio di un esperimento per valutare la replicazione delle isole e la funzione delle cellule beta in isole di ratto è illustrato nella figura 2. Questo esempio mostra che l'iperespressione adenovirale di ipotetici "Gene # 6" stimola robusta replica isolotto senza alterare la funzione delle cellule beta. Nel pannello superiore, i risultati del saggio di incorporazione di timidina dimostrare che aumentando l'espressione di "Gene # 6" aumenta la sintesi del DNA, come misurato mediante incorporazione di timidina. Poiché la maggior parte delle cellule del isolotto ratto sono cellule beta, è probabile che questo aumento timidina indica un incremento della replicazione delle cellule beta. Tuttavia, gli esperimenti di conferma devono essere eseguite per stabilire con fermezza questo. Nel pannello inferiore, i risultati del saggio secrezione insulinica dimostrano che la sovraespressione di "Gene # 6" non altera una delle funzioni primarie di cellule beta, cioè, insulin secrezione di glucosio a bassa e alta. La qualità dell'isolamento isolotto e la salute degli isolotti in seguito al trattamento con adenovirus è indicato dalla volte maggiore della secrezione di insulina a basse concentrazioni di glucosio e alta. Se aumentando l'espressione di "Gene # 6" compromissione della funzione delle cellule beta, questo sarebbe probabilmente riflette come una diminuzione dell'insulina secreta a concentrazioni elevate stimolatorie, glucosio (16,7 mM). Una curva dose-risposta per diverse concentrazioni di glucosio potrebbe anche essere eseguita.
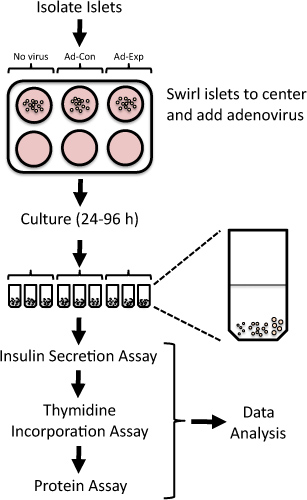
Figura 1. Panoramica del protocollo per valutare la replica delle isole e la funzione delle cellule beta nelle isole di ratto isolate in seguito adenovirale-mediate alterazioni nell'espressione genica. Isole di ratto isolate di fresco sono esposti a adenovirus per 24 ore e poi coltivate fino a 96 h. Timidina viene valutata in finale 24 ore, seguita dalla misura della secrezione di insulinaglicemia bassa e alta.
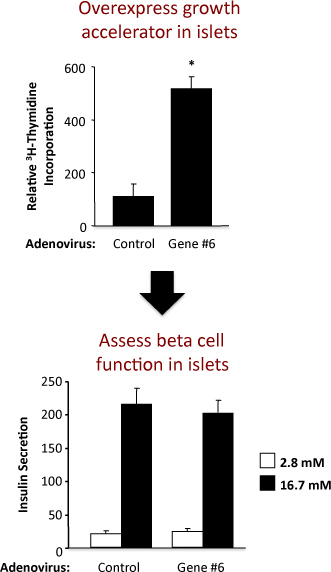
Figura 2. Risultati di un esperimento utilizzando un adenovirus di controllo e un adenovirus sovraesprimendo un gene ipotetico etichettato come "Gene # 6". Il pannello superiore illustra il timidina e il pannello inferiore della secrezione di insulina.
Discussione
Stabilire percorsi che possono essere modulate per stimolare la replicazione e migliorare la funzione delle cellule beta sono importanti per entrambe le forme principali di diabete. Poiché funzionale massa di cellule beta dipende dalla esistenza e la funzione di cellule che secernono insulina, valutando questi determinanti simultaneamente ha i suoi vantaggi. Questo protocollo descrive un protocollo semplificato per identificare se la sovraespressione o la soppressione di una proteina porta a variazioni di massa funzion...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Questo lavoro è stato sostenuto dalla concessione DK078732 dal NIH (per PTF).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| RPMI 1640 mezzi | Gibco | 11879 | |
| Penicillina / streptomicina | Gibco | 15140 | |
| 6-pozzetti | BD-Falcon | 35-1146 | Non-TC trattati |
| [Metil-3 H]-timidina | Perkin Elmer | NET027Z001MC | 1 mCi / ml |
| Micro-provette da centrifuga; | Denville | C2170 | 1,7 ml |
| NaCl | Sigma | 59888 | |
| KCl | Acros | 42409 | |
| KH 2 </ Sub> PO 4 | Acros | 20592 | |
| MgSO 4 | Acros | 41348 | |
| CaCl 2 | Acros | 34961 | |
| HEPES | Sigma | H0887 | Soluzione 1 M |
| 35% BSA | Sigma | A7979 | |
| NaHCO 3 | Acros | 42427 | |
| d-glucosio | Sigma | G8769 | |
| TCA | Fisher Scientific | SA9410-1 | 10% w / v |
| NaOH | Acros | 12426 | |
| Scintillazione tubo | Sarstedt | 58,536 | 7 ml, PP |
| Scintillazione tappo del tubo di conteggio | Sarstedt | 65,816 | |
| Econo-Safe cocktail di conteggio | RPI | 111175 | |
| Insulina RIA | Siemens | TKIN2 | |
| BCA Assay Kit | Thermo Scientific | 23250 | |
| Attrezzatura | |||
| Centrifuga | Eppendorf | 5415R | |
| Scintillazione portaprovette | Sarstedt | 93.1431.001 | |
| Contatore a scintillazione liquida | Perkin Elmer | Tri-Carb 2910TR |
Riferimenti
- Ferrannini, E. beta-Cell function in subjects spanning the range from normal glucose tolerance to overt diabetes: a new analysis. J. Clin. Endocrinol. Metab. 90, 493-500 (2005).
- Weyer, C., Bogardus, C., Mott, D. M., Pratley, R. E. The natural history of insulin secretory dysfunction and insulin resistance in the pathogenesis of type 2 diabetes mellitus. J. Clin. Invest. 104, 787-794 (1999).
- Keenan, H. A. Residual insulin production and pancreatic ss-cell turnover after 50 years of diabetes: Joslin Medalist Study. Diabetes. 59, 2846-2853 (2010).
- Bain, J. R., Schisler, J. C., Takeuchi, K., Newgard, C. B., Becker, T. C. An adenovirus vector for efficient RNA interference-mediated suppression of target genes in insulinoma cells and pancreatic islets of langerhans. Diabetes. 53, 2190-2194 (2004).
- Fueger, P. T. Trefoil factor 3 stimulates human and rodent pancreatic islet beta-cell replication with retention of function. Mol. Endocrinol. 22, 1251-1259 (2008).
- Schisler, J. C. Stimulation of human and rat islet beta-cell proliferation with retention of function by the homeodomain transcription factor Nkx6.1. Mol. Cell Biol. 28, 3465-3476 (2008).
- Chan, C. B. Overexpression of uncoupling protein 2 inhibits glucose-stimulated insulin secretion from rat islets. Diabetes. 48, 1482-1486 (1999).
- Cozar-Castellano, I., Takane, K. K., Bottino, R., Balamurugan, A. N., Stewart, A. F. Induction of beta-cell proliferation and retinoblastoma protein phosphorylation in rat and human islets using adenovirus-mediated transfer of cyclin-dependent kinase-4 and cyclin D1. Diabetes. 53, 149-159 (2004).
- Icyuz, M. Adenovirus infection activates akt1 and induces cell proliferation in pancreatic islets1. Transplantation. 87, 821-824 (2009).
- Kaneto, H. Activation of the hexosamine pathway leads to deterioration of pancreatic beta-cell function through the induction of oxidative stress. J. Biol. Chem. 276, 31099-31104 (2001).
- Antinozzi, P. A., Berman, H. K., O'Doherty, R. M., Newgard, C. B. Metabolic engineering with recombinant adenoviruses. Annu. Rev. Nutr. 19, 511-544 (1999).
- Newgard, C. B., Becker, T. C., Berman, H. K., O'Doherty, R. M. Regulation of overexpressed hexokinases in liver and islet cells. Biochem. Soc. Trans. 25, 118-122 (1997).
- Becker, T. C., BeltrandelRio, H., Noel, R. J., Johnson, J. H., Newgard, C. B. Overexpression of hexokinase I in isolated islets of Langerhans via recombinant adenovirus. Enhancement of glucose metabolism and insulin secretion at basal but not stimulatory glucose levels. J. Biol. Chem. 269, 21234-21238 (1994).
- Csete, M. E. Adenoviral-mediated gene transfer to pancreatic islets does not alter islet function. Transplant Proc. 26, 756-757 (1994).
- Csete, M. E. Efficient gene transfer to pancreatic islets mediated by adenoviral vectors. Transplantation. 59, 263-268 (1995).
- Meng, Z. X. Activation of liver X receptors inhibits pancreatic islet beta cell proliferation through cell cycle arrest. Diabetologia. 52, 125-135 (2009).
- Ronnebaum, S. M. A pyruvate cycling pathway involving cytosolic NADP-dependent isocitrate dehydrogenase regulates glucose-stimulated insulin secretion. J. Biol. Chem. , (2006).
- Milburn, J. L. Pancreatic beta-cells in obesity. Evidence for induction of functional, morphologic, and metabolic abnormalities by increased long chain fatty acids. J. Biol. Chem. 270, 1295-1299 (1995).
- Szot, G., Koudria, P., Bluestone, J. Murine Pancreatic Islet Isolation. J. Vis. Exp. (7), e255 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon