È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
High Throughput singola cellula e cellula Multiple-Micro-incapsulamento
In questo articolo
Riepilogo
Combinando goccia generazione monodisperse con ordinamento inerziale di cellule e particelle, si descrive un metodo per incapsulare un numero desiderato di celle o particelle in una singola goccia a tassi kHz. Abbiamo dimostrato efficienze due volte superiori a quelli di incapsulamento non ordinate per raccogliere le gocce singola e doppia-particelle.
Abstract
Microfluidic encapsulation methods have been previously utilized to capture cells in picoliter-scale aqueous, monodisperse drops, providing confinement from a bulk fluid environment with applications in high throughput screening, cytometry, and mass spectrometry. We describe a method to not only encapsulate single cells, but to repeatedly capture a set number of cells (here we demonstrate one- and two-cell encapsulation) to study both isolation and the interactions between cells in groups of controlled sizes. By combining drop generation techniques with cell and particle ordering, we demonstrate controlled encapsulation of cell-sized particles for efficient, continuous encapsulation. Using an aqueous particle suspension and immiscible fluorocarbon oil, we generate aqueous drops in oil with a flow focusing nozzle. The aqueous flow rate is sufficiently high to create ordering of particles which reach the nozzle at integer multiple frequencies of the drop generation frequency, encapsulating a controlled number of cells in each drop. For representative results, 9.9 μm polystyrene particles are used as cell surrogates. This study shows a single-particle encapsulation efficiency Pk=1 of 83.7% and a double-particle encapsulation efficiency Pk=2 of 79.5% as compared to their respective Poisson efficiencies of 39.3% and 33.3%, respectively. The effect of consistent cell and particle concentration is demonstrated to be of major importance for efficient encapsulation, and dripping to jetting transitions are also addressed.
Introduction
Continuous media aqueous cell suspensions share a common fluid environment which allows cells to interact in parallel and also homogenizes the effects of specific cells in measurements from the media. High-throughput encapsulation of cells into picoliter-scale drops confines the samples to protect drops from cross-contamination, enable a measure of cellular diversity within samples, prevent dilution of reagents and expressed biomarkers, and amplify signals from bioreactor products. Drops also provide the ability to re-merge drops into larger aqueous samples or with other drops for intercellular signaling studies.1,2 The reduction in dilution implies stronger detection signals for higher accuracy measurements as well as the ability to reduce potentially costly sample and reagent volumes.3 Encapsulation of cells in drops has been utilized to improve detection of protein expression,4 antibodies,5,6 enzymes,7 and metabolic activity8 for high throughput screening, and could be used to improve high throughput cytometry.9 Additional studies present applications in bio-electrospraying of cell containing drops for mass spectrometry10 and targeted surface cell coatings.11 Some applications, however, have been limited by the lack of ability to control the number of cells encapsulated in drops. Here we present a method of ordered encapsulation12 which increases the demonstrated encapsulation efficiencies for one and two cells and may be extrapolated for encapsulation of a larger number of cells.
To achieve monodisperse drop generation, microfluidic "flow focusing" enables the creation of controllable-size drops of one fluid (an aqueous cell mixture) within another (a continuous oil phase) by using a nozzle at which the streams converge.13 For a given nozzle geometry, the drop generation frequency f and drop size can be altered by adjusting oil and aqueous flow rates Qoil and Qaq. As the flow rates increase, the flows may transition from drop generation to unstable jetting of aqueous fluid from the nozzle.14
When the aqueous solution contains suspended particles, particles become encapsulated and isolated from one another at the nozzle. For drop generation using a randomly distributed aqueous cell suspension, the average fraction of drops Dk containing k cells is dictated by Poisson statistics, where Dk = λk exp(-λ)/(k!) and λ is the average number of cells per drop. The fraction of cells which end up in the "correctly" encapsulated drops is calculated using Pk = (k x Dk)/Σ(k' x Dk'). The subtle difference between the two metrics is that Dk relates to the utilization of aqueous fluid and the amount of drop sorting that must be completed following encapsulation, and Pk relates to the utilization of the cell sample. As an example, one could use a dilute cell suspension (low λ) to encapsulate drops where most drops containing cells would contain just one cell. While the efficiency metric Pk would be high, the majority of drops would be empty (low Dk), thus requiring a sorting mechanism to remove empty drops, also reducing throughput.15
Combining drop generation with inertial ordering provides the ability to encapsulate drops with more predictable numbers of cells per drop and higher throughputs than random encapsulation. Inertial focusing was first discovered by Segre and Silberberg16 and refers to the tendency of finite-sized particles to migrate to lateral equilibrium positions in channel flow. Inertial ordering refers to the tendency of the particles and cells to passively organize into equally spaced, staggered, constant velocity trains. Both focusing and ordering require sufficiently high flow rates (high Reynolds number) and particle sizes (high Particle Reynolds number).17,18 Here, the Reynolds number Re =uDh/ν and particle Reynolds number Rep =Re(a/Dh)2, where u is a characteristic flow velocity, Dh [=2wh/(w+h)] is the hydraulic diameter, ν is the kinematic viscosity, a is the particle diameter, w is the channel width, and h is the channel height. Empirically, the length required to achieve fully ordered trains decreases as Re and Rep increase. Note that the high Re and Rep requirements (for this study on the order of 5 and 0.5, respectively) may conflict with the need to keep aqueous flow rates low to avoid jetting at the drop generation nozzle. Additionally, high flow rates lead to higher shear stresses on cells, which are not addressed in this protocol. The previous ordered encapsulation study demonstrated that over 90% of singly encapsulated HL60 cells under similar flow conditions to those in this study maintained cell membrane integrity.12 However, the effect of the magnitude and time scales of shear stresses will need to be carefully considered when extrapolating to different cell types and flow parameters. The overlapping of the cell ordering, drop generation, and cell viability aqueous flow rate constraints provides an ideal operational regime for controlled encapsulation of single and multiple cells.
Because very few studies address inter-particle train spacing,19,20 determining the spacing is most easily done empirically and will depend on channel geometry, flow rate, particle size, and particle concentration. Nonetheless, the equal lateral spacing between trains implies that cells arrive at predictable, consistent time intervals. When drop generation occurs at the same rate at which ordered cells arrive at the nozzle, the cells become encapsulated within the drop in a controlled manner. This technique has been utilized to encapsulate single cells with throughputs on the order of 15 kHz,12 a significant improvement over previous studies reporting encapsulation rates on the order of 60-160 Hz.4,15 In the controlled encapsulation work, over 80% of drops contained one and only one cell, a significant efficiency improvement over Poisson (random) statistics, which predicts less than 40% efficiency on average.12
In previous controlled encapsulation work,12 the average number of particles per drop λ was tuned to provide single-cell encapsulation. We hypothesize that through tuning of flow rates, we can efficiently encapsulate any number of cells per drop when λ is equal or close to the number of desired cells per drop. While single-cell encapsulation is valuable in determining individual cell responses from stimuli, multiple-cell encapsulation provides information relating to the interaction of controlled numbers and types of cells. Here we present a protocol, representative results using polystyrene microspheres, and discussion for controlled encapsulation of multiple cells using a passive inertial ordering channel and drop generation nozzle.
Protocollo
I protocolli in questa sezione descrivono i materiali e le attrezzature utilizzati specificamente per ottenere i risultati sperimentali presentati. Si noti che i fornitori alternativi per apparecchiature chimiche e possono essere utilizzati.
1. Dispositivo di Fabbricazione e litografia soft
Tecniche standard di litografia soft, 21 alcuni dei quali sono stati descritti in articoli precedenti Giove, 22 sono stati utilizzati per la creazione di polidimetilsilossano (PDMS) le reti microcanali legati ai substrati di vetro. Oltre fabbricazione maestro stampo replica di SU-8 fotolitografia, i processi possono essere effettuati all'esterno di una stanza pulita o cappa pulita, tuttavia, polvere e particelle dovrebbe ancora essere minimizzato per ottenere risultati coerenti.
- Progettare un micro-canale schema come mostrato in figura 1 in AutoCAD (AutoDesk Inc.). Impiegare un produttore di terze parti (Fineline Imaging Inc.) per stampare una risoluzione elevata (50.000 dpi) transmaschera di trasparenza su pellicola Mylar o quarzo dove i canali sono trasparenti su uno sfondo scuro.
- Creare un silicio e SU-8 master photoresist per lo stampaggio replica. In breve, girare SU-8 2050 (MicroChem) photoresist negativo con rpm consigliata dal costruttore su una spin-spalmatrice per creare uno strato spesso 52 micron su una superficie pulita 7,5 cm o 10 wafer di silicio cm. Dopo morbido cuocere, bordo la rimozione del tallone, l'esposizione ai raggi UV attraverso una maschera di contatto, post-esposizione cuocere, lo sviluppo e l'esposizione inondazioni, misurare lo spessore effettivo del SU-8 layer utilizzando un profilometro Dektak (Veeco). Nastro lo stampo principale sul fondo di un 4 "o 5" capsula Petri per preparare stampaggio PDMS replica.
- Mix PDMS base di elastomero con elastomero agente di indurimento (Dow Corning) in un rapporto di 10:1 w / w di base e catalizzatore. Versare ben miscelato precursore PDMS sul maestro silicio per creare uno strato di 2-3 mm di spessore finale. Una miscela di 20 g di base di elastomero con 2 g di agente di indurimento è sufficiente a coprire una 4 "superficie di diametro.
- Posizionare il master stampo PDMS e in essiccatore sotto vuoto (Jencons) di de-il gas non indurito PDMS. Utilizzando un regolatore di pressione (Cole Parmer), lentamente diminuire la pressione estensimetro camera da 0 "Hg a -27" Hg oltre 20 minuti per evitare eccessiva formazione di schiuma. Lasciare dispositivo in camera da vuoto a -27 "Hg per 30 minuti o fino a bolle d'aria scomparire.
- Rilascio del vuoto e spostare stampo master e PDMS ad un forno a 65 ° C (Thermo Scientific) per un minimo di quattro ore. Il dispositivo può essere lasciato nel forno durante la notte per migliorare la vulcanizzazione.
- Rimuovere il dispositivo dal forno e lasciare raffreddare. Tagliare con cautela PDMS intorno wafer circolare usando un coltello di precisione e la buccia fuori PDMS. Tagliare contorno dispositivo come mostrato in figura 1 con un bisturi.
- Punch porte fluidico (tre per dispositivo) nelle tre regioni rotonde mostrati in figura 1 con un punzone biopsia. Per questo dispositivo, utilizzare uno 0,75 millimetri di diametro esterno punzone (Harris).
- Aderire nastro adesivo sul lato modellato del PDMS e la buccia di cancellare qualunquepolvere. Come alternativa di risparmio di costi, ma praticabile per apparati convenzionali plasma di ossigeno, 21,22 plasma trattare il lato modellato del PDMS e un ambiente pulito 3 "x 1" vetrino per microscopio usando un portatile di laboratorio corona treater (Electro-Technic Products Inc .) 23. Si noti che questo dispositivo dovrebbe essere utilizzato in una cappa aspirante o zona ben ventilata causa dello scarico di ozono, e di tutti gli orologi e telefoni cellulari devono essere tenuti almeno dieci metri di distanza. Regolare la corona di raggiungere una corona stabile, con un minimo scintille. Lentamente sventolare l'elettrodo circa 1/4 "sopra ogni superficie per circa 20 secondi e poi subito a portare le superfici trattate in contatto in modo da formare un forte legame permanente prima che le superfici PDMS ritornano al loro stato nativo.
- Posizionare il dispositivo su una piastra metallica, posto in un forno freddo, impostare il forno a 120 ° C, e cuocere notte per completare legame e per riportare il PDMS al suo stato originale idrofobo. 24 Durante questa cottura ad alta temperatura, tegli superficie di vetro del canale anche essere reso idrofobo dovuta alla deposizione di uno strato idrofobo sottile sul vetro. In alternativa, rivestimenti idrofobi come AQUAPEL (PPG Industries) può essere iniettato nei porti fluidici utilizzando una siringa da 1 ml e un ago da siringa. 12 cura ma fermamente iniettare il AQUAPEL seguita da spurgo dell'aria nei porti fluidici senza rompere il vetro di PDMS legame . Aggressivamente ripetere lo spurgo d'aria su tutte le porte di entrata e uscita, mentre pulendo l 'eventuale AQUAPEL eccesso al fine di evitare eventuali depositi che potrebbero ostruire i canali dopo l'essiccazione.
2. Preparazione del campione
- Preparare una coltura cellulare secondo le procedure stabilite per il vostro tipo di cellula scelto. Per il particolare dispositivo utilizzato in questo studio, 8-15 micron di particelle o cellule devono ordinare in modo adeguato per l'incapsulamento. Tipi di cellule più piccole o più grandi possono richiedere variando le dimensioni del canale di messa a fuoco per ottenere un'adeguata Re p. Per il merisultati dimostrazione THOD mostrato in questo articolo, 9,9 micron microsfere di polistirene (G1000, Thermo Scientific) sono utilizzati come surrogati delle cellule.
- Preparare la particella o sospensione acquosa delle cellule attraverso la miscelazione delicata. Quando si usano cellule o particelle di polistirene, di controllo della concentrazione è essenziale (vedi Figura 4) per ottenere ideale incapsulamento ordinato. Utilizzando i dati precedenti 12 come guida, calcolare la cella desiderata o concentrazione di particelle in base alla spaziatura treno ordinato e micro-canale formato come: una cella o particella per orari dei treni previsti longitudinali spaziatura tra la focalizzazione canale sezione trasversale. Se la concentrazione magazzino (1% w / w) è insufficiente, aumentare la concentrazione (qui al 1,5% w / w) delicatamente centrifugazione del campione archivio, rimuovere il liquido supernatante, e ri-sospensione le particelle di vortex, o miscelazione gentile quando si utilizzano celle. Preparare la quantità necessaria per tenere conto del volume di raccolta desiderato e per la fase di esecuzione associata a flOW tuning.
- Entrambe le cellule e particelle di polistirene avere un peso specifico maggiore di uno. Sebbene non mostrato in questo protocollo, per esperimenti a lungo termine di durata dell'ordine di parecchi minuti ad alcune ore, galleggiabilità corrispondere la soluzione aggiungendo un soluto come CaCl 2 per particelle o OptiPrep (Sigma-Aldrich) per le cellule.
- Preparare un campione di 10 ml della fase continua olio fluorocarbonio miscelando l'olio fluorocarburico FC-40 (3M) e PFPE-PEG blocco tensioattivo copolimero a 25 (2,5% w / w) (Raindance Technologies) in una provetta da centrifuga da 15 mL. In alternativa, l'olio minerale leggero (Chemicals processo PTI) può essere utilizzato con ABIL-EM 90 tensioattivo (2,5% w / w) (Evonik Goldschmidt Corporation).
3. Setup sperimentale
- Accendere il microscopio ottico invertito (Axio Observer, Zeiss) e la macchina fotografica ad alta velocità (Phantom V310, Vision Research). Focus e ispezionare i canali per zoccoli e detriti dal manualmente spostando il dispositivo outilizzando una fase microscopio motorizzato. Alcuni piccoli detriti possono essere spinto fuori quando i flussi di liquido attraverso. Per i detriti più grandi o evidenti zoccoli, selezionare un altro canale sul dispositivo, come i detriti nel canale di messa a fuoco può degradare in modo significativo la qualità di ordinazione. Si noti che gli zoccoli possono essere rimossi in condizioni di flusso premendo con forza sulla superficie PDMS al di sopra della regione colpita con una pinzetta contundenti.
- Tagliare tre lunghezze di tubo in PVC (0,01 "ID/0.03" OD, Tygon) per l'ingresso acquosa, di ingresso e di uscita olio, emulsione. Per ridurre al minimo volume morto, quel tanto che basta tagliare tubi per raggiungere dalle pompe siringa alla fase microscopio. Tagliare estremità tubi un angolo di 45 ° per facilitare l'inserimento nei porti fluidici.
- Utilizzare delle pinzette per premere fissare il tubo finisce nei porti fluidici perforate nel passaggio 1 e quindi premere il montaggio di due calibro 30 a punta smussata aghi da siringa in acciaio inox (SmallParts) nelle estremità libere del acquosa rispettivi tubi di ingresso e di olio (non necessario adesivo) . Posizionare il tubo di uscita in un r rifiutieservoir. Questo tubo viene successivamente spostato in un serbatoio di raccolta.
- Spostare il dispositivo e il tubo collegato alla fase microscopio, allineare, e concentrarsi su l'ugello dispositivo utilizzando un obiettivo disponibile (20x è stato utilizzato per questo esperimento). Regolare per K hler illuminazione e altre impostazioni del microscopio come richiesto per la registrazione ottimale.
- Riempire una siringa da 1 ml (BD) con ben miscelato fase acquosa e una siringa da 3 mL (BD) con la fase oleosa soluzione preparata nella fase 2. Si noti che tutte le siringhe di ogni volume può essere usato e deve essere attentamente selezionati a seconda dei tempi di esecuzione desiderati e la minimizzazione di qualsiasi pulsatilità. Inclinare una siringa in verticale e sfiorare per passare le bolle d'aria alla presa di siringa. Premere lentamente lo stantuffo sufficiente per spingere l'aria per la punta della siringa. Tenendo la siringa verticalmente, collegare le siringhe per l'ago della siringa rispettivo già attaccato al dispositivo nella Fase 3,3. Premere lo stantuffo per forzare l'aria attraverso il volume ago della siringa morto finché il liquido è psvuotata attraverso il tubo quasi al dispositivo. Montare saldamente la siringa per una pompa a siringa (Nexus 3000, Chemyx) e coinvolgere il blocco dello stantuffo. Ripetere i collegamenti per la seconda siringa e montare una pompa seconda siringa.
- Accendere ogni pompa siringa e programma utilizzando i protocolli del produttore pompa. Impostare le portate iniziali di Q olio = 50 microlitri / min e Q = aq 5 microlitri / min per la fase olio e fase acquosa, rispettivamente. Avviare le pompe.
- Attendere per ciascun fluido di entrare nel dispositivo e riempire i canali, spingendo fuori l'aria restante morto. Questa operazione potrebbe richiedere alcuni minuti. Se c'è una grande quantità di aria nel tubo di ingresso, aumentare temporaneamente ciascuna portata finché l'aria viene espulsa. Non aumentare le portate così alte che le pressioni di grandi dimensioni si verificano nel canale, che porta a PDMS-to-vetro fallimento bond.
- Utilizzando le portate iniziali, osservare la formazione di gocce al ugello (risultati qui: 20x magnification, il frame rate 21005 fps, l'esposizione 3 ms). Ridurre il campo di vista telecamera solo l'ugello per massimizzare il frame rate e ridurre i requisiti di memoria, se possibile. Acquisizione di video di esempio e verificare che la frequenza di campionamento è sufficiente per evitare l'aliasing.
- Per evitare di getto (vedi figura 2), iniziare con bassi tassi di flusso acquose. Lentamente aumentare il tasso di flusso acquoso di osservare ordinamento delle particelle nel canale lungo soluzione acquosa come all'aumentare della portata.
- Se la concentrazione di particella è troppo bassa per fornire treni con relativamente poche "dispersi" e particelle del campione non è stato galleggiabilità trovati, fisicamente inclinare la pompa a siringa verso l'uscita siringa per fornire graduale sedimentazione delle particelle verso l'uscita siringa. Questo metodo è illustrato nel protocollo video. Periodicamente ruotando la siringa lungo il suo asse può anche ridurre sedimentazione indesiderato.
- Una volta ordinamento adeguata verifica, regolare la portata di olio per sintonizzare la frequenza di generazione edimensione delle gocce. Il volume di goccia media può essere calcolata utilizzando la velocità di flusso acquoso divisa per la frequenza di generazione goccia misurata mediante cattura video. Iterativamente regolare entrambi i flussi di raggiungere tassi di incapsulamento desiderati e volumi goccia.
- Una volta ordinato stabile incapsulamento è confermata, spostare il tubo di uscita dal serbatoio dei rifiuti in un serbatoio di raccolta o di un mangime in un altro dispositivo per il test successivo.
- Determinare il tempo di raccolta in base al numero desiderato di goccioline e la frequenza di generazione calcolato.
- Registrare la frazione di gocce contenenti 0, 1, 2, ..., N particelle di quantificare l'efficienza utilizzando sia risultati goccia video di generazione o pipettando un campione di emulsione raccolto per l'ispezione.
4. Risultati rappresentativi
I risultati sono presentati che conseguire sia controllato singola particella e particella controllato in doppio-incapsulamento (Figura 3). Con il tagliola portata FC-40 di olio a metà, una singola particella, incapsulamento diventa due particelle incapsulamento. Al contrario, avremmo potuto aumentato il tasso di flusso acquoso di consegnare le particelle all'ugello più rapidamente, ma avrebbe anche aumentato il rischio di getto del flusso acquoso. Gli istogrammi in figura 3 presenta il numero frazionario di particelle per caduta per i due casi, insieme con confronti con le statistiche Poisson. Le gocce occasionali con le particelle a zero sono principalmente dovute al "mancante" particelle nei treni ordinati, mentre i casi in cui ci sono particelle più incapsulati che risultato desiderato da locali elevate concentrazioni di particelle e le particelle che a volte migrano verso una delle due posizioni verticali messa a fuoco. Si noti che galleggiamento corrispondente come descritto al punto 2 non è stato utilizzato. Invece, la pompa a siringa è stata fisicamente inclinato per permettere deposizione di particelle verso l'uscita siringa, portando a una concentrazione elevata di particelle durante la corsa.
Un percorso sperimentale che illustra la necessità di particella e corretta concentrazione cellulare è mostrato in Figura 4. Senza ordine completo, i gruppi localizzati di ordine particelle e sono incapsulati, ma tante gocce sono senza particelle. Un istogramma mostra l'efficienza di incapsulazione diminuito per il desiderato due incapsulamento delle particelle.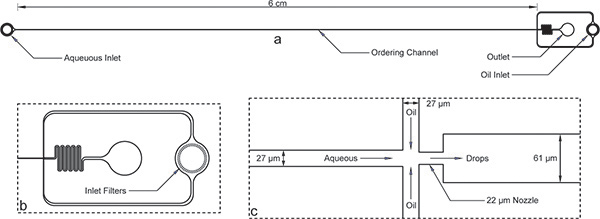
Figura 1. Dispositivo di incapsulamento. a) totale con dispositivo di insenature, outlet, e lungo canale di ordinazione. L'altezza del dispositivo è di 52 micron e la larghezza del canale di ordinazione è di 27 micron. b) Sia acquoso e bocche olio hanno filtri detriti grandi fessure l'ordine della larghezza del canale di ordinazione per la vista ingrandita di ingresso dell'olio. c) La vista ingrandita dell'ugello mostra uguali larghezze di canale di 27 micron per i canali acquosi e olio, seguiti dalla contrazione ugello di 22 micron e improvvisa espansione a un canale più ampio 61 um.Si noti che le dimensioni del dispositivo illustrato qui sono stati verificati utilizzando un profilometro dopo microfabbricazione e differiscono leggermente dalle dimensioni nominali sulla maschera. Una vera immagine del canale di ordinazione e l'ugello sono disponibili on-line come figura supplementare 1 . La maschera di file di AutoCAD è stata inoltre inserita on-line come un supplemento a questo manoscritto.

Figura 2. Isteresi di un gocciolamento di transizione getto utilizzando un dispositivo più ampio (80 micron di larghezza x 22 um alto). a) A rate costante flusso FC-40 (Q olio = 45 microlitri / min), si verifica la formazione calo costante a 10 kHz con una soluzione acquosa di portata Q aq = 8 microlitri / min. Poiché il flusso acquosa viene lentamente aumentata a 10 m &u; L / min, getto del flusso di fluido acquoso viene attivato. b) Quando la portata viene restituito a 8 microlitri / min getto continua. Si noti che la formazione calo costante può essere ristabilita con una breve pausa la pompa di flusso acquoso (una pausa di 1 secondo è tipico).
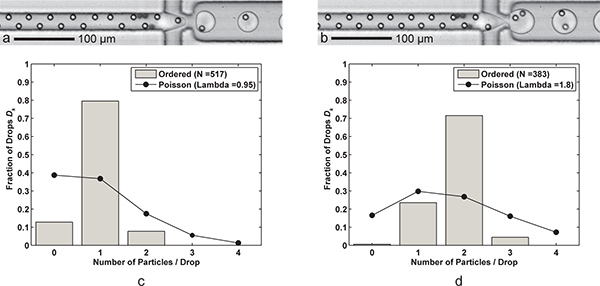
Figura 3. Incapsulamento singolo e doppio-particella. A) formazione delle gocce con una cella per goccia (Q olio = 60 microlitri / min, Q aq = 9 pl / min) con un tasso di abbandono generazione di 6,1 kHz, dimensioni calo medio del 24,4 pL, e una singola cellula l'efficienza di cattura D k = 79,5% e P k = 83,7% (λ = 0,95) per un campione di n d = 517 gocce e n p = 491 particelle. b) la formazione di discesa a due celle per goccia si ottiene semplicemente riducendo l'FC-40 velocità di flusso di olio Q a 30 μL / min. Più grande (39,8 pL) gocce sono formate a un tasso di 3,8 kHz con due celle efficienza di cattura D k = 71,5% e P k = 79,5% (λ = 1,80) per un campione di dimensione n d = 383 gocce e n p = 689 particelle. cd) Due istogrammi confrontare l'efficienza di incapsulamento delle particelle goccia D k ha ordinato di incapsulamento singolo e doppio di particelle con le statistiche di Poisson (incapsulamento casuale). Si noti che per entrambi i casi, la spaziatura delle particelle nella direzione del flusso è circa 17-18 micron per completamente ordinati particelle alternati. Video supplementari mostrano sia l'incapsulamento singolo e doppio-particelle sono disponibili online. Clicca qui per vedere 3 film supplementari . Clicca qui per vedere 3b Movie supplementari .

Concentrazione Figura 4. Influisce notevolmente l'efficienza di incapsulamento. A) al diminuire della concentrazione, l'ordinamento piena non si verifica, e quindi "buchi" nei treni emergono, lasciando qualche goccia con meno di particelle previsti. B) L'istogramma mostra la minore efficienza ( D k = 55,9%, P k = 70,9%) per due particelle incapsulamento a causa di un valore inferiore di λ = 1,57 dove ci sono tanti quanti singola particella, diminuisce in quanto vi sono due particelle gocce. Ciò risulta dalla figura Q olio = 30 microlitri / min e Q aq = 9 pL / min, le condizioni di flusso stesse di figura 3b. Un video rappresentante supplementare è disponibile online. Clicca qui per vedere Supplemental Movie 4 .
Discussione
Nonostante i livelli relativamente alti di ordine, non tutte le gocce conterrà il numero corretto di particelle o cellule. Efficienza di incapsulazione può essere calcolato come numero di cellule o particelle che incapsulate in gocce con l'uso desiderato diviso per il numero totale. Questi dati grezzi può essere ottenuto da un algoritmo automatico video ad alta velocità o da un campione di immagini emulsione raccolto. Questo può essere paragonato alla frazione di particelle P k incapsulato i...
Divulgazioni
JE è un inventore di un brevetto basato sulla tecnologia utilizzata in questo manoscritto.
Riconoscimenti
Ringraziamo Technologies Raindance per il campione di PFPE-PEG tensioattivo utilizzato in questo studio, e ringraziamo il BioMEMS Resource Center (Mehmet Toner, regista) per lo stampo wafer di silicio utilizzati per creare repliche di canale PDMS.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| AutoCAD | AutoDesk | ||
| Trasparenza Mask | Fineline Imaging Inc. | ||
| SU-8 Photoresist | MicroChem | 2050 | |
| Dektak Profilometro | Veeco | ||
| Petri Dish | BD Falcon | 351058 | |
| PDMS silicone elastomero Kit | Dow Corning Corp. | Sylgard 184, il Codice materiale (240) 4019862 | |
| Vacuum Essiccatore | Jencons | 250-030 | |
| Vacuum Pump | Alcatel Vacuum Technology | 2010 C2 | |
| Regolatore di vuoto | Cole-Parmer | EW-00910-10 | |
| Forno | Thermo Scientific | Lindberg Blu M, OV800F | |
| Biopsia Punch, 0,75 mm | Harris | Uni-Core 15072 | |
| Laboratorio Corona treater | Electro-Technic Products Inc. | BD-20AC, SKU 12051A | |
| Slides di vetro | Gold Seal | 3010 | |
| AQUAPEL | PPG Industries | Strategia alternativa | |
| Microsfere di polistirene, 9,9 micron | Thermo | G1000 | |
| OptiPrep | Sigma-Aldrich | D1556 | Non dimostrata |
| Siringhe Luer-Lok | BD | 1 mL: 309628 3 mL: 309.585 | |
| FC-40 Fluorocarbon Oil | 3M Inc. | Sigma Aldrich, F9755 | |
| PFPE-PEG Fluorosurfactant | Raindance Technologies | ||
| Mineral olio leggero | Prodotti chimici di processo PTI | 08042-47-5 | Strategia alternativa |
| Mineral Oil Tensioattivo | Evonik Goldschmidt Corporation | ABIL EM 90 | Strategia alternativa |
| Tygon PVC Tubing | SmallParts | TGY-010 | |
| 30 Gauge Luer-Lok siringa con ago, 1/2 " | SmallParts | NE-301PL-C | |
| Microscopio invertito | Carl Zeiss Imaging | Axio Observer.Z1 | |
| Speed Camera Alta | Vision Research | Phantom V310 | |
| Pompe siringa (2) | Chemyx Inc. | Nexus 3000 | |
| Olio di silicone | Dow Corning | 200 fluido, 10 cSt | Optional per l'archiviazione Emulsion |
Riferimenti
- Zagnoni, M., Lain, G. L. e., Cooper, J. M. Electrocoalescence mechanisms of microdroplets using localized electric fields in microfluidic channels. Langmuir : the ACS journal of surfaces and colloids. 26, 14443-14449 (2010).
- Niu, X. Z., Gielen, F., Edel, J. B., deMello, A. J. A microdroplet dilutor for high-throughput screening. Nat. Chem. 3, 437-442 (2011).
- Vincent, M. E., Liu, W., Haney, E. B., Ismagilov, R. F. Microfluidic stochastic confinement enhances analysis of rare cells by isolating cells and creating high density environments for control of diffusible signals. Chemical Society reviews. 39, 974-984 (2010).
- Huebner, A. Quantitative detection of protein expression in single cells using droplet microfluidics. Chemical communications. , 1218-1220 (2007).
- Love, J. C., Ronan, J. L., Grotenbreg, G. M., van der Veen, A. G., Ploegh, H. L. A microengraving method for rapid selection of single cells producing antigen-specific antibodies. Nature biotechnology. 24, 703-707 (2006).
- Bradshaw, E. M. Concurrent detection of secreted products from human lymphocytes by microengraving: Cytokines and antigen-reactive antibodies. Clin. Immunol. 129, 10-18 (2008).
- Liu, W. S., Kim, H. J., Lucchetta, E. M., Du, W. B., Ismagilov, R. F. Isolation, incubation, and parallel functional testing and identification by FISH of rare microbial single-copy cells from multi-species mixtures using the combination of chemistrode and stochastic confinement. Lab on a chip. 9, 2153-2162 (2009).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab on a chip. 8, 1265-1272 (2008).
- Koster, S. Drop-based microfluidic devices for encapsulation of single cells. Lab on a chip. 8, 1110-1115 (2008).
- Kelly, R. T., Page, J. S., Marginean, I., Tang, K., Smith, R. D. Dilution-free analysis from picoliter droplets by nano-electrospray ionization mass spectrometry. Angew Chem. Int. Ed. Engl. 48, 6832-6835 (2009).
- Hong, J., deMello, A. J., Jayasinghe, S. N. Bio-electrospraying and droplet-based microfluidics: control of cell numbers within living residues. Biomedical materials. 5, 21001 (2010).
- Edd, J. F. Controlled encapsulation of single-cells into monodisperse picolitre drops. Lab on a chip. 8, 1262-1264 (2008).
- Anna, S. L., Bontoux, N., Stone, H. A. Formation of dispersions using "flow focusing" in microchannels. Applied Physics Letters. 82, 364 (2003).
- Utada, A., Fernandez-Nieves, A., Stone, H., Weitz, D. Dripping to Jetting Transitions in Coflowing Liquid Streams. Physical Review Letters. 99, (2007).
- Chabert, M., Viovy, J. L. Microfluidic high-throughput encapsulation and hydrodynamic self-sorting of single cells. Proceedings of the National Academy of Sciences of the United States of America. 105, 3191-3196 (2008).
- Segrí, G., Silberberg, A. Radial Particle Displacements in Poiseuille Flow of Suspensions. Nature. 189, 209-210 (1961).
- Carlo, D. D. i. Inertial microfluidics. Lab on a chip. 9, 3038-3046 (2009).
- Carlo, D. D. i., Edd, J., Humphry, K., Stone, H., Toner, M. Particle Segregation and Dynamics in Confined Flows. Physical Review Letters. 102, (2009).
- Humphry, K. J., Kulkarni, P. M., Weitz, D. A., Morris, J. F., Stone, H. A. Axial and lateral particle ordering in finite Reynolds number channel flows. Physics of Fluids. 22, 081703 (2010).
- Lee, W., Amini, H., Stone, H. A., Carlo, D. D. i. Dynamic self-assembly and control of microfluidic particle crystals. Proceedings of the National Academy of Sciences of the United States of America. 107, 22413 (2010).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane. Anal. Chem. 70, 4974-4984 (1998).
- Kotz, K., Cheng, X., Toner, M. PDMS Device Fabrication and Surface Modification. J. Vis. Exp. (8), e319 (2007).
- Haubert, K., Drier, T., Beebe, D. PDMS bonding by means of a portable, low-cost corona system. Lab on a chip. 6, 1548-1549 (2006).
- Hatch, A. C. 1-Million droplet array with wide-field fluorescence imaging for digital PCR. Lab on a chip. , 3838-3845 (2011).
- Holtze, C. Biocompatible surfactants for water-in-fluorocarbon emulsions. Lab on a chip. 8, 1632-1639 (2008).
- Garstecki, P., Stone, H., Whitesides, G. Mechanism for Flow-Rate Controlled Breakup in Confined Geometries: A Route to Monodisperse Emulsions. Physical Review Letters. 94, (2005).
- Garstecki, P., Fuerstman, M. J., Stone, H. A., Whitesides, G. M. Formation of droplets and bubbles in a microfluidic T-junction-scaling and mechanism of break-up. Lab on a chip. 6, 437-446 (2006).
- Nie, Z. Emulsification in a microfluidic flow-focusing device: effect of the viscosities of the liquids. Microfluidics and Nanofluidics. , (2008).
- Holt, D. J., Payne, R. J., Chow, W. Y., Abell, C. Fluorosurfactants for microdroplets: interfacial tension analysis. Journal of colloid and interface science. 350, 205-211 (2010).
- Holt, D. J., Payne, R. J., Abell, C. Synthesis of novel fluorous surfactants for microdroplet stabilisation in fluorous oil streams. Journal of Fluorine Chemistry. 131, 398-407 (2010).
- Hatch, A. C., Fisher, J. S., Pentoney, S. L., Yang, D. L., Lee, A. P. Tunable 3D droplet self-assembly for ultra-high-density digital micro-reactor arrays. Lab on a chip. 11, 2509-2517 (2011).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab on a chip. 12, 422-433 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon