È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Procedimento per la realizzazione di nanofibre Biofunzionali
In questo articolo
Riepilogo
Un approccio efficace per la preparazione di nanofibre decorate con gruppi funzionali in grado di interagire specificamente con proteine è descritto. Il primo approccio richiede la preparazione di un polimero funzionalizzato con gruppo funzionale adeguata. Il polimero funzionale è realizzato in nanofibre da electrospinning. L'efficacia del legame delle nanofibre con una proteina viene studiata tramite microscopia confocale.
Abstract
Elettrofilatura è un metodo di trattamento efficace per la preparazione di nanofibre decorate con gruppi funzionali. Nanofibre decorati con gruppi funzionali possono essere utilizzati per studiare le interazioni materiale-biomarker cioè agire come biosensori con potenziale come rivelatori di singola molecola. Abbiamo sviluppato un approccio efficace per la preparazione di polimeri funzionali dove la funzionalità è la capacità di legarsi specificamente con una proteina modello. Nel nostro sistema modello, il gruppo funzionale è 2,4-dinitrofenil (DNP) e la proteina è anti-DNP IgE (immunoglobuline E). Il polimero funzionale, α, ω-bi [2,4-dinitrofenile caproico] [poli (etilene ossido)-b-poli (2-metossistirene)-b-poli (ossido di etilene)] (CDNP-PEO-P2MS-PEO- CDNP), viene preparato mediante polimerizzazione anionica vivente. L'iniziatore difunzionale utilizzato nella polimerizzazione è stato preparato mediante reazione di trasferimento di elettroni di α-metilstirene e potassio (specchio) metallo. Il 2-metossistirene monomero è stato aggiuntoprima l'iniziatore, seguita dalla aggiunta del secondo monomero, ossido di etilene, e infine il polimero vivente è stato terminato da metanolo. L'α, ω-dihydroxyl polimero [HO-PEO-P2MS-PEO-OH] è stato fatto reagire con N-2 ,4-DNP-∈-ammino caproico, mediante accoppiamento DCC, causando la formazione di α, ω-bi [ 2,4-dinitrophenylcaproic] [poli (etilenossido)-b-poli (2-metossistirene)-b-poli (ossido di etilene)] (CDNP-PEO-P2MS-PEO-CDNP). I polimeri sono stati caratterizzati da FT-IR, 1 H NMR e Gel Permeation Chromatography (GPC). Le distribuzioni di peso molecolare dei polimeri erano strette (1,1-1,2) e polimeri con peso molecolare maggiore di 50.000 è stato utilizzato in questo studio. I polimeri sono stati polveri giallo e solubile in tetraidrofurano. Un solubile in acqua CDNP-PEO-P2MS-PEO-CDNP / DMEG (glicole dimethoxyethylene) si lega e raggiunge vincolante stato stazionario con la soluzione di IgE nel giro di pochi secondi. Alto peso molecolare (cioè acqua insolubile circa 50.000) CDNP-PEO-P2MS-PEO-CDNP polimeri, contenente 1% di nanotubi di carbonio a parete (SWCNT) sono stati trasformati in nanofibre elettroattivi (100 nm a 500 nm di diametro) sul substrato di silicio. Spettroscopia di fluorescenza mostra che anti-DNP IgE interagisce con le nanofibre legandosi con i gruppi funzionali DNP decorare le fibre. Queste osservazioni suggeriscono che nanofibre opportunamente funzionalizzati promettenti per lo sviluppo di rilevamento del dispositivo biomarker.
Protocollo
1. Sintesi di α, ω-dihydroxyl Polymer [HO-PEO-P2MS-PEO-OH]
- Assemblare reattore di polimerizzazione, come mostrato in Figura 1. Il reattore per questo esperimento sono costituiti da un fondo rotondo da 100 ml 2-collo pallone avente un giunto standard cono esterno (Chemglass), due adattatori di controllo del flusso con rubinetti (Chemglass), ed uno stelo Teflon agitazione. Adattatore A (Figura 1) è stato usato per mantenere Ultra High Purity (UHP) Azoto scorre attraverso il sistema per impedire all'aria e all'umidità di penetrare nel sistema inerte. Adattatore B (Figura 1) è stato usato per iniettare il solvente, monomero e iniziatore nel pallone di reazione.
- Asciugare 200 ml di tetraidrofurano (THF) su metallo Na, utilizzando benzofenone come indicatore, per un minimo di 6 ore sotto gas azoto secco.
- Asciugare 10 ml di 2-metossistirene su idruro di calcio per 24 ore.
- Preparare un bagno freddo temperatura mantenuta a -78 ° C usando un impasto di isopropanolo and azoto liquido.
- Aggiungere 25 ml di THF nel pallone di reazione di polimerizzazione (vedi Figura 1) sotto azoto e tenere reattore sotto gas azoto per tutta la polimerizzazione.
- Mettere 100 ml pallone rotondo in slurry.
- Aggiungere 2 ml (0,27 mmol / ml) di soluzione di iniziatore nel pallone di reazione.
- Iniettare il primo monomero, 2-metossistirene (4 ml) nel pallone di reazione.
- Consentono la reazione per 40 min.
- Aggiungere 1 ml del secondo monomero, ossido di etilene.
- Permettere la polimerizzazione di continuare a temperatura ambiente per due giorni.
- Terminare il polimero con HCl (6 M) / metanolo (1/20, vol / vol).
- Purificare il polimero mediante precipitazione in esani e polimero secco in un forno a vuoto.
- Caratterizzare il polimero mediante NMR.
2. Funzionalizzazione di α, ω-dihydroxyl polimero con N-2 ,4-DNP-Ε-amino acido Caproic ottenere il Polym funzionaleer, CDNP-PEO-P2MS-PEO-CDNP
- In un pallone a tre collo, posizionare il α, ω-dihydroxyl polimero (0,05 mmol), l'acido N-2 ,4-DNP-E-ammino caproico (0,25 mmol), DCC (0,15 mmol) e DMAP (0,005 mmoli) e asciugare sulla linea di vuoto per 4 h.
- Distillare diclorometano secco (10 ml) nel pallone.
- Rilasciare il vuoto sotto azoto e mescolare reazione per 12 ore a temperatura ambiente.
- Miscela di reazione filtro e recuperare polimero facendo precipitare due volte in esani e metanolo.
- Asciutto polimero precipitato in un forno sotto vuoto a 40 ° C.
- Determinare la struttura polimerica e funzionalità da FT-IR, 1 H NMR.
3. Preparazione della soluzione per CDNP-PEO-P2MS-PEO-CDNP/SWCNT Electrospinning
- Sciogliere 20% w di CDNP-PEO-P2MS-PEO-CDNP in clorobenzene.
- Sciogliere 20% e il 40% w w di polistirene (MW 800.000) in clorobenzene per preparare due soluzioni. Il polistirene molecolare più elevato viene utilizzato per increase polimero a catena a catena entanglement e ottenere la viscosità ottimale necessaria per electrospinning.
- Mescolare le soluzioni polimeriche preparate in 3.1 e 3.2 insieme per formare i rapporti 1:1 e 1:2 dei polimeri e di aggiungere 1 w% nanotubi di carbonio a parete singola (SWCNT) alla miscela e mescolare durante la notte per una distribuzione uniforme di nanotubi di carbonio.
4. Electrospinning di Polymer-Composite CNT
- Montare il electrospinning montata come mostrato nella Figura 2. Sul lato destro della figura è l'Altissimo Sorgente Tensione Glassman. Accanto ad essa è uno stand replica su cui è collegato il wafer di silicio. A sinistra è un altro stand storta sul quale è montata la siringa e dietro è la lampada per visualizzare la procedura come progredisce.
- Utilizzando una siringa ipodermica, prelevare una piccola quantità della miscela CDNP-PEO-P2MS-PEO-CDNP/polystyrene/SWCNT (circa 1 ml) e montare la siringa ipodermica sul cavalletto storta.
- Un wafer di silicio è il monteed attraverso dalla siringa in modo sicuro ad una distanza di 10 cm, e la clip massa della sorgente di alta tensione è collegato ad esso.
- Fissare la clip recante l'alta tensione da applicare l'ago della siringa, spingere il pistone leggermente (per sospendere una goccia sulla punta dell'ago) e, a questo punto, elettrofilatura è pronto.
- Alimentazione della sorgente di alta tensione e regolare misuratore di tensione a 10 kV. A seconda della natura dei polimeri nel materiale composito, tensioni superiori può essere necessario, specialmente se nanofibre inferiore a 100 nanometri di diametro sono desiderati.
- Wafer di silicio Smonta e mettere in un essiccatore durante la notte per asciugare completamente.
5. Caratterizzazione di Nanofibre
- Imaging iniziale di nanofibre è fatto con microscopio ottico per osservare la prospettiva globale delle fibre.
- Utilizzare Microscopio Elettronico a Scansione di osservare i dettagli più fini, come morfologia, diametro, dimensione dei pori medio, ecc
- Portaresu immagini ulteriormente con un microscopio a forza atomica per osservare 3-D topografia delle fibre, ecc
6. Specificità di legame di nanofibre con Anti-IgE DNP Protein
- Preparare una soluzione di 4 ug / l marcato in modo fluorescente, FITC-IgE (Fluorescein Isothio-cianato-Immunoglobuline E) in PBS-BSA (Soluzione tampone fosfato-albumina di siero bovino) soluzione.
- Mettere un piccolo pezzo di wafer di silicio su cui ci sono nanofibre su un coprioggetto MatTek bene. Incubare le nanofibre in questa soluzione per un hr. Incubazione avviene pipettando gentilmente out, 10 ul soluzione IgE sul wafer di silicio.
- Dopo l'incubazione, rimuovere non legato IgE mediante lavaggio campione tre volte con PBS-BSA soluzione tampone. La soluzione di PBS viene erogato delicatamente sulla parete del piatto MatTek, per evitare spruzzi buffer direttamente sulle nanofibre. Agitare il piatto delicatamente a mano, per distribuire soluzione tampone su nanofibre. Rimuovere con cautela tampone con una pipetta e ritorba questo due volte.
- Per il controllo, incubare a nanofibre IgG marcato in modo fluorescente (non specifico per DNP) nelle stesse condizioni.
- Visualizza le fibre legate con un microscopio confocale a osservare legame con le IgE. Per il nostro studio, è stato utilizzato il microscopio confocale Leica TCS SP2 con lente 63x.
7. Corrente-tensione Comportamento delle nanofibre
- Collegare due micro posizionatori ad una sorgente di corrente molto bassa come il SourceMeter 6430 Keithley sensibile. La impostato per determinare il comportamento corrente di tensione è mostrato in Figura 3. Questa figura mostra la stazione di sonda utilizzata per determinare le caratteristiche iniziali IV delle nanofibre. Esso è costituito dalla Bausch and Lomb Microscopio MicroZoom, una fase di vuoto Chuck, e quattro Micropositioners utilizzate delle sonde. In alto a destra è l'Agilent 34405A Multimetro digitale utilizzato nella misurazione della tensione e sotto che è il Keithley 6430 Sub-Femtoamp Meter Fonte remoto utilizzato per rifornirsi di basse correnti che sono stati immessi nelle fibre.
- Montare i bracci di sonda dei posizionatori micro sul tappeto di fibre da parti opposte con le punte toccano le fibre.
- Collegare altri due micro posizionatori a un multimetro digitale, montare i bracci di sonda in-tra gli altri due e la terra le punte sul tappeto di fibre. Assicurarsi che le quattro punte sono allineati il più possibile.
- Ingresso diverse quantità di corrente dalla Keithley (tipicamente nell'intervallo nA).
- Misurare la caduta di tensione attraverso le punte esterne, per ogni grandezza della corrente erogata.
- Riportando questi valori indicano il tipo di dispositivo, il feltro di fibre comporta come.
8. Risultati rappresentativi
Functional Polymer
"> Il metodo per la sintesi di α, ω-bi [2,4-dinitrofenile caproico] [poli (etilene ossido)-b-poli (2-metossistirene)-b-poli (ossido di etilene)] (CDNP-PEO- P2MS-PEO-CDNP) è mostrato in Figura 4. 1 La struttura del polimero funzionale è stata confermata da FT-IR (Figura 5) e 500 MHz 1 H NMR (Figura 6). La FT-IR mostra la totale scomparsa dei la-OH assorbimento ampia circa 3.500 cm -1 indicano funzionalizzazione quantitativa con il gruppo CDNP. Ciò è confermato anche dallo spettro NMR mostrato in Figura 6. Uso l'integrazione dei picchi dello spettro NMR, è stato determinato che il CDNP-PEO polimeri-P2MS-PEO-CDNP sono quantitativamente funzionalizzati.Nanofibre
In figura 7, una stuoia di nanofibre conduttivi ottenuti elettrofilatura CDNP-PEO-P2MS-PEO-CDNP / polistirene / SWCNT da clorobenzene è shproprio. Immagini confocali ottenuti hanno dimostrato che la proteina si lega con l'IgE DNP sulla superficie della fibra. 3 Questa è un'indicazione della specificità di legame di elettrofilati DNP-polimeri verso anticorpi IgE. L'intensità della luce è un indicatore della presenza di IgE sulle nanofibre come la proteina fluorescente viene etichetta.
Figura 8a è un (Atomic Force Microscope) immagine AFM di una delle nanofibre ottenute da questo processo e figura 8b mostra la dimensione di questo nanofibre particolare è di circa 150 nm di diametro. Da questo processo fibre tra 100-700 nm vengono ottenute. In questo momento attuale è difficile da preparare fibre con una dimensione specifica. Questo è coerente con quanto osservato da altri gruppi. 4 Figura 9 mostra le immagini SEM di CDNP-PEO-P2MS-PEO-CDNP / polistirene / SWCNT nanofibre e il diametro delle nanofibre sono tra 200 nm a 300 nm. Ci sono tre SEM immagini di nanofibers mostrato a diversi ingrandimenti. Studio delle tre immagini mostra le morfologie delle fibre sono lineari e perline. L'obiettivo generale è quello di preparare le fibre che sono per lo più lineare. Figura 10 mostra il grafico IV di tappeti di nanofibre preparate da CDNP-PEO-P2MS-PEO-CDNP / polistirolo / SWCNT. Il grafico mostra il comportamento di un resistore (ohmico). Quando l'antigene è legata alle nanofibre, ci aspettiamo di vedere un cambiamento nel comportamento IV del tappeto di fibre come questa variazione di resistenza è una caratteristica che suggerisce che le fibre funzionali hanno potenziali applicazioni come il componente attivo in sensori per il rilevamento singola molecola .
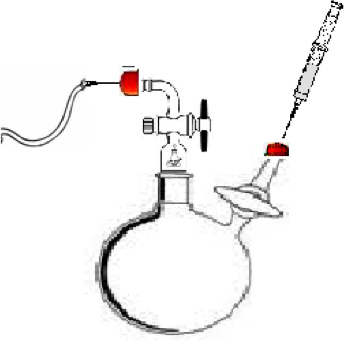
Figura 1. Reattore di polimerizzazione per sintetizzare il α, ω-dihydroxyl polimero. A) Il punto di iniezione per il flusso di azoto gassoso UHP. B.) il punto di iniezione per il solvente, monomero, e iniziatore. C) Il recipiente di reazione.

Figura 2. Configurazione utilizzata per electrospinning utilizzando una sorgente di tensione ad alta Glassman.

Figura 3. Installazione utilizzato per misurare appezzamenti IV, per una sub-femtoamp Remote SourceMeter (Keithley).
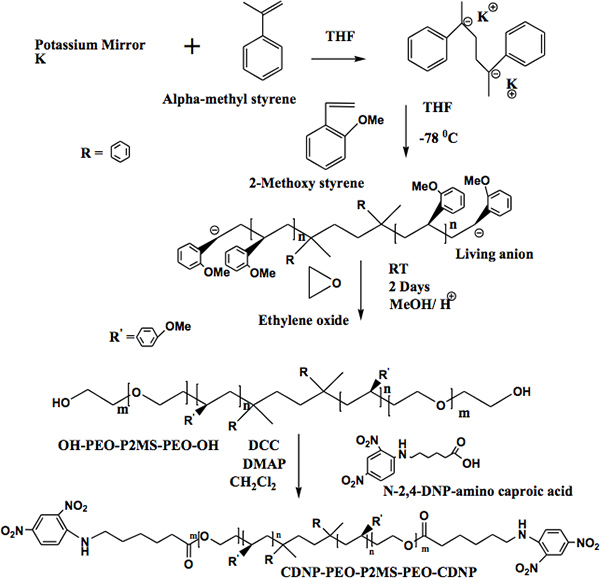
Figura 4. A). Approccio sintetico per la preparazione OH-PEO-P2MS-PEO-OH polimeri. B) Funzionalizzazione di α, ω-diidrossi [poli (etilenossido)-b-poli (2-metossistirene)-b-poli (ossido di etilene)].
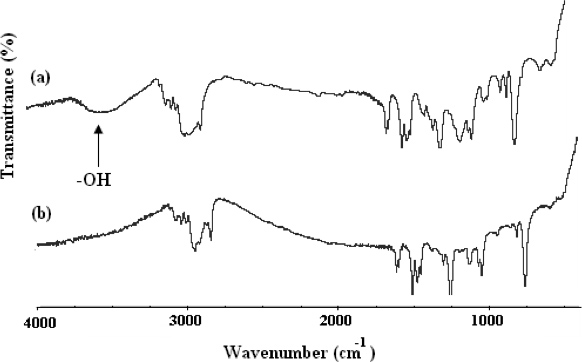
Figura 5. Spettri FT-IR di (A) OH-PEO-P2MS-PEO-OH, precursore CDNP-PEO-P2MS-PEO-CDNP e (B) CDNP-PEO-P2MS-PEO-CDNP.

Figura 6. 500 MHz NMR del protone di CDNP-PEO-P2MS-PEO-CDNP.
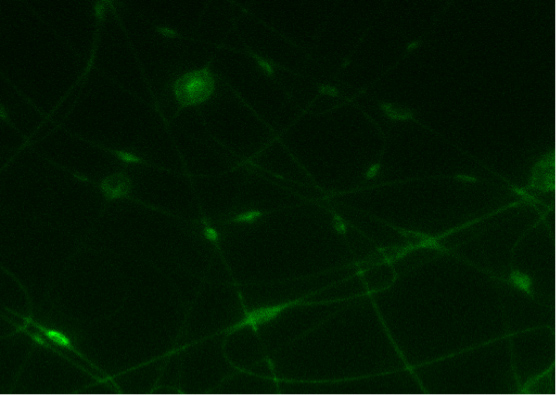
Figura 7. A) immagine legame di FITC-IgE con CDNP-PEO-P2MS-PEO-CDNP fibre elettrofilate da clorobenzene. B) Immagine al microscopio confocale del controllo (nanofibre con IgG).

Figura 8. A) immagine AFM di CDNP-PEO-P2MS-PEO-CDNP Fibre elettrofilate da clorobenzene e B) AFM profilo dimensione cioè di una fibra illustrato nella figura 5a.

Figura 9. Immagini SEM di CDNP-PEO-P2MS-PEO-CDNP / polistirolo / SWCNT nanofibre.
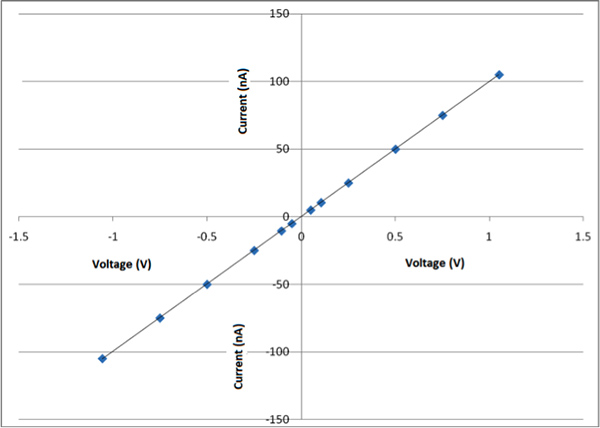
Figura 10. Trama IV di stuoie di nanofibre preparate da CDNP-PEO-P2MS-PEO-CDNP / polistirolo / SWCNT.
Discussione
In questa relazione, abbiamo presentato un approccio efficace per la preparazione di nanofibre biofunzionali. Le nanofibre sono decorate ad un gruppo funzionale che è specifico di una proteina modello. Il procedimento e l'approccio contenute in questa comunicazione sono di natura generale e può essere utilizzato per preparare nanofibre decorati con qualsiasi gruppo funzionale desiderato. La polimerizzazione anionica vivente è potente metodo per sintetizzare strutture polimeriche controllati covalentemente legati ...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato sostenuto da NSF HRD-0630456, un NSF CREST Programma e NSF è DMR-0934142.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
| Sodio metallico | Sigma-Aldrich | 282065 | |
| Benzophenone | Sigma-Aldrich | 239852 | |
| 2-metossistirene | Sigma-Aldrich | 563064 | |
| Tetraidrofurano | Sigma-Aldrich | 178810 | |
| Clorobenzene | Sigma-Aldrich | 319996 | |
| CNT a parete singola | Sigma-Aldrich | 704113 | |
| Polistirolo | Sigma-Aldrich | 81416 | |
| Silicon Wafer | Silicon Quest Int'l | 720200 | |
| Zeiss FESEM | Carl Zeiss Inc. | Ultra 60 | |
| Probestation con Bausch & Lomb MicroZoom II microscopio ad alte prestazioni | Bausch e Lomb | ||
| Leica Confocal scansione del sistema | Leica Microsystems | TCS SP2 | |
| Sub-femtoamp SourceMeter remoto | Keithley Instruments | 6430 | |
| Selezione automatica Multimetro digitale | Keithley Instruments | 175A | |
| Pompa a siringa | Chemyx Inc. | Fusion 200 | |
| Microscopio ottico Zeiss | Carl Zeiss Inc. | Zeiss / AxioTECH |
Riferimenti
- Sannigrahi, B., Sil, D. Synthesis and Characterization of α,ω-bi[2,4-dinitrophenyl (DNP)] poly(2-methoxystyrene) Functional Polymers. Preliminary Evaluation of the Interaction of the Functional Polymers with RBL Mast Cells. Journal of Macromolecular Science, Part A. 45, 664-671 (2008).
- Gordon, K., Sannigrahi, B. Synthesis of Optically Active Helical Poly(2-methoxystyrene). Enhancement of HeLa and Osteoblast Cell Growth on Optically Active Helical Poly(2-methoxystyrene) Surfaces. Journal of Biomaterials Science. 2, 2055-2072 (2009).
- Baird, E. J., Holowka, D. Highly Effective Poly(Ethylene Glycol) Architectures for Specific Inhibition of Immune Receptor Activation. Biochemistry. 2, 12739-12748 (2003).
- Ramakrisna, S., Fugihara, K., Lim, W. -. E., Ma, Z. . Introductions to Electrospinning and Nanofibers. , (2005).
- Kameoka, J., Craighead, H. G. Fabrication of Oriented Polymeric Nanofibers on Planar Surfaces by Electrospinning. Applied Physics Letters. 83, 371-3773 (2003).
- Ramakrishna, S., Lala, N. L. Polymer Nanofibers for Biosensor Applications. Topics in Applied Physics. 109, 377-392 (2007).
- Reuven, D., Sil, D. Archetypical Conductive Polymer Structure for Specific Interaction with Proteins. Journal of Macromolecular Science Part A: Pure and Applied Chemistry. , (2012).
- Ogunro, O., Karunwi, K. Chiral Asymmetry of Helical Polymer Nanowire. The Journal of Physical Chemistry Letters. 1, 704-707 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon