È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un saggio per permeabilità del neuroepitelio Zebrafish embrionali
In questo articolo
Riepilogo
Descriviamo un animale vivo misurazione quantitativa per tutta la permeabilità del cervello zebrafish embrionale. La tecnica analizza la capacità di mantenere fluido cerebrospinale e molecole di differenti pesi molecolari all'interno del lume del tubo neurale e quantifica loro movimento fuori dei ventricoli. Questo metodo è utile per determinare differenze di permeabilità epiteliale e maturazione durante lo sviluppo e la malattia.
Abstract
Il sistema ventricolare cerebrale è conservata tra vertebrati ed è composto da una serie di cavità interconnesse chiamati ventricoli cerebrali, che si formano durante le prime fasi di sviluppo del cervello e si mantengono per tutta la vita dell'animale. Il sistema ventricolare cerebrale si trova in vertebrati, e ventricoli svilupparsi dopo la formazione del tubo neurale, quando il lume centrale riempie di liquido cerebrospinale (CSF) 1,2. CSF è un liquido ricco di proteine, che è essenziale per il normale sviluppo del cervello e funzione 3-6.
In zebrafish, l'inflazione ventricolo del cervello inizia a circa 18 ore dopo la fecondazione (HPF), dopo che il tubo neurale è chiuso. Più processi sono associati con la formazione del cervello ventricolo, compresa la formazione di un neuroepitelio, formazione di giunzione a tenuta che regola la permeabilità e la produzione di CSF. Abbiamo mostrato che il Na, K-ATPasi è richiesto per gonfiaggio ventricolo cerebrale, impattando tutti questi processies 7,8, mentre la 5a claudina è necessario per la formazione di giunzione a tenuta 9. Inoltre, abbiamo dimostrato che "rilassamento" del neuroepitelio embrionale, attraverso l'inibizione della miosina, è connesso all'inflazione ventricolo cerebrale.
Per studiare la regolazione della permeabilità durante il gonfiaggio ventricolo cerebrale zebrafish, abbiamo sviluppato un colorante test ventricolare ritenzione. Questo metodo utilizza l'iniezione ventricolo del cervello in un embrione di zebrafish vivente, una tecnica già sviluppata nel nostro laboratorio 10, di etichettare fluorescente liquido cerebrospinale. Gli embrioni vengono poi ripresi nel corso del tempo come si muove il colorante fluorescente attraverso i ventricoli cerebrali e neuroepitelio. La distanza del fronte del colorante si allontana dal basale (non-luminale) lato del neuroepitelio nel tempo è quantificato ed è una misura della permeabilità neuroepiteliale (Figura 1). Osserviamo che i coloranti 70 kDa e piccoli si muoverà attraverso il neuroepitelio e può essere detected fuori del cervello zebrafish embrionale a 24 HPF (Figura 2).
Questo saggio ritenzione colorante può essere utilizzato per analizzare permeabilità neuroepiteliale in una varietà di differenti contesti genetici, in momenti diversi durante lo sviluppo, e dopo perturbazioni ambientali. Può anche essere utile per esaminare accumulo patologico di CSF. Nel complesso, questa tecnica consente agli investigatori di analizzare il ruolo e la regolazione della permeabilità durante lo sviluppo e la malattia.
Protocollo
1. Preparazione per Microiniezione
- Preparare aghi microiniezione tirando tubi capillari con Sutter estrattore ago strumenti.
- Carico ago microiniezione con colorante fluorescente (FITC-destrano).
- Montare ago su micromanipolatore e apparecchi microiniezione.
- Spezzare con cautela l'ago microiniezione con pinze a circa 2 micron di larghezza, tuttavia, questo può variare a seconda della configurazione microiniettore. Per i nostri aghi microiniezione, questo corrisponde alla prima regione dell'ago dalla punta che non si pieghi.
- Misurare la dimensione delle goccioline di olio, la regolazione del tempo di iniezione e la pressione, in modo che ogni iniezione eroga 1 nl. Impostazioni di esempio per Harvard Apparatus microiniettore sono: equilibrio P = 1,4 psi, P out = 1,4 psi, iniettare P = 22,9 psi, P = 67,8 psi chiare con un tempo di iniezione di 0,4-0,7 sec. Il diametro del nostro ago utilizzando queste impostazioni è di circa 2 micron. Tuttavia, le impostazioni saranno microiniettore specifici e varianoecondo l'ago di diametro.
2. Preparazione dei Embrioni
- Cappotto 2 piatti con 1% di agarosio in acqua per ogni condizione, fori curiosare in agarosio con una punta di pipetta 1-200 microlitri, e rimuovere i tappi di agarosio. Riempire i piatti con i media embrioni.
- Con le pinzette, embrioni dechorionate che sono 18 anni o più hpf allo stereomicroscopio. Gli embrioni si svolgono secondo Kimmel et al. 11.
- Trasferire gli embrioni dechorionated nel primo piatto rivestito di agarosio.
- Per anestetizzare embrioni, aggiungere tricaine (0,1 mg / ml) al piatto fino embrioni interrompe il movimento (fatta secondo Westerfield 12).
3. Iniettare i ventricoli cerebrali
- Embrioni Orient così che stai cercando al loro fianco dorsale mettendo la coda dell'embrione nel foro. Se la vostra micromanipolatore è sulla destra, quindi spostare l'embrione in modo che il prosencefalo è a sinistra e romboencefalo verso destra.
- Ago Situazione al wipunto dest del ventricolo rombencefalo.
- Attenzione forare lamiera del tetto del ventricolo romboencefalo assicurandosi di non passare attraverso la profondità del cervello nel tuorlo (Figura 1A).
- Iniettare 1-2 nl di colorante fluorescente nei ventricoli assicurandosi che il colorante riempie l'intera lunghezza dei ventricoli cerebrali.
- Trasferire gli embrioni al secondo piatto agarosio rivestita riempito con i media embrioni e ri-anestetizzare, come descritto al punto 2.4.
- Immediatamente iniziare imaging, come descritto nella sezione 4 per ottenere una immagine tempo zero.
4. Imaging
- Embrioni Orient con la coda nel buco, come descritto al punto 3.1.
- Utilizzare un microscopio da dissezione con la luce sia trasmessa e fluorescenza permette di registrare un'immagine dorsale campo chiaro. Mantenere l'ingrandimento costante tra immagini di embrioni differenti. In questo modo per un confronto diretto di analisi eseguite con Image J (5,2-6).
- Senza spostare il, microscopio embrione o un piatto, prendere uncorrispondente immagine fluorescente.
- Ripetere l'operazione per ogni embrione in momenti desiderati.
5. Quantificazione del Movimento Dye
- Unire chiaro e immagini fluorescenti in Photoshop come precedentemente descritto da Gutzman e Sive 10.
- Misurare la distanza si muove fronte del colorante in software Image J disponibili http://rsbweb.nih.gov/ij/ .
- Apri il file unito in J Immagine e utilizzare lo strumento Linea per disegnare una linea dal prosencefalo cerniera-point per tingere frontale con un angolo di 10-20 ° da neuroepitelio (Figura 1A). Questa regione è stata scelta perché è sul primo e più evidente di colorante fuoriuscita del neuroepitelio tipo selvatico.
- Selezionare lo strumento di misurazione per calcolare la lunghezza della linea.
- Ripetere per ogni time-point.
- Calcolare distanza netta il fronte del colorante spostato nel tempo sottraendo distanza per t = 0 da altri punti temporali.
- Tracciate sugrafico.
6. Risultati rappresentativi
Un esempio dei risultati ottenuti in un saggio di permeabilità neuroepiteliale utilizzando embrioni di tipo selvatico è mostrata in Figura 1B-D. Per differenziare accuratamente permeabilità, è utile per testare con coloranti diversi weightsto molecolare identificare una dimensione che è solo leggermente permeabile nel tipo selvatico o embrioni di controllo (Figura 2). Questo permette l'identificazione di mutanti genetici o condizioni ambientali che aumentare o diminuire la permeabilità (Figura 1D, linee verde e rosso rispettivamente). Per il neuroepitelio 24 HPF zebrafish, 70 kDa FITC perdite Destrano lentamente nel corso di 2 ore, mentre 2.000 kDa non e 10 kDa quasi subito perdite fuori. Quindi 70 kDa è il peso ideale molecolare per identificare le condizioni che aumentano e diminuiscono la permeabilità neuroepiteliale.
Se l'ago non trova la lume ventricolare, fluorescenza wmalato apparire al di fuori del cervello per t = 0 (per un esempio vedere Gutzman e Sive, 2009 10). Questi embrioni dovrebbero essere scartata poiché il colorante non è stato iniettato inizialmente contenuta all'interno del cervello e nessuna conclusione chiara riguardo movimento del colorante e la permeabilità della neuropeithelium può essere fatto.
Infine, se gli embrioni hanno ventricoli piccoli o non gonfiati ventricoli cerebrali, pre-iniezione di ventricoli con una soluzione salina può essere fatto prima della iniezione del colorante fluorescente. Questo gonfia i ventricoli che fanno successiva visualizzazione dei ventricoli più facile quando si inietta con il colorante fluorescente. Opportuni controlli devono essere eseguiti per determinare se l'iniezione di soluzione salina sconvolge il normale sviluppo del tubo neurale.
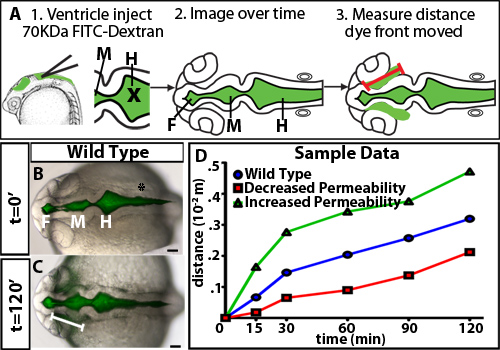
Figura 1. Naturalmente il tempo di diversi coloranti peso molecolare. (A) Diagramma sperimentale. Prima, Colorante fluorescente viene iniettato nei ventricoli. X = posizione di ago per l'iniezione. Successivo immagini dorsali vengono acquisite nel corso del tempo. Infine, la distanza percorsa dal fronte del colorante del proencefalo viene misurata cerniera-point (rappresentata da una linea rossa). (BC) Fusione chiaro e fluorescenti immagini dorsali a 22 HPF (t = 0 min, B) e 24 HPF (t = 120 min, C). Linea bianca indica la distanza del fronte del colorante dal ventricolo proencefalo. (D) di dati ipotetici permeabilità del campione. Blu = tipo selvaggio o di controlli, rosso = campione con permeabilità ridotta rispetto al controllo, e il verde del campione = con aumento della permeabilità rispetto al controllo.
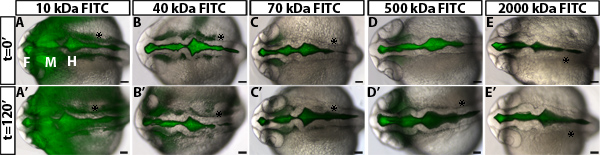
Figura 2. La misura della permeabilità neuroepiteliale a diversi coloranti peso molecolare. (AE) brightfield dorsale dalla fusione e immagini fluorescenti di 22 embrioni di tipo HPF selvatico al tempo t = 0 min dopo l'iniezione con FITC-dExtran dei pesi molecolari seguenti: 10 kDa (A), 40 kDa (B), 70 kDa (C), 500 kDa (D) e (E 2000 kDa). (A'-E ') stesso embrione come in (AE) a t = 120 minuti a 24 HPF. Anteriore a sinistra. F = proencefalo, M = mesencefalo, H = rombencefalo. Asterisk = orecchio.
Discussione
Abbiamo dimostrato la capacità di quantificare permeabilità del cervello vivente zebrafish embrionale come determinato per un colorante iniettato di un dato peso molecolare. Nostra osservazione che neuroepitelio zebrafish embrionale è differenzialmente permeabile ai coloranti di differente peso molecolare suggerisce che il colorante si muove attraverso permeabilità paracellulare. Tuttavia, non si può escludere la possibilità di un contributo transcellulare alla permeabilità osservato. Questa tecnica può essere a...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institute for Mental Health, e la National Science Foundation. Un ringraziamento speciale ai membri di laboratorio esclusivo per molte utili discussioni e critiche costruttive, e per Olivier Paugois per la zootecnia, esperto di pesce.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
| Destrano, fluoresceina, anionico, Lisina fissabile | Invitrogen | D7136, D7137, D1822, D1820, D1845 | |
| Tricaine polvere | Sigma | A5040 | |
| Tubi capillari | FHC Inc. | 30-30-1 |
Riferimenti
- Harrington, M. J., Hong, E., Brewster, R. Comparative analysis of neurulation: first impressions do not count. Mol. Reprod. Dev. 76, 954-965 (2009).
- Lowery, L. A., Sive, H. Strategies of vertebrate neurulation and a re-evaluation of teleost neural tube formation. Mech. Dev. 121, 1189-1197 (2004).
- Salehi, Z., Mashayekhi, F. The role of cerebrospinal fluid on neural cell survival in the developing chick cerebral cortex: an in vivo study. Eur. J. Neurol. 13, 760-764 (2006).
- Martin, C. Early embryonic brain development in rats requires the trophic influence of cerebrospinal fluid. Int. J. Dev. Neurosci. 27, 733-740 (2009).
- Lehtinen, M. K. The cerebrospinal fluid provides a proliferative niche for neural progenitor cells. Neuron. 69, 893-905 (2011).
- Gato, A. Embryonic cerebrospinal fluid regulates neuroepithelial survival, proliferation, and neurogenesis in chick embryos. Anat. Rec. A. Discov. Mol. Cell Evol. Biol. 284, 475-484 (2005).
- Lowery, L. A., Sive, H. Totally tubular: the mystery behind function and origin of the brain ventricular system. Bioessays. 31, 446-458 (2009).
- Lowery, L. A., Sive, H. Initial formation of zebrafish brain ventricles occurs independently of circulation and requires the nagie oko and snakehead/atp1a1a.1 gene products. Development. 132, 2057-2067 (2005).
- Zhang, J. Establishment of a neuroepithelial barrier by Claudin5a is essential for zebrafish brain ventricular lumen expansion. Proc. Natl. Acad. Sci. U.S.A. 107, 1425-1430 (2010).
- Gutzman, J. H., Sive, H. Zebrafish brain ventricle injection. J. Vis. Exp. , (2009).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev. Dyn. 203, 253-310 (1995).
- Westerfield, M., Sprague, J., Doerry, E., Douglas, S., Grp, Z. The Zebrafish Information Network (ZFIN): a resource for genetic, genomic and developmental research. Nucleic Acids Research. 29, 87-90 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon