Method Article
High Throughput sequenziale ELISA per la convalida dei biomarcatori di acuta Graft-versus-host disease
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Convalida elevato throughput di biomarcatori candidati multipli può essere eseguita da ELISA sequenziale per minimizzare gelo / disgelo e l'uso di campioni di plasma preziosi. Qui, dimostriamo come eseguire in sequenza ELISA per sei diversi biomarcatori plasmatici convalidati 1-3 Di graft-versus-host disease (GVHD) 4 Il campione di plasma stesso.
Abstract
Consigli proteomica scoperta strategie hanno la possibilità di identificare un gran numero di nuovi biomarker in grado di migliorare i test diagnostici e prognostici in ambito clinico e può aiutare a interventi terapeutici guida. Se la quantità di proteine candidate sono identificati, può essere difficile per validare biomarcatori candidati in modo tempestivo ed efficace da campioni di plasma di pazienti che sono event-driven, di volume finito e insostituibili, come all'inizio della acute graft-versus- host disease (GVHD), una complicazione potenzialmente pericolosa per la vita del trapianto allogenico di cellule staminali ematopoietiche (HSCT).
Qui si descrive il processo di esecuzione ELISA commercialmente disponibili per sei proteine convalidati GVHD: IL-2Rα 5, TNFR1 6, 7 HGF, IL-8 8, elafin 2, e REG3α 3 (noto anche come PAP1) in modo sequenziale per minimizzare cicli gelo-disgelo, Scongelati plasma nel tempo e l'utilizzo di plasma. Per questa procedura si eseguire i test ELISA in ordine sequenziale come determinato dal fattore di diluizione del campione, come stabilito nel nostro laboratorio utilizzando quelle kit ELISA e protocolli con piccole modifiche per facilitare ottimali prestazioni sequenziali ELISA. I risultanti concentrazioni plasmatiche di biomarker possono essere raccolti e analizzati per i dati significativi emersi all'interno di una coorte di pazienti. Mentre questi biomarcatori sono attualmente per scopi di ricerca, il loro inserimento nella cura clinica è attualmente in fase di studio in studi clinici.
Questa tecnica può essere applicata per eseguire saggi ELISA per proteine / citochine multiple di interesse sullo stesso campione (s) fornito i campioni non devono essere miscelati con altri reagenti. Se kit ELISA non sono dotati di pre-rivestite piastre a 96 pozzetti mezzo pozzetti o 384 pozzetti può essere utilizzato per ridurre ulteriormente l'uso di campioni / reagenti.
Introduzione
Acute graft-versus-host disease (GVHD), una delle principali cause di mortalità senza ricadute (NRM) dopo trapianto allogenico di cellule staminali ematopoietiche (HSCT), viene misurata da una disfunzione in tre organi: la pelle, il fegato e gastrointestinali (GI) tratto 4. GVHD acuta si verifica in genere tra due e otto settimane dopo il trapianto, ma si può verificare in seguito, e spesso è clinicamente indistinguibile da altre post-HSCT complicanze quali la tossicità regime di condizionamento, infezioni o effetti collaterali dei farmaci. Attraverso l'uso di strategie di proteomica e di high-throughput di convalida utilizzando sequenziale ELISA, abbiamo identificato 6 proteine la cui concentrazione sono elevate al momento della comparsa di manifestazioni cliniche di GVHD. IL-2Rα, TNFR1, HGF e IL-8, quando combinati in un 4-biomarker pannello può diagnosticare GVHD al momento della comparsa dei sintomi clinici e può prevedere post-trapianto sopravvivenza indipendentemente gravità GVHD 1. Elafin, un biomarker per GVHD della skin, in grado di discriminare tra eruzione GVHD e rash da altre cause, come eruzioni da farmaci e possono predire la sopravvivenza dei trapianti 2. Abbiamo recentemente identificato REG3α come biomarker di GVHD del tratto gastrointestinale inferiore, l'organo bersaglio più associato con NRM. La concentrazione plasmatica di REG3α può identificare in modo affidabile GVHD come la causa per il post-trapianto diarrea e correlati alla gravità istologica di GVHD in diagnostici biopsie intestinali. Concentrazioni REG3α all'esordio GI GVHD può anche prevedere la risposta alla terapia e GVHD NRM 3. L'integrazione di questi biomarcatori convalidati GVHD in cura clinica è attualmente in fase di studio in studi clinici.
Questi esperimenti sono stati eseguiti su piccole aliquote di plasma raccolti da pazienti sottoposti a trapianto tra il 2000 e il 2010, al momento di insorgenza GVHD che sono insostituibili e di quantità limitata. A causa della natura preziosa di questi campioni, abbiamo sviluppato un method di misurare concentrazioni di proteine plasmatiche più in modo efficiente e riproducibile per eliminare eccesso di cicli gelo-disgelo, il tempo di scongelamento e l'utilizzo del plasma. Questa tecnica può essere applicata per eseguire saggi ELISA per proteine / citochine multiple di interesse sullo stesso campione (s) fornito i campioni non devono essere miscelati con altri reagenti. Se kit ELISA non sono dotati di pre-rivestite piastre a 96 pozzetti mezzo pozzetti o 384 pozzetti può essere utilizzato per ridurre ulteriormente l'uso di campioni / reagenti. Questo manoscritto si concentra sugli aspetti tecnologici di misurazione biomarcatori GVHD.
Protocollo
1. Esperimento Giorno 0: Preparazione del campione e rivestimento di test ELISA Piastra con Anticorpo di cattura per IL-2Rα, REG3α e HGF
- Aliquote di campioni di plasma da analizzare viene tirato, scongelati e centrifugato a 12.000 rpm per 10 minuti per separare i coaguli in basso e lipidi sopra dal plasma. 150 pl di plasma non diluito saranno piastrate da ciascun campione su un 96-ben-V piastra inferiore (piastra sorgente) pipettando manuale secondo mappe predefinite. Le aliquote saranno avvolti in parafilm e mantenute in una camera umida a 4 ° C durante l'intero processo, non più di 72 ore.
- IL-2Rα e anticorpi di cattura HGF sarà ricostituito e diluito specifiche del costruttore e 50 pl saranno piastrate in ciascun pozzetto di rispettivi 96 pozzetti alta binding mezzo pozzetti quali vengono sigillati ed incubate per una notte a 4 ° C. In alternativa, le piastre possono essere molti essiccato a 37 ° C e conservato a 4 ° C per un uso successivo, dipendonozione sulla stabilità della proteina.
- Anticorpo di cattura REG3α sarà diluito secondo il protocollo del produttore utilizzando un tampone di rivestimento fabbricante e 25 pl saranno piastrate in ciascun pozzetto di una a 384 pozzetti Nunc Maxi-Sorp piastra che viene quindi sigillato e incubate per una notte a 4 ° C.
2. Esperimento Giorno 1: IL-2Rα ELISA (Figura 1)
- L'IL-2Rα targa di prova viene lavata, bloccata con Blotto in TBS, e lo standard è ricostituito e un 8-punto della curva standard viene preparata protocollo del produttore.
- Dopo lavaggio della piastra dopo la fase di bloccaggio, 50 microlitri di plasma non diluito è placcato in duplicato dalla piastra sorgente alla piastra test ELISA, e 50 pl di ciascuno standard è placcato in duplicato. La piastrina è sigillata e incubata per 2 ore a temperatura ambiente su un rotatore piastra fissata a 300 rpm.
- Il plasma viene recuperato dalla IL-2Rα piastra test ELISA e rimesso nelle Nazioni Unitediluito fonte piastra plasma. L'ELISA è completato da protocollo produttore (con volumi regolate per mezzo pozzetti) e la densità ottica di ciascun pozzetto sarà letto utilizzando un lettore di piastre insieme a 450-570 nm, ed i dati memorizzati e analizzati.
3. Esperimento 1 ° giorno: REG3α ELISA (Figura 1)
- 10 microlitri di plasma non diluito viene trasferito in un separato v-bottom piastra sorgente. 90 microlitri di tampone fornito dal produttore di diluizione viene aggiunto a ciascun pozzetto per creare una piastra sorgente diluizione 1:10.
- L'ELISA REG3α viene eseguita per protocollo del produttore (con volumi regolato per piastre a 384 pozzetti) e la densità ottica di ciascun pozzetto sarà letto utilizzando un lettore di piastre impostato a 450-620 nm, ed i dati vengono memorizzati e analizzati.
4. Esperimento 1 ° giorno: Elafin e rivestimento di prova TNFR1 Piastra con Anticorpo di cattura
- Elafin e anticorpi di cattura TNFR1 sarà ricostituito e dilbuite per specifiche del costruttore e 50 microlitri si piastrate in ciascun pozzetto di rispettivi 96 pozzetti alta binding mezzo pozzetti quali vengono sigillati e incubate per una notte a temperatura ambiente per Elafin, ed a 4 ° C per TNFR1.
5. Esperimento Giorno 1-2: HGF ELISA (Figura 1)
- Dopo aver completato l'IL-2Rα ELISA e assicurando la prova non ha bisogno di essere ripetuto, 60 microlitri di plasma non diluito viene trasferito in una nuova piastra sorgente e poi 60 ml di 1% BSA in PBS 1 x viene aggiunto a ciascun pozzetto per fare una 01:02 diluito plasma piatto di origine.
- La piastra di prova HGF viene lavata, bloccata con Blotto in TBS, e lo standard è ricostituito e un 8-punto della curva standard viene preparata protocollo del produttore.
- Dopo aver lavato la piastra dopo la fase di blocco, 50 pl di 1:2 plasma diluito è placcato in doppio con il piatto test ELISA, e 50 ml di ogni standard è placcato in duplice copia. La piastra è sigillato eincubate per una notte a temperatura ambiente su un rotatore piastra impostata a 300 RPM.
- Il plasma diluito 1:02 venga recuperato dalla piastra HGF test ELISA e rimesso nel piatto 1:02 diluito fonte di plasma. L'ELISA è completato da protocollo produttore (con volumi regolate per mezzo pozzetti) e la densità ottica di ciascun pozzetto sarà letto utilizzando un lettore di piastre insieme a 450-570 nm, ed i dati memorizzati e analizzati.
6. Esperimento 2 ° giorno: Elafin ELISA
- 10 microlitri di plasma non diluito viene trasferito in una nuova piastra sorgente e quindi 190 ml di 1% BSA in PBS 1 x viene aggiunto a ciascun pozzetto per fare 200 pl di plasma dluted 1:20.
- L'ELISA Elafin come eseguita secondo il protocollo del produttore (con volumi regolato per mezzo pozzetti), e la densità ottica di ciascun pozzetto sarà letto utilizzando un lettore di piastre impostato a 450-570 nm, ed i dati memorizzati e analizzati.
7. Esperimento Day 2: TNFR1 ELISA
- 25 pl di 1% BSA in PBS viene aggiunto alla piastra sorgente 1:20 (ora contenente 100 pl di plasma 1:20) per ottenere 125 ml di plasma diluito 1:25.
- L'ELISA TNFR1 è completato da protocollo produttore (con volumi regolate per mezzo pozzetti) e la densità ottica di ciascun pozzetto sarà letto utilizzando un lettore di piastre impostato a 450-570 nm, ed i dati memorizzati e analizzati.
8. Esperimento 2 ° giorno: IL-8 ELISA
- 60 pl di plasma diluito 1:02 sarà trasferito in una nuova piastra sorgente e quindi 180 ml di IL-8 diluente viene aggiunto a ciascun pozzetto per fare un 1:06 diluito piastra sorgente plasma.
- L'IL-8 ELISA è completato da protocollo produttore (con volumi regolate per mezzo pozzetti) e la densità ottica di ciascun pozzetto sarà letto utilizzando un lettore di piastre impostato a 450-570 nm, ed i dati memorizzati e analizzati.
Una volta che tutti i saggi ELISA sono stati completati, disusod magazzino plasma sarà sostituito nelle aliquote scongelati e congelati per un uso futuro.
Risultati
Il flusso di lavoro biomarker e tempi indicati nella Tabella 1 e Tabella 2, rispettivamente. Una volta completato, le concentrazioni di 6 diverse proteine sono state quantificate sullo stesso campione di plasma utilizzando un totale di 150 ml di plasma. Placcatura i campioni in duplicato per test consente di assicurazione interna della qualità, con il CV inferiore al 10% è ottimale. Per una esecuzione sequenziale ELISA su piatti più consistenti, densità ottica dello standard elevato sono preferiti e permette una migliore inter-piastra affidabilità delle misurazioni; curva standard OD può essere paragonato a cercare tra le piastre di valutare per incoerenza ELISA prestazioni (Figura 2). Tempi di sviluppo utilizzando tetrametilbenzidina substrato colorimetrico e alta concentrazione di OD osservato per ciascun biomarker nel nostro laboratorio sono elencati nella Tabella 3.
tp_upload/4247/4247fig1.jpg "alt =" Figura 1 "/>
Figura 1. Flusso di lavoro per IL-2Rα, REG3α e HGF ELISA. Dopo che i campioni di plasma sono stati placcati sulle IL-2Rα targhe di prova ELISA che venga recuperato per fare piastre fonte di diluizione per l'ELISA altri. Per l'ELISA HGF, il plasma viene recuperato per preparare la piastra di diluizione 1:06 per IL-8. Clicca qui per ingrandire la figura .
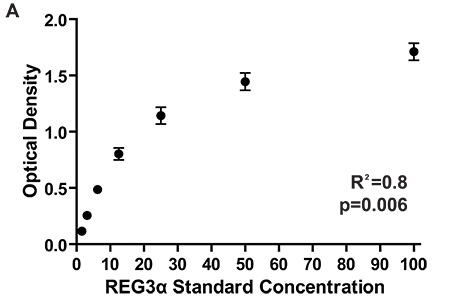
Figura 2. Densità ottiche per la curva standard di 7 piatti diversi ELISA misura concentrazioni REG3α corrispondenti ai 1084 pazienti testati per il primo biomarcatore REG3α GI relazione GVHD 3. DO coerente tra le piastre assicurare coerenti e proteine di concentrazione tra le piastre. Le concentrazioni di proteinein campioni di plasma sono determinati confrontando densità ottica del campione per le densità ottiche della curva standard.
| Esperimento Giorno 0 | 1. Preparare i campioni |
| 2. IL-2Rα, HGF e REG3α cattura Ab | |
| Esperimento 1 ° giorno | 1. IL-2RαELISA |
| 2. REG3αELISA | |
| 3. HGF ELISA (attraverso placcatura campione) | |
| 4. Elafin e TNFR cattura Ab | |
| Esperimento 2 ° giorno | 1. HGF ELISA completamento |
| 2. Elafin ELISA | |
| 3. TNFR1 ELISA | |
| 4. IL-8 ELISA | |
| 5. Ricongelare inutilizzatoplasma |
Tabella 1. GVHD Biomarker Panoramica del flusso di lavoro
| Giorno 0 | Preparazione del campione e pernottamento incubazione corpo cattura | ||||||
| ELISA | IL-2Rα | REG3α | HGF | Elafin | TNFR1 | IL-8 | |
| Tempo (h) | 0,0 | Blocco | |||||
| 1,0 | Campioni argentati, dorati | ||||||
| 3,0 | Reclaim campioni di plasma; rilevamento Ab | Blocco; Preparare i campioni (diluizione 1:10) | |||||
| 4.0 | I campioni placcati (1:10) | ||||||
| 5.0 | Streptavidina-HRP | Rilevamento Ab | |||||
| 5,5 | TMB | Streptavidina-HRP | |||||
| 6.0 | Piastra di lettura | TMB | Blocco; Preparare i campioni (1:2) | ||||
| 6,5 | Piastra di lettura | ||||||
| 7.0 | I campioni placcati (1:2) | Cattura Ab (incubazione per una notte) | Cattura Ab (incubazione per una notte) | ||||
| Giorno 2 | |||||||
| Tempo (h) | 0,0 | Reclaim plasma, rilevamento Ab | Blocco; Preparare i campioni (1:20) | ||||
| 1,0 | Esempio di placcatura (1:2) | Blocco, un'ulteriore diluizione di 1:20 campioni diluizione 1:25 | |||||
| 2,0 | HRP | Esempio di placcatura (1:25) | |||||
| 2,5 | TMB | ||||||
| 3,0 | Piastra di lettura | Rilevamento Ab | |||||
| 3,5 | Preparare campioni (diluizione 1:6) | ||||||
| 4.0 | Rilevamento Ab | Esempio di placcatura (1:6) | |||||
| 5.0 | HRP | ||||||
| 5,5 | TMB | ||||||
| 6.0 | Piastra di lettura | HRP | Rilevamento Ab | ||||
| TMB | |||||||
| 7.0 | Piastra di lettura | TMB | |||||
| 7,5 | Piastra lettura | ||||||
| Dopo il completamento | Sostituire plasma originario in aliquote e congelare per un uso successivo | ||||||
Tabella 2. Timeline per l'esecuzione di ELISA.
| Plasma Fattore di diluizione | Alta Concentrazione standard | Substrato Tempo di sviluppo (minuti) | Alta OD | Curva | |
| IL-2Rα | 01:01 | 2000 pg / ml | 5 | 1 | Lineare |
| HGF | 01:02 | 4000 pg / ml | 22 | 2,1 | 4-parametro |
| IL-8 | 01:06 | 200 pg / ml | 12 | 2,7 | 4-parametro |
| REG3α | 01:10 | 100 ng / ml | 12 | 1,7 | 4-parametro |
| Elafin | 01:20 | 2000 pg / ml | 20 | 1,9 | 4-parametro |
| TNFR1 | 01:25 | 800 pg / ml | 8 | 2,7 | Lineare |
Tabella 3. Dettagli ELISA per 6 Biomarcatori GVHD.
Discussione
Il metodo sequenziale ELISA qui presentato consente la misurazione delle proteine plasmatiche multiple su piccoli volumi di plasma che possono essere difficili da ottenere e / o insostituibili come campioni di soggetti umani con malattie rare o campioni di plasma ottenuti da topi 9,10. I test ELISA sequenziali sono tipicamente eseguite nell'ordine del fattore di diluizione del plasma aumentando, con ELISA richiedono plasma diluito ≥ 1:10 tipicamente non dover essere recuperato, anche se questo può essere fatto se desiderato. La possibilità di eseguire sequenziale ELISA è limitato dal kit ELISA / protocolli in cui si mischia il plasma con altri reagenti o per i quali tamponi diluizioni differenti sono necessari per il plasma, il che esclude la ablility di riutilizzare un campione a causa delle preoccupazioni che un incompatibili buffer / reagente interferire con le prestazioni di un determinato test. Un'attenta progettazione, 10 o più metodica ELISA può essere eseguita sul campione di plasma stesso.
ENT "> I singoli laboratori potrebbe essere necessario regolare diluizioni del plasma al fine di ottenere risultati interpretabili basati sulla concentrazione plasmatica attesi della proteina di interesse nei campioni da parte dei soggetti di prova. differenze di attrezzature di laboratorio può comportare la necessità di ottimizzare l'incubazione e lo sviluppo colorimetrico volte, numero di lavaggi e / o lavare ammollo volte al fine di ottimizzare qualsiasi dato ELISA.Per aumentare alta produttività e precisione e capacità di effettuare analisi in un modo economicamente vantaggioso, l'uso di una piattaforma di movimentazione robotica liquido capace di analisi su piastre a 384 pozzetti ed un lavatore automatico con unità di impilaggio sono raccomandati. Questo apparecchio può aumentare l'accuratezza e la precisione di analisi eseguite da più utenti, e contribuire a garantire la coerenza di analisi per ridurre le inter-e intra-saggio di variazione.
Abbiamo usato sequenziale ELISA su piattaforme multiplex disponibili per due motivi: 1) La maggior parte dellecoppie di anticorpi per nuove proteine non possono essere facilmente essere coniugati in perline o altro materiale così come lunga e costosa, 2) i singoli test ELISA sono più precisi di microarray multiplex o perline, secondaria ad una assenza di reattività crociata 11. Se un metodo affidabile viene stabilita effettuare multiplexati, bead-based microarrays, può essere in grado di sostituire il processo sequenziale ELISA, ma può essere limitata dalla capacità di coniugare gli anticorpi per perline e / o dal numero di proteine desiderate essere analizzato.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Supportato da sovvenzioni NIH RC1-HL-101102, P01-CA039542, T32-HL007622, la Fondazione Hartwell, e la Fondazione Doris Duke Charitable. Dr. Paczesny è un investigatore della Hartwell Eric fondo e il programma di ricerca Amy Strelzer Manasevit.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
| IL-2 R alpha DuoSet | R & D Systems | DY223 | |
| Umano HGF DuoSet | R & D Systems | DY294 | |
| Umano IL-8 OptEIA KIT II | Becton Dickinson | 550999 | |
| Ab-Match MONTAGGIO umana PAP1 (REG3α) Kit | MBL internazionale | 5323 | |
| Ab-Match kit universale | MBL internazionale | 5310 | |
| Umano sTNFRI/TNFRSF1A DuoSet | R & D Systems | DY225 | |
| Umano Trappin-2/Elafin DuoSet | R & S Syderiva | DY1747 | |
| 96 pozzetti in polistirene piastre inferiori coniche | Thermo Scientific | 249570 | Usata per piatti di origine plasmatica |
| CoStar mezza e alta vincolanti piastre da 96 pozzetti | Corning | 3690 | Per IL-2Rα, HGF, TNFR1 e elafin ELISA |
| 384 pozzetti Nunc MaxiSorp piastre | Nunc | 464718 | Per REG3α Elisa |
| HyClone Soluzione tampone fosfato, 1x | Thermo Scientific | SH30256.02 | |
| Sieroalbumina bovina, Frazione V, shock termico trattato | Fisher Scientific | BP1600-100 | |
| Blocker Blotto in TBS | Thermo Scientific | 37530 | Agente bloccante per IL-2Rα HGF e TNFR1 ELISA |
| DulbeccoPBS | Gibco | 21600-069 | Tampone di lavaggio per IL-2Rα, HGF, Elafin e TNFR1 ELISA |
| Perossido Susbtrate TMB | Kirkegaard e Laboratori Perry | 50-76-00 | |
| Tween 20 | Acros Organics | 233362500 | Tampone di lavaggio per IL-2Rα, HGF, Elafin e TNFR1 ELISA |
| Acido solforico | Sigma-Aldrich | 84720 | (Diluito a 2N) per la soluzione di stop |
Riferimenti
- Paczesny, S. A biomarker panel for acute graft-versus-host disease. Blood. 113, 273-278 (2009).
- Paczesny, S. Elafin is a biomarker of graft-versus-host disease of the skin. Science Translational Medicine. 2, 13ra12 (2010).
- Ferrara, J. L. Regenerating islet-derived 3 alpha is a biomarker of gastrointestinal graft-versus-host disease. Blood. , (2011).
- Ferrara, J. L., Levine, J. E., Reddy, P. Graft-versus-host disease. Lancet. 373, 1550-1561 (2009).
- Miyamoto, T. Serum concentration of the soluble interleukin-2 receptor for monitoring acute graft-versus-host disease. Bone Marrow Transpl. 17, 185-190 (1996).
- Holler, E. Role of tumor necrosis factor alpha in acute graft-versus-host disease and complications following allogeneic bone marrow transplantation. Transplant. Proc. 25, 1234-1236 (1993).
- Okamoto, T. Increased hepatocyte growth factor in serum in acute graft-versus-host disease. Bone Marrow Transpl. 28, 197-200 (2001).
- Uguccioni, M. Elevated interleukin-8 serum concentrations in beta-thalassemia and graft-versus-host disease. Blood. 81, 2252-2256 (1993).
- Osuchowski, M. F., Siddiqui, J., Copeland, S., Remick, D. G. Sequential ELISA to profile multiple cytokines from small volumes. J. Immunol. Methods. 302, 172-181 (2005).
- Osuchowski, M. F., Remick, D. G. The repetitive use of samples to measure multiple cytokines: the sequential ELISA. Methods. 38, 304-311 (2006).
- Schweitzer, B. Multiplexed protein profiling on microarrays by rolling-circle amplification. Nat. Biotechnol. 20, 359-365 (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon