Method Article
Ottimizzato Metodi di modellazione e colorazione proliferazione per il monitoraggio divisione cellulare utilizzando coloranti Tracking Cellulari
In questo articolo
Riepilogo
Il successo delle tinture di tracciamento cellulari per monitorare la funzione immunitaria e la proliferazione cellulare coinvolge diversi passaggi critici. Si descrivono metodi per: 1) ottenendo luminoso, uniforme, riproducibile etichetta-re con coloranti membrana; 2) selezionando fluorocromi e condizioni di acquisizione dati, e 3) la scelta di un modello per quantificare la proliferazione cellulare basata sulla diluizione colorante.
Abstract
Coloranti fluorescenti tracciamento cellulari, in combinazione con flusso e citometria immagine, sono potenti strumenti con cui studiare le interazioni ei destini di diversi tipi di cellule in vitro e in vivo. 1-5 Anche se ci sono letteralmente migliaia di pubblicazioni utilizzando questi coloranti, alcuni dei più comunemente riscontrate delle applicazioni di tracciamento cellulari include il monitoraggio di:
- stelo e cellule progenitrici quiescenza, la proliferazione e / o differenziazione 6-8
- antigen-driven trasferimento membrana 9 e / o la proliferazione di cellule precursori 3,4,10-18 e
- funzione immunitaria delle cellule di regolamentazione e effettore 1,18-21.
Disponibili in commercio coloranti tracciamento cellulari variano ampiamente nella loro composizione chimica e proprietà di fluorescenza, ma la caduta grande maggioranza in una delle due classi base al loro meccanismo di marcatura delle cellule. "Coloranti membrana", caratterizzato da PKH26, sono coloranti altamente lipofile tcappello partizione stabilmente ma non covalente nelle membrane cellulari 1,2,11. "Coloranti proteine", caratterizzata da CFSE, sono amino-reattivi coloranti che formano legami covalenti stabili con le proteine cellulari 4,16,18. Ogni classe ha i suoi vantaggi e limitazioni. La chiave per la loro corretta applicazione, in particolare negli studi multicolor in cui vengono utilizzati coloranti diversi per monitorare diversi tipi di cellule, è quindi quello di comprendere le criticità che consentono un uso ottimale di ogni classe 2-4,16,18,24.
I protocolli inclusi qui sottolineare tre cause più comuni di risultati mediocri o variabile durante l'uso delle cellule-tracking coloranti. Questi sono:
- Il mancato raggiungimento luminoso, uniforme, etichettatura riproducibile. Questo è un punto di partenza indispensabile per qualsiasi studio di monitoraggio delle cellule, ma richiede attenzione a diverse variabili quando si utilizza coloranti membrana di quando si usa coloranti proteine o reagenti equilibrio vincolanti come gli anticorpi.
- Ottimali combinazioni di fluorocromind / o mancata includere controlli di compensazione critici. Monitoraggio fluorescenza colorante è tipicamente 10 Febbraio - 10 marzo volte più luminoso di fluorescenza degli anticorpi. È pertanto indispensabile per verificare che la presenza di colorante tracciamento non compromette la possibilità di rilevare altre sonde utilizzate.
- Il mancato ottenimento di una buona misura con software di modellazione di picco. Tale software consente di confronto quantitativo delle risposte proliferative in diverse popolazioni o stimoli in base al numero precursore o altre metriche. Ottenere una buona misura, tuttavia, richiede l'esclusione di morti / cellule morenti che possono distorcere i profili di diluizione colorante e la congruenza delle ipotesi alla base del modello con le caratteristiche del profilo osservato diluizione colorante.
Esempi qui riportati illustrano come queste variabili possono influenzare risultati usando membrane e / o coloranti proteiche per monitorare la proliferazione cellulare.
Protocollo
1. Membrana Etichettatura generale con PKH26 Dye cellulare Tracking (Rif. 25, Figura 1)
- Utilizzare la tecnica sterile per i passaggi 1,1-1,9. Preparare ~ 10 7 cellule mononucleari del sangue periferico umano o linfociti (hPBMC, HPBL) usando il metodo standard del laboratorio con l'aggiunta di un ultimo giro 300 xg per minimizzare la contaminazione delle piastrine. Risospendere le cellule a 10 7 / ml di BSA in HBSS +1% e posto sul ghiaccio, riservando da 500 microlitri aliquota (5x10 6 cellule) per l'uso nella Fase 2.
- Luogo 5x10 6 celle (500 pl) in una da 12 x 75 millimetri tubo di polipropilene conica. Lavare una volta con 3,5 ml di HBSS. Aspirare accuratamente il supernatante, lasciando non più di 15-25 ml di liquido residuo, ma facendo attenzione a non rimuovere le cellule. La fiala per preparare una sospensione 2x cella nel passo 1,4.
- Durante la fase di lavaggio in cella 1,2, aggiungere 0,5 ml di veicolo diluente etichettatura C (dal kit PKH26GL) per un x 12 75 millimetri tubo di polipropilene conica. La fiala di preparazionesono una soluzione 2x PKH26 nel Passo 1,5.
- Aggiungere 0,5 ml di diluente veicolo etichettatura C al pellet lavato dal punto 1.2 e aspirare e dispensare 3-4 volte per ottenere una sospensione di cellule singole (2x cellule). Evitare la formazione di bolle e miscelazione eccessiva, che può ridurre la vitalità cellulare e di recupero.
- Subito dopo aver preparato la sospensione 2x cellulare al punto 1.4, preparare un 2x (4 mM) soluzione colorante con l'aggiunta di 2,0 ml di 1,0 mM PKH26 magazzino colorante in etanolo (dal kit PKH26GL) al tubo C diluente preparata al punto 1.3 e al vortice disperdere uniformemente.
- Subito dopo la preparazione della soluzione 2x colorante al punto 1.5, rapidamente pipettare la sospensione 2x cella da 1,4 passo nella soluzione colorante 2x e contemporaneamente aspirare e dispensare 3-4 volte per disperdere completamente le cellule nelle tinture Non:. Aggiungere 1,0 mM colorante direttamente alla cellule, versare cellule 2x 2x in colorante, oppure aggiungere celle a 2x 2x colorante mentre vortex. Perché colorazione è quasi istantaneo, tali metodi produrre menointensità uniformi rispetto al metodo consigliato (Figura 2).
- Dopo 1 minuto, aggiungere 1,0 ml di siero inattivato con il calore o BSA HBSS +5% per fermare l'assorbimento colorante all'interno della membrana cellulare. Il mancato utilizzo abbastanza proteine rischia la formazione di aggregati di colorante, che può pellet con cellule durante le fasi di lavaggio e causare etichettatura involontaria di altre cellule presenti in un esperimento. Se medio con calore siero inattivato al 10% (CM) o HBSS 1% BSA deve essere utilizzato come reagente di arresto, eseguire la colorazione in un tubo di polipropilene 15 ml conica e aggiungere almeno 5,0 ml di reagente di arresto per assicurare adsorbimento di tutti prive di personalità giuridica colorante.
- Centrifugare le cellule marcate per 5 min @ ~ 400 x g. Aspirare accuratamente il supernatante senza rimuovere le cellule. Lavare il pellet due volte con 4 ml di HBSS CM o BSA 1%, disperdendo il pellet ben prima recentrifugation. Per minimizzare riporto di colorante adsorbito sulle pareti del tubo e massimizzare l'efficacia del lavaggio, trasferire le cellule a un tubo di polipropilene fresco dopo la fiRST risospensione. Nota: le cellule colorate adeguatamente esporrà una tinta rosa distinto nel pellet.
- Risospendere il pellet di cellule in lavato 1,0% ml HBSS BSA +1. Contare le cellule, determinare il recupero delle cellule, e regolare il volume per dare una concentrazione finale di 10 7 / ml. Con aspirazione attento, il recupero delle cellule dovrebbe essere ≥ 85%. Se il recupero delle cellule è <70%, determinare la causa prima di procedere ulteriormente. Prelevare un'aliquota di 150 microlitri (1.5x10 6 celle) e posto in ghiaccio per l'uso al punto 2.
2. Preparazione dei controlli di configurazione dello strumento e del test (Tabella 1)
- Aliquotare 50 pl (5x10 5) di cellule non marcate dalla sospensione cellulare salvato nel passaggio 1,1 in ciascuna delle cinque 1,8 ml provette Eppendorf: 1, 3, 4, 5, e 7. Aliquotare 50 pl (5x10 5) di cellule PKH26 POS Passo 1,9 in ciascuna delle tre provette: 2, 6 e 8.
- Aggiungere 10 microlitri IgG blocco (100 mg / tubo di IgG, si veda la tabella dei reagenti) per Tubi 1-8e incubare per 10 min a temperatura ambiente (20-25 ° C).
- Aggiungere una quantità saturante dell'anticorpo (i) indicato nella Tabella 1 nelle provette 4, 5, 7, e 8 e incubare tutti i campioni (Tubi 1-8) per 30 min a temperatura ambiente e al riparo dalla luce.
- Aggiungere 1,5 ml di HBSS BSA 1% di tutti i campioni, il pellet per centrifugazione (5 min @ 400 xg) e lavare una volta con 1,5 ml di HBSS 1% BSA, con aspirazione attenzione per evitare perdita di cellule.
- Risospendere ogni campione in 500 ml di BSA HBSS +1%. Se necessario per i campioni da analizzare sul citometro, trasferire in un tubo da 12 x 75 mm in basso rotondo. Aggiungere 10 microlitri di 100 pg / ml 7-AAD giornaliera stock di lavoro (vedi tabella dei reagenti) Tubi a 3, 6, 7 e 8, come indicato nella tabella 1. Incubare in ghiaccio per 30 minuti prima di utilizzare nella configurazione di flusso citometro e verifica colorazione (Fase 3).
3. Configurazione portata Citometro e verifica colorazione
- Verificare che il flusso cytometer funziona correttamente, mediante procedure definite dal laboratorio per il controllo di qualità giornaliero. Verificare che i segnali possono essere prontamente individuato in ciascuna finestra spettrale da utilizzare, e che le risposte del rivelatore sono linearmente proporzionale alla intensità del segnale della finestra da utilizzare per il controllo della proliferazione 14.
- Acquisire FSC e SSC dati per tubo 1 utilizzando scale di visualizzazione lineari. Regolare l'amplificazione di ogni rivelatore in modo che la popolazione linfocitaria cade nel quadrante in basso a sinistra del diagramma a punti, non è fuori scala in entrambi i parametri, e non è interrotta a causa di soglia. Raccogliere dati ungated FSC e SSC per tutti i campioni in Piazza di 3,3-3,7.
- Acquisire dati per il tubo 1, senza utilizzare la compensazione del colore e scale di visualizzazione logaritmica per tutti e 4 rivelatori di fluorescenza. Regolare alta tensione ciascun sensore (HV) per posizionare l'autofluorescenza di linfociti non colorati sulla scala con pochi / nessun accumulo di cellule nel primo canale. Impostare un limite di analisi per ogni istogrammacorrispondente al più luminoso del 2% delle cellule non colorati.
- Utilizzo senza la compensazione del colore e le impostazioni HV con sede in Piazza di 3.2 e 3.3, l'acquisizione dei dati per il tubo 2, la raccolta FSC, SSC e segnali in tutti e 4 rivelatori di fluorescenza. Per il rivelatore utilizzato per monitorare PKH26 fluorescenza, verificare che tutte le cellule PKH26 pos appaiono su scala come picco singolo simmetrica nella decade 3 ° -4 °, con poche cellule / no l'ultimo canale. Se ci sono più picchi o la forma del picco è inclinata, ripetere il passaggio 1 con particolare attenzione al sale minimizzazione e la tecnica di miscelazione (Figura 2). Se necessario, regolare concentrazione di colorante.
- Utilizzo delle impostazioni stabilite al punto 3.3, l'acquisizione dei dati per il tubo 3, la raccolta di FSC, SSC e segnali in tutti e 4 rivelatori di fluorescenza. Per il rivelatore utilizzato per monitorare 7-AAD fluorescenza, verificare che 7-AAD cellule pos cadere al di sopra del limite del 2% stabilito al punto 3.3 (vale a dire, che non vitali delle cellule sono ben risoltivitali da 7-AAD cellule neg).
- Utilizzo delle impostazioni stabilite al punto 3.3, l'acquisizione dei dati per il tubo 4, la raccolta di FSC, SSC e segnali in tutti e 4 rivelatori di fluorescenza. Verificare che le cellule CD8 pos sono ben risolti da cellule non marcate (ad esempio, caduta sopra il limite del 2% stabilito al punto 3.3 per il rivelatore FITC). Ripetere con tubo 5 e verificare che le cellule CD8 pos sono ben risolti da cellule non marcate (ad esempio caduta sopra il limite del 2% stabilito al punto 3.3 per il rivelatore APC).
- Impostazioni con sede in Fase 3.3, acquisire dati per i tubi 6, 7 e 8, raccogliendo FSC, SSC e segnali in tutte le quattro rivelatori di fluorescenza.
- Utilizzare i file di elenco in modalità raccolti per le provette 1-5 e il software di compensazione del colore per stabilire un colore si sovrappongono matrice per ogni fluorocromo nei rivelatori utilizzati per monitorare i tre fluorocromi altri. Applicare questa matrice al file di elenco modalità per Campione 6 e verificare che la presenza di PKH26 labEling non altera la capacità di individuare 7-AAD cellule pos.
- Applicare il colore si sovrappongono matrice dal punto 3.8 a il file elenco modalità di Campione 7 e verificare che: a) 3 sottopopolazioni ben risolte (CD3 CD4, CD3 neg neg pos neg CD4 e CD3 CD4 pos pos) possono essere identificati su un FITC vs APC dot plot, e b) la presenza di anticorpi anti-CD3-FITC e anti-CD4-APC non altera la capacità di individuare 7-AAD cellule pos. Se la presenza di anticorpi anti-CD3-FITC altera il limite superiore al 2% per i dati raccolti sul rivelatore PKH26, regolare il confine come richiesto.
- Applicare la matrice colore sovrapposizione dal punto 3.8 a il file elenco modalità di Campione 8. Se la presenza di PKH26 etichettatura altera il limite del 2% per il FITC, 7-AAD o rivelatori di APC da quelle impostate utilizzando il controllo autofluorescenza al punto 3.3, regolare di nuovo il confine (i) in base alle esigenze utilizzando Tube 7 della tabella 1 e verificare che È ancora possibile distinguish CD3 CD4 pos pos, pos CD3 CD4 neg, CD3 e CD4 neg neg cellule utilizzando il limite impostato (i).
4. Proliferazione Selezione del modello per il monitoraggio cellulare Divisione mediante diluizione Dye
- Determinare la spaziatura tra le generazioni, che dipende dal numero di canali e decenni logaritmiche sul citometro. Per gli strumenti digitali, questo valore, tipicamente 4 o 5 decenni, è determinato dal numero di bidoni nel processore di segnale digitale. Negli strumenti analogici, dove il numero di decenni, è raramente un numero intero, la modellazione accurata richiede il numero preciso di decenni per essere determinati sperimentalmente. Per fare questo, i dati da una miscela di grani calibrati fluorescenti con quelle-assegnate relative intensità viene acquisito le stesse impostazioni del rivelatore ad alta tensione utilizzati nell'esperimento. La posizione dei picchi tallone consente la calibrazione della scala logaritmica in termini di intCampo ensity per decade logaritmica. Specificamente, questo viene fatto disegnando il numero di canale per ogni tipo di tallone contro il registro del produttore-valore assegnato. La pendenza di un best-fit linea retta per i valori dei dati tallone dà il numero di unità di intensità relative per canale. Moltiplicato per il numero di canali, questo valore è quindi il numero di decenni di registro per il fondo scala, da cui il numero dei canali corrispondenti a una duplice riduzione dell'intensità (cioè, la spaziatura generazione figlia) può essere calcolato 14.
- Decidere se utilizzare una distanza fissa tra le generazioni o per consentire la spaziatura di galleggiare. A Standard (fisso) si avrà di utilizzare il valore di spaziatura generazionale determinato al punto 4.5 per assegnare la posizione di ogni generazione, e viene solitamente utilizzato quando l'istogramma manca picchi distinti. Un'impostazione galleggiante permette ad ogni posizione di picco generazionale deve essere determinato dalla forma dell'istogramma e viene in genere utilizzato quando distinguishablpicchi elettronici generazionali sono evidenti.
- Decidere se utilizzare una larghezza fissa di picco per tutte le generazioni o una larghezza variabile. Una larghezza fissa utilizza la SD calcolato per il campione di controllo non stimolato per modellare tutte le generazioni ed è di solito scelto quando il campione non ha distinguibili picchi generazionali. Una larghezza variabile consente al programma di variare indipendentemente l'SD per ogni generazione e viene utilizzato al meglio con distinguibili picchi generazionali.
- Eseguire un programma che contiene un modulo di analisi di proliferazione (qui ModFit LT versione 3.3). Caricare il file di pos PKH26 stimolato dal set di dati da analizzare (ad esempio, un stimolato 96 ore di cultura PKH26 cellule pos di contrasto come per tubo 8 della tabella 1).
- Selezionare i parametri per l'analisi, in questo caso PKH26 (585/42) con gate sui vitali (7-AAD neg) CD3 linfociti pos e FSC e SSC di escludere detriti piccoli e grandi aggregati (Figura 3). Nel definirequeste regioni attenzione per includere l'area ad alta dispersione in avanti, dove esplosioni sono tipicamente presenti e si noti che CD3 espressione può essere down-modulata in colture stimolate.
- Creare un nuovo modello di proliferazione utilizzando la procedura guidata proliferazione. Utilizzo del file Open Data (scheda Start), caricare il file di controllo non stimolato PKH26 pos e definire la posizione del canale di picco nella distribuzione dei genitori corrispondente alle cellule indivisi.
- Analizzare il file per il controllo non stimolato PKH26 pos, rilevando i valori di posizione di picco dei genitori e la larghezza (deviazione standard). Se una larghezza fissa di picco (SD) si desidera, selezionare Blocco SD.
- Caricare il neg PKH26 controllo (ad esempio, a 96 ore di coltura PKH26 cellule neg controcolorate come per Tube 7 in Tabella 1). Regolare il numero di generazioni impostando il canale di picco per la più debole generazione di sopra del neg PKH26 controllo. Questo determina il number delle generazioni figlie del modello può adattarsi con precisione ed è in genere 6-9 generazioni.
- Aprire il file di dati per il campione stimolata (ad esempio, un stimolato 96 ore di cultura PKH26 cellule pos di contrasto come per tubo 8 della tabella 1) e confermare che le regioni per la posizione di picco dei genitori e del SD di cui al punto 4,7 rimangono invariati. Se la spaziatura fissa generazionale si desidera, selezionare l'opzione Modello standard, altrimenti selezionare l'opzione mobile.
- Analizza ogni file sperimentale nel set di dati, utilizzando lo stesso modello definito al punto 4.9. Variare leggermente la posizione di picco dei genitori può essere necessario per la misura meglio definiti sia visivamente che dal ridotto chi quadrato (RCS) valore.
- Registrare i parametri desiderati proliferazione derivanti dal best-fit per ogni file sperimentale nel set di dati. Per una descrizione completa dei parametri possibili, vedere rif. 22.
Risultati
Coloranti a membrana come PKH26 macchia da quasi istantaneo suddivisione in membrane cellulari, piuttosto che per reazione chimica (per CFSE) o legame di equilibrio (per gli anticorpi). Mancanza di attenzione alle criticità illustrate nella figura 1 può provocare macchie dim o eterogenei del tipo mostrato in Figura 2. In contrasto, l'uso di condizioni di etichettatura ottimizzati (Figura 1, Tabella 2) risultati in distribuzioni luminose omogenei adatti per una varietà di applicazioni di tracciamento cellule compresi monitoraggio divisione cellulare basata sulla diluizione colorante (Figura 3). Le cellule morte / morenti perdere diverse quantità di colorante di monitoraggio, in grado di ampliare e / o inclinare intensità generazione figlia e complicare la proliferazione di modellazione basata su diluizione colorante 3,4,16,18. Uso di un colorante redditività raccomanda pertanto nella raccolta dei dati diluizione tintura in condizioni in cui un numero significativo di cellule morte possono essere preinviato, quali colture stimolate (Figura 3) o più campioni (Figura 4).
Poiché inseguimento etichettatura tintura dona tipicamente intensità di fluorescenza di diversi ordini di grandezza maggiore rispetto immunofenotipizzazione, è importante comprendere controlli compensazione adeguata (Tabella 1) e verificare che la presenza di inseguimento colorante non compromettere la capacità di risolvere cellule anticorpi positivi e negativi (Figura 4). Per evitare la necessità di compensazione colore eccessivo, è preferibile inserire un luminoso fluorocromo, o non è presente sulle cellule di interesse come un colorante esclusa da cellule vive, nel canale spettrale (s) adiacente al colorante tracciamento (Figura 4A e B vs. 4C & D). Quando si utilizza un software di modellazione di picco per quantificare misura della proliferazione, ottenendo una buona misura richiede ipotesi corrispondenti all'interno del modello alle caratteristiche del prof diluizione coloranteiles analizzati (Figura 5 e Tabella 3). Con un'opportuna scelta dei coloranti di rilevamento e reagenti vitalità, è anche possibile caratterizzare risposte proliferative in più sottopopolazioni linfocitarie simultaneamente. Per esempio, come illustrato in figura 6, l'aggiunta di un colorante di monitoraggio secondo semplifica discriminazione tra cellule T regolatorie (etichettati con Claret CellVue) e altamente proliferavano cellule T effettrici (marcato con CFSE) e fornisce maggiore dettaglio sulle loro interazioni che potrebbe essere ottenuto con 3 H-timidina etichettatura 18,27.
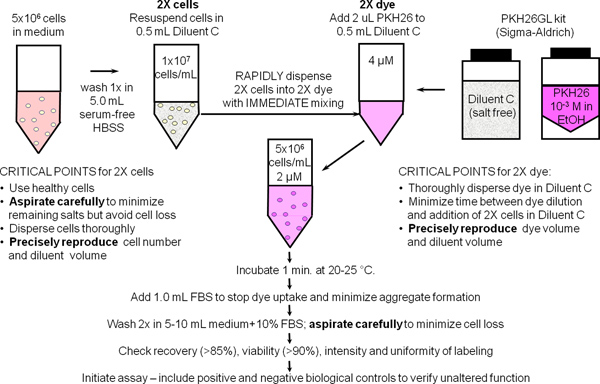
Figura 1. Protocollo generale di etichettatura a membrana per PKH26, PKH67 e coloranti CellVue. Partizionamento di questi coloranti altamente lipofile nel membra cellanes si verifica essenzialmente istantaneamente su di miscelazione con le cellule quando la colorazione viene effettuata in senza sale veicolo Diluente C fornito per massimizzare l'efficienza e la solubilità colorante colorazione. Come riassunto in questo schema di etichettatura membrana generale con PKH26, luminoso, colorazione uniforme e riproducibile è quindi più facilmente ottenuta con: 1) minimizzare la quantità di proteine e / o sali presenti nella fase di colorazione e 2) utilizzando una tecnica di miscelazione che assicura rapida dispersione omogenea di cellule in tintura (cioè, espone simultaneamente tutte le cellule alla stessa concentrazione di colorante).
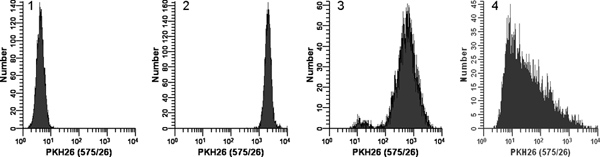
Figura 2. Effetto della colorazione condizioni PKH26 distribuzioni fluorescenza (ristampato dal rif. 18). Repliche dei campioni di crescita logaritmica, U colto937 cellule sono state colorate con PKH26 (concentrazioni finali: 1 x 10 7 cellule / ml, 12 - 15 um PKH26) per 3 minuti a temperatura ambiente, con o senza miscelazione immediato dopo l'aggiunta di cellule 2x a 2x colorante. Dopo il lavaggio, le cellule colorate sono state analizzate su un flusso Beckman Coulter citometro Ciano utilizzando le impostazioni dello strumento costante Istogramma 1:. Controllo senza macchia con PKH26 rilevatore di tensione regolata per mettere tutte le celle su scala nella prima decade con pochi / nessun accumulo di cellule nel primo canale. Istogramma 2: colorazione a 15 pM colorante con l'aggiunta di cellule 2x a 2x colorante con miscelazione immediata portato in un luminoso, colorato omogeneamente, simmetrica popolazione di cellule poste nella quarta decade, con pochi / senza le cellule si accumulano nel l'ultimo canale (gMFI = . 2548, gCV = 26,2%) Istogramma 3: colorazione a 15 pM colorante con l'aggiunta di cellule 2x a 2x colorante ma senza miscelazione immediatamente portato ad una intensità ridotta e una più ampia CV (gMFI = 505 , GCV = 116%) e una sottopopolazione debolmente colorato, forse a causa di un calo di cellule distribuiti sulla parete del tubo piuttosto che nella soluzione colorante 2x Istogramma 4:. Un errore di colorazione portato a 3 ml di concentrato colorante etanolica patrimonio che viene aggiunto direttamente a 2x cellule in C diluente senza ulteriore miscelazione invece di essere utilizzato per preparare una soluzione 2x colorante in Diluente C. Ciò ha determinato una concentrazione di colorante finale di 12 mM, ma ha dato una colorazione estremamente debole ed eterogeneo (gMFI = 32.9, gCV = 1.020%). Il diritto osservato inclinazione molto probabilmente riflette l'effetto combinato di: i) miscela scadente a causa di cellule anche molto diversi e volumi coloranti e ii) il fatto che le cellule più vicini al punto di erogazione colorante sarebbe esposto a una maggiore concentrazione di colorante rispetto a quelli più di distanza. Clicca qui per ingrandire la figura .
sull'articolo 3 "src =" / files/ftp_upload/4287/4287fig3.jpg "fo: content-width =" 4.5in "fo: src =" / files/ftp_upload/4287/4287fig3highres.jpg "/>
Figura 3. L'uso di una sonda vitalità semplifica gating di profili di proliferazione cellulare T hPBMC state marcate con PKH26 (concentrazione finale cella: 3x10 7 / ml, concentrazione finale colorante: 10 pM).. Dopo coltura per 96 ore in presenza (stimolato) o assenza (non stimolate) di anti-CD3 e IL-2, le cellule sono state colorate con anti-CD3-FITC, anti-CD19-APC e 7-AAD, e sono stati analizzati su una FACSCalibur citofluorimetro (vedi riferimento 13 per i dettagli). La compensazione del colore è stata eseguita al momento della acquisizione di dati tramite circuiti cablati compensazione. Il grado di proliferazione è stato modellato come descritto al punto 4 utilizzando la procedura guidata proliferazione in ModFit LT3.3. I dati del neg PKH26 di controllo (Tabella 1, Tubo 7) sono sovrapposti per riferimento (grigio istogrammi pieni nella colonna 3). Viabilità per non stimolata e sticulture formulata rispettivamente del 76% e il 62% (dati ungated per pannelli A e B, rispettivamente). Pannello A. PKH26 cellule colorate in coltura per 96 ore in mezzo sono stati gated per includere vitali (7-AAD neg) cellule CD3 pos (R1). Oltre all'inserimento anticorpo e 7-AAD morti cancello esclusione cella, un forward scatter (FSC) rispetto side scatter (SSC) gate (R2) è stato utilizzato per escludere detriti e aggregati. Si noti l'assenza di cellule morte della trama ultima in questo pannello. Il miglior modello adatto per il profilo PKH26 proliferazione (colonna 3) ha un picco singolo con RCS = 2,1 (Donor 6, Tabella 3), indicando buona simmetria, ed è stato utilizzato per definire la posizione di partenza parentale e ampiezza del picco per l'analisi del stimolato esempio da questo insieme di dati (Pannello B). Pannello B. Un'aliquota di replica PKH26 cellule marcate è stato coltivato con anti-CD3 e IL-2 per 96 ore e gated nello stesso modo come nel Pannello A. Un modello con posizione flottante picco e la larghezza del picco galleggiante dato la soluzione migliore per questi dati con RCS = 1,3 (Donor 6, Tabella 3). Pannello C. Lo stesso file di dati come nel Pannello A è stata analizzata senza l'uso di 7-AAD dati. Quando un primario FSC e SSC è stato utilizzato per escludere parzialmente le cellule morte ed aggregati (R2) e una porta secondaria per selezionare CD3 eventi positivi (R3), una piccola popolazione residua di cellule morte rimasto (0,2% di eventi gated). Il modello migliore vestibilità ha un unico picco con RCS = 2.2. Pannello D. Lo stesso file di dati come nel Pannello di B era recintato come nel Pannello di C. Nota la popolazione più grande residuo di cellule morte nel campione stimolato (1,29% di eventi gating) per questa strategia di gating. Il modello migliore vestibilità era uno con posizione flottante di picco e la larghezza di picco variabile (RCS = 1.3). Clicca qui per ingrandire la figura .
ig4.jpg "fo: content-width =" 5in "fo: src =" / files/ftp_upload/4287/4287fig4highres.jpg "/>
Figura 4. Effetto della scelta fluorocromo e concentrazione di colorante sulla capacità di linfociti immunofenotipo etichettati con PKH26. HPBMC stati isolati da 24-hr sangue vecchio e provviste PKH26 come descritto nella Fase 1, con l'eccezione che la colorazione è stata effettuata in 12 x 75 mm in basso rotondo provette di polistirene invece di 12 x 75 millimetri tubi di polipropilene coniche. Immediatamente dopo marcatura con PKH26, le cellule sono state colorate con i reagenti indicati immunofenotipiche e vitalità, ed analizzati su un citometro LSRFortessa utilizzando la strategia di gating della figura 3A e la seguente configurazione ottica: 488 nm laser: FSC-A (488 nm); SSC -A (488/10 BP), FITC-A (530/30 BP); PKH26-A (575/26 BP), 7-AAD-A o PerCP-A (695/40 BP). 640 nm laser: APC-A o TOPRO-3-A (670/14 BP). La compensazione del colore è stata eseguita al momento della acquisizione di dati tramite il software BD diva. "Auto"indica autofluorescenza del no-anticorpo di controllo nella relativa finestra spettrale (APC per i pannelli A e B, PerCP per pannelli C e D). I dati del neg PKH26 di controllo (Tabella 1, Tubo 7) sono sovrapposti per riferimento (grigio istogrammi pieni, colonna 5). Post-colorazione Viabilità erano simili per tutti i campioni (88-92%). Pannello Celle A. etichettati con PKH26 ad una concentrazione finale di 2 mM sono stati controcolorati con anti-CD3-FITC, anti-CD4-APC, e 7-AAD ( tubo 8 di Tabella 3). Dopo il gating vitali (7-AAD neg) CD3 linfociti pos (colonna 1) e l'esclusione di detriti e aggregazioni basate sulle FSC e SSC (vedi figura 3A), PKH26 intensità è stata valutata in combinazione con CD4 APC (colonne 2 e 3). Se non compensata (colonna 2) o compensato (colonna 3), questa combinazione fluorocromo comportato buona risoluzione tra CD4 pos cellule T e le cellule T CD4 neg), come verificato sia da un non-antibody, controllo autofluorescente (Tubo 6 della tabella 1, colonna 4) e due colori terreno di CD3 vs. CD4 (colonna 6). Pannello B. Usando la stessa combinazione fluorocromo come nel Pannello A, ma aumentando la finale PKH26 concentrazione a 4 mM non ha pregiudicato la capacità di risolvere CD4 pos cellule T CD4 da neg cellule T. Pannello C. A Un'aliquota di cellule replicano autonomamente etichettati con PKH26 ad una concentrazione finale di 2 mM stata controcolorati con anti-CD3-FITC, anti-CD4-PerCP, e TOPRO-3. Dopo il gating vitali (TOPRO-3 neg) CD3 linfociti pos (colonna 1) e l'esclusione di detriti e aggregazioni basate sulle FSC e SSC (vedi figura 3A), PKH26 intensità è stata valutata in combinazione con anti-CD4-PerCP (colonne 2 e 3). Sostanziali sovrapposizioni spettrali PKH26 nel canale PerCP è evidente nei dati non compensati (colonna 2), e la risoluzione tra PKH26 CD4 pos pos e PKH26 CD4 pos neg eventi è marginale dopo la compensazione viene applicata (cfr. colonna 3 con il no-anticorpo, il controllo autofluorescente mostrato nella colonna 4). Pannello D. Quando PKH26 concentrazione è aumentata a 4 mM, non è più possibile utilizzare la combinazione di fluorocromo pannello C. sovrapposizione spettrale da PKH26 nel canale PerCP supera l'intensità del segnale di CD4 (colonna 2) e CD4 pos PKH26 eventi POS può più essere risolto da CD4 neg PKH26 pos cellule T (colonna 3 vs. colonna 4). Clicca qui per ingrandire la figura .
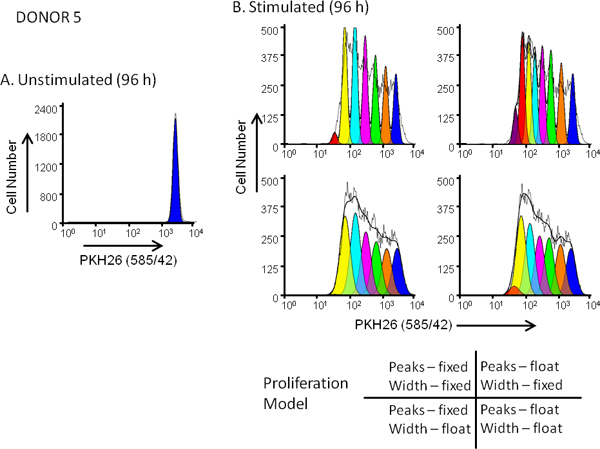
Figura 5. Effetto di selezione del modello di proliferazione. bontà di adattamento per i profili di diluizione colorante hPBMC sono state marcate con PKH26 (concentrazione cellulare finale: 3x10 7 / ml; concentrazione finale colorante: 10 mM). Dopo coltura per 96 ore in presenza (stimolato) o assenza (non stimolate) di anti-CD3 e IL-2, le cellule sono state raccolte contrastate con anti-CD3-FITC, anti-CD19-APC e 7-AAD e analizzato su un FACSCalibur citofluorimetro (vedi riferimento 13 per metodi dettagliati). La compensazione del colore è stata eseguita al momento della acquisizione di dati tramite circuiti cablati compensazione. Pannello A. PKH26 Il profilo di intensità da una cultura non stimolato 96 ore per il Donatore 5, un moderato responder, è stato recintato come mostrato in figura 3A e utilizzati per fornire la proliferazione ModFit Wizard con una prima stima di posizione e la larghezza per il picco corrispondente indivisi cellule parentali. Pannello B. PKH26 Il profilo di intensità da un parallelo stimolato la cultura 96 ore è stato analizzato utilizzando le stime a partire dalPannello A e 4 diverse combinazioni di impostazioni "proliferazione Wizard ', corrispondenti a potenze di picco fisso o variabile, e larghezze di picco fisso o variabile per le generazioni successive, come mostrato figlia. Come riassunto nella tabella 3, il modello che ha dato il miglior adattamento ai dati osservati (basso ridotta chi-quadrato; RCS) era la combinazione "floating / floating" in cui non era permesso solo posizioni di picco, ma anche le deviazioni standard dei picchi generazione figlia per variare (RCS = 1,5). Dello stesso ha dato la soluzione migliore per Donatore 6, un alto responder (Figura 3B e Tabella 3).
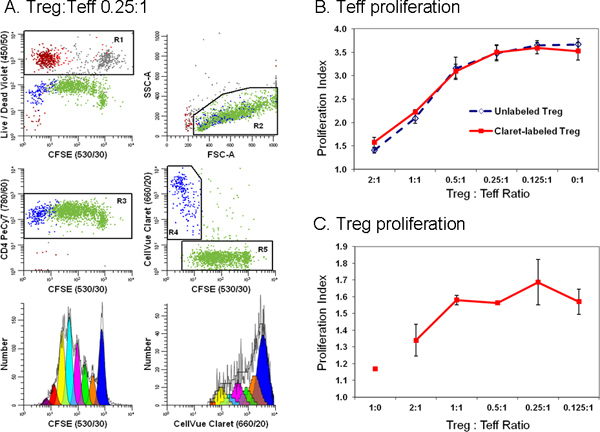
Figura 6. L'aggiunta di un colorante secondo monitoraggio cella semplifica la discriminazione tra cellule T effettrici e di regolamentazione in un test di citometria a flusso di soppressione(Adattato da Rif. 18). Linfociti monociti-impoverito preparati con filtri leucaferesi Trima sono state colorate con anticorpi anti-CD127-PE, anti-CD4-PE-Cy7, e anti-CD25-APC e il flusso ordinati in popolazioni di effettrici (Teff.; CD4 pos CD127 CD25 luminoso dim), normativo (Treg; CD4 pos CD127 CD25 dim pos), e accessori (CD4 neg) cellule. Ordine cellule Treg marcate con Claret CellVue (concentrazione cellulare finale: 1x10 6 / ml; concentrazione finale colorante: 1 pM) e Teff ordinati etichettati con CFSE (concentrazione cellulare finale: 5 × 10 7 / ml; finale concentrazione di colorante, 5 pM) sono stati co-coltura a vari rapporti in presenza di cellule accessorie anti-CD3, anti-CD28 e irradiati. Dopo 96 ore, le colture sono state raccolte, contrastate con anti-CD4-PE-Cy7 e LIVE / DEAD Violet fissabile, ed analizzati su un citometro a flusso LSRII e compensazione del colore è stata eseguita al momento dati ACQUISIZIOn utilizzando BD DiVa software (vedi riferimento 18 per tutti i dettagli, inclusi i controlli di compensazione). Gli indici di proliferazione di Teff e Treg sono stati modellati come descritto al punto 4, utilizzando la procedura guidata proliferazione in ModFit LT3.3. Punti dati di pannelli B e C rappresentano la media ± 1 deviazione standard dei campioni in triplo pannello A. I dati rappresentativi sono mostrati per uno dei tre campioni in triplo a Treg:. Teff rapporto di 0.25:1. LIVE / DEAD reagente Violet fissabile è stato utilizzato per escludere le cellule morte (R1, la trama in alto a sinistra; cellule accessorie = rosso-marrone, non vitale Teff = grigio e non vitale Treg = rosso) da tutti i grafici di altri dati. Colorazione Claret CellVue è stato utilizzato per distinguere Treg vitale (R4, trama centro destra, blu) da vitali ma altamente proliferato Teff (R5, trama centro destra, verde). Un singolo CFSE profilo di parametri proliferazione per Teff (basso plot a sinistra) è stato generato da gating sulle cellule che erano CFSE pos (R5), CD4 pos (R3), vitale (non R1), e aveva linfociti scproprietà Atter (R2). Un singolo parametro CellVue profilo Claret proliferazione per Treg stato generato da gating sulle cellule che erano CellVue Claret pos (R4), CD4 POS (R3), valida (non R1), e ha proprietà scatter linfociti (R2). Nota la regione generosa linfociti (R2) definito per includere blasti linfociti. Si noti inoltre che il numero totale di celle da raccogliere dipende la popolazione più bassa frequenza di interesse. In un esperimento di proliferazione cellulare in cui la popolazione di interesse possono essere distribuiti su una vasta gamma di intensità rappresentano fino a sette o otto generazioni un gran numero di cellule devono essere raccolti per modellare accuratamente e calcolare il numero di cellule in ogni generazione. Quando si studia cellule rare, può essere necessario eseguire semplicemente il tubo campione quasi asciutto per raccogliere il massimo numero possibile di eventi. Per l'esempio mostrato qui, facendo ciò ha determinato un totale di ~ 25.000 eventi, di cui 11.923 erano Teff (I proliferazionendice 3.85) e 1380 erano Treg (indice di proliferazione 1.83). Pannello B. Come previsto, aumentando la percentuale di presente Tregs in co-colture hanno portato ad una maggiore soppressione della proliferazione cellulare Teff. Risultati simili sono stati ottenuti con entrambi CellVue Claret-tinto (linea continua) o macchia (linea tratteggiata) Treg, indicando che la colorazione con il colorante Claret CellVue inseguimento non incidono Treg potenza. Pannello C. Treg sono relativamente anergici e, come previsto, fatto non proliferano quando incubati con anti-CD3, anti-CD28, e cellule accessorie in assenza di cellule Teff (Treg: Teff rapporto di 1:0). Tuttavia, poiché la percentuale di Teff presente in co-colture aumentata (cioè, come Treg: rapporto Teff diminuito), il grado di proliferazione Treg anche aumentato. Le barre di errore generalmente più grandi per questi dati, almeno in parte riflettere la portata limitata della proliferazione, portando ad un numero minore di eventi raccolti relativi Teff e maggiore incertezzaty nella modellazione del numero di cellule in ogni generazione. Clicca qui per ingrandire la figura .
| Tubo No. (Scopo) | PKH26 | Anticorpo (i) | 7-AAD |
| 1 (programma di installazione, di compensazione) | - | - | - |
| 2 (programma di installazione, di compensazione) | + | - | - |
| 3 (programma di installazione, di compensazione) | - | - | + |
| 4 (compensazione) | - | CD8-FITC b | - |
| 5 (compensazione) | - | CD8-APC b | - |
| 6 (nessun controllo Ab) | + | - | + |
| 7 (con inseguimento colorantecontrollo) | - | CD3-CD4-FITC o CD19-APC APC c | + |
| 8 (T0 controllo) | + | CD3-CD4-FITC o CD19-APC APC c | + |
. Strumento Tabella 1 Setup Controlli a a comandi elencati sono adatti per a 4 colori saggio delle cellule CD4 monitoraggio proliferazione T con:. PKH26 (proliferazione colorante), CD3-FITC (pan-T marcatore della cella), CD4-APC (T-helper cella marcatore), 7-aminoactinomycin D (7-AAD, morto l'esclusione delle cellule) b Brighter surrogati di CD3-CD4-FITC e APC (migliore capacità di rilevare gli errori di compensazione) c Figura 3:.. CD3-FITC e CD19-APC. d Figura 4: CD3-FITC e CD4-APC.
| Tipo di cella | Cella Concentrazione finale | Concentrazione finale Dye </ Strong> | Riferimento |
| hPBMC b | 1 x 10 7 / ml | 2 pM PKH67 | 10,17 |
| 5 x 10 6 / ml | 2 pM PKH26 | 12 | |
| 3 x 10 7 / ml | 10 pM PKH26 | 13 | |
| 5 x 10 7 / ml | 30 um PKH26 | 18 | |
| 1 x 10 6 / ml | 1 CellVue Claret pM c | 18 | |
| 3 x 10 7 / ml | 4 Claret CellVue pM | 13 | |
| 5 x 10 7 / ml | 5 Claret CellVue pM | 18 | |
| Le cellule in coltura | 5 x 10 5 / ml | 0,1 micron PKH26 (1 ° cellule mammarie) | 8 |
| 1 x 10 7 / ml | 15 um PKH26 (U937) | 18 | |
| 1 x 10 7 / ml | 12,5 -15 pM PKH26 (U937) | 15 | |
| 1 x 10 7 / ml | 1 pM PKH67 (K562) | 18 | |
| 1 x 10 7 / ml | 1 pM PKH67 (linee cellulari T) | 9 | |
| 1 x 10 7 / ml | 10 CellVue Claret pM (YAC-1) | 23 |
Tabella 2. Che non generino interferenze membrana-Dye di colorazione a. Un adattato e aggiornato dal rif. 18. B Un lavaggio a bassa velocità (300 xg) è stato utilizzato per ridurre al minimo la contaminazione delle piastrine. C cellule Treg (CD4 flusso filtrate pos pos CD25 CD127 linfociti neg).
| Modello Impostazioni | Modello Risultati | ||||||||
| Donatore | Trattamento | Posizione Peak | SD | Ruolo dei genitori | Parental SD | # Di Peaks Equipaggiata | RCS | PI | PF |
| 5 | Non stimolata | Galleggiante | Galleggiante | 209 | 4,5 | 1 | 5,1 | 1,0 | 0 |
| 5 | Stimolato | Fisso | Fisso | 209 | 4,5 | 7 | 35 | 3,9 | 31 |
| 5 | Stimolato | Galleggiante | Fisso | 209 | 4,5 | 8 | 19 | 4,3 | 30 |
| 5 | Stimolato | Fisso | Galleggiante | 209 | 9,2 | 6 | 1,9 | 3,8 | 30 |
| 5 | Stimolato | Galleggiante | Galleggiante | 209 | 9.0 | 7 | 1,5 | 3,7 | 29 |
| 6 | Non stimolata | Galleggiante | Galleggiante | 205 | 4.0 | 1 | 2,1 | 1,0 | 0 |
| 6 | Stimolato | Fisso | Fisso | 205 | 4.0 | 6 | 42 | 6,6 | 60 |
| 6 | Stimolato | Galleggiante | Fisso | 205 | 4.0 | 7 | 12 | 7,4 | 60 |
| 6 | Stimolato | Fisso | Galleggiante | 205 | 8,6 | 6 | 6,9 | 6,8 | 62 |
| 6 | Stimolato | Galleggiante | Galleggiante | 205 | 6,5 | 6 | 1,3 | 6,5 | 59 |
Tabella 3. Impatto del Modello proliferazione sulla bontà di adattamento (RCS) e metriche di una proliferazione. Una colorazione del campione, raccolta di dati e di interruzione del segnale come descritto nella Figura 3A & B.
Discussione
I metodi descritti qui sono quelli che si trovano nei nostri laboratori combinati per dare più affidabile risultati ottimali per l'etichettatura hPBMC utilizzando coloranti membrana 13,16,18 e per fenotipizzazione sottoinsieme dei linfociti e la proliferazione di monitoraggio utilizzando membrana o proteine coloranti 2,11,13,16, 18. Come illustrato nelle figure 1 e 2, luminoso un'etichettatura uniforme è più facilmente ottenuta limitando la presenza di sali fisiologiche e utilizzando una tecnica di miscelazione che si traduce in un rapido, omogeneo esposizione delle cellule alla stessa concentrazione di colorante. Perché colorazione con coloranti membrana avviene suddividendo nel doppio strato lipidico, altre variabili che alterano libera concentrazione di colorante può anche avere un impatto efficienza etichettatura. Per esempio, l'etichettatura rotonde risultati polistirolo fondo tubi in lavaggio meno efficiente di sali prima di risospensione in Diluente C e anche in ridotta concentrazione libera colorante per tingere adsorbimento sulle pareti del tubo, in particolarea basse concentrazioni di colorante. Entrambi i fattori tendono a dare distribuzioni colorazione più ampi rispetto a quando l'etichettatura sono realizzate utilizzando tubi di polipropilene coniche inferiori (figure 3, 4 e risultati non pubblicati). Età del campione e il tipo può colpire anche ampiezza del picco, anche quando le procedure di colorazione ottimizzati vengono utilizzati. Ad esempio, il curriculum vitae PKH26 pos linfociti isolati dal campo di sangue appena prelevato 14-20% (Figura 3, rif. 13 e dati non pubblicati), mentre il curriculum vitae linfociti isolati da 24 campioni di sangue ore vecchi o TRIMA gamma pheresis filtri 25-30 % (Figura 4 e cod. 18).
Colorazione uniformità e la misura in cui cellule non vitali possono essere esclusi dall'analisi sia influenzare il fatto picchi distinguibili figlia sono evidenti nel profilo diluizione colorante, che a sua volta influenza la scelta di un modello di proliferazione per adattare i dati osservati (figure 5 e 6 ). Anche se ModFit (Verity Software House, Topsham, ME) viene qui utilizzato come esempio di software utilizzato per generare metriche come indice di proliferazione e frequenza Precursore (figure 3, 5 e 6, Tabella 3), altri pacchetti contengono anche i moduli per l'analisi dati proliferazione. Questi includono FCSExpress (De Novo Software, Los Angeles, CA) e FlowJo (Albero Star, Inc., Ashland, OR). Tutti questi programmi utilizzano una non-lineare dei minimi quadrati per trovare iterativamente la soluzione migliore per i dati grezzi modificando la posizione, l'altezza e SD (o larghezza) di picchi gaussiani che rappresentano generazioni figlia sequenziali. Indice di proliferazione (PI) e frequenza Precursore (PF) sono le misure più comunemente usati di estensione della proliferazione. PI, come definito da ModFit, è una misura di aumento del numero di cellule nel corso del saggio, analogo al 'indice di stimolazione' di un saggio di timidina. PF restituisce la frazione di cellule nel popolate inizialeioni che hanno risposto allo stimolo alla proliferazione. Si consiglia cautela, tuttavia, quando leggendo la letteratura a partire dal terminologia varia un po 'tra i pacchetti software (ad esempio, FlowJo e ModFit utilizzare definizioni e calcoli diversi per ciò che si intende per "indice di proliferazione") 22.
Le criticità discusse qui per l'etichettatura e l'analisi proliferazione con coloranti membrana sono anche incontrato quando si utilizza coloranti proteine. Per esempio, attenzione alla tecnica di miscelazione deve anche osservare, con esclusione delle cellule morte / morenti, per ottenere distribuzioni uniformi e picchi distinguibili figlia utilizzando CFSE (Figura 6) 2-4,13,18,24. Scelta appropriata di fluorocromi per fenotipizzazione e valutazione della redditività è importante anche al fine di evitare eccessive sovrapposizioni spettrali e l'incapacità di riconoscere le cellule anticorpi positivi, in particolare con coloranti visibili proteine che emettono come CFSE 2-4,11,13,16,18 . La riduzione della concentrazione di colorante inseguimento diminuisce i problemi di compensazione in adiacenti canali spettrali, ma limita anche il numero di divisioni cellulari che possono essere monitorati prima di intensità cellula figlia iniziano a sovrapporsi con autofluorescenza. In alternativa, l'uso di coloranti cellule più recenti di monitoraggio come il Claret emettitore rosso lontano CellVue (Sigma-Aldrich, St. Louis, MO) o viola emissione CellTrace Violet (Life Technologies, Grand Island, NY) possono ridurre i problemi di compensazione (Figura 6). Infine, sebbene coloranti membrana generalmente tendono a mostrare una minore tossicità 11,26, è possibile sovra-label cellule con o classe di colorante. È quindi sempre necessario verificare che la concentrazione del colorante tracciamento utilizzato non ha modificato la funzionalità delle cellule che devono essere monitorati (Figura 6) 3,13,16,18.
Divulgazioni
K. Humphrey, JD Tario, Jr. e PK Wallace hanno ricevuto pre-commerciali reagenti cellulari di monitoraggio per la valutazione da Life Technologies, Inc. e BD Biosciences. AD Bantly e JS Moore hanno ricevuto pre-commerciali di monitoraggio cella reagenti per la valutazione da Life Technologies, Inc. e il finanziamento da PTI Research, Inc. per la pre-commerciale caratterizzazione di cellule CellVue vari monitoraggio coloranti. K. Muirhead è impiegato da SciGro, Inc., che fornisce servizi di consulenza per Phanos Technologies, Inc. (proprietario del PKH e coloranti CellVue) e fornisce il sostegno supporto tecnico per Sigma-Aldrich e molecolari tecnologie di targeting, Inc. (distributori di questi coloranti).
Produzione e l'accesso gratuito a questo articolo è sponsorizzato da Sigma-Aldrich.
Riconoscimenti
Gli autori In particolare, desidero ringraziare le seguenti persone per il loro contributo tecnico e intellettuale allo sviluppo di questi metodi nel corso degli anni: Bruce Bagwell (Verity Software House), Nadège Bercovici (IDM), Lizanne Breslin (Zynaxis cellulare Scienza e la ricerca PTI) , Brian Gray (PTI Research), Jan Fisher (Dartmouth Medical School), Alice Givan (Dartmouth Medical School), Betsy Ohlsson-Wilhelm (SciGro, Inc.), e Mary Waugh (Dartmouth Medical School). Avrebbero anche ringraziare la classe Bowdoin del 2006 dai Corsi Annuali di metodi di ricerca e applicazioni della citometria a flusso, che hanno generato i dati mostrati nella Figura 2.
La citometria a flusso è stata effettuata presso il Laboratorio di flusso Roswell Park Cancer Institute di Citometria, che è stato istituito in parte da contributi in conto impianti del Programma NIH strumento condiviso, e riceve sostegno da parte del Sussidio Core (5 P30 CA016056-29) dal NazionaleCancer Institute a Roswell Park Cancer Institute, e presso il Centro di Citometria a Flusso Abramson Cancer and Laboratory risorse cella Ordinamento della University of Pennsylvania, che è stato istituito in parte da contributi in conto impianti del Programma NIH strumento condiviso, e riceve il sostegno di NIH # 2P30 CA016520 dal National Cancer Institute. Il lavoro illustrato nelle figure 3 e 5, è stata sostenuta anche in parte da SBIR concessione EB00228 dal National Institute of Biomedical Imaging e Bioingegneria (NIBIB) assegnato a PTI Research, Inc.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente o attrezzature | Azienda | Numero di catalogo | Commenti |
| Acquistabile | |||
| 7-D Aminoactinomycin | Sigma-Aldrich | A9400 | |
| Albumina di siero bovino (BSA) | Sigma-Aldrich | A4503 | |
| Siero bovino fetale (FBS) | Atlanta Biologicals | S11150 | |
| Hanks soluzione salina bilanciata (HBSS) | Life Technologies | 14175-079 | Calcio e magnesio libero, senza rosso fenolo |
| IgG umane Cohn frazione II e III globuline | Sigma-Aldrich | G-4386 | |
| Topo anti-CD3 umana-FITC | BD Biosciences | 349201 | Saturazione concentrazione determinata mediante titolazione di laboratorio |
| Mouse anti-umani CD4-APC | BD Biosciences | 340672 | Saturazione concentrazione determinata mediante titolazione di laboratorio |
| Mouse anti-umani CD4-PECy7 | BD Biosciences | 348799 | Saturazione concentrazione determinata mediante titolazione di laboratorio |
| Topo anti-CD8 umana-FITC | BD Biosciences | 347313 | Saturazione concentrazione determinata mediante titolazione di laboratorio |
| Topo anti-umano CD8-APC | Caltag (Life Technologies) | MHCD0805 | Saturazione concentrazione determinata mediante titolazione di laboratorio |
| Mouse Anti-Human CD19-APC | Caltag (Life Technologies) | MHCD1905 | concentrazione di saturazione, come determinato mediante titolazione di laboratorio |
| Topo anti-CD25-APC umana | BD Biosciences | 340938 | Saturazione concentrazione determinata mediante titolazione di laboratorio |
| Topo anti-umano CD127-PE | BD Biosciences | 557938 | Saturazione concentrazione determinata mediante titolazione di laboratorio |
| Topo anti-CD3 umano | eBiosciences | 16-0037-85 | 1,0 mg / ml; azide libero |
| Topo anti-CD28 umano | eBiosciences | 16-0289-85 | 1,0 mg / ml; azide libero |
| PBS | Gibco | 21300-058 | |
| PKH26 rosso fluorescente linker kit cella contenente 10-3M PKH26 in EtOH e Diluente C | Sigma-Aldrich | PKH26GL-1KT o MINI26-1KT | Procedure in Fase 1 si applicano anchedi kit contenenti PKH67 o coloranti CellVue altri |
| CellVue Claret lontano rosso fluorescente linker kit cella contenente 10 3M Claret CellVue in EtOH e Diluente C | Sigma-Aldrich | MINCLARET-1KT o MIDCLARET-1KT | |
| 5 - (e-6)-carbossifluoresceina diacetato, succinimmidil estere (CFDA-SE) | Invitrogen (Life Technologies) | C34554 | Non fluorescente; spaccati dalle esterasi membrana per formare fluorescente ammino-reattiva carbossifluoresceina succinimidyl estere (CFSE) |
| LIVE / DEAD Viola fissabile | Invitrogen (Life Technologies) | L34955 | |
| Sterile 12 x 75 mm conica tubi di polipropilene & berretti | VWR | 60818-102 | Fornisce una migliore efficienza della membrana colorante colorazione (tintura ridotto assorbimento, meno perdita di cellule durante l'aspirazione supernatante) |
| 12 x 75 mm round fondo polistirolo tubi | Becton Dickinson | 21008-936 | |
| Citometro di flusso | BD Bioscience | FACSCalibur LSRFortessa | Qualsiasi citometro grado di rilevare FITC, PKH26, e 7-AAD (es. 488 nm;. Em 520 nm, 567 nm e 655 nm, rispettivamente) e APC ex. 633-640 nm; em. 660 nm) |
| Citometro di flusso | Beckman Coulter | LSRII CIANO | Qualsiasi citometro grado di rilevare FITC, PKH26, e 7-AAD (es. 488 nm;. Em 520 nm, 567 nm e 655 nm, rispettivamente) e APC ex. 633-640 nm; em. 660 nm) |
| Preparati in laboratorio, | |||
| 7-Aminoactinomycin D, madre alla concentrazione | NA | NA | 1 mg / ml in PBS. Congelare in aliquote e conservare a -20 ° C. |
| 7-Aminoactinomycin D, worre magazzino | NA | NA | 100 pg / ml in PBS; preparare tutti i giorni da 1 mg / ml di brodo congelato. |
| IgG blocco | NA | NA | HBSS + 10 mg / ml di IgG umano Cohn frazione II e III globuline + 10 mg / ml di BSA. |
Riferimenti
- Poon, R. Y., Ohlsson-Wilhelm, B. M., Bagwell, C. B., Muirhead, K. A., Diamond, R. A., DeMaggio, S. Use of PKH Membrane Intercalating Dyes to Monitor Cell Trafficking and Function. Living Color: Flow Cytometry and Cell Sorting Protocols. , 302-352 (2000).
- Wallace, P. K., Muirhead, K. A. Cell Tracking 2007: A Proliferation of Probes and Applications. Immunol. Invest. 36, 527-562 (2007).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2, 2057-2067 (2007).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2, 2049-2056 (2007).
- Bolton, D. L., Minang, J. T., Trivett, M. T., Song, K., Tuscher, J. J., Li, Y., Piatak, M., O'Connor, D., Lifson, J. D., Roederer, M., Ohlen, C. Trafficking, Persistence, and Activation State of Adoptively Transferred Allogeneic and Autologous Simian Immunodeficiency Virus-Specific CD8+ T Cell Clones during Acute and Chronic Infection of Rhesus Macaques. J. Immunol. 184, 303-314 (2010).
- Juopperi, T. A., Sharkis, S. J. Isolation of Quiescent Murine Hematopoietic Stem Cells by Homing Properties. Meth. Mol. Biol. 430, 21-30 (2008).
- Kusumbe, A. P., Bapat, S. A. Cancer stem cells and aneuploid populations within developing tumors are the major determinants of tumor dormancy. Cancer Res. 69, 9245-9253 (2009).
- Pece, S., Tosonim, D., Confalonieri, S., Mazzarol, G., Vecchi, M., Ronzoni, S., Bernard, L., Viale, G., Pelicci, P. G., Fiore, P. P. D. i. Biological and Molecular Heterogeneity of Breast Cancers Correlates with Their Cancer Stem Cell Content. Cell. 140, 62-73 (2010).
- Gertner-Dardenne, J., Poupot, M., Gray, B. D., Fournié, J. -. J. Lipophilic fluorochrome trackers of membrane transfers between immune cells. Immunol. Invest. 36, 665-685 (2007).
- Bercovici, N., Givan, A. L., Waugh, M. G., Fisher, J. L., Vernel-Pauillac, F., Ernstoff, M. S., Abastado, J. P., Wallace, P. K. Multiparameter precursor analysis of T-cell responses to antigen. J. Immunol. Methods. 276, 5-17 (2003).
- Givan, A. L., Fisher, J. L., Waugh, M. G., Bercovici, N., Wallace, P. K. Use of cell-tracking dyes to determine proliferation precursor frequencies of antigen-specific T cells. Methods Mol. Biol. 263, 109-124 (2004).
- Schwaab, T., Tretter, C. P., Gibson, J. J., Cole, B. F., Schned, A. R., Harris, R., Fisher, J. L., Crosby, N., Stempkowski, L. M., Heaney, J. A., Ernstoff, M. S. Tumor-related immunity in prostate cancer patients treated with human recombinant granulocyte monocyte-colony stimulating factor (GM-CSF). Prostate. 66 (6), 667-674 (2006).
- Bantly, A. D., Gray, B. D., Breslin, E., Weinstein, E. G., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Moore, J. S. CellVue Claret, a New Far-Red Dye, Facilitates Polychromatic Assessment of Immune Cell Proliferation. Immunol. Invest. 36, 581-605 (2007).
- Givan, A. L. A flow cytometric assay for quantitation of rare antigen-specific T-cells: using cell-tracking dyes to calculate precursor frequencies for proliferation. Immunol. Invest. 36, 563-580 (2007).
- Tario, J. D., Gray, B. D., Wallace, S. S., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Wallace, P. K. Novel lipophilic tracking dyes for monitoring cell proliferation. Immunol Invest. 36, 861-885 (2007).
- Wallace, P. K., Tario, J. D., Fisher, J. L., Wallace, S. S., Ernstoff, M. S., , ., Muirhead, K. A. Tracking Antigen-Driven Responses by Flow Cytometry: Monitoring Proliferation by Dye Dilution. Cytometry. 73, 1019-1034 (2008).
- Barth, R. J., Fisher, D. A., Wallace, P. K., Channon, J. Y., Noelle, R. L., Gui, J., Ernstoff, M. S. A Randomized Trial of Ex vivo CD40L Activation of a Dendritic Cell Vaccine in Colorectal Cancer Patients: Tumor-Specific Immune Responses Are Associated with Improved Survival. Clin. Cancer Res. 16, 5548-5556 (2010).
- Tario, J. D., Muirhead, K. A., Pan, D., Munson, M., Wallace, P. K. Tracking Immune Cell Proliferation and Cytotoxic Potential Using Flow Cytometry. Meth. Mol. Biol. 699, 119-164 (2011).
- Fuse, S., Underwood, E. Simultaneous Analysis of In Vivo CD8+ T Cell Cytotoxicity Against Multiple Epitopes using Multicolor Flow Cytometry. Immunol. Invest. 36, 829-845 (2007).
- Schütz, C., Fleck, M., Mackensen, A., Zoso, A., Halbritter, D., Schneck, J. P., Oelke, M. Killer artificial antigen-presenting cells: a novel strategy to delete specific T cells. Blood. 111, 3546-3552 (2008).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev. Vaccines. 9, 601-616 (2010).
- Roederer, M. Interpretation of cellular proliferation data: Avoid the panglossian. Cytometry. 79A, 95-101 (2011).
- Quah, B. J. C., Parish, C. R. The Use of Carboxyfluorescein Diacetate Succinimidyl Ester (CFSE) to Monitor Lymphocyte Proliferation. J. Vis. Exp. (44), e2259 (2010).
- Houlihan, D. D., Newsome, P. N. Critical Review of Clinical Trials of Bone Marrow Stem Cells in Liver Disease. Gastroenterology. 135, 438-450 (2008).
- Brusko, T. M., Hulme, M. A., Myhr, C. B., Haller, M. J., Atkinson, M. A. Assessing the In Vitro Suppressive Capacity of Regulatory. T Cells. Immunol. Invest. 36, 607-628 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon