È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Enumerazione delle popolazioni dei leucociti del sangue periferico per le principali studi clinici multicentrici utilizzando un intero saggio Fenotipizzazione Sangue
In questo articolo
Riepilogo
In questo rapporto, dimostriamo la procedura di colorazione e l'analisi di un test di fenotipizzazione effettuato su sangue intero fresco per enumerare le principali popolazioni innata e adattiva dei leucociti. Sottolineiamo considerazioni per l'esecuzione di queste procedure nel contesto di uno studio clinico multicentrico.
Abstract
Crioconservazione dei leucociti del sangue periferico è ampiamente usato per conservare le cellule per la valutazione della risposta immunitaria negli studi clinici e offre molti vantaggi per la facilità e la standardizzazione delle valutazioni immunologiche, ma gli effetti negativi di questo processo sono stati osservati in alcuni sottogruppi di cellule, come i granulociti, cellule B , e cellule dendritiche 1-3. Saggiare leucociti freschi fornisce un quadro più preciso della stato in vivo delle cellule, ma è spesso difficile da eseguire nel contesto di ampi studi clinici. Saggi su cellule fresche sono dipendenti da impegni di volontariato e tempi e, se in termini di tempo, la loro applicazione può essere poco pratico a causa delle ore di lavoro richieste del personale di laboratorio. Inoltre, quando le sperimentazioni sono condotte a molteplici centri, laboratori con le risorse e la formazione necessarie per eseguire i saggi non può essere situato in prossimità sufficiente a siti clinici. Per risolvere questi problemi, abbiamo sviluppatopato un 11-colore del pannello colorazione anticorpo che può essere utilizzato con tubi Trucount (Becton Dickinson, San Jose, CA) e al fenotipo enumerare le popolazioni principali leucociti nel sangue periferico, producendo più robusto tipo cellulare informazioni specifiche di saggi come un emocromocitometrico completo (CBC), o con saggi disponibili in commercio pannelli progettati per tubi Trucount che macchiano solo per alcuni tipi di cellule. La procedura di colorazione è semplice, richiede solo 100 ml di sangue intero fresco, e dura circa 45 minuti, rendendo così possibile la standard di sangue laboratori di trasformazione da eseguire. Si è adattato dal tubo BD scheda tecnica Trucount ( versione 8/2010 ). Il cocktail di anticorpi colorazione può essere preparata in anticipo in massa a un laboratorio saggio centrale e spediti a laboratori di lavorazione del sito. Tubi colorati possono essere fissatie congelati per la spedizione al laboratorio analisi centrale per l'analisi di citometria a flusso multicolore. I dati generati da questo pannello colorazione può essere utilizzato per monitorare variazioni di concentrazione dei leucociti nel tempo in relazione all'intervento e potrebbe facilmente essere ulteriormente sviluppato per valutare gli stati di attivazione di specifici tipi cellulari di interesse. In questo rapporto, dimostriamo la procedura utilizzata dal sangue di elaborazione tecnici di laboratorio per eseguire la colorazione di sangue intero fresco e la procedura per analizzare questi campioni macchiati in un laboratorio analisi centrale di supporto di uno studio clinico multicentrico. I dettagli del video la procedura in quanto viene eseguito nel contesto di un progetto di sperimentazione clinica del sangue nel HIV Vaccine Trials Network (HVTN).
Protocollo
Nota: per proteggere i fluoroforo anticorpi coniugati dalla luce, eseguire tutte le fasi di un bio-Armadio di sicurezza con la luce spenta.
1. Antibody colorazione Preparazione del pannello
- Il pannello colorazione anticorpo può essere trovato in Tabella 1. Concentrazione di anticorpi dovrebbe essere definita mediante titolazione con sangue intero e utilizzando la stessa attrezzatura citometria di flusso e le procedure che saranno utilizzati per acquisire i campioni fenotipizzazione macchiati.
- Una volta che i titoli di colorazione adeguati sono determinati, unire tutti gli anticorpi in una miscela unica in un lock-tappo del tubo. Aggiungere tampone di lavaggio flusso (Dulbecco PBS con 2% di siero fetale bovino inattivato) per portare il volume totale di 100 microlitri. Scala la miscela per il numero di campioni che colorati. Questa miscela può essere conservato a 4 ° C per un massimo di otto settimane.
2. Colorazione
- Se il sangue raccolto deve essere utilizzato per altri scopi in annunciodizione di questo saggio, impostare una aliquota parte mentre più sensibili al tempo procedure sono eseguite il sangue residuo. L'aliquota può essere conservato a temperatura ambiente per 4 ore dopo l'iniezione in vena senza significativa perdita di cellule.
- Verificare che non vi è un intatto tallone pellet sul fondo del tubo Trucount ed etichetta il tubo per identificare il campione viene macchiato. Negli studi clinici HVTN, il Laboratorio di Data Management System (Frontier Science and Technology Research Foundation, Amherst, NY) è usato per etichettare e tenere traccia dei campioni colorati.
- Registrare i numeri di lotto e le date di scadenza di tutti i reagenti. Registrare il numero di conteggio Trucount tubo cordone fornito dal produttore sulla borsa di tubi, assicurarsi che il numero di lotto sulla borsa corrisponde al numero di lotto sul tubo.
- Utilizzare pipettaggio inverso per pipettare esattamente 100 pl di sangue intero nella provetta Trucount, appena sopra il fermo metallico. Evitare sbavature di sangue lungo il lato del tubo.
- Uso regolare (in avanti) tecnica di pipettaggio, pipettare 100 pl del pannello misto colorazione anticorpale (Vedi Tabella 1) nel tubo Trucount. Tappare la provetta e vortex a bassa velocità per circa 15 secondi per mescolare. Ispezionare visivamente il tubo per garantire che il pellet tallone è completamente sciolto.
- Incubare la provetta Trucount per 15 minuti a temperatura ambiente (15-30 ° C) al buio.
- Se necessario, diluire una aliquota di 10 × soluzione FACS Lisi a 1X con DIH 2 O. Aggiungere 900 microlitri 1 × soluzione FACS Lisi al tubo.
- Tappare la provetta e agitare bene a bassa velocità per circa 15 secondi per mescolare. Spingere verso il basso il tappo saldamente in posizione di bloccaggio sul tubo e sigillare con la pellicola di laboratorio.
- Conservare il tubo a -65 ° C a -95 ° C fino a quando il campione è pronto per la spedizione al laboratorio di analisi centrale o per analisi in casa. I campioni sono stabili in questa fase per almeno quattro settimane. Se la spedizione o il saggio immediatamentetamente, questo passaggio può essere omesso.
3. Spedizione
Nota: Le istruzioni che seguono utilizzano un sistema di trasporto isolato da Saf-T-Pak, Inc. idoneo alla spedizione categoria B sostanze biologiche esenti secondo la International Air Transport Association e (IATA). Se l'analisi dei campioni nella stessa posizione come la colorazione si è verificato, andare alla sezione 4.
- I campioni possono essere spediti immediatamente dopo colorazione o una volta che sono congelati a -65 ° C a -95 ° C. Avvolgere ogni tubo completamente in pellicola e mettere in casella campione macchiato. Posizionare la scatola macchiato campione all'interno di una tenuta poli-borsa con materiale assorbente.
- Posizionare la tenuta poly-bag e contenuto in un sacchetto di Tyvek e sigillare con meno aria possibile nel sacchetto.
- Posizionare il pacchetto campione (campione all'interno imballaggio secondario) all'interno della scatola interna marrone.
- Posizionare l'interno marrone bbue all'interno del torace polistirolo, fissandolo nella dentellatura per evitare che si spostino.
- Riempire la cassa in polistirolo con ghiaccio secco (circa 8 kg) e posizionare il coperchio a tenuta sul petto.
- Nastro saldamente il contenitore di spedizione e la nave come sostanza biologica, Categoria B (UN3373) con il ghiaccio proprio a secco (UN1845) le marcature; seguire IATA PI-650 istruzioni.
- Al ricevimento, i campioni vengono conservati a -65 ° C a -95 ° C fino a che vengono analizzati.
4. Scongelamento e Citometria a Flusso analisi
- Togliere il campione macchiato dal freezer a scongelare a temperatura ambiente al buio prima di raccogliere il citofluorimetro. Se la raccolta di dati su più di un campione, standardizzare il processo per tutte le provette sfalsando scongelamento modo che i tubi non sono seduti a temperatura ambiente per più di 1 ora ciascuno.
- I campioni devono essere acquisiti utilizzando un citofluorimetro quattro laser dotato di filtri adatti, come il BD LSRII. Utilizzare standard di calibrazione citometro e metodi di compensazione fluorescenza per i dati di raccolta 4.
Nota: Non impostare soglie scatter scatter in avanti o di lato durante la raccolta 5. Perline Trucount può scendere al di sotto della soglia impostata più basso possibile per questi parametri che causano un sottoinsieme di perline di non essere contabilizzati durante l'analisi. Se richiesto dallo strumento di fissare una soglia, impostare il più basso possibile Am Ciano soglia canale. Perché leucociti CD45 + colorati con il pannello sarà Am Ciano positivo, e perline Trucount anche fluorescenza nel Ciano Am canale, ciò dovrebbe consentire di tutti i dati pertinenti devono essere opportunamente raccolti.
- Agitare la provetta per 5 secondi prima di caricare sul citofluorimetro. Perline Trucount reagiscono molto in molti canali. Porta le perle al momento della raccolta, trovando la popolazione che è altamente doppio positivo per Cy5 PE e APC (i due colors che più facilmente distinguere le perle dalle celle può variare a seconda strumentazione). Selezionare la porta tallone come arresto del cancello, e registrare i dati fino a quando almeno 20.000 perle vengono acquisiti.
- Analizzare i dati utilizzando un software appropriato, come FlowJo (Treestar; Ashland, OR). Figura 1 mostra lo schema di gating utilizzata per l'analisi delle diverse popolazioni leucocitarie da un pareggio rappresentante sangue di controllo.
5. Calcoli Trucount
- Ogni tubo Trucount contiene un pellet liofilizzato di perline fluorescenti. Dopo l'aggiunta di liquido al tubo e di vortex, le perle dovrebbe diventare equamente distribuiti in tutto il campione. Il numero di perle in pellet varia leggermente da lotto e si trova sulla custodia per i tubi.
- Porta le perline Trucount e delle popolazioni di cellule, come mostrato in Figura 1 per determinare i conteggi di eventi per ogni popolazione. Confrontando il numero di eventi in il cancello tallone al numero totale di perline originariamente nel tubo consente di determinare il rapporto di campione prelevato, che può quindi essere utilizzato per determinare la concentrazione assoluta (cioè cellule / mL) per ogni popolazione. La seguente equazione può essere utilizzato per questo scopo: La concentrazione cellulare (# cellule / pl sangue intero) = [# di popolazione (eventi / eventi / # # perlina perline totali in pellet)] / 100 ul.
6. Risultati rappresentativi
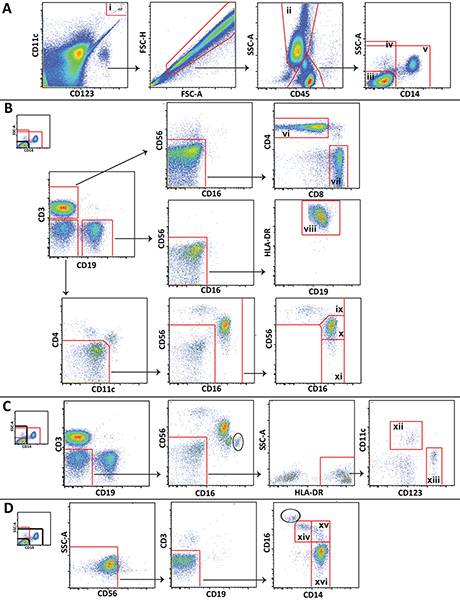
Figura 1. Regime Soppressione utilizzato per l'analisi delle principali popolazioni leucocitarie che mostrano i dati rappresentativi di un volontario sano. A) perline Trucount (i) sono gated ed esclusi dalle cellule. Granulociti (ii) sono delineati e lympohcytes e monociti sono divisi in 3 popluations: CD14linfociti negativi (iii), tutte le cellule CD14 negative (iv), e non-linfociti (v). B) CD14 linfociti negativi sono gated per distinguere cellule T CD4 + (vi), cellule T CD8 + (vii), cellule B (viii), CD56 cellule luminose NK (ix), CD56 cellule dim NK (x), e CD56 cellule negative NK (xi). C) Tutte le cellule CD14 negative sono gated distinguere mieloide (xii) e plasmacitoidi (xiii) cellule dendritiche. D) non-lympocytes sono gated di distinguere non classici (xiv), intermedi (xv), e classica (xvi) monociti. Clicca qui per ingrandire la figura .
Sottopopolazioni cellulari più specifiche che non sono mostrati nella Figura 1 (ad esempio, cellule NKT o neutrofili) può anche essere distinti utilizzando il pannello presentiamo, e lo schema di gating può essere esteso o modificato per soddisfare esigenze specifiche di studio. Alcuni passi gating indicati sono unici a questo metodo. Di particolare nota, un cancello inclusione ecancello esclusione rimangono attorno alle perline Trucount e posti uno sopra l'altro, uno per cancello per contare le perline, e uno di escludere le perline dall'analisi cellulare (Figura 1A). Inoltre, poiché i linfociti, monociti e granulociti non sono così facilmente distinguibili nel sangue intero in quanto sono nelle cellule mononucleari del sangue periferico da scatter in avanti e laterale scatter, gating queste cellule con CD45 espressione e side scatter è spesso necessario (Figura 1A). Granulociti contaminanti (cerchio) che non potevano essere separati da linfociti e monociti con CD45 e side scatter si distinguono in alcuni appezzamenti per la loro alta espressione CD16 (Figura 1C e 1D Figura). Il numero di granulociti contaminanti è generalmente piccolo, e non interferiscono con gating monociti e cellule NK.
Discussione
In questo rapporto, presentiamo una perlina metodo basato per l'enumerazione di popolazioni leucocitarie in sangue fresco intero mediante citometria di flusso e coprire i parametri necessari per il suo utilizzo in uno studio clinico multicentrico, con l'analisi del campione centralizzata. Questo metodo si basa su e ottimizza il protocollo BD Trucount e consente il suo utilizzo affidabile in un ambiente clinico multicentrico. Il saggio colorazione è semplice e richiede circa 45 minuti per eseguire, rendendo cos?...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Ringraziamo Jessica Jones, Erica Clark, Costanza Ducar, Donna Smith, Roy Lewis, Lily Apedaile, Joanne Wiesner, Devin Adams, Corey McBain e Stephen Voght per la loro assistenza nello sviluppo di questo manoscritto metodo, e video.
Questo lavoro è stato sostenuto dalla Fondazione Bill e Melinda Gates Foundation CAVD concessione 38645 (MJM) e National Institutes of concede Salute UM1 AI068618 e U01 AI069481 (MJM). EA-N. è sostenuto da NIH Grant T32 AI007140. Ringraziamo il James B. Charitable Trust Pendleton per la loro donazione generoso equipaggiamento.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente Nome | Azienda | Numero di catalogo | |
| Trucount assoluti Tubi di conteggio | BD Biosciences | 340334 | |
| FACS 10X Soluzione di Lisi | BD Biosciences | 349202 | |
| Categoria B & Sistema spedizione Esente, isolato | Saf-T-Pak | STP-320 | |
| AmCyan CD45 anticorpo monoclonale | BD Biosciences | 339192 | |
| CD3 FITC anticorpo monoclonale | BD Biosciences | 349201 | |
| CD8 PerCP-Cy 5,5 anticorpo monoclonale | BD Biosciences | 341051 | |
| CD4 Alexa Fluor 700 anticorpi monoclonalidy | BD Biosciences | 557922 | |
| HLA-DR ECD anticorpo monoclonale | Beckman Coulter | IM3636 | |
| V450 CD14 anticorpo monoclonale | BD Biosciences | 560349 | |
| CD19 PE anticorpo monoclonale | BD Biosciences | 555413 | |
| CD16 APC-H7 anticorpo monoclonale | BD Biosciences | 560195 | |
| CD56-PE Cy7 anticorpo monoclonale | BD Biosciences | 335791 | |
| CD11c APC anticorpo monoclonale | BD Biosciences | 559877 | |
| CD123 PE-Cy5 anticorpo monoclonale | BD Biosciences | 551065 |
Riferimenti
- Taylor, M. J., London, N. J., Thirdborough, S. M., Lake, S. P., James, R. F. The cryobiology of rat and human dendritic cells: preservation and destruction of membrane integrity by freezing. Cryobiology. 27, 269-278 (1990).
- Reimann, K. A., Chernoff, M., Wilkening, C. L., Nickerson, C. E., Landay, A. L. Preservation of lymphocyte immunophenotype and proliferative responses in cryopreserved peripheral blood mononuclear cells from human immunodeficiency virus type 1-infected donors: implications for multicenter clinical trials. The ACTG Immunology Advanced Technology Laboratories. Clin Diagn Lab Immunol. 7, 352-359 (2000).
- Boonlayangoor, P., Telischi, M., Boonlayangoor, S., Sinclair, T. F., Millhouse, E. W. Cryopreservation of human granulocytes: study of granulocyte function and ultrastructure. Blood. 56, 237-245 (1980).
- Perfetto, S. P., Ambrozak, D., Nguyen, R., Chattopadhyay, P., Roederer, M. Quality assurance for polychromatic flow cytometry. Nat Protoc. 1, 1522-1530 (2006).
- Brando, B., Barnett, D., Janossy, G., Mandy, F., Autran, B., Rothe, G., Scarpati, B., D'Avanzo, G., D'Hautcourt, J. L., Lenkei, R., Schmitz, G., Kunkl, A., Chianese, R., Papa, S., Gratama, J. W. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42, 327-346 (2000).
- Bull, M., Lee, D., Stucky, J., Chiu, Y. L., Rubin, A., Horton, H., McElrath, M. J. Defining blood processing parameters for optimal detection of cryopreserved antigen-specific responses for HIV vaccine trials. J. Immunol Methods. 322, 57-69 (2007).
- Kantor, A. B., Roederer, M., Herzenberg, L., Blackwell, C., Weir, D. . The handbook of Experimental Immunology. 43, 1-49 (1996).
- Hulspas, R. Flow cytometry and the stability of phycoerythrin-tandem dye conjugates. Cytometry A. 75, 966-972 (2009).
- Le Roy, C., Varin-Blank, N., Ajchenbaum-Cymbalista, F., Letestu, R. Flow cytometry APC-tandem dyes are degraded through a cell-dependent mechanism. Cytometry A. 75, 882-890 (2009).
- Mandy, F., Brando, B. Enumeration of absolute cell counts using immunophenotypic techniques. Curr. Protoc. Cytom. Chapter 6, Unit 6 (2001).
- Vuckovic, S. Monitoring dendritic cells in clinical practice using a new whole blood single-platform TruCOUNT assay. J. Immunol Methods. 284, 73-87 (2004).
- Lichtner, M. Circulating dendritic cells and interferon-alpha production in patients with tuberculosis: correlation with clinical outcome and treatment response. Clin. Exp. Immunol. 143, 329-337 (2006).
- Hosmalin, A., Lichtner, M., Louis, S. Clinical analysis of dendritic cell subsets: the dendritogram. Methods Mol. Biol. 415, 273-290 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon