Method Article
Imaging 3D e ricostruzione di strutture cerebrovascolari in Zebrafish embrionali
In questo articolo
Riepilogo
Imaging di sviluppo cerebrovascolare in zebrafish larvale è descritto. Sono forniti anche tecniche per facilitare l'imaging 3D e modificare lo sviluppo cerebrale con trattamenti chimici.
Abstract
Zebrafish sono un potente strumento per studiare la biologia dello sviluppo e patologia in vivo. La piccola dimensione e relativa trasparenza di embrioni di zebrafish li rendono particolarmente utile per l'esame visivo dei processi come cuore e sviluppo vascolare. In diversi studi recenti zebrafish transgenici che esprimono EGFP in cellule endoteliali vascolari sono stati usati per immagine e analizzare reti vascolari complesse nel cervello e retina, usando la microscopia confocale. Le descrizioni sono forniti da preparare, trattare e immagine embrioni di zebrafish che esprimono una maggiore proteina fluorescente verde (EGFP), e quindi generare rendering 3D completi del sistema cerebrovascolare. Protocolli includono il trattamento di embrioni, confocale, e protocolli di fissaggio che conservano EGFP fluorescenza. Inoltre, sono forniti consigli utili su come ottenere immagini di alta qualità delle strutture cerebrovascolari, come ad esempio la rimozione dell'occhio senza danneggiare vicina tessuto neurale. Potenziali insidiecon confocale sono discussi, insieme con i passi necessari per generare ricostruzioni in 3D stack di immagini confocale utilizzando liberamente disponibile software open source.
Introduzione
Zebrafish forniscono un potente sistema per studiare la biologia dello sviluppo, e la relativa trasparenza dei loro embrioni è suscettibile di studi di imaging basata su 1. Lo zebrafish è stato ora utilizzato come modello per lo sviluppo dei vertebrati per decenni. Teleostei, inclusi zebrafish, hanno un sistema vascolare vertebrato semplificato che non ha omologo ragionevole invertebrati. Il sangue viene pompato dalla camera anteriore di un cuore a due camere attraverso branchie, dove è ossigenata. Il sangue dalle branchie converge alla aorta dorsale e passa attraverso le arterie che si diramano in vasi più piccoli, infine capillari raggiungendo in tessuti di organi. Da capillari ossigeno viene rilasciato e anidride carbonica viene assorbita. Sul lato venoso dei capillari sangue scorre nelle vene sempre più grandi e viene infine aspirato nella camera posteriore del cuore, in cui il ciclo si ripete.
Un zebrafish adulto può deporre 200 o più uova alla volta, e ONCe fecondato, si sviluppano rapidamente 2. Entro un giorno l'asse corpo è ben sviluppato, compresi i muscoli che muovono contratto e l'embrione intorno all'interno della membrana coriali. Da 2-7 giorni dopo la fecondazione (dpf) la maggior parte dei sistemi del corpo a sviluppare, tra cui gli occhi e un sistema nervoso centrale in grado di coordinare nuotare verso il cibo o lontano dalla luce intensa. Fino a 7 embrioni DPF sono abbastanza piccoli da consentire la visualizzazione al microscopio. Linee transgeniche che esprimono proteine fluorescenti possono essere esposte con microscopia confocale o fluorescenza. Confocale può essere accoppiato con il software open-source 3 per creare rendering 3D delle strutture vascolari complete in embrioni di zebrafish che forniscono una prospettiva biologia dei sistemi di sviluppo vascolare. Studi in questione con i cambiamenti nella complessità vascolare e cerebrovascolari potranno beneficiare di questo protocollo in quanto consente una analisi a livello di sistemi di reti vascolari 4,5. Una raccolta di metodi e risorse sono fornired per consentire un facile adozione e di queste tecniche per studi che richiedono l'imaging di strutture vascolari in zebrafish embrionale. L'efficienza di costo di zebrafish come modello animale sta combinando con le tecnologie di imaging emergenti per fornire nuove piattaforme con cui valutare gli effetti angiogenici di vie molecolari di sviluppo dei vertebrati e l'omeostasi.
Protocollo
1. Zebrafish Zootecnica, Embrione generazione e trattamento
- Condurre i seguenti protocolli di zebrafish sotto la guida di un cura degli animali e l'uso comitato istituzionale (IACUC) e all'interno delle linee guida per la cura degli animali del NIH o di altre normative enti / linee guida.
- Ceppi di zebrafish che esprimono proteine fluorescenti in specifici tessuti, cellule o organi sono disponibili presso il Zebrafish International Center Resource (Zirc). Ad esempio, Tg (KDR: EGPF) s843 esprimono EGFP in cellule endoteliali vascolari 6, che possono essere utilizzati per produrre complete strutture vascolari 3D come mostrato in questo protocollo. Altre linee di zebrafish transgenico sono disponibili da Zirc.
- Casa zebrafish adulto in un sistema di acquacoltura appropriato che monitora pH, salinità, temperatura, ossigeno disciolto, luce, ed altri fattori ambientali 7. Il pesce zebra mostrata qui sono stati alloggiati in un sistema Aquaneering Inc. (San Diego, CA) a 28,5 ° C con un lig 14 oreht/10 ore di buio. Alimentare zebrafish adulto una dieta equilibrata di artemie e NRD 4/6 cibo Pesci (Brine Shrimp diretto, Ogden, Utah).
- Maschio adulto e zebrafish donna in età fertile dovrebbero essere alloggiati separatamente per aumentare l'accoppiamento di successo.
- Stimolare la deposizione delle uova e la fecondazione ponendo femmine (2-4) e maschi (4-6) insieme in un contenitore di accoppiamento che dispone di un fondo a rete con fori abbastanza grande per le uova cadono attraverso, ma troppo piccola per il numero di adulti zebrafish per passare . Impostare accoppiamenti la sera prima; uova vengono deposte in prossimità dell'alba, mentre di solito il ciclo di luce diurna aumenta lentamente di intensità (alba). Controllare uova sul fondo del contenitore accoppiamento ogni 15-30 minuti.
- Raccogliere le uova con un colino a maglia e pulito con tampone E3 (5 mM NaCl, 0,17 mM KCl, 0.33 mM CaCl 2, 0.33 MgSO mm 4). Trasferire le uova fino a 100 mm piastre di coltura riempito con tampone E3 e conservare in un incubatore a 28 ° C.
- Per studiare le sostanze chimiche che alterano cerebrovascular ramificazione aggiungi concentrazioni chimiche desiderati. Ad esempio ramificazione neovasular può essere indotta con inibitore di γ-secretasi (GSI IX/DAPT/N- [N-(3,5-Difluorophenacetyl-L-alanil)] estere-S-phenylglycinet-butil) solubilizzati in DMSO 4, iniziando 24 ore dopo la fecondazione (HPF). A quel tempo gli embrioni punti sono ancora all'interno del corion, e molte sostanze chimiche possono passare attraverso di esso 8. Se una condizione di trattamento ha neurali motorie o effetti che possono compromettere la capacità di embrioni per liberarsi del corion, quindi gli embrioni devono essere de-chorionated tra 24 e 48 HPF, che può essere fatto sia con una pinza di pronasi 2. Embrioni mostrati nelle immagini fornite sono state dechorionated afferrando delicatamente il corion con due pinze affilato e strappare aperto.
- Se necessario / desiderato, formazione di pigmento può essere inibita con l'aggiunta di 0,003% N-Phenylthiourea (PTU) al buffer E3 a 24 HPF.
2. Confocale Imaging di cerebrovascolare StructUres in Zebrafish fisso embrioni
- Sacrificare embrioni in 250 mg / L Tricaine metansolfonato, e poi fissarli per immersione in 2-4% paraformaldeide notte a 4 ° C. Contenitori con embrioni fluorescenti dovrebbero essere avvolti in carta stagnola. Una volta fissato, embrioni devono essere conservati in PBS a 4 ° C fino ripreso - EGFP fluorescenza diventa meno risolto dopo circa una settimana, ma morfologia (come visto in campo chiaro) è conservato molto più lungo.
- Preparatevi a montare l'embrione rimuovendo prima un occhio usando un ago di tungsteno affilato. Tagliare tutto il tessuto connettivo dell'occhio prima tagliare i muscoli, e infine tagliare il nervo ottico per spostare l'occhio. (Nota: remove Se l'imaging entrambi i lati si desidera entrambi gli occhi.)
- Una volta che l'occhio viene rimosso, montare l'embrione in un coprioggetti una goccia di 3% di metilcellulosa. Orientare l'embrione in modo che il lato con l'occhio rimosso sia rivolta coprioggetti ed è più vicino al vetro possibile. Coprire l'intero embrione con methylcellulose per prevenire l'essiccamento durante l'imaging.
- Immagine dell'embrione montato immediatamente utilizzando un microscopio confocale invertito equipaggiato con un obiettivo 20x Plan Apo alta qualità (apertura numerica = 0,75 o superiore). Questa configurazione è preferibile un microscopio non invertita che richiederebbe sandwich dell'embrione tra due piani di vetro, e premendo l'embrione contro il vetro superiore.
- Raccogliere fette ottici in 1 micron incrementi con un livello medio o grande apertura. Passi più grandi di 2,5 micron possono anche essere utilizzati, ma può essere più difficile da determinare l'ordine spaziale degli oggetti più piccoli. Piccole aperture producono maggiore nitidezza, ma le scansioni lunghi richiesti possono candeggiare EGFP e anche limitare la profondità di imaging nella embrione che può essere raggiunto. Un microscopio confocale permette l'imaging circa a metà strada attraverso un embrione.
- Se si desidera l'imaging del pesce intero, rimuovere entrambi gli occhi fin dall'inizio (vedi nota nel passo 3.2), ruotare l'embrione dopo imaging un lato e ripetere i passaggi 2,3-2,5 per il lato opposto.
3. 3D Ricostruzione di Zebrafish embrionali Cerebrovasculature
- Utilizzare la distribuzione Fiji 3 su open source ImageJ (http://fiji.sc), che è ottimizzata per rendering 3D, gratuito e compatibile con PC, Mac e Linux.
- Importa pile confocale a Fiji per andare a Plugins> LOCI> BioFormats Importatore 9, quindi selezionare il file confocale, ad esempio name.ids per pile Nikon (Figura 2A). Selezionare Visualizza stack con modalità HyperStack, Colore: scala di grigi, controllare autoscale, controllare i canali divisi.
- Queste selezioni si apriranno quattro pannelli canali separati; per EGFP saranno necessari solo uno, di solito il terzo giù. Chiudere gli altri tre pannelli (rosso, blu e alfa) lasciando l'immagine a 16 bit con un nome lungo seguito da C = 1 (Figura 2A).
- Regolare la soglia dalla scansione se l'immagine utilizzando il rotolo tab lungo il fondo per trovare una fetta che ha la regione o la struttura di interesse, poi vai a Immagine> Regolazioni> Soglia (Figura 2C).
- Nel pannello che si apre, fare scorrere la barra superiore (livello di nero) a sinistra in modo che la struttura possa essere visto molto bene su sfondo, e lasciare la slitta inferiore (livello di bianco), dove è (Figura 2D). Seleziona B & W, selezionare Sfondo scuro. Non selezionare Soglia calcolate per ogni immagine, a meno diversi aggiustamenti sono necessari per ogni sezione, selezionare Sfondo nero. Questo processo crea una nuova immagine a 8 bit.
- ATTENZIONE: soglia non può essere annullata o salvato in ImageJ, quindi lo stack confocale dovrà essere ricaricato ogni volta che è necessario un cambiamento. Annotare i numeri e provare diverse impostazioni fino ad ottenere il risultato desiderato.
- Vai a Plugins> Visualizzatore 3D> soglia 0, il fattore 1 (migliore) o 2 (buono) ridefinizione, deselezionare le caselle di colore rosso e blu per fare un uscita in 3D verde - altrimenti will produrre un rendering bianco - selezionare Applica (non Auto) (Figura 2E).
- Ruotare, girare e ingrandire l'immagine 3D utilizzando il mouse e comandi da tastiera (Figura 2F).
- Salvare immagini fisse in qualsiasi momento utilizzando l'opzione di cattura nel menu. La dimensione della casella di immagine sullo schermo determina le dimensioni in pixel dell'immagine prodotta quindi se un immagine ad alta risoluzione si desidera fare la scatola più grande trascinando l'angolo in basso a destra.
- Creare un filmato di filatura in 3D selezionando Visualizza> Record di rotazione di 360 gradi (Figura 2G). Default Rotazione a 2 gradi al passo, ma possono essere modificati a 5 gradi per esempio, che creerà file di dimensioni molto più piccole, ma possono aggiungere scatti per l'animazione.
- Salvare il file in uno dei diversi formati disponibili per la successiva visualizzazione con i lettori multimediali, caricare su Internet o utilizzando in presentazioni PowerPoint. Il lettore multimediale open source VLC ( http :/ / www.videolan.org / vlc / index.html), è gratuito e gestisce questi video molto bene.
Risultati
Ricostruzione 3D di strutture vascolari fornisce una prospettiva globale e visivamente interessante di sviluppo zebrafish. Metodi figure 1 e 2 mostrano che sono tipicamente fatte. Figura 3 mostra diversi angoli di strutture vascolari in 6 dpf zebrafish che esprime EGFP in cellule endoteliali. Con un colore verde o bianco solido può essere difficile apprezzare intensità del segnale; pseudo-colorazione forniscono intensità immagine da un look-up-table e permette una migliore percezione della profondità in cui le strutture si sovrappongono. Un esempio di una pseudo-colore immagine 3D del sistema vascolare in un 6 dpf zebrafish è fornito in Figura 4. Fluorescence Imaging di embrioni vivi può essere usata per studiare le caratteristiche fisiologiche che includono occhio e movimento del corpo, e l'attività cardiaca. Figure 3 e 4 mostrare i risultati rappresentativi ottenuti con questi metodi, utilizzando la linea zebrafish transgenico descritto. Risoluzione di immagini dipende dalle caratteristiche del microscopio, ma la luminosità del segnale EGFP è sufficiente per una buona qualità di immagine con la maggior parte dei sistemi commerciali. Ricostruzione e rendering di rappresentazioni 3D è coerente e opzioni all'interno di questo software open-source forniscono sempre buoni risultati.
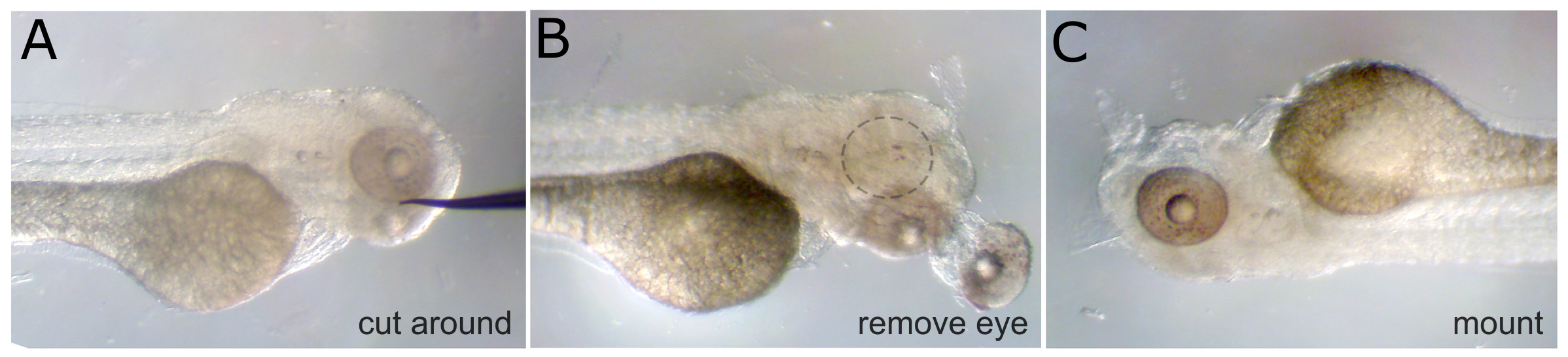
Figura 1. Rimozione degli occhi. A) Una fisso 3 dpf embrione con un bisogno tungsteno posizionato accanto all'occhio. Tessuto viene tagliato intorno all'occhio da questa posizione. B) L'occhio è cade fuori e muscoli oculari sottostanti e nervo ottico sono tagliati. La cavità oculare vuota è indicata con il cerchio tratteggiato. C) Lo stesso embrione è girato e montato con metil cellulosa, con l'occhio intatto rivolto verso l'alto. hres.jpg "target =" _blank "> Clicca qui per vedere una versione più grande di questa figura.
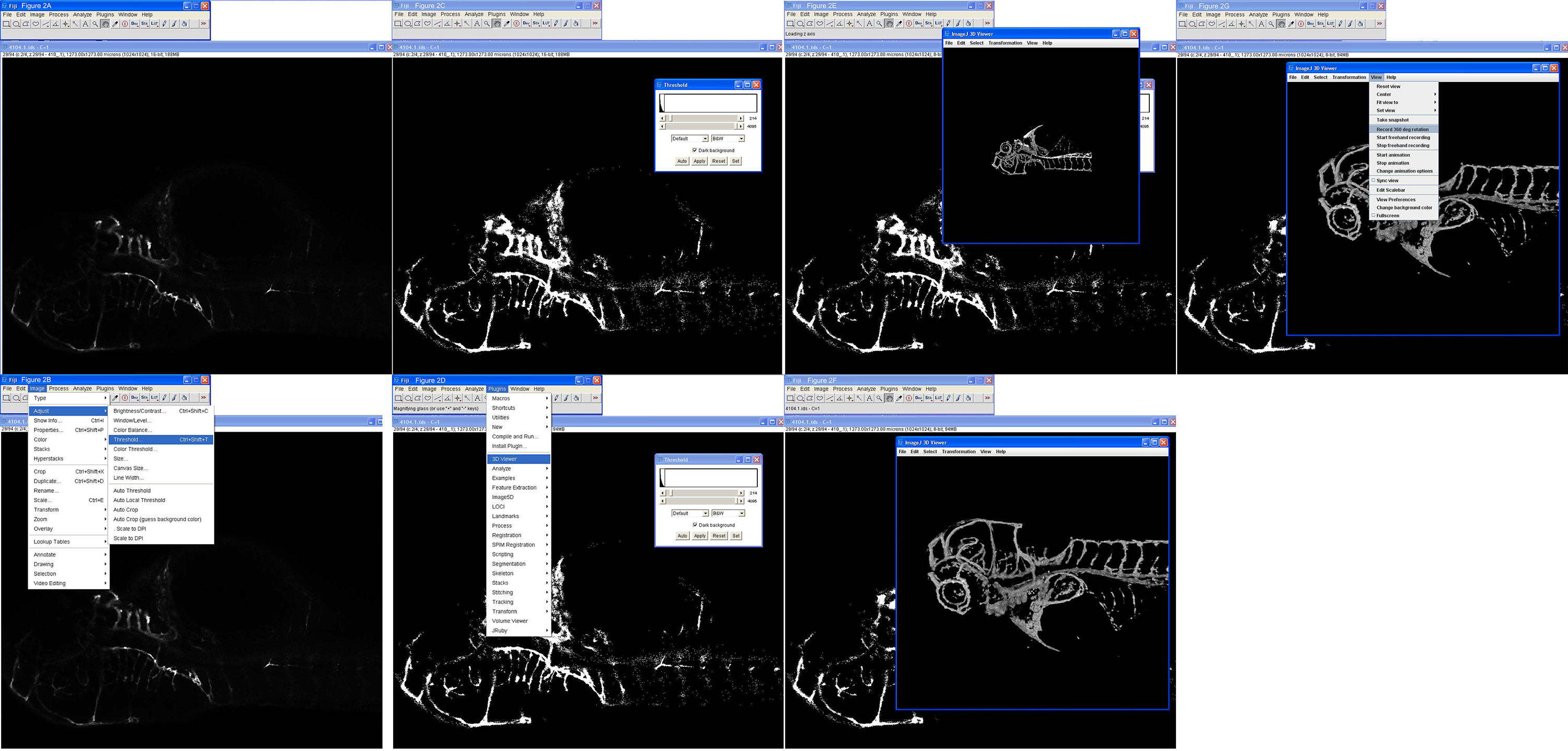
Figura 2. Passo-passo ricostruzione 3D di una pila di immagini confocale. A) Aprire il file (4104.1.ids) caricato all'interno Fiji utilizzando Plugins> LOCI> BIOFORMAT per selezionare. B) Dopo aver trovato una fetta con la regione di interesse, regolazione soglia viene selezionato come mostrato in figura. C) Soglia viene regolato a 214 con il top è selezionato scorrimento e applicare. visualizzatore D) 3D si chiama come mostrato in figura. E) La ricostruzione 3D è mostrato di una zebrafish con l'occhio intatto, per l'orientamento. F) L'immagine è stata ingrandita e ruotata. G) Un film rotazione di 360 gradi è realizzato come mostrato. res.jpg "target =" _blank "> Clicca qui per vedere una versione più grande di questa figura.
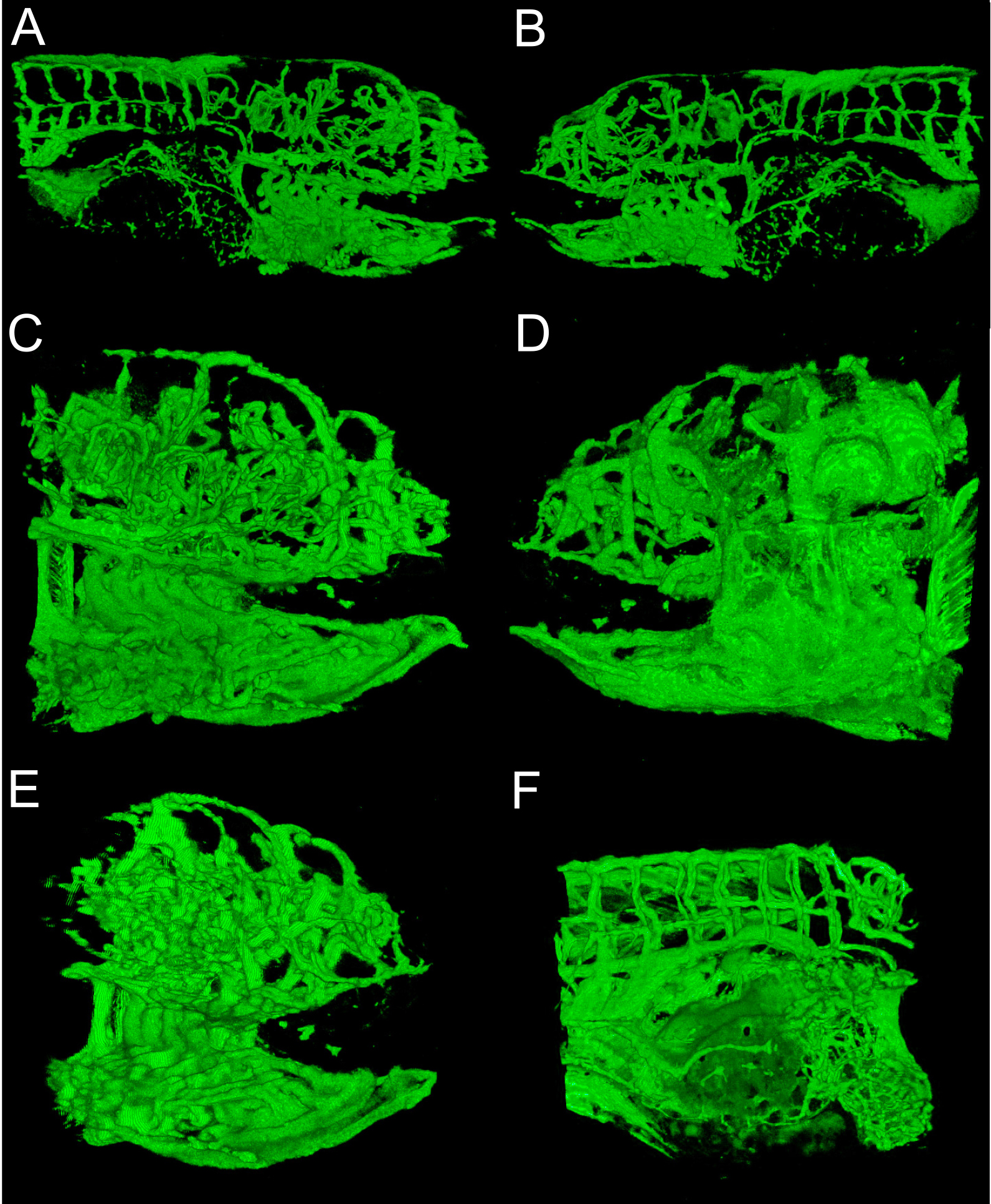
Figura 3. Prospettive di ricostruzione 3D. A) punto di vista mediale del 6 dpf embrione ripreso con obiettivo 10x, la bocca si trova sulla destra, non branchie all'interno della bocca. B) laterale dello stesso embrione, nota pinna è un ciclo nel mezzo. C) Stessa embrione ripreso con obiettivo 20x, punto di vista mediale, la risoluzione branchia nota. D) prospettiva laterale della 20x di imaging obiettivo. La pinna è sul bordo destro del pannello. E) vista antero-mediale della 20x rappresentazione oggettiva, branchie nota all'interno della bocca. F) Addome dello stesso embrione ripreso con un obiettivo 20x, la testa verso destra. Nota vascolare sul sacco vitellino in basso a destra.jove.com/files/ftp_upload/50417/50417fig3highres.jpg "target =" _blank "> Clicca qui per vedere una versione più grande di questa figura.
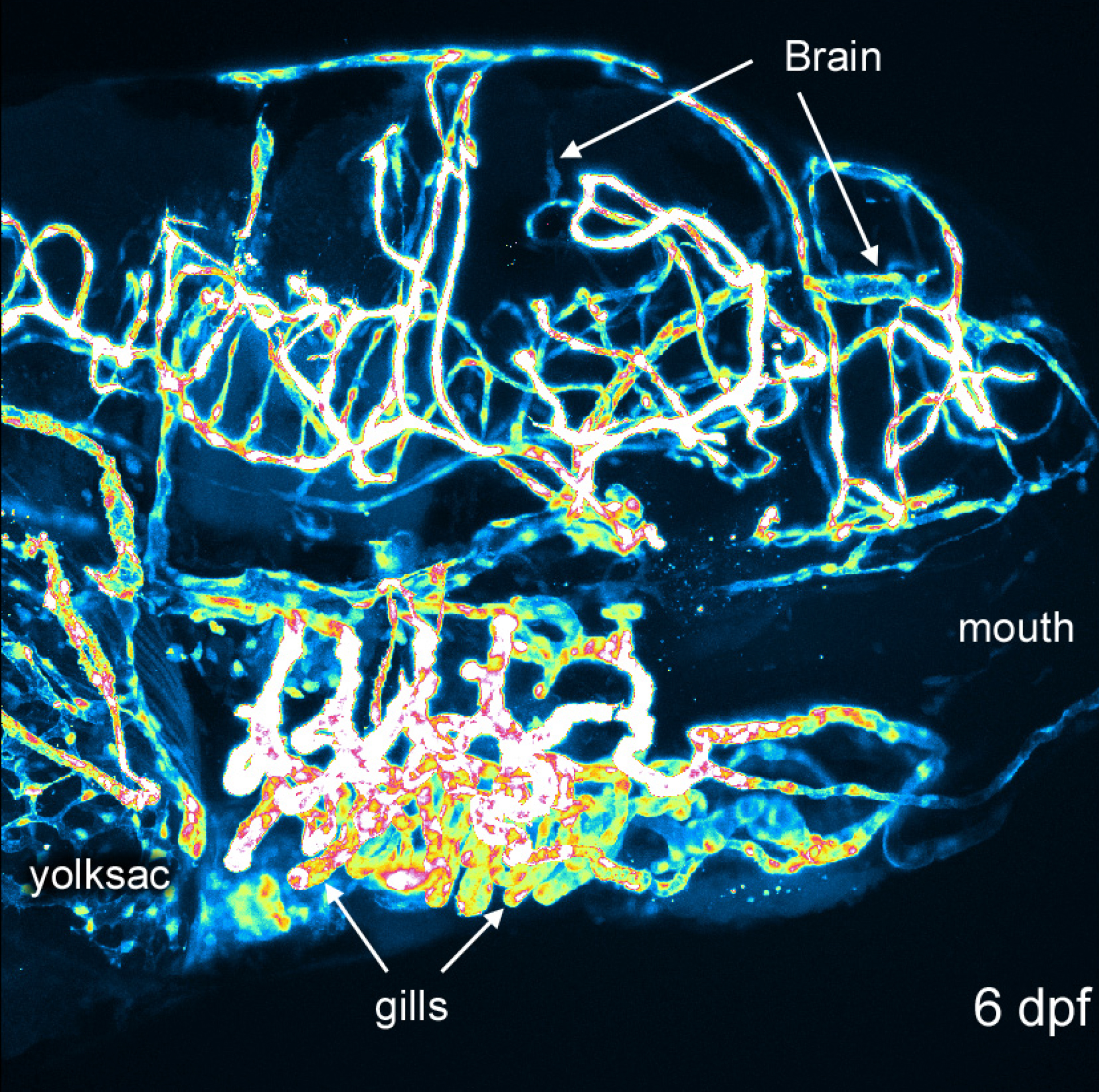
Differenze Figura 4. Intensità in 6 dpf embrione. Immagine di una ricostruzione 6 dpf utilizzando un pseudocolore look-up-table per l'intensità del segnale. Bocca, il cervello, le branchie e sacco vitellino sono etichettati per l'orientamento. Cliccate qui per vedere una versione più grande di questa figura.
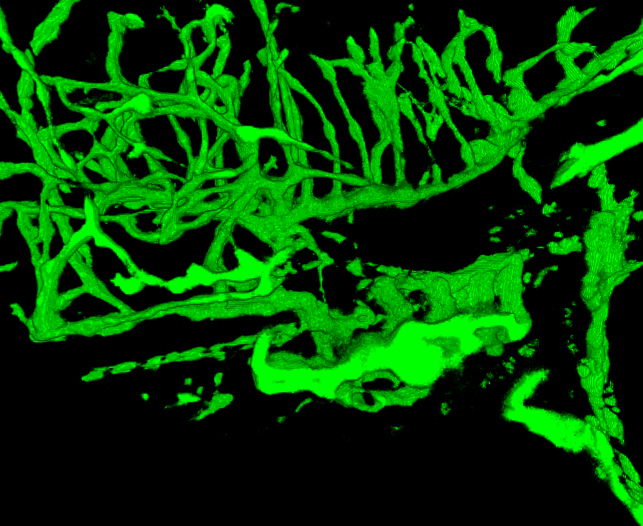
Figura 5. Movie del sistema vascolare ricostruito in un zebrafish 4 dpf. Il pesce è stato ripreso a 2,5 micron. Le immagini eranoda l'imaging metà dell'embrione. Confrontare strutture vascolari con strutture in un zebrafish GSI trattati forniti in Figura 6. Noti la minore densità dei vasi sanguigni nella testa e branchie grandi. (Vedere "Zfish_spin.avi" File supplementare sotto Downloads)
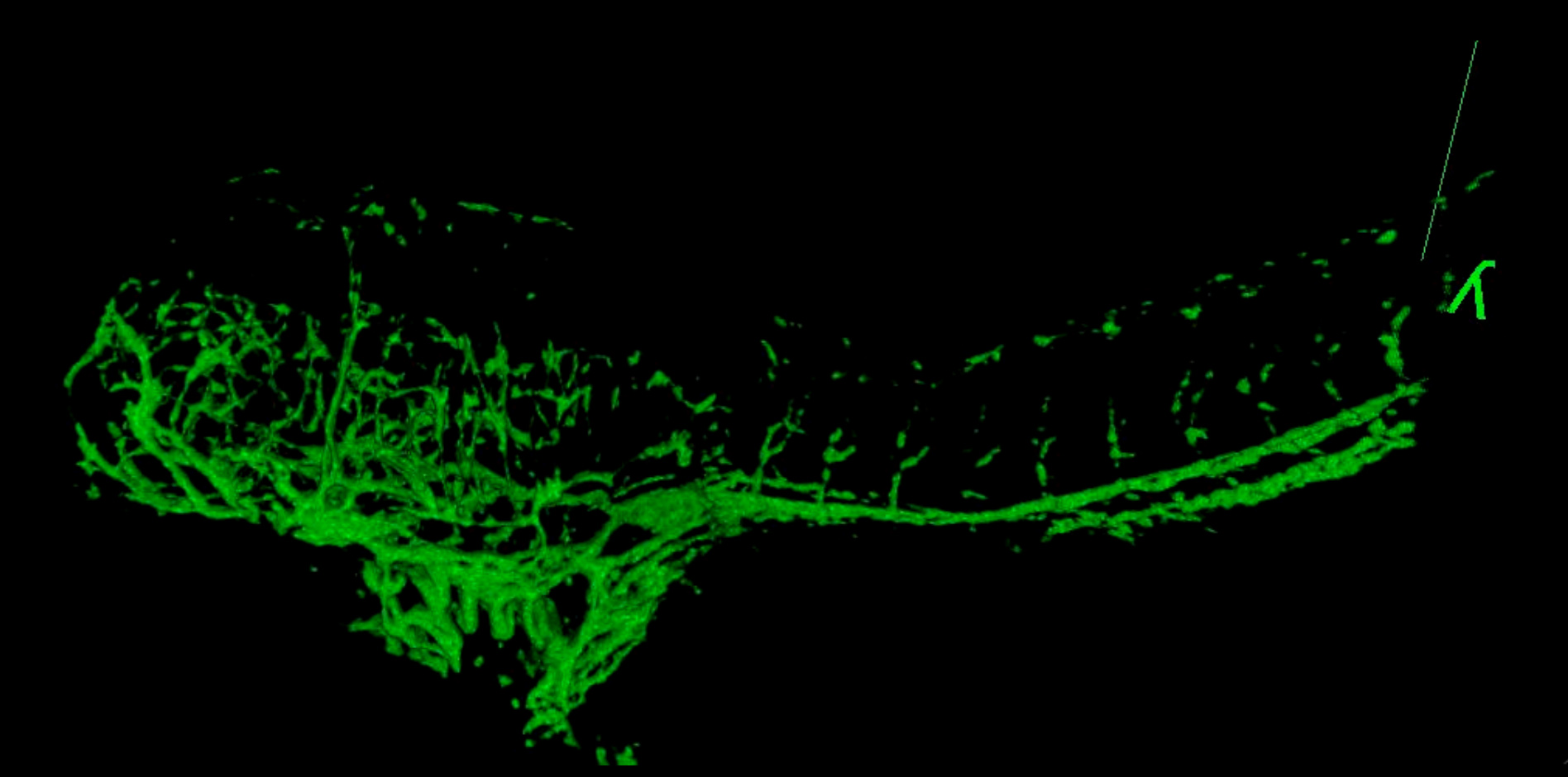
Figura 6. 3D Movie del sistema vascolare in un embrione GSI-trattato a 4 dpf. Il pesce è stato ripreso a 2,5 micron attraverso da laterale a linea mediana. Confrontare strutture vascolari con il controllo 4 dpf pesce mostrato in Figura 5. Il dorso arcuato e dimensioni ridotte sono tipici in embrioni trattati con questa sostanza chimica. (Vedere "GSI-treated_4dpf_fish.avi" File supplementare sotto Downloads)
Discussione
I metodi qui descritti forniscono una base per gli studi visivi del sistema vascolare nello sviluppo di zebrafish. Esemplari vivi possono essere usate per valutare i parametri fisiologici, come la frequenza cardiaca e la gittata sistolica cardiaca, mentre i campioni fissi possono essere usate per alta risoluzione confocale. Drosophila e C. elegans consentire intero corpo di imaging, ma zebrafish sono vertebrati e fornire un modello utile per tessuti vertebrati, compreso un sistema vascolare cellule endoteliali allineato. Questi studi possono incorporare significative linee transgeniche e risorse genomiche dalla comunità di ricerca zebrafish. Ricostruzione 3D e rendering delle immagini confocale di zebrafish embrionale, come qui descritte, consentirà un approccio di biologia dei sistemi di ramificazione vascolare e del sangue densità dei vasi che non è possibile con modelli animali grandi come ratti e topi. Inoltre, come amnioti zebrafish sviluppano in un ambiente modificabili (buffer E3), dove si può facilmente aggiungere chemicals che inibiscono gli enzimi specifici o altri processi che influenzano lo sviluppo vascolare. La concentrazione e la tempistica di consegna chimiche possono essere modificati, consentendo al ricercatore condizioni di trattamento di fine-tune.
1. Modifiche e risoluzione dei problemi
Le modifiche al sistema possono includere linee transgeniche di zebrafish che esprimono proteine fluorescenti EGFP o altri in una varietà di tessuto, organo o regione specifici modelli 10. Inoltre, l'analisi delle variazioni neovascolari nella retina zebrafish è stato recentemente pubblicato 5. Problemi con la pigmentazione di embrioni anziani e zebrafish adulti possono essere compensati da incrocio con linee transgeniche che non producono pigmenti di scala o pigmentato retinico. Problemi con la fluorescenza diminuita in genere derivano da condizioni di fissazione inadeguato. Paraformaldeide (4%) per 1 giorno è ottimale, ma fissativi più forti, come la glutaraldeide, tetrossido di osmio o alcool, possonodistruggere EGFP fluorescenza. Dopo la fissazione, gli embrioni devono essere conservati in PBS a 4 ° C e sempre protetti dalla luce solare diretta.
2. Limitazioni di questa tecnica
La qualità e la risoluzione di rendering 3D prodotti con questo protocollo dipendono dalla qualità delle immagini generate. Penetrazione della luce attraverso questi embrioni è limitata al piano sagittale utilizzando un microscopio confocale standard. Questo aspetto delle immagini limita la profondità delle immagini in embrioni grandi e negli adulti, ma i sistemi di microscopia multi-fotone più avanzati consentono per l'imaging a profondità maggiori.
3. Importanza rispetto ai metodi esistenti
Questo protocollo fornisce un approccio per l'analisi delle reti del vaso sanguigno a livello dei sistemi che possono incorporare un intero animale. Rappresentazioni precedenti di tali dati, spesso invocato serie di immagini disposte insieme, ma il rendering 3D fornisce una migliore risoluzione del rapporto spazialetionships coinvolti.
4. Applicazioni future
Nuovi sviluppi nel campo dell'imaging e trattamento dei tessuti fornirà molte nuove applicazioni per questi metodi che possono comprendere facendo embrioni superiore o gli adulti trasparente 11-14. Maggiore trasparenza aumenterà notevolmente la penetrazione nei tessuti da laser confocale e multi-fotone. Inoltre, poiché la velocità di telecamere e fotomoltiplicatori aumentare potrebbe essere presto possibile produrre rendering 3D di pesci in tempo reale, fornendo una 4 ° dimensione di analisi.
5. Passaggi critici
Un passo fondamentale in questo protocollo è la preparazione per l'imaging, che comprende la fissazione corretta. Imaging deve essere fatto il più presto possibile dopo fissazione con obiettivi di alta qualità che hanno le migliori aperture numeriche disponibili. Risoluzione dipende dal sistema di imaging utilizzata, sistemi così alta qualità sono generalmente migliori. Generazione di rendering 3D è la memoria intensivaper così nuovi, computer di fascia alta, con una grande quantità di memoria e di buoni processori grafici sono raccomandati.
Il sistema visivo biologia qui descritto è stato ottimizzato per zebrafish transgenici che esprimono EGFP in cellule endoteliali vascolari, sebbene questi metodi possono essere adattati agli embrioni transgenici che esprimono GFP, o altre proteine fluorescenti, in popolazioni di neuroni, muscoli, ghiandole o qualsiasi numero di altre cellule. Il principale vantaggio nel lavorare con questo sistema è la possibilità di studiare ciò che sta accadendo in tutta embrione in qualsiasi momento durante questo periodo di sviluppo, negli animali fisse e / o dal vivo.
Divulgazioni
Non c'è nulla da rivelare.
Riconoscimenti
Gli autori ringraziano i membri passati e presenti dei nostri laboratori che hanno contribuito a sviluppare queste tecniche. Finanziamento parziale fornito DE da una sovvenzione da parte del California Institute for Regenerative Medicine / CIRM (RN1-00538).
Materiali
| Name | Company | Catalog Number | Comments |
| N – Phenylthiourea | Alfa Aesar, catalog #41972 | 0.2 M in E3 buffer, kept at 4 °C | |
| E3 buffer | Sigma | 5 mM NaCl, 0.17 mM KCl, 0.33 mM CaCl2, 0.33 mM MgSO4 | |
| Confocal microscope | Nikon | D-EclipseC1 on a Nikon TE-2000U | |
| Glass bottom dishes | Mat-Tek | ||
| GSI IX/DAPT | N-[N-(3,5-Difluorophenacetyl-L-alanyl)]-S-phenylglycinet-butyl ester EMD Biosciences | ||
| 24 well plates | Becton-Dickinson, cat# 351147 | BD Falcon | |
| Transfer pipettes | VWR, cat #414004-001 | VWR disposable transfer pipettes | |
| Methyl-cellulose | Alfa Aesar, cat#43146 | 3% in E3 buffer | |
| NRD 4/6 Fish food | Brine Shrimp Direct | Dried | |
| Brine shrimp | Brine Shrimp Direct | Live | |
| Tungsten wire | Small Parts # TW-016-60 | 0.016” OD | |
| Tricaine | VWR # 101107-950 | Tricaine methanesulfonate 250 mg/L in E3 buffer |
Riferimenti
- Staudt, D., Stainier, D. Uncovering the molecular and cellular mechanisms of heart development using the zebrafish. Annu Rev Genet. 46, 397-418 (2012).
- Westerfield, M. The Zebrafish Book. , University of Oregon Press. (2007).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9, 676-682 (2012).
- Cameron, D. J., et al. Alzheimer's-related peptide amyloid-β plays a conserved role in angiogenesis. PLoS ONE. 7, (2012).
- Cunvong, K., Huffmire, D., Ethell, D. W., Cameron, D. J. Amyloid-β increases capillary bed density in the adult zebrafish retina. Invest Ophthalmol Vis Sci. 54, 1516-1521 (2013).
- Jin, S. W., Beis, D., Mitchell, T., Chen, J. N., Stainier, D. Y. Cellular and molecular analyses of vascular tube and lumen formation in zebrafish. Development. 132, 5199-5209 (2005).
- Lawrence, C. The husbandry of zebrafish (Danio rerio): a review. Aquaculture. 269, 1-20 (2007).
- Hagedorn, M., Kleinhans, F. W., Artemov, D., Pilatus, U. Characterization of a major permeability barrier in the zebrafish embryo. Biol Reprod. 59, 1240-1250 (1998).
- Schmid, B., Schindelin, J., Cardona, A., Longair, M., Heisenberg, M. A high-level 3D visualization API for Java and ImageJ. BMC Bioinformatics. 11, 274(2010).
- Opitz, R., et al. Transgenic zebrafish illuminate the dynamics of thyroid morphogenesis and its relationship to cardiovascular development. Dev Biol. 372, 203-216 (2012).
- Gleave, J. A., et al. Neuroanatomical phenotyping of the mouse brain with three-dimensional autofluorescence imaging. Physiol Genomics. 44, 778-785 (2012).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497, 332-337 (2013).
- Markaki, Y., Smeets, D., Cremer, M., Schermelleh, L. Fluorescence in situ hybridization applications for super-resolution 3D structured illumination microscopy. Methods Mol Biol. 950, 43-64 (2013).
- Walter, T. J., Sparks, E. E., Huppert, S. S. 3-dimensional resin casting and imaging of mouse portal vein or intrahepatic bile duct system. J Vis Exp. 68, e4272(2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon