Method Article
Iniezione intra-linfonodo di particelle polimeriche biodegradabili
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
I linfonodi sono i tessuti immunologici che orchestrano la risposta immunitaria e sono un obiettivo critico per i vaccini. I biomateriali sono stati impiegati per colpire meglio i linfonodi e per controllare la consegna di antigeni o coadiuvanti. Questo articolo descrive una tecnica che combina queste idee per iniettare particelle polimeriche biocompatibili nei linfonodi.
Abstract
La generazione di risposta immunitaria adattiva si basa su un efficiente drenaggio o traffico di antigene ai linfonodi per la lavorazione e la presentazione di queste molecole estranee ai linfociti T e B. I linfonodi sono quindi diventati obiettivi critici per nuovi vaccini e immunoterapie. Una strategia recente per colpire questi tessuti è l'iniezione diretta di linfonodi di componenti del vaccino solubili, e gli studi clinici che coinvolgono questa tecnica sono stati promettenti. Sono state inoltre studiate diverse strategie di biomateriale per migliorare il targeting dei linfonodi, ad esempio la messa a punto delle dimensioni delle particelle per un drenaggio ottimale delle particelle del vaccino contro i biomateriali. In questo articolo presentiamo un nuovo metodo che combina l'iniezione diretta di linfonodi con particelle polimeriche biodegradabili che possono essere cariche di antigene, coadiuvante o altri componenti del vaccino. In questo metodo le microparticelle polimeriche o le nanoparticelle sono sintetizzati da un protocollo di doppia emulsione modificato che incorpora stabilizzatori lipidici. Le proprietà delleparticelle (ad esempio dimensioni, carico del carico) sono confermate rispettivamente dalla diffrazione laser e dalla microscopia fluorescente. I linfonodi del topo vengono quindi identificati mediante iniezione periferica di un colorante tracciante non tossico che consente la visualizzazione del sito di iniezione bersaglio e la successiva deposizione di particelle polimeriche nei linfonodi. Questa tecnica consente il controllo diretto sulle dosi e le combinazioni di biomateriali e componenti vaccinale consegnati ai linfonodi e potrebbe essere sfruttata nello sviluppo di nuovi vaccini a base di biomateriali.
Introduzione
I linfonodi (LN) sono i centri di comando del sistema immunitario. In questo sito immunologico, l'antigene che presenta le cellule primi linfociti ingenui contro specifici antigeni estranei per attivare risposte immunitarie cellulari e umoriali. Le LN sono quindi diventate un obiettivo attraente per la somministrazione di vaccini e immunoterapie. Sfortunatamente, la maggior parte delle strategie vaccinale si traducono in una consegna inefficiente e transitoria di antigene e coadiuvanti al tessuto linfoide1. Approcci che migliorino l'individuazione e la conservazione dei componenti dei vaccini nelle LN potrebbero quindi avere un impatto significativo sulla potenza e sull'efficienza dei nuovi vaccini.
Una strategia per aggirare la sfida del targeting LN che ha dimostrato grande interesse per i nuovi studi clinici è l'iniezione diretta, intra-LN (i.LN.)2-4. Questi studi hanno utilizzato la guida ecografico per fornire vaccini alle LN come semplice procedura ambulatoriale. Rispetto alle tradizionali vie di iniezione periferica, questo approccio ha portato a un significativo risparmio di dose e a una migliore efficacia in contesti terapeutici tra cui allergie ecancro 2-4. Questi studi hanno impiegato l'iniezione di vaccini solubili (cioè senza biomateriali)che sono stati rapidamente cancellati dal drenaggio linfatico. Pertanto, sono state somministrate iniezioni multiple o cicli di iniezioni multiple per ottenere questi impressionanti effetti terapeutici. Una migliore ritenzione nella LN potrebbe migliorare l'interazione tra antigene e/o adiuvante e cellule immunitarie, migliorando ulteriormente la potenza dell'adescamento delle cellule immunitarie. Questo potenziale è supportato da recenti studi che mostrano che la cinetica dell'antigene e del parto adiuvante gioca un ruolo fondamentale nel determinare la rispostaimmunitaria specifica generata 5-7. Inoltre, localizzare e ridurre al minimo le dosi di farmaci e vaccini potrebbe ridurre o eliminare gli effetti sistemici, come l'infiammazione cronica.
I biomateriali sono stati ampiamente studiati per migliorare la potenza e l'efficienza deivaccini 1,8,9. L'incapsulamento o l'adsorbimento sui trasportatori di biomateriali può proteggere fisicamente il carico dalla degradazione e superare i limiti di solubilità. Un'altra caratteristica degna di nota dei portatori di biomateriali, come micro o nanoparticelle polimeriche, è la capacità di coricarsi diverse classi di carico e, successivamente, rilasciare questi carichi a intervalli controllati. Tuttavia, una limitazione significativa che continua a ostacolare i vaccini biomateriali e le immunoterapie in vivo è il targeting inefficiente delle cellule immunitarie e il traffico limitato ai linfonodi. Ad esempio, l'iniezione periferica di vaccinibiomateriali attraverso percorsi convenzionali (ad esempio intradermico, intramuscolare) presenta in genere un cattivo targeting LN, con fino al 99% del materiale iniettato rimasto nel sito diiniezione 4,10. Più recentemente, le dimensioni dei portatori di vaccini biomateriali sono state ottimizzate per migliorare il traffico preferenziale o il drenaggio di questi vaccini verso le LN attraverso il flusso interstiziale8,10. Questi progressi hanno portato a maggiori risposte immunitarie cellulari e umoristico, sottoscrivendo l'importanza di indirizzare e progettare l'ambiente LN per nuovi vaccini.
Questo documento presenta un protocollo di vaccinazione che combina particelle polimeriche stabilizzate dai lipidi e consegna i.LN. per generare depositi di vaccini arilascio controllato 5,11. Sulla base di recenti studi che utilizzano tecniche chirurgiche per i.LN. neitopi 6,7,12,13, abbiamo sviluppato una strategia rapida e non chirurgica per iniettare vaccini biomateriali in piccoli animali5. Combinando la somministrazione di i.LN. con portatori di vaccini biomateriali, la risposta cellulare CD8 T è migliorata in modo potente entro 7 giorni dopo una singola iniezione di depositi di vaccini arilascio controllato 5. È stata generata anche unaforte risposta umorista (cioè tatri anticorpali); entrambi i miglioramenti erano legati ad una maggiore ritenzione di componenti del vaccino nei linfonodi che è stata mediata dal rilascio controllato dai portatori di biomateriali. È interessante notare che le dimensioni delle particelle vaccino hanno alterato il destino di questi materiali una volta nelle LN: le particelle su scala nanometrica hanno mostrato un maggiore assorbimento diretto da parte delle cellule, mentre microparticelle più grandi sono rimaste nell'ambiente LN extracellulare e hanno rilasciato carichi(ad esempio coadiuvanti) che sono stati ripresi dall'antigene residente nella LN che presentale cellule 5. Questi dati suggeriscono due percorsi che potrebbero essere sfruttati per nuovi vaccini controllando le dimensioni dei biomateriali iniettati i.LN.
In questo articolo le particelle polimeriche biodegradabili stabilizzate dai lipidi (micro e nanoscala) vengono sintetizzati utilizzando una strategia di doppiaemulsione modificata 5,11. Le proprietà delle particelle sono caratterizzate da diffrazione laser e microscopia. Queste particelle vengono quindi iniettate direttamente nelle LN inguinali identificate non chirurgicamente utilizzando un comune colorante tracciante non tossico14. L'analisi post-iniezione delle LN mediante istologia o citometria del flusso può essere utilizzata per verificare la distribuzione delle particelle all'interno dell'ambiente LN, nonché per monitorare l'assorbimento cellulare e la ritenzione di particelle nel tempo. Per i protocolli che descrivono in dettaglio l'elaborazione istologica e la citometria del flusso, i lettori sono riferiti ai recenti articoli jove e alle relazionidi giornale 15-22. I risultati tipici dimostrano il targeting locale di LN di questi depositi che potrebbero essere sfruttati per ottenere risposte immunitarie potenti ed efficienti o per personalizzare l'immunità per gli agenti patogeni bersaglio.
Protocollo
Tutti gli studi sugli animali in questo protocollo sono stati completati in conformità con le linee guida federali, statali e locali e utilizzando protocolli esaminati e approvati dal Comitato istituzionale per la cura e l'uso degli animali (IACUC) dell'Università del Maryland.
1. Sintesi di micro e nanoparticelle stabilizzate dai lipidi
- In una fiala di vetro da 7 ml, combinare lipidi DOPC, DSPE-PEG e DOTAP con un rapporto molare 60:20:20 per preparare un mix lipidico maestro.
- Per sintetizzare un singolo campione: Trasferire 242,9 μl, 287,4 μl e 71,9 μl, rispettivamente di DOPC, DSPE-PEG e DOTAP, nel flaconcino usando pipette sierologiche in vetro da 2 ml.
- Per sintetizzare più campioni: moltiplicare ogni volume lipidico sopra per il numero di campioni e combinarlo in un unico flaconcino, quindi trasferire aliquote uguali di questa miscela lipidica in flaconcini corrispondenti a ciascun campione da preparare.
- Lipidi secchi sotto un flusso delicato di gas azoto per 10 minuti o posizionare nel forno sottovuoto durante la notte.
- In un unico flaconcino di vetro vuoto da 20 ml sciogliere 80 mg di PLGA in 5 ml di diclorometano per ogni campione di particelle per generare una soluzione di stock polimerico da 16 mg/ml.
- Aggiungere 5 ml di soluzione polimerica al flaconcino o ai flaconcino contenenti i lipidi secchi, il cappuccio e il vortice per 30 secondi.
- Per sintetizzare microparticelle:
- Inizia a sonicare la fase organica contenente il polimero, i lipidi e altri carichi insolubili in acqua sul ghiaccio a 12 W usando un sonicatore.
- Creare l'emulsione acqua-in-olio (w/o) utilizzando una pipetta per aggiungere 500 μl di H2O distillato, o H2O contenente 1 mg di peptide, proteine o altro carico solubile in acqua.
- Continuare a sonicare per 30 secondi a 12 W sul ghiaccio, dondolando delicatamente il flaconcino su e giù e da un lato all'altro intorno alla punta del sonicatore per garantire una completa emulsione.
- Creare l'emulsione acqua-in-olio in acqua (w/o/w) versando l'emulsione w/o in 40 ml di H2O in un bicchiere da 150 ml.
- Omogeneizzare per 3 minuti a 16.000 giri/min utilizzando un omogeneizzatore digitale.
- Aggiungere una barra di agitazione magnetica, trasferire il becher su una piastra di agitazione e lasciare che l'emulsione w/o/w si mescola durante la notte per rimuovere il solvente in eccesso.
- Per sintetizzare le nanoparticelle:
- Inizia a sonicare la fase organica contenente il polimero, i lipidi e altri carichi insolubili d'acqua sul ghiaccio a 14 W.
- Creare l'emulsione w/o utilizzando una pipetta per aggiungere 500 μl di H2O distillato o H2O contenente 1 mg di peptide, proteine o altro carico solubile in acqua.
- Continuare a sonicare per 30 secondi a 14 W sul ghiaccio.
- Creare l'emulsione w/o/w versando l'emulsione w/o a 40 ml di H2O in un bicchiere da 150 ml e sonicando per 5 minuti a 16 W sul ghiaccio. Scuotere delicatamente il flaconcino su e giù e da un lato all'altro intorno alla punta del sonicatore per garantire una completa emulsione.
- Aggiungere una barra di agitazione magnetica, trasferire il pallone su una piastra di agitazione e lasciare che l'emulsione w/o/w si mescola durante la notte per rimuovere il solvente in eccesso.
- La mattina dopo, lavare e raccogliere particelle:
- Versare l'emulsione attraverso un filtro cellulare in rete di nylon da 40 μm in un tubo conico da 50 ml.
- Particelle di centrifuga per 5 min a 5.000 x g per le microparticelle o 5 min a 24.000 x g per le nanoparticelle.
- Decantare le particelle supernatanti e lavate rimontendo in 1 ml di H2O.
- Trasferire particelle sospese in un tubo di microcentrifugo da 1,5 ml.
- Centrifuga per 5 min a 5.000 x g per le microparticelle o 5 min a 24.500 x g per le nanoparticelle.
- Lavare le particelle altre due volte rimuovendo il supernatante, rimescolando in 1 ml H2O e centrifugando come nel passaggio 1.6.5. Dopo il lavaggio, sospendere le particelle in 1 ml H2O per un uso immediato o liofilizzare per una conservazione estesa.
2. Misurazione della resa di sintesi
- Preweighare una fiala di vetro vuota da 20 ml. Aggiungere 100 μl di sospensione delle particelle al flaconcino preweighed dopo aver pipettato su e giù con una micropipetta da mescolare.
- Lyophilize le particelle o asciugare sotto un dolce flusso di azoto.
- Pesare la fiala contenente il polimero essiccato. Determinare la resa delle particelle nel flaconcino sottraendo il peso originale del flaconcino dalla massa del flaconcino contenente le particelle essiccate.
- Determinare la resa complessiva delle particelle moltiplicando la massa delle particelle nel flaconcino per il fattore di diluizione. Per determinare la resa percentuale, dividere la massa delle particelle per la massa di input teorica massima e moltiplicare per il 100%.
3. Determinazione della dimensione delle particelle
- Pulire la cella di frazione di vetro in dotazione in stile cuvette riempiendosi con acqua deionizzata e pulendo con tampone con punta di cotone. Trasferire 10 ml di H2O distillato alla cella di fazione pulita, aggiungere la barra magnetica di micro agitazione e caricare la cella di frazione nel supporto cellulare dell'analizzatore di dimensioni delle particelle.
- Regolare la velocità di agitazione magnetica nell'analizzatore di particelle per ottenere una miscelazione completa nella cella di frazione e chiudere la porta del vano.
- Allineare i laser alla cella di frazione utilizzando l'interfaccia software dello strumento.
- Utilizzare l'interfaccia software dello strumento per registrare una lettura di base con la cella di frazione contenente solo H2O distillato.
- Pipettare la sospensione originale delle particelle su e giù con una micropipetta da mescolare.
- Pipetta 10 μl di sospensione delle particelle (tipicamente circa 0,5 mg) nella cella frazionale. Assicurarsi che il volume del campione di particelle aggiunto alla cella sia sufficiente a generare la potenza del segnale nell'intervallo appropriato come indicato sull'interfaccia software dello strumento. La massa effettiva delle particelle richieste dipende dalla resa percentuale e dalle proprietà ottiche del campione di particelle.
- Chiudere la porta del compartimento dell'analizzatore di dimensioni delle particelle e misurare la dimensione delle particelle utilizzando un indice di rifrazione di 1,60 per PLGA.
- Utilizzare l'interfaccia software per calcolare il diametro delle particelle utilizzando una base numerica.
4. Visualizzazione delle particelle
- Sospensione delle particelle pipetta su e giù con micropipetta da mescolare. Diluire la sospensione delle particelle a 1 mg/ml in acqua deionizzata.
- Preparare uno scivolo al microscopio aggiungendo 3 μl di sospensione di particelle diluite e montando un coverslip con un angolo di 45 ° per evitare la formazione di bolle. Posizionare la diapositiva sullo stadio del microscopio e sull'immagine utilizzando i set di filtri appropriati per ogni carico fluorescente.
5. Preparazione di topi per i.LN. iniezione
- Preparare la soluzione di colorante tracciante:
- Preparare una soluzione dello 0,1% (w/v) di colorante tracciante sciogliendo 10 mg di polvere colorante con 10 ml di H2O distillato.
- Sterilizzare la soluzione colorante in una fiala di vetro utilizzando un filtro siringa da 0,2 μm.
- Un giorno prima dell'iniezione, anestetizzare il topo usando isoflurane secondo un protocollo animale approvato dalla IACUC. Per valutare la profondità dell'anestesia, eseguire un test riflesso del dito del dito del giorno e monitorare la frequenza respiratoria per garantire una frequenza respiratoria di circa 100-140 respiri al minuto.
- Radere i capelli alla base della coda e del quarto posteriore usando i tosatrici mentre il topo viene anestetizzato. Rimuovere i capelli dal lato ventrale dell'animale e lateralmente intorno al lato dorsale appena sopra l'articolazione della gamba posteriore (anca).
- Iniettare colorante tracciante.
- Per ogni iniezione di colorante, utilizzare una micropipetta per trasferire 10 μl di soluzione colorante in un tubo di microcentrifugo e aspirare l'intero 10 μl in un ago 31G attaccato a una siringa da 1 ml.
- Iniettare 10 μl di soluzione colorante per via sottocutanea su ciascun lato della base della coda in cui i capelli sono stati tagliati, ricaricandosi tra un'iniezione e l'altra.
- Rimuovere i capelli rimanenti applicando una leggera crema depilatoria tramite tamponi di cotone. Assicurati di rivestire l'area tra la coscia posteriore e l'addome.
- Lasciare incubare la crema depilatoria sulla pelle per 3 minuti. Dopo l'incubazione, mano guantata bagnata con H2O calda e strofinare delicatamente la crema depilatoria nella pelle.
- Rimuovere immediatamente la crema depilatoria bagnando la mano guantata con H2O calda e strofinando la base della coda e il quarto posteriore. Ripetere fino a quando l'eccesso di depilatorio viene rimosso, assicurandosi di tenere la mano bagnata per evitare irritazioni.
- Rimuovere lo spilatorio residuo dal mouse bagnando un panno morbido o un tovagliolo di carta con H2O caldo e in un unico movimento, pulendo la parte inferiore del mouse. Evitare un movimento di sfregamento per prevenire abrasioni o danni alla pelle al mouse.
- Lasciare che il mouse si riprenda sotto una lampada termica e ritorni a tenere.
6. i.LN. Iniezione di particelle
- Il giorno seguente, anestetizza il topo usando l'isoflurane secondo un protocollo animale approvato dalla IACUC.
- Esaminare il mouse per confermare il drenaggio del colorante tracciante in ogni linfonodo inguinale. Il linfonodo dovrebbe essere visibile come una macchia scura vicino alla coscia posteriore e all'addome.
- Preparare la soluzione di iniezione di particelle:
- Particelle di resuspend in H 2 Odistillatoalla concentrazione di iniezione desiderata. Per ogni iniezione, utilizzare una micropipetta per trasferire 10 μl di soluzione particellare in un tubo di microcentrifugo.
- Aspirare l'intero 10 μl in un ago di insulina 31G attaccato a una siringa da 1 ml.
- Iniettare la dose di particelle:
- Dopo aver visualizzato LN, stringere la pelle intorno a LN usando pollice, indice e dito medio per tirare la provocazione della pelle e consentire il posizionamento controllato del volume di iniezione.
- Avvicinati all'LN con l'ago con un angolo di 90° rispetto alla pelle e penetra la pelle sopra l'LN tinto a una profondità di 1 mm.
- Iniettare lentamente l'intero volume. Durante l'iniezione, osservare il volume LN attraverso la pelle per confermare l'iniezione mediante ingrandimento visibile della LN.
- Consentire al mouse di recuperare sotto una lampada termica e tornare a tenere o condurre ulteriori test.
Per le tecniche di analisipertinenti (ad esempio istologia, citometria del flusso) si vedano gli articoli 265, 1743 e 3054 e i protocolli attuali in immunologia, capitoli 5 e 2115-22.
Risultati
I risultati attesi per i protocolli presentati in questo manoscritto possono essere suddivisi in tre categorie: sintesi delle particelle, preparazione animale e iniezione di particelle.
La figura 1 descrive la sintesi e la caratterizzazione delle particelle polimeriche biodegradabili, stabilizzate dai lipidi anfifili. I risultati del protocollo di sintesi dell'evaporazione emulsione/solvente(figura 1A)possono essere valutati qualitativamente mediante ispezione visiva delle emulsioni finali generate; i lotti di particelle devono essere emulsioni omogenee e stabili con un aspetto opaco. Le complicazioni includono emulsioni che cremano o flocculate, spesso a causa di una conservazione impropria degli stabilizzatori lipidici. Per evitare questa instabilità, i lipidi devono essere conservati a -80 °C in uno stato disidratato o in una fiala sigillata spurgata con azoto. La valutazione quantitativa della sintesi delle particelle può essere eseguita utilizzando la diffrazione laser o lo scattering dinamico della luce per analizzare la distribuzione delle dimensioni (Figura 1B). I risultati attesi includono particelle monomodali strettamente distribuite, che indicano una popolazione uniforme di particelle. I parametri di sintesi descritti in questo manoscritto generano distribuzioni medie numerate centrate rispettivamente a circa 100 nm o 3 μm per nanoparticelle e microparticelle. Un'ulteriore valutazione qualitativa della sintesi delle particelle può essere ottenuta attraverso la modifica del protocollo di cui sopra per incorporare più classi di carico fluorescente. Nella figura 1C, le immagini al microscopio di microparticelle cariche di un peptide fluorescente (FITC, verde), un colorante lipofilo (DiD, rosso) e un'immagine sovrapposta (gialla) confermano la creazione di particelle entro l'intervallo di dimensioni desiderato e l'incapsulamento del peptide all'interno del volume della particella.
I primi due gruppi della figura 2 riassumono i risultati attesi della preparazione animale per la strategia di iniezione i.LN. descritta in questo documento. La metodologia prevede la marcatura delle LN inguinali mediante iniezione periferica di un tracciante non tossico per identificare la posizione per la successiva iniezione di particelle ( Figura2A)5. Come notato, il drenaggio del colorante tracciante a seguito dell'iniezione sottocutanea alla base della coda consentirà la visualizzazione delle LN inguinali (Figura 2B)5. L'ingestione di creme depilatorie approvate può rappresentare un pericolo per i topi. Pertanto, si dovrebbe fare attenzione a rimuovere completamente tutta la crema applicata, prestando particolare attenzione alle zampe e al lato ventrale dei topi. La depilatoria deve essere rimossa utilizzando un panno bagnato e morbido o un tovagliolo di carta bagnato in un unico movimento liscio. Evitare lo sfregamento per rimuovere la crema, in quanto ciò può portare ad abrasioni sulla pelle esposta dei topi.
La conferma del locale di consegna alla LN inguinale può essere valutata attraverso l'osservazione o l'istologia. Il volume LN può essere monitorato visivamente durante l'iniezione come indicatore di iniezione riuscita. I risultati attesi includono un'efficiente distribuzione del carico in tutta la struttura LN, senza perdite significative ai tessuti o alle cellule adiacenti. Inoltre, man mano che il fluido iniettato sposta/diluisce il tracciante nella LN, la concentrazione/colorazione del colorante dovrebbe diventare meno intensa dopo l'iniezione. L'osservazione del tessuto dovrebbe rivelare una LN intatta, ma ingrandita a causa dell'iniezione di liquidi. Le potenziali sfide includono l'iniezione troppo rapidamente o la mancanza della LN, che possono causare l'eluizione del volume nel tessuto sottocutaneo circostante. Questi esiti indesiderati possono essere confermati dalla necroscopia o dall'istologia, dove la sospensione delle particelle sarà osservata diffondersi a cellule e tessuti remoti da nodi mirati all'iniezione. Al contrario, un risultato atteso sarebbe l'identificazione di un LN inguinale allargato a causa del contenimento delle particelle all'interno della struttura LN. Il trattamento istologico delle LN asportate può confermare definitivamente la consegna del carico al tessuto linfoide, come mostrato nelle figure 2C e 2D. Si noti che le particelle nella figura 2 incorporano il carico fluorescente per consentire la visualizzazione del carico durante l'iniezione, nonché durante l'elaborazione istologica e la microscopia fluorescente.
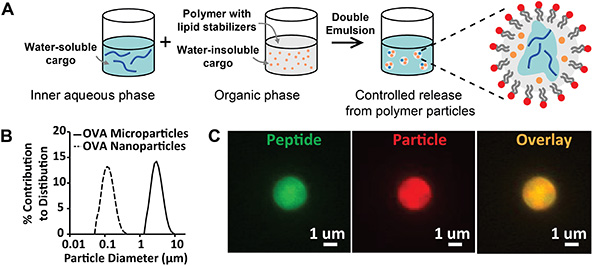
Figura 1. Sintesi e caratterizzazione delle particelle lipidiche stabilizzate. A) Schema che descrive la sintesi delle particelle stabilizzate dai lipidi preparate per evaporazione emulsione/solvente. B) Distribuzioni di dimensioni di microparticelle (linea solida, diametro = 2,8 μm) e nanoparticelle (linea tratteggiata, diametro = 113 nm). C)Immagini in microscopia fluorescente di particelle cariche di peptide con etichetta fluorescente e un colorante di particelle fluorescenti. Etichette: peptide (verde) e particella (rosso). Clicca qui per visualizzare l'immagine più grande.

Figura 2. I.LN. Iniezione e distribuzione di particelle biodegradabili all'interno di LN. A) Metodologia per iniezione i.LN. B) Visualizzazione delle LN in un mouse attraverso la pelle (immagine superiore) e successiva necroscopia (immagine inferiore)5. C)Colorazione istologica di una LN che conferma la deposizione e la distribuzione di microparticelle polimeriche fluorescenti (particelle, verde; T-cellule, rosso; Cellule B, blu). D)Nanoparticelle con etichetta fluorescente (50 nm, immagine sinistra) e microparticelle (6 μm, immagine destra) nelle LN 24 ore dopo l'iniezione. Clicca qui per visualizzare l'immagine più grande.
Discussione
La tecnica descritta in questo protocollo consente la consegna controllata di vaccini alle LN e alle cellule di presentazione dell'antigene residente in LN. Il carico incapsulato di biomateriale può essere localizzato all'interno della LN, consentendo la manipolazione delle dosi di uno o più tipi di carico consegnate al microambiente LN. La localizzazione e il rilascio controllato da particelle polimeriche ha dimostrato di generare una potente risposta immunitaria cellulare e umorista a dosi significativamente inferiori rispetto agli approcci convenzionali. Inoltre, attraverso la manipolazione delle dimensioni del vettore di biomateriali, la modalità primaria di elaborazione cellulare può essere modulata tra l'assorbimento diretto di nanoparticelle o il rilascio di carichi extracellulari da microparticellepiù grandi 5. Questi risultati stabiliscono la fattibilità della somministrazione di biomateriali i.LN. come piattaforma per la somministrazione di vaccini terapeutici.
La sintesi delle particelle PLGA per evaporazione emulsione/solvente è stata ampiamente utilizzata nelle applicazioni disomministrazione di farmaci 23,24. Pertanto, le potenziali sfide associate a questa tecnica riguardano principalmente l'identificazione e la deposizione di vaccini di successo nel sito target della LN. Sebbene l'uso del colorante tracciante faciliti la visualizzazione delle LN inguinali mirate, le dimensioni e la profondità target sotto la pelle sono piccole. Pertanto, gli autori raccomandano di assegnare tempo e topi per praticare la preparazione e le iniezioni di topi. Durante la preparazione animale (cioè la rasatura e l'applicazione di depilatori), si deve fare attenzione a non tagliare i topi sul lato ventraledell'animale dove l'angolo della gamba con l'addome rende la pelle più soggetta a lesioni da tosaerba. Inoltre, tutti i depilatori devono essere rimossi con acqua tiepida per impedire agli animali di ingerire la crema durante il normale comportamento di toelettatura. Per praticare le iniezioni di LN, è possibile somministrata una maggiore concentrazione di coloranti traccianti e praticare gli animali, e quindi iniettati più volte. Dopo iniezione i topi possono essere necropificati e le dimensioni delle LN degli animali iniettati possono essere confrontate con un LN di controllo non iniettato. Una limitazione di questa tecnica è il limite fisico del volume di iniezione che può essere caricato nella struttura LN. Il nostro protocollo suggerisce un volume di iniezione di 10 μl nei topi, anche se altri studi hanno riportato volumi di iniezione maggiori almeno fino a 20 μl.13 Tuttavia, la somministrazione diretta di vaccini tramite iniezione i.LN. consente un drastico risparmio di dose, quindi la funzione di questi vaccini non dovrebbe generalmente essere limitata da vincoli di volume.
Come notato, cambiare la proprietà fisicadelle particelle (cioè le dimensioni) è un meccanismo efficace per alterare la via o i risultati indotti dai biomateriali e dai carichi incapsulati nel tessuto LN. Il protocollo di evaporazione emulsione/solvente può essere facilmente modificato per alterare proprietà fisiche o chimiche come la carica o la funzionalità della superficie e la velocità di biodegradazione / rilascio delcarico 23,24. Ad esempio, la cinetica di rilascio può essere sintonizzata attraverso composizioni polimeriche alternative e la funzione superficiale può essere modificata utilizzando composizioni lipidiche modificate o poly (alcol vinilico). Il carico caricato in particelle può essere facilmente manipolato per contenere diversi antigeni o coadiuvanti per agenti patogeni bersaglio. Il vantaggio di questo approccio si ottiene attraverso la combinazione della consegna i.LN. con il rilascio locale e controllato di merci da biomateriali. Questa sinergia stabilisce una piattaforma che può essere sfruttata per generare in modo efficiente risposte immunitarie adattive utilizzando dosi minute e con effetti collaterali non specifici / sistemici ridotti.
Divulgazioni
I costi di produzione e le spese di accesso per questi articoli sono stati parzialmente sponsorizzati da HORIBA, Ltd.
Riconoscimenti
Questo lavoro è stato finanziato in parte dalla fondazione PhRMA e da un Research and Scholar Award dell'Università del Maryland, College Park. Ringraziamo il Prof. Darrell Irvine per il supporto del lavoro iniziale condotto nel completamento di"Ingegneria in situ del microambiente linfonodo tramite iniezione intranodale di particelle polimeriche che rilasciano coadiuvanti". 5 la commissione per i
Materiali
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375 | 10 mg/ml stock in chloroform |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[amino(polyethylene glycol)-2000] ammonium salt (DSPE-PEG) | Avanti Polar Lipids | 880128 | 10 mg/ml stock in chloroform |
| 1,2-Dioleoyl-3-trimethylammonium-propane chloride salt (DOTAP) | Avanti Polar Lipids | 890890 | 10 mg/ml stock in chloroform |
| Polylactic-co-glycolic acid (PLGA) | Sigma-Aldrich | P2191 | Lactide:Glycolide (50:50). MW 30,000-60,000 |
| Dichloromethane (DCM) | VWR | BDH1113 | |
| Isoflurane | Vetone | 502017 | |
| Nair | Nair | ||
| Evans blue tracer dye | VWR | AAA16774-09 | |
| U-100 BD Ultra-Fine Short Insulin Syringes, 31 G 5/16 in needle | VWR | BD328418 | |
| Single-Use Needles, BD Medical, 21 G, 1.5 in needle | VWR | BD305167 | |
| Syringes with BD Luer-Lok Tip, BD Medical, 1 ml | VWR | BD309628 | |
| Falcon Cell Strainers, Sterile, Corning, 40 µm | VWR | 21008-949 | |
| Vybrant DiD Cell-Labeling Solution | Invitrogen | V-22887 | |
| Fluoresbrite YG Microspheres 6.00 µm | Polysciences | 17149 | |
| Fluoresbrite YG Microspheres 0.05 µm | Polysciences | 17156 | |
| Ovalbumin, Purified | Worthington Biochemical | LS003056 | |
| Qsonica Sonicator Ultrasonic Processor Q125 | Qsonica | Q125 | 1/8 in diameter microtip probe |
| Ultra-Turrax T 25 digital homogenizer | IKA | YO-04739-22 | 10 G dispersing element |
| Fluorescent Microscope | Olympus | IX-83 | |
| Laser Diffraction Particle Size Distribution Analyzer | Horiba | LA-950 | Including provided cuvette-style glass fraction cell |
| Professional 8685 Peanut Classic Clippers | Wahl |
Riferimenti
- Swartz, M. A., Hirosue, S., Hubbell, J. A. Engineering Approaches to Immunotherapy. Sci. Transl. Med. 4, (2012).
- Adamina, M., et al. Intranodal immunization with a vaccinia virus encoding multiple antigenic epitopes and costimulatory molecules in metastatic melanoma. Mol. Ther. 18, 651-659 (2010).
- Ribas, A., et al. Intra-Lymph Node Prime-Boost Vaccination against Melan A and Tyrosinase for the Treatment of Metastatic Melanoma: Results of a Phase 1. Clinical Trial. Clin. Cancer Res. 17, 2987-2996 (2011).
- Senti, G., et al. Intralymphatic allergen administration renders specific immunotherapy faster and safer: a randomized controlled trial. Proc. Natl. Acad. Sci. U.S.A. 105, 17908-17912 (2008).
- Jewell, C. M., Lopez, S. C. B., Irvine, D. J. In situ engineering of the lymph node microenvironment via intranodal injection of adjuvant-releasing polymer particles. Proc. Natl. Acad. Sci. U.S.A. 108, 15745-15750 (2011).
- Johansen, P., et al. Antigen kinetics determines immune reactivity. Proc. Natl. Acad. Sci. U.S.A. 105, 5189-5194 (2008).
- Randolph, G. J., Angeli, V., Swartz, M. A. Dendritic-cell trafficking to lymph nodes through lymphatic vessels. Nat. Rev. Immunol. 5, 617-628 (2005).
- Irvine, D. J., Jewell, C. M. Ch. 132. Comprehensive Biomaterials. Ducheyne, P., et al. , (2011).
- Moon, J. J., Huang, B., Irvine, D. J. Engineering Nano- and Microparticles to Tune Immunity. Adv. Mater. 24, 3724-3746 (2012).
- Reddy, S. T., et al. Exploiting lymphatic transport and complement activation in nanoparticle vaccines. Tissue Eng. Part A. 14, 734-735 (2008).
- Bershteyn, A., et al. Polymer-supported lipid shells, onions, and flowers. Soft Matter. 4, 1787-1791 (2008).
- Johansen, P., et al. Direct intralymphatic injection of peptide vaccines enhances immunogenicity. Eur. J. Immunol. 35, 568-574 (2005).
- Mohanan, D., et al. Administration routes affect the quality of immune responses: A cross-sectional evaluation of particulate antigen-delivery systems. J. Controlled Release. 147, 342-349 (2010).
- Harrell, M. I., Iritani, B. M., Ruddell, A. Lymph node mapping in the mouse. J. Immunol. Methods. 332, 170-174 (2008).
- He, H., Courtney, A. N., Wieder, E., Sastry, K. J. Multicolor Flow Cytometry Analyses of Cellular Immune Response in Rhesus Macaques. J. Vis. Exp. , 1743(2010).
- Matheu, M. P., Parker, I., Cahalan, M. D. Dissection and 2-Photon Imaging of Peripheral Lymph Nodes in Mice. J. Vis. Exp. e265. , 265(2007).
- Salmon, H., et al. Ex vivo Imaging of T Cells in Murine Lymph Node Slices with Widefield and Confocal Microscopes. J. Vis. Exp. , 3054(2011).
- Donaldson, J. G. in Current Protocols in Immunology: Immunofluorescence Staining. , John Wiley & Sons, Inc. (2001).
- Hofman, F. in Current Protocols in Immunology: Immunohistochemistry. , John Wiley & Sons, Inc. (2001).
- Holmes, K., Lantz, L. M., Fowlkes, B. J., Schmid, I., Giorgi, J. V. in Current Protocols in Immunology: Preparation of Cells and Reagents for Flow Cytometry. , John Wiley & Sons, Inc. (2001).
- Sharrow, S. O. in Current Protocols in Immunology: Overview of Flow Cytometry. , John Wiley & Sons, Inc. (2001).
- Sharrow, S. O. in Current Protocols in Immunology: Analysis of Flow Cytometry Data. , John Wiley & Sons, Inc. (2001).
- Anderson, J. M., Shive, M. S. Biodegradation and biocompatibility of PLA and PLGA microspheres. Adv. Drug Deliv. Rev. 28, 5-24 (1997).
- Danhier, F., et al. PLGA-based nanoparticles: an overview of biomedical applications. J. Controlled Release. 161, 505-522 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon