Method Article
Utilizzando Chips microfluidica per l'imaging dal vivo e studio delle risposte lesioni in
In questo articolo
Riepilogo
Drosophila larve sono un sistema modello attraente per l'imaging dal vivo a causa della loro cuticola trasparente e potenti genetica. Questo protocollo descrive come utilizzare un dispositivo PDMS singolo strato, chiamato il 'chip di larva' per l'imaging dal vivo di processi cellulari all'interno dei neuroni di 3 ° instar larve di Drosophila.
Abstract
L'imaging dal vivo è una tecnica importante per lo studio dei processi biologici cellulari, ma questo può essere difficile in animali vivi. La cuticola traslucido della larva di Drosophila rende un interessante organismo modello per studi di imaging dal vivo. Tuttavia, una sfida importante per le tecniche di imaging dal vivo è quello di immobilizzare e posizionare un animale sulla microscopio in maniera non invasiva. Questo protocollo rappresenta un metodo semplice e facile da usare per immobilizzare e di imaging larve di Drosophila su un polidimetilsilossano (PDMS) dispositivo microfluidica, che noi chiamiamo il 'chip di larva'. Il chip larva comprende un PDMS microcamera-fasciante che è collegato a un vetrino di vetro sottile, che, a richiesta di un vuoto mediante una siringa, immobilizza l'animale e porta strutture ventrali come il cordone nervoso, nervi segmentali e corpo muscoli della parete, nelle immediate vicinanze di coprioggetto. Questo permette di immagini ad alta risoluzione, e soprattutto, evita l'uso di anesthetics e sostanze chimiche, che facilita lo studio di una vasta gamma di processi fisiologici. Poiché larve correggere facilmente l'immobilizzazione, possono essere facilmente sottoposti a più sessioni di imaging. Questo permette di studi longitudinali oltre l'andamento nel tempo che vanno da ore a giorni. Questo protocollo descrive passo-passo come preparare il chip e come utilizzare il chip per l'imaging dal vivo di eventi neuronali in 3 ° instar larve. Questi eventi includono il rapido trasporto di organelli negli assoni, le risposte di calcio al pregiudizio, e gli studi time-lapse del traffico di proteine foto-cabriolet su lunghe distanze e tempi. Un'altra applicazione del chip è studiare rigenerativa e risposte degenerative lesione assonale, così la seconda parte di questo protocollo descrive un nuovo e semplice procedura per ferire assoni all'interno nervi periferici da schiacciamento del nervo segmentale.
Introduzione
Il moscerino della frutta, Drosophila melanogaster, è stata utilizzata come organismo modello per oltre 100 anni, e si è dimostrato determinante nella definizione di segnalazione fondamentale e percorsi di sviluppo che sono conservati dagli invertebrati per la salute umana. L'imaging dal vivo è un approccio importante per studiare i meccanismi cellulari, e il semplice piano corpo e la cuticola traslucido della larva di Drosophila rende un interessante sistema per l'imaging dal vivo, soprattutto perché ci sono molti strumenti genetici disponibili per esprimere le proteine fluorescenti taggati in tipi cellulari specifici.
Una sfida importante per le tecniche di imaging dal vivo è quello di immobilizzare e posizionare un animale per la microscopia in modo non invasivo. Approcci immobilizzazione convenzionali includono dissezione 1,2 o l'uso di cloroformio, entrambi i quali la morte dell'animale. Etere 4 e isofluorano 5-8 sono stati utilizzati anche gli anestetici. Mentre anestetici offrono molti vantaggi, Essi inibiscono anche attività neurale e fisiologia importante (compreso il battito cardiaco) 9-11, quindi può influenzare il processo studiato e creare stress sul animale. Ci sono anche problemi di sicurezza umani a lavorare con etere e isofluorane.
Abbiamo sviluppato un metodo di drug-free per immobilizzare larve di Drosophila in un unico dispositivo microfluidica strato PDMS, che noi chiamiamo il 'chip di larva' 12. Questo protocollo descrive come ottenere o fare il chip larva, e su come utilizzarlo per l'imaging dal vivo nei primi mesi del-scenica 3 ° instar larve. Il chip comprende una microcamera-fasciante, che, a richiesta di un vuoto mediante una siringa, immobilizza l'animale con forza meccanica delicata. Il metodo di immobilizzazione porta strutture ventrali come il cordone nervoso, i nervi segmentali e muscoli della parete del corpo, nelle immediate vicinanze di un coprioggetto di vetro. Questo permette di imaging ad alta risoluzione di tali strutture con elevato aper numericotura (ad alto ingrandimento) obiettivi.
Vantaggi del chip larva rispetto ad altre tecniche convenzionali sono i seguenti: (i) uso di chip larva sostituisce l'uso di prodotti chimici, consentendo immagini in vivo di animali non anestetizzati. (Ii) Larve recuperare subito dopo il rilascio del chip (a differenza di un periodo di recupero 2 ore per isofluorane 8,13). Questo permette l'imaging su scale temporali ampi, che vanno da millisecondi a minuti, per ore e giorni. (Iii) L'uso di PDMS, che è un materiale permeabile ai gas, consente di diffusione continuo di ossigeno / aria dall'ambiente nel corpo larva. (Iv) Il chip è facile e sicuro da usare, e (v) è riutilizzabile, e può essere fabbricato ad un costo minimo.
Oltre alle istruzioni per l'uso del chip di larva, questo protocollo fornirà alcuni esempi del suo uso per studiare gli eventi neuronali in 3 ° instar larve. Questi includono l'imaging dal vivo di Axonatrasporto l, risposte di calcio di lesioni, e gli studi time-lapse del traffico di proteine foto-cabriolet su lunghe distanze e tempi.
Un'altra applicazione del chip è studiare risposte neuronali a danno assonale. Per questo una procedura aggiuntiva è descritta (parte 3) per ferire gli assoni all'interno nervi periferici da uno schiacciamento del nervo segmentaria. Questa semplice analisi può essere eseguita sia rapida e riproducibile allo stereomicroscopio dissezione standard, che consente per molti animali da elaborare allo stesso tempo. Risposte cellulari al danno possono essere studiati da imaging dal vivo nel chip larva.
Protocollo
1. Rendere il PDMS Chip
Per fare un chip PDMS dallo stampo SU-8, seguire i passaggi 1,1-1,7. Se il chip è a portata di mano, ma deve assemblato per l'uso, passare al punto 1.8.
- Mescolare 45 g di base di PDMS e 4.5 g di induritore (10:01 ratio) da un kit PDMS in un piccolo contenitore di plastica usa e getta e mescolare accuratamente con un bastoncino di plastica.
- Mettere il recipiente in un contenitore vuoto (ad esempio un essiccatore) per 10 minuti per rimuovere eventuali bolle.
- Collocare lo stampo SU-8 in fondo a 150 mm di diametro e piatto di plastica versare lentamente il composto PDMS sullo stampo. Fare attenzione a non generare bolle mentre versando il PDMS.
- Curare le PDMS in un forno (o incubatore) a 650 ° C per 4 ore.
- Togliere lo stampo PDMS/SU-8 curata dal forno e lasciate raffreddare per qualche minuto.
- Utilizzando una lama di rasoio, tagliare il PDMS vulcanizzati lungo il bordo della stampo SU-8 e staccarla dalla SU-8 stampo.
- Dividere la lastra PDMSin singoli chip PDMS usando una lama di rasoio.
- Utilizzando un ago di erogazione 21 G, fare un buco nella porta di aspirazione (illustrato nella Figura 1A) del chip PDMS.
- Prendete una erogazione ago 23 G e ruotare la punta dell'ago dalla sua base un paio di volte per rompere l'ago punta fuori dal mozzo serratura.
- Inserire la punta dell'ago 23 G in un piccolo pezzo di tubo di polietilene in modo che il tubo copra almeno un millimetro dell'ago. Quindi utilizzare una lama di rasoio per tagliare il tubo in eccesso lontano dall'ago. Questo crea un anello di plastica intorno un'estremità dell'ago, che creerà una guarnizione quando inserito nella porta di aspirazione sotto vuoto.
- Per l'uso con un microscopio invertito (Figure 1B e 2A-B): inserire la punta dell'ago 23 G nel foro della porta di aspirazione. Per l'uso con un microscopio verticale (Figure 1C e 2C-D): colpire un secondo foro sul lato del chip PDMS con Vernice 21 Gnsing ago; questo foro fornirà accesso al primo foro dal lato. Quindi inserire la punta dell'ago 23 G con l'anello tubo nel foro laterale. Posizionare un pezzo di nastro biadesivo sopra la parte superiore del chip PDMS per sigillare il foro superiore (Figura 1C).
- Prendete un pezzo di tubo in polietilene che è di circa 20 cm di lunghezza. Collegare un lato del tubo alla punta dell'ago che viene inserito nella porta vuoto.
- Collegare l'altra estremità del tubo ad una delle porte di una valvola a 3 vie (vedi '3 vie rubinetto 'nell'elenco dei materiali)
- Attaccare una siringa da 20 ml in una delle due porte rimanenti. L'ultima porta è aperta per l'ambiente.
2. Utilizzando la Larva Chip per Live Imaging
- Pulire il chip PDMS con nastro adesivo trasparente. Fissare un pezzo di nastro sul fondo del chip. Assicurarsi che il nastro sia a contatto con l'intera superficie PDMS, e poi staccare il nastro.
- Ripetere il passaggio precedente 2-3x per assicurarsi che nonsono particelle o olio (trattenuti dagli esperimenti precedenti) sulla superficie del chip PDMS. Poiché il chip PDMS è riutilizzabile, è molto importante rimuovere residui di olio in quanto può influenzare l'adesione di PDMS al vetro e provocare tenuta insufficiente.
- Trasferimento precoce (cioè di foraggiamento) 3 ° larve instar di una piastra di Petri contenente acqua. (Il foraggiamento 3 ° fase instar larve sono nel cibo, piuttosto che il lato del flaconcino cultura). Bagnare le larve in acqua per rimuovere terreno di coltura.
- Prendete un bicchiere coprioggetto pulito e mettere una piccola goccia di Halocarbon 700 olio al suo centro.
- Utilizzando pinze, delicatamente prendere un pulito, precoce messa in scena 3 ° instar larva dall'acqua (la larva deve essere ~ 3,5-4 mm di lunghezza). Posizionare l'animale brevemente un leggero pulire o tovagliolo di carta per rimuovere l'acqua in eccesso e poi metterlo sulla goccia di petrolio. La goccia deve essere abbastanza piccolo tale che la trachea delle larve non sono rivestite. Lasciate che la sta larvay sulla goccia di olio per 10 sec.
- Rimuovere la larva dalla goccia di olio e poi metterlo su un vetro coprioggetto pulito.
- Trasferire la larva di un altro bicchiere coprioggetto pulito. Questo passaggio rimuove l'olio in eccesso.
- Prestare attenzione all'orientamento larva. Per l'imaging i nervi del midollo e segmentale neurali, il lato ventrale della larva dovrebbe sedersi sul vetrino. Il suo lato dorsale, caratterizzato da due tubi tracheali longitudinali, deve essere rivolto verso l'alto. Nota: questo è l'orientamento della larva preferisce naturalmente.
- Posizionare delicatamente il chip PDMS sulla parte superiore della larva. La larva deve essere allineato al centro centro della microcamera, con la coda rivolta verso la porta di aspirazione. Fare attenzione che la larva non toccare i bordi della camera. Ciò è particolarmente importante per i terminali anteriori e posteriori tracheali. Nota: questo passaggio è meglio farlo sotto uno stereomicroscopio.
- Spingere il circuito integrato PDMS contro il vetrino di vetro per ottenere una buona tenuta. Assicurarsi che la larva è interamentedelimitata dalla microcamera quando il chip PDMS è a contatto con il vetrino di vetro.
- Commutare la valvola a 3 vie in modo che la siringa possa aspirare aria dalla microcamera PDMS (attraverso il tubo) per creare un vuoto.
- Con una mano, tenere saldamente il vetrino chip di PDMS / vetro. Con l'altra mano per tirare lo stantuffo della siringa. Prelevare 2-2,5 ml di aria, fino a sentire resistenza nel manico siringa, per creare il vuoto. Il vuoto produce una tenuta ottimale tra il chip PDMS, olio, e le interfacce coprioggetto e limita la mobilità della larva.
- Commutare la valvola fuori tale che il chip di PDMS è isolato dalla siringa e dal contesto. Come risultato, un livello di vuoto relativamente stabile è mantenuta nella microcamera senza la necessità di tenere lo stantuffo della siringa.
- Controllare la larva sotto lo stereoscopio per assicurarsi che l'intero corpo animale viene posto all'interno della microcamera, e che l'animale è immobile. La trachea deve essere visibile. Il resto delChip PDMS dovrebbe essere in contatto con il coprioggetto. Nota: vedere le figure 2E e 2F esempi di animali immobilizzati correttamente nel chip. Alcuni orientamenti corretti sono riportati nelle figure 2G e 2H.
- Posizionare il chip larva (chip di PDMS + vetrino di vetro) sul microscopio. Il chip larva, il tubo e la siringa deve essere maneggiato con cura per evitare il distacco del chip PDMS dal vetrino. Per un microscopio verticale, fissare il lato 'top' del chip al palco microscopio con nastro biadesivo (Figura 1C).
- Utilizzare un obiettivo ad alto ingrandimento (ad immersione in olio, 40-63X è raccomandato) per localizzare la struttura dell'animale (s) di interesse ed eseguire imaging. In alcuni casi, un ingrandimento inferiore può essere necessarie per identificare la regione desiderata per l'imaging prima di passare a maggiore ingrandimento.
- Quando l'imaging è completato, rilasciare il vuoto commutando la valvola nella posizioneche è aperta per l'ambiente.
- Staccare il chip PDMS dal vetrino. La larva deve essere immediatamente mobili.
- Usare pinze per rimuovere la larva dalla microcamera e posizionare con cura la larva su una piastra di agar succo d'uva per il recupero.
3. Indurre una lesione del nervo Crush di nervi larvale Segmentari
- Seguire passo 2.3 per isolare presto messo in scena 3 ° instar larve del genotipo desiderato. Come descritto al punto 2.3 bagnano le larve in acqua per rimuovere il cibo.
- Utilizzare una stazione di anestesia norma fly di CO 2, con emissioni di CO 2 pad tenuto sotto uno stereomicroscopio dissezione, per sottomettere le larve. Le larve dovrebbe diventare immotile dopo il posizionamento di CO 2 pad per 1-2 min.
- Ora posizionare un singolo larva anestetizzato su una piastra di agar succo d'uva con lo stereomicroscopio. Girare il lato ventrale degli animali fino a visualizzare il cordone nervoso ventrale e segmentaria nervi attraverso la cuticola ( Figura 3). Assicurarsi che la larva è completamente immotile.
- Utilizzando Dumostar numero 5 pinze, pizzicare i nervi segmentali strettamente attraverso la cuticola per 5-10 sec. Quando questo è fatto correttamente, la cuticola rimane intatta e la parete del corpo non è forata. Nota: La lesione può essere condotta in diverse posizioni lungo l'asse del corpo anteriore-posteriore, purché il cavo ventrale nervo, ghiandole salivari, intestino e non sono danneggiati. La posizione lesioni più efficace è verso la fine del segmento addominale 3a, come illustrato in Figura 3D. Infortunio in questa posizione danneggia la maggior parte dei nervi ed è il più facile da riprodurre senza uccidere l'animale.
- Dopo la lesione, ruotare l'animale in modo che il suo lato ventrale sulla piastra uva. Dovrebbe essere in grado di muovere la testa e mangiare. Se l'infortunio ha avuto successo, allora la parte posteriore della larva sarà paralizzato.
- Mantenere gli animali feriti sulla piastra di agar succo d'uva a 25 &# 176, C per il tempo desiderato in base all'obiettivo sperimentale. Per motoneuroni, il moncone prossimale comincia a germogliare entro 8-10 ore di lesioni 14, e il moncone distale inizia a degenerare entro 6-8 ore 15. Per la classe IV DA neuroni sensoriali, il moncone prossimale comincia a germogliare all'interno di 4-6 ore, e l'inizio moncone distale a degenerare entro 3-4 ore dopo l'infortunio. Nota: con opportuni driver GAL4 e giornalisti fluorescenti, la germinazione e la degenerazione possono essere osservati nel chip larva (per esempio, vedere la Figura 6).
Risultati
Il chip larva è costituito da un unico blocco strato PDMS, (un chip PDMS) il cui progetto è illustrato schematicamente in Figura 1. (Vedere anche il file DXF supplementare per progettare il proprio stampo). La microcamera larva, porto vuoto e canali perimetrali (Figura 1A) sono 140 micron rientranze nel chip PDMS. Il chip è posizionato sulla parte superiore di una prima scena 3 ° larva, che poggia su di un vetrino coprioggetto con olio (Figure 1B e 1 C). L'interfaccia di vetro olio tra il vetrino e il chip PDMS permette una tenuta da creare su richiesta di un vuoto mite. Questo sigillo intrappola le larve all'interno della camera, e fin dai primi anni in scena 3 ° instar larva è leggermente più spesso rispetto alla camera, sigillando la camera crea qualche costrizione fisica sull'animale, in modo efficace immobilizzazione e limitando il suo movimento. In questo stato immobilizzato, certo ventralestrutture del corpo, come il cordone nervoso ventrale segmentale e sono spinti vicino a coprioggetto. Questo è vantaggioso per l'imaging, poiché nello stato immobilizzato queste strutture possono trovarsi entro la distanza di lavoro di 40X e 63X obiettivi. Dopo il vuoto viene rilasciato, la larva può essere facilmente rimosso dalla microcamera, permettendo ulteriori esperimenti da eseguire. Questo approccio immobilizzazione puramente meccanico può mantenere il 90% delle larve vive dopo periodi di immobilizzazione continuo fino a 1 ora 12.
Il vuoto viene creato da un semplice siringa da 20 ml, quindi l'intera unità è facile da trasportare da un stereomicroscopio dove viene svolto il posizionamento nella camera, ad un microscopio confocale o epifluorescenza, dove viene eseguita l'imaging dal vivo. La siringa è collegata alla porta di aspirazione tramite tubo in polietilene e aghi da 23 G dispensazione (con mozzi blocco rimosso), come descritto nei passaggi 1,6-1,14. Per i microscopi invertiti, il tubosiringa e sono collegati tramite la parte superiore della piastrina (Figure 1B, 2A e 2 B). Per microscopi verticali, sono collegati tramite una porta sul lato del chip (Figure 1C, 2C, 2 e D). La configurazione per microscopi invertiti è un po 'più facile da usare. La siringa viene tirato per creare un vuoto dolce (di circa 10 psi), che lega l'interfaccia-vetro olio-PDMS per formare una tenuta ottimale tra coprioggetto e il dispositivo PDMS, intrappolando e immobilizzando la larva all'interno della camera.
Il posizionamento della larva nella microcamera (passaggi 2,7-2,10 nel protocollo) è critica per l'immobilizzazione efficace e sopravvivenza (figure 2E-H). Se l'animale è troppo grande per la camera, (figura 2G), o se la sua testa o trachea devono trovarsi tra il bordo della camera e le copertinelabbro (Figura 1H), allora è improbabile che sopravvivere alla procedura.
Di seguito sono riportati alcuni esempi di utilizzo del chip larvale studiare varie risposte cellulari nei neuroni (figure 4-7, un film S1 e S2 film).
Imaging del trasporto assonale veloce: Il chip larva è stato utilizzato per l'immagine del trasporto cinesina-mediata delle vescicole sinaptiche all'interno dei singoli assoni periferici (Figura 4 e Movie S1) Il anterograda (~ 1.0 micron / sec) e retrograda (~ 0,8 micron / sec. ) il movimento di queste vescicole può essere facilmente studiata da film raccolti su un microscopio confocale disco rotante.
Posizionamento del animale di microchirurgia laser:. Un neurone dendrite sensoriale è stata sezionato utilizzando un laser pulsato colorante UV (Figura 5 e film S2) Protocolli per l'uso di til suo metodo per la microchirurgia può essere trovato altrove 16,17. La tecnica di immobilizzazione efficiente consente rapidi cambi di tempo-scala nel neurone feriti, quali i cambiamenti nel calcio intracellulare (rilevati dal geneticamente codificato Ca 2 + indicatore GCamp3.0 18), per essere individuati e misurati (Figura 5).
Studio delle risposte rigenerativi e degenerative a lesioni: Se l'animale è permesso di riposare tra le sessioni di imaging, il chip larva quindi essere utilizzato per studiare gli eventi cellulari che si verificano su una vasta gamma di scale temporali. Ad esempio, sia 'rigenerativa' e le risposte degenerative a danno assonale, che si svolgono su un arco temporale di 15 ore, possono essere esposte nel chip larva (Figura 6). In questo esempio, gli assoni dei motoneuroni octopaminergic sono stati feriti tramite il schiacciamento del nervo segmentale (Figura 3), descritta nella parte 3 del protocollo. Il moncone assone prossimale,che subisce nuova germinazione, e gli assoni distali, che formano varicosità e poi vengono frammentati attraverso il processo di degenerazione Walleriana, possono essere esposte e studiate a diversi intervalli di tempo dopo la lesione.
Monitoraggio proteine fluorescenti fotoconvertibile nel tempo in vivo: lo sviluppo di proteine fluorescenti fotoconvertibile, la cui fluorescenza cambia irreversibilmente l'esposizione alla luce UV) permette di etichettare specificamente un sottoinsieme di proteine all'interno di una cella, e traccia il destino delle proteine marcate con il tempo 19 , 20. Questa tecnica è più comunemente condotta in coltura cellulare, tuttavia, con il chip larva si può tracciare proteine fotoconvertibile geneticamente codificate all'interno delle celle definite in vivo. Come esempio mostriamo che la proteina Denda2-α-tubulina fusion, espressa in classe IV DA neuroni sensoriali, può essere photoconverted nei corpi cellulari (Figure 7A e 7 B). Il trasporto delle proteine photoconverted può essere seguito nel tempo: entro due giorni abbiamo potuto rilevare una quantità significativa di proteina photoconverted entro i terminali degli assoni dei neuroni sensoriali, che si trovano ~ 1 mm dalla posizione originale nel corpo cellulare (figure 7A e 7 C).
Tutti gli esempi descritti (figure 4-7 e Film S1 e S2) sono stati ripresi utilizzando un sistema confocale disco rotante, costituito da uno scanner Nipkow CSU10 e una fotocamera C9100-50 EMCCD, montati su un Axio Observer con 63X (1,5 NA) Obiettivo del petrolio, e guidato utilizzando il software di acquisizione Volocity.
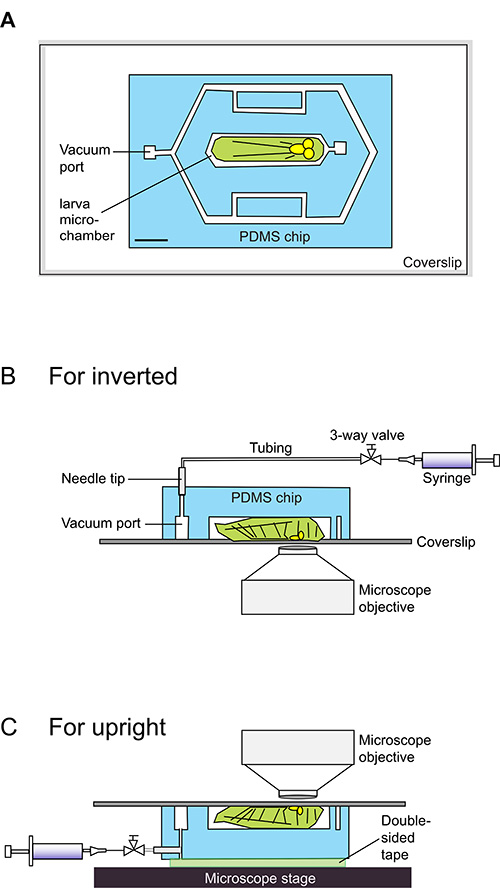
Figura 1. cartoni schematiche per l'uso del chip di larva.
(A) Il chip larva comprende chip PDMS, indicata in azzurro, aderito a un vetrino coprioggetto. Il chip contiene 140 micron di spessore canali microfluidica, indicati in bianco. La microcamera centrale è stata progettata per adattarsi perfettamente una prima messa in scena 3 ° instar Drosophila larva (cartooned in verde chiaro). Un file DXF contenente esatte dimensioni che possono essere utilizzati per progettare lo stampo è fornito come dati supplementari. Scale bar = 1,5 mm. (BC) Side-viste schemi per caricare una larva in un chip larva. La larva si siede lato ventrale su un vetrino, e il suo corpo si trova all'interno del 140 micron profondo microcamera. Una siringa da 20 ml è collegato alla luce di aspirazione del vuoto e viene usato per indurre un vuoto dolce. L'interfaccia-PDMS vetro Halocarbon è vincolata dal vuoto in una tenuta ermetica, che limita la larva della microcamera. Questo sigillo è facilmente reversibilerilasciando la pressione dalla siringa, dopo che l'animale riprenda immediatamente motilità. Per microscopi verticali (B), il vuoto siringa è collegato tramite polietilene-50 tubo dalla parte superiore del chip. Per microscopi invertiti (C), queste connessioni vengono realizzate tra il lato del chip, mentre il 'top' del chip è attaccato alla fase microscopio mediante nastro biadesivo.
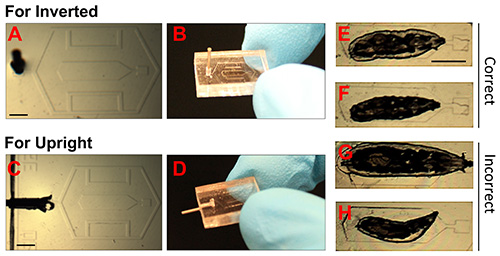
Figura 2. Immagini di chip PDMS e corretto posizionamento di larva.
(AD). Fotografie che mostrano PDMS chip per microscopi invertiti e verticali. Il G punta dell'ago erogatore 23 è stata inserita nella porta vuoto, che consente il collegamento tramite tubi a vuoto (siringa). Barra della scala = (EH) 1.5 mm.. immagini in campo chiaro di immobilizzato larve di Drosophila. E e F mostrare esempi di animali immobilizzati correttamente. L'animale più piccolo in F è preferibile se saranno condotti più immagini su tempi lunghi (> 12 ore). G indica un animale che è troppo grande, e H mostra un piccolo animale che è posizionato in modo non corretto. Barra della scala = 1,5 mm. Clicca qui per vedere l'immagine ingrandita.
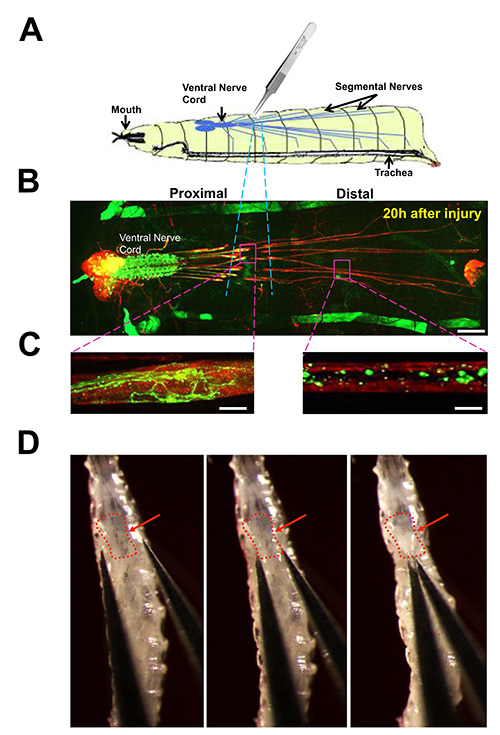
Figura 3. Nerve lesione da schiacciamento dei nervi segmentale in Drosophila larve.
(A) Cartoon del test schiacciamento del nervo. I nervi segmentale all'interno di un 3 ° instar larva sono schiacciati pizzicando la cuticola ventrale con il numero 5 pinze. (B) Veduta del sistema nervoso larvale di un animale sezionato 20 ore dopo schiacciamento del nervo. Immunostaining per membrane neuronali con anticorpi anti-HRP (rosso) mette in evidenza i lobi del cervello, cordone nervoso ventrale, e lunghe nervi segmentali che contengono motoneuroni e assoni dei neuroni sensoriali. Un sottoinsieme dei singoli motoneuroni sono etichettati guidando espressione di UAS-mCD8-GFP (green) con il driver m12-Gal4. Corpi cellulari e dendriti di questi neuroni si trovano nel cordone nervoso ventrale, mentre i loro assoni proiettano ai muscoli della parete del corpo attraverso i nervi segmentale. (Questo driver spinge anche l'espressione della GFP nel muscolo 12 per ogni hemisegment larvale, che insieme possono essere considerati come strisce antero-posteriori su entrambi i lati dell'animale). La regione danneggiata dalla calca è evidenziato con linee blu tratteggiate. Barra della scala = 70 micron. (C) Close up vista degli assoni danneggiati, 20 ore dopo l'infortunio. A sinistra: ilassone prossimale ha subito germinazione e la nuova crescita. A destra: l'assone distale è frammentato, con poco GFP restante, a causa della degenerazione Walleriana e liquidazione dei detriti. Barra della scala = 10 micron. (D) Immagini della schiacciamento del nervo in uno dei primi 3 ° instar larva. La freccia rossa al cordone nervoso ventrale. La posizione della cotta è verso il fondo del 3 ° segmento, come descritto nel testo Protocol (protocollo 3). Le immagini in D sono stati originariamente pubblicati in J. Biol Cella 191, 211-223, doi:.. 10,1083 (2010) Clicca qui per vedere l'immagine ingrandita.
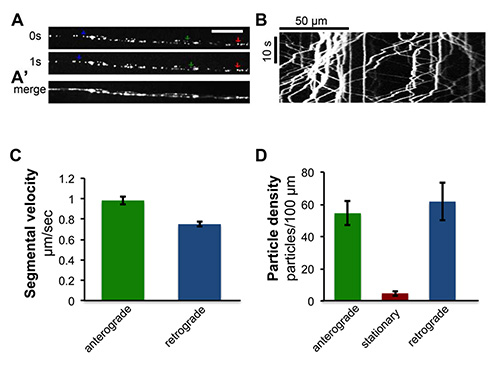
Figura 4. Time-lapse imaging di trasporto assonale delle vescicole sinaptiche peptidergici. L'ratto peptide natriuretico atriale ANF con etichetta GFP, UAS-ANF-GFP 21, è stata espressa entro motoneuroni specifici utilizzando il driver eve-RRa-Gal4 22. Immagini dal vivo di nervi segmentale rivela il rapido trasporto di ANF-GFP etichettati vescicole peptidergici negli assoni. Vedi anche Movie S1. (A) cornici singole di assoni del motoneurone dal vivo time-lapse imaging. Frecce verdi, rosse e blu indicano esempi di anterograda, vescicole stazionarie e retrograde, rispettivamente. Scale bar = 5 micron. (A ') individuali tempi del film sono state fuse con ImageJ. (B) A chimografo generata da time-lapse imaging di trasporto ANF-GFP, è stato generato da una raccolta di singoli fotogrammi che abbracciano un minuto di tempo di imaging utilizzando il 'multipla chimografo' plug-in per ImageJ 23. (C) Quantificazione delle velocità segmentale medi, che sono stati calcolati dalle pendici delle tracce segmentati in kymographs. La barra verde presentazionevelocità ts anterograda segmentale (n = 543) e la barra blu presenta velocità retrograda segmentale (n = 548) di vescicole da 10 kymographs. (D) Quantificazione della densità delle particelle. Densità di particelle è stata misurata dal numero di anterograda (mostrato nella barra verde), particelle stazionari (mostrato in barra rossa) e retrograde (mostrato in blu bar) per 100 micron di lunghezza dell'assone da 10 kymographs. I dati di questa figura sono stati pubblicati anche in precedenza in Ghannad-Rezaie et al, PLoS One 7 (1), e29869, doi:. 0.1371/journal.pone.0029869 (2012).
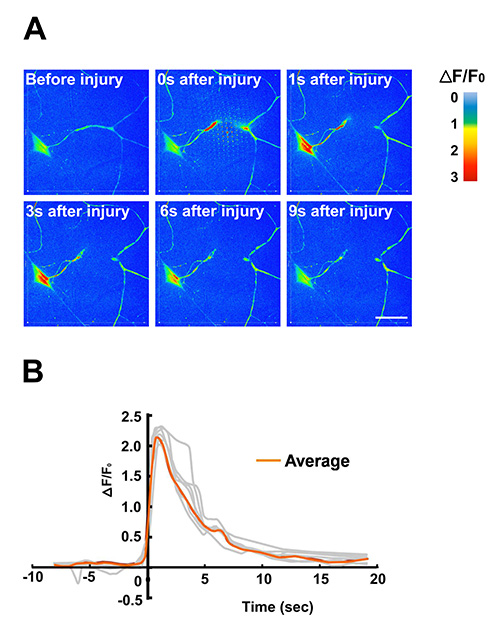
Figura 5. Uso del chip larva di microchirurgia laser e di imaging calcio.
Un dendrite di un neurone sensoriale Classe IV è sezionato da con impulsi laser ad alta potenza di un laser a colorante pulsato UV. Protocolli per l'uso di questo metodo di microchirurgia si trovano altrove 16. L'immobilizzazione efficace nel chip larva consente rapidi cambi nei livelli intracellulari di calcio per essere studiati da immagini dal vivo. In questo esempio, l'indicatore di calcio geneticamente codificato GCaMP3.0 è stata espressa in classe IV dendritiche arborization (C4da) neuroni sensoriali utilizzando il driver PPK-Gal4. (A) time-lapse immagini di intensità GCaMP3.0 erano false colorata a seconda del colore scala di intensità per indicare le variazioni di intensità nel tempo. Singoli fotogrammi sono stati estratti da un filmato time-lapse (Film S2) ripreso su un microscopio confocale disco rotante a 5 fotogrammi / sec. (B) Quantificazione delle dinamiche di calcio in risposta alla microchirurgia laser. La variazione piega normalizzata di soma GCaMP3.0 intensità di fluorescenza (ΔF/F0) dei singoli neuroni è stata rilevata in tempo (n = 7, mostrata in grigio). La ΔF/F0 media è stata rappresentata in arancione. È stato osservato l'aumento picco dell'intensità GCaMP3.0 tra 1-2 sec dopo l'infortunio. Priorità è stata sottratta dal G-CaMP3.0 intensità di fluorescenza crudo. I dati di questa figura sono stati pubblicati anche in precedenza in Ghannad-Rezaie et al, (2012) PLoS One 7 (1):. E29869. doi: 10.1371/journal.pone.0029869 12.
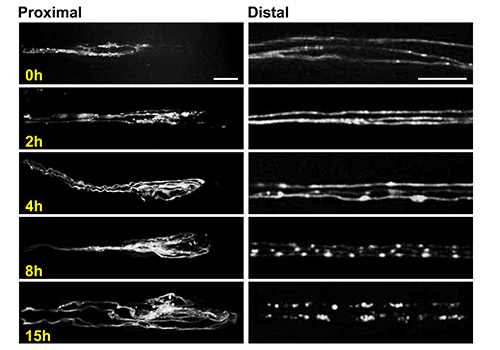
Figura 6. Imaging assonale germinazione e la degenerazione utilizzando il chip larva. Immagini confocali rappresentativi del moncone prossimale (a sinistra) e moncone distale (destra) degli assoni del motoneurone octopaminergic in diversi momenti dopo l'schiacciamento del nervo. Le immagini sono state prese in posizioni analoghe, come mostrato in Figura 3C. Questi neuroni sono etichettati da guidare l'espressione di un transgene UAS-mCD8-RFP usando l'Tdc2-GAL4 24,25 driver. I corpi cellulari di questi neuroni si trovano nel cordone nervoso ventrale 24. Tre assoni individuali può essere visto in un singolo nervo segmentale, e sono facilmente risolti uno dall'altro. Questa è una situazione ideale per lo studio di eventi cellulari individuali, come la frammentazione degli assoni degenerati, che si completa entro 15 ore per questi neuroni. Le immagini sono state ottenute da animali vivi che utilizzano il chip larva a 63X di ingrandimento su un microscopio confocale disco rotante. Bar scale = 10 micron per i pannelli di sinistra (monconi prossimali) e 20 micron per i pannelli di destra (ceppi distali). Clicca qui per vedere l'immagine ingrandita.
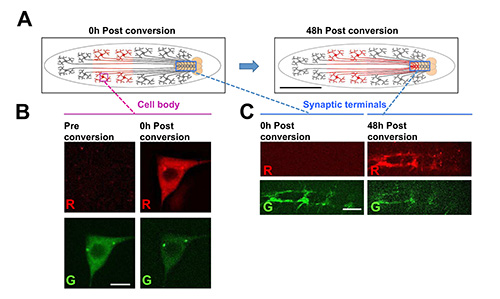
Figura 7. Utilizzando la larvachip per monitorare le proteine fluorescenti photoconverted su tempi lunghi e le distanze di animali vivi.
In questo esempio, una proteina di fusione della proteina fluorescente fotoconvertibile Dendra2 19, fusa ad α-tubulina, è espressa da un transgene UAS-Dendra2-α-tubulina nella classe IV arborization dendritica (C4da) neuroni sensoriali, utilizzando il driver PPK-GAL4 26. (A) Schema per l'esperimento fotoconversione. I corpi cellulari dei neuroni C4da si trovano in periferia e si estendono assoni attraverso i nervi segmentali per formare terminali sinaptici nel cordone nervoso. Il Dendra2-α-tubulina in un sottoinsieme di corpi cellulari nella metà posteriore dell'animale è sottoposto a fotoconversione da illuminazione UV per 6 secondi usando un filtro DAPI serie con lampada Hg (fumetto sinistra). Dopo il tempo, la photoconverted Dendra2-α-tubulina può essere rilevata ai terminali sinaptici nel cordone nervoso ventrale. Ciò indica che la proteina tubulina è stato transfoggiava sulla lunga distanza (di circa 1-2 mm). Immagini Scala bar = 1 mm (B) Esempio di Dendra2-α-tubulina in una sensoriale corpo cellulare dei neuroni classe IV prima e dopo fotoconversione. Barra della scala = 5 micron. (C) esempio, immagini di terminali sinaptici per la classe IV neuroni sensoriali alle due 0 ore o 48 ore dopo fotoconversione dei corpi cellulari. L'aspetto particolare di photoconverted Dendra2-α-tubulina ai terminali sinaptici dopo tempo implica che la proteina ha viaggiato dal corpo cellulare ad assone capolinea. Fotoconversione e di imaging a tutti i tempi è stato condotto nel chip larva. Scale bar = 15 micron. Clicca qui per vedere l'immagine ingrandita.
Movie S1. microchirurgia laser e di imaging di calcio di un neurone C4da. Un laser UV pulsato è stato utilizzato per un transetto primary ramo dendritiche. Recisione Laser indotto un rapido aumento di intensità GCaMP, che ha avuto inizio presso il sito della lesione e viaggiò verso il corpo cellulare. UAS-GCaMP3.0 18 è stata espressa utilizzando il driver specifico PPK-Gal4 C4da 26. Gli film erano false colorato per indicare i livelli di intensità relativi di GCaMP3.0. Il time-lapse imaging è stato condotto con disco rotante microscopia confocale a 5 fotogrammi / sec.
Movie S2. rapido trasporto assonale di ANF-GFP in motoneuroni.
Il ratto peptide natriuretico atriale ANF con etichetta GFP, UAS-ANF-GFP 21, è stata espressa entro motoneuroni specifici utilizzando il driver eve-RRa-Gal4 22. Il trasporto di queste vescicole peptidergici all'interno nervi segmentale larvali è stato ripreso sul chip larva a 300 msec / frame utilizzando un microscopio confocale disco rotante.
Figure1 supplementare (file DXF)
File DXF per il silicio stampo di fabbricazione. Il file è stato progettato per la maschera di fotoresist negativo (maschera scura presentato istanza di SU-8) su un wafer di silicio da 4 pollici. La seconda riga contiene 5 stampi per fare i chip larva utilizzati in questo protocollo. Ognuno di questi chip (in riga 2) contengono una camera di ~ 5,4 millimetri x 1,5 mm progettato per adattarsi tempestivamente 3 ° instar larva. La prima riga (riga 1) contiene una camera più grande (~ 5,4 millimetri x 2 mm), mentre la terza fila (riga 3) contiene una camera più piccola (~ 4,4 millimetri x 1,5 mm). Questi possono essere utilizzati con larve di dimensioni maggiori e minori, rispettivamente. Barra della scala = 2 mm.
Discussione
Fare o di ottenere il chip larva:
Il chip larva consiste in un blocco PDMS (la cosiddetta 'chip di PDMS') associato a un vetrino coprioggetto. Il protocollo al punto 1 descrive la procedura per effettuare e utilizzando chips larva, ipotizzando uno stampo SU-8 è disponibile. Lo stampo SU-8 è microfabbricati da fotolitograficamente patterning una spessa SU-8 strato fotosensibile 140 micron su un wafer di silicio (per i dettagli vedi Ghannad-Rezaie et al. 12). Come la microfabbricazione dello stampo SU-8 richiede l'accesso ad attrezzature specializzate, si consiglia di ordinare da un impianto di microfabbricazione (ad es. L'impianto LNF presso l'Università del Michigan 14), o da una fonderia inviando loro la progettazione di chip che viene fornito come file supplementare. Se si vuole modificare la struttura del chip PDMS (ad esempio per l'uso con larve di diverse dimensioni), con un programma CAD che gestisce i file DXF (es. Autocad) può essere utilizzato. Un SU-8 stampo può anche essere fatta in casa seguendo le istruzioni in Mondal et al. 27 Molti lettori potrebbero trovare conveniente di ottenere semplicemente un chip PDMS di esempio per provare la tecnica prima di fabbricare le proprie chips. Questo sarà reso liberamente disponibile su richiesta.
L'uso della microfluidica 'di chip larva' per l'imaging dal vivo:
Il metodo di immobilizzazione nel chip larva evita l'uso di anestetici, e invece coinvolge pressione, tramite l'applicazione di un vuoto, per limitare i movimenti dell'animale. Mentre gli animali possono sopravvivere immobilizzazione nel chip per più ore 12, un periodo di immobilizzazione più breve (5-15 min) è raccomandato. Questo è il tempo sufficiente per l'imaging molti eventi cellulari di interesse, inclusi i cambiamenti nel calcio intracellulare, o trasporto assonale veloce. Questo è anche il tempo sufficiente per manipolazioni desiderati in animali vivi, come ad esempio a base di laser microchirurgia, photobleaching, e photoconverSion.
Per studiare gli eventi longitudinalmente su un periodo di tempo più lungo in un singolo animale, gli animali possono essere inseriti nel chip e ripreso più volte, separati da periodi di riposo. Piastre di agar succo d'uva sono ideali per il riposo tra le sessioni di imaging, in quanto forniscono una fonte di cibo semplice e umidità. Sessioni di imaging più influenzano la sopravvivenza delle larve a un certo punto, dal momento che ogni sessione comporta un certo rischio di danneggiare l'animale (vedi parte 2 nella risoluzione dei problemi, qui di seguito). Gli animali possono essere ordinariamente ripreso> 5 volte nel corso di due giorni con un tasso di sopravvivenza superiore al 50%. Poiché gli animali non sono anestetizzati, sono sani e mobili subito dopo il rilascio del vuoto nel chip. Non vi è quindi alcun bisogno di tempo di recupero tra le sessioni di imaging, così la spaziatura tempo tra le sessioni è flessibile e può essere regolato agli obiettivi dell'esperimento.
Risoluzione dei problemi:
La tecnica più comune èfa causa con il circuito integrato larva e soluzioni consigliate sono le seguenti:
(1) L'animale si muove troppo. Troppo mobilità può interferire con gli obiettivi di imaging. I motivi più comuni per questo nel chip larva sono a) l'animale è troppo piccolo per il chip, o b) la pressione di vuoto applicata durante la fase di immobilizzazione è compromessa. Il chip larva descritto in questo protocollo è stato progettato per l'inizio graduale 3 ° instar larve. La dimensione ottimale per l'animale è 3,5-4 mm di lunghezza (lungo l'asse antero-posteriore). Per garantire che il livello di vuoto è sufficiente tirare la siringa 2-2,5 ml, o fino a sentire resistenza nel manico. Una indicazione che il vuoto sta lavorando è che piccole bolle nel canale perimetrale possono essere viste muoversi lentamente verso la sorgente di vuoto. Un'altra indicazione è che il coprioggetto dovrebbe sempre viaggiare con il chip quando il chip viene sollevato dalla parte superiore (e questo è il metodo consigliato per trasportare la camerauna volta che le larve è posizionato e il vuoto è on). Il vuoto può essere compromessa se ci sono crepe nella tubazione, o in presenza di olio nel tubo. Questo può essere facilmente affrontata sostituendo il 23 G erogazione punta dell'ago e tubo di polietilene-50 (da passaggi 1,6-1,14).
(2) L'animale muore dopo l'imaging nel chip. La procedura è destinata a causare il minimo stress sulla animali, e gli animali di tipo selvatico genotipo hanno un tasso di sopravvivenza> 90%, anche dopo un'ora di immobilizzazione sul chip 12. Dal momento che alcuni genotipi possono essere meno resistenti allo stress del chip, prima verificare che tipo di animali selvatici (ad esempio, Cantone S) sopravvivono la tecnica di immobilizzazione. a) La causa più comune di letalità è corretto posizionamento della larva (vedi figure 2G-H). Se parti della cuticola, testa o trachea non sono del tutto all'interno della camera, allora possono diventare danneggiati durante l'immobilizzazione, e unlarva che è troppo grande per il chip (> 4 mm) è meno probabilità di sopravvivere. b) Una causa meno comune per letalità è l'uso di una pressione eccessiva o quando si carica il chip vuoto. Se correttamente posizionato nel chip, la pressione generata dal vuoto è ben tollerato. Tuttavia pressione eccessiva, sia dal vuoto o nella fase iniziale di posizionamento del animale può essere un problema. E 'meglio conoscere il grado di pressione necessaria empiricamente da prove di tipo selvaggio larve di dimensioni corrette. c) Se troppo olio Halocarbon copre trachea dell'animale l'animale può potenzialmente avere problemi con sopravvivenza a lungo termine. L'olio svolge diversi ruoli importanti nel chip: è importante per la creazione del vuoto, l'ottica durante l'imaging, e contrasta essiccazione nel chip. Olio Tuttavia eccessivo dovrebbe essere evitato. (Questo può anche portare a olio nel tubo e siringa, compromettendo il vuoto). I cappotti protocollo proposti solo il lato ventrale della larva con l'olio, poi removes olio in eccesso dal posizionamento della larva su un vetrino pulito prima del trasferimento al vetrino finale per l'imaging. d) fototossicità può essere vissuta dalla sessione di imaging. Come con qualsiasi applicazione di imaging dal vivo, è ideale da utilizzare tempi di esposizione brevi con una bassa intensità di luce laser, che è meglio realizzato utilizzando una macchina fotografica ad alta sensibilità o rivelatore. Cercare di minimizzare l'illuminazione con luce UV, inclusa la luce ad ampio spettro creato da sorgenti luminose Hg.
Altre questioni e le direzioni future:
Poiché questo metodo non utilizza anestetici, il cuore dell'animale continua a battere. Questo crea una certa mobilità inevitabile, che colpisce l'imaging in alcuni luoghi più di altri. Gli esempi qui dimostrano che il cordone ventrale dei nervi, i nervi segmentali, e la parete del corpo possono essere prontamente ripreso senza interferenze da parte battito cardiaco. Nei casi in cui il battito cardiaco colpisce di imaging, i movimenti regolari possono a volte essere corretti conin software di analisi (ad esempio, lo stabilizzatore plug per ImageJ). Questo funziona bene quando i singoli oggetti si muovono su una scala temporale veloce (per esempio ~ 1 micron / sec per il trasporto assonale veloce) o su una scala temporale molto lento (minuti o ore). Tuttavia, quando l'oggetto (s) di interesse movimento con una gamma di velocità e direzioni, può essere più difficile da correggere i movimenti battito cardiaco indotto.
Un altro problema è lieve variabilità in ottica da animale ad animale, o tra più sessioni di imaging dello stesso animale nel chip. Il più profondo l'oggetto di interesse è dentro l'animale, tanto maggiore sarà questa variazione. Nervi segmentale e il cordone nervoso ventrale sono normalmente troppo in profondità all'interno quindi animale per essere ripreso su un microscopio normale. Tuttavia la pressione lieve sperimentato nel chip larva spinge queste strutture molto vicino alla cuticola e vetrino. La distanza esatta di queste strutture dal vetrino avrà piccole variazioni di trIAL a giudizio. La variazione per oggetti chiudere la cuticola, come i corpi cellulari dei neuroni sensoriali, è inferiore. È quindi importante, particolarmente per eseguire misurazioni di intensità, di utilizzare un gran numero di animali e prove indipendenti per conto della variabilità in ottica.
Mentre gli esempi mostrati qui sono concentrati sui processi all'interno dei neuroni, l'approccio dovrebbe essere suscettibili di imaging di qualsiasi struttura in animale che può essere proposto entro la profondità di messa a fuoco dell'obiettivo del microscopio. Ciò include la cuticola, muscoli della parete del corpo, e le loro NMJs. Trachea sul lato ventrale dell'animale e potenzialmente parti del tubo digerente potrebbe anche essere ripreso. L'animale può anche essere posizionato con il lato dorsale verso il coprioggetto per l'imaging breve termine delle strutture in prossimità della superficie dorsale. La capacità di strutture dell'immagine profondità dentro l'animale è limitata dalla distanza di lavoro dell'obiettivo microscopio utilizzato. Strutture come imI dischi aginal sono inaccessibili al più alto ingrandimento (ad esempio 40X) obiettivi.
I chip larva descritti in questo protocollo sono progettati per le larve nei primi anni del 3 ° stadio instar (che variano nel formato 3,5-4 mm). Tuttavia molte domande interessanti richiedono l'imaging a diversi stadi larvali. Chip più piccoli per ospitare 2 ° instar larve, o chip più grandi per ospitare stadi tardivi 3 ° possono essere facilmente progettati utilizzando lo stesso principio. (Figura complementare 1 contiene un file DXF facilmente modificabile per fare stampi in silicone con dimensioni delle camere alterati). Il semplice principio della tenuta reversibile potrebbe essere applicato anche ad altri microrganismi come C. elegans o zebrafish, con la variante principale è la dimensione della camera. Una direzione futura utile è quello di progettare un chip che può immobilizzare molti animali contemporaneamente, da utilizzare per scopi di screening. Tuttavia, per questo, il progetto avrebbe bisogno di essere significativamente diversadal dispositivo corrente, dove i problemi di posizionamento dell'animale nel chip deve essere trattata per ogni animale in modo indipendente.
La calca test nervo per studiare le risposte di pregiudizio nei nervi periferici larvali:
Il test schiacciamento del nervo descritto qui per i nervi segmentale larvale è un metodo semplice per introdurre una lesione assoni periferici in Drosophila. I vantaggi di questo metodo sono: a) è semplice da condurre con gli strumenti standard che si trovano in un laboratorio di Drosophila (a CO 2 di origine e pinze stereomicroscopio), b) può essere condotta rapidamente per molti animali, rendendo l'analisi biochimica dei cordoni nervosi dopo l'infortunio fattibile 14; c) le risposte molecolari e cellulari a questa lesione sono altamente riproducibili 14,15,28 e possono essere usati per scoprire i processi che sono anche importanti in neuroni vertebrati 29,30.
Metodi alternativi per ferire i neuroni è quello di focusa laser ad alta potenza, per esempio, un pulsato UV o laser a femtosecondi, di recidere un assone via laser microchirurgia 17,31-33. Il chip larva è un metodo ideale per posizionare l'animale per tale microchirurgia. Tuttavia, a causa delle piccole differenze ottiche tra le prove, discusse sopra, il metodo basato sul laser può essere più difficile da riprodurre in larve, soprattutto nei nervi larvali segmentale. Inoltre, sulla base laser danno assonale richiede più tempo per posizionare ciascun animale, quindi è più difficile condurre su larga scala (con un grande numero di animali).
Risoluzione dei problemi:
Il problema tecnico più comunemente incontrati dalla schiacciamento del nervo è la morte da danni agli organi interni. Nel condurre la calca, è importante non schiacciare il cavo ventrale del nervo, ghiandole salivari, o l'intestino. E 'anche importante non forare la cuticola. Questi problemi sono meglio evitare portando la pinza ad un angolo di 45 ° rispetto al tensioattivo cuticolae (vedi Figura 3).
La qualità della pinza ha un grande impatto sulla efficacia della compressione e sopravvivenza dopo. Consigliamo numero Dumostar 5 pinze. Per mantenere la loro nitidezza, le pinze devono essere maneggiati con cura, non utilizzati per altri scopi, e sostituiti una volta che diventano smussato o piegato.
La dimensione dell'animale può anche influenzare l'efficacia della cotta. Piccoli animali (meno di 3 millimetri di lunghezza) sono molto meno probabilità di sopravvivere il pregiudizio. Con grandi animali, (vagando 3 stadi rd), è più difficile individuare i nervi ed evitare danni alle grandi ghiandole salivari e intestino, e c'è meno tempo per studiare le risposte del pregiudizio prima impupamento. Il schiacciamento del nervo è più efficace condotta nei primi mesi del 3 ° instar larve (che sono ~ 3-4,5 mm di lunghezza lungo l'asse antero-posteriore).
La fonte di cibo che l'animale è sollevata sopra può influenzare laforza della cuticola e sopravvivenza dopo la calca. Si consiglia di allevare animali negli alimenti ottenuti da una ricetta standard lievito glucosio.
Il metodo migliore per imparare a fare la calca in modo efficace è quello di praticare in molti animali, in primo luogo con l'obiettivo primario di raggiungere la sopravvivenza (e non impupamento) 24 ore dopo la calca. I principianti normalmente hanno un basso tasso di sopravvivenza (ad esempio 10%), ma una volta che la tecnica è appreso, i tassi di sopravvivenza può raggiungere ~ 90%.
Altre questioni e le direzioni future:
Il saggio cotta fornisce un potente metodo per studiare la germinazione di assoni prossimale al sito di lesione e la degenerazione degli assoni e sinapsi distali al sito di lesione. Benché la percentuale di degenerazione variano tra i diversi tipi di neuroni, sono altamente riproducibili in un determinato tipo neurone, fornendo testimonianza della riproducibilità del dosaggio pregiudizio.
Al contrario, la 'rigenerativa' germinazionerisposta osservata negli assoni prossimali è più impegnativo di studio. Tutti gli assoni del nervo segmentale avviare vasta germinazione vicino al sito della lesione (per esempio, vedi Figura 6 e Figura 3). Tuttavia, l'entità di germinazione può variare da neurone a neurone, ed è difficile da quantificare. Una misura analoga e la variabilità in germinazione possono essere osservati dopo lesioni più focali dei singoli motoneuroni nei nervi segmentale introdotti utilizzando un UV impulsi laser a colorante. Interpretiamo che la direzionalità nondiscriminate della germinazione è dovuta alla mancanza di spunti di orientamento nei nervi segmentali. Al contrario, gli assoni dei neuroni sensoriali ferite da laser vicino ai loro corpi cellulari subiscono nuova crescita assonale nella stessa direzione come l'assone perduto 34. Assoni in questa regione dell'animale sono probabilmente esposti alle informazioni di posizione più specifico per l'orientamento degli assoni rigeneranti. L'ambiente all'interno di nervi segmentali è improbabile avere molto resemblance l'ambiente che gli assoni originariamente navigati durante la loro guida nell'embrione, quindi non si prevede di avere informazioni per guidare gli assoni rigeneranti.
Un'altra limitazione per studiare la rigenerazione utilizzando il segmentale test schiacciamento del nervo è che gli assoni sensoriali e del motoneurone feriti hanno ancora una distanza significativa per coprire (0,25-1 mm) per raggiungere il loro obiettivo, e un periodo di tempo limitato (<3 giorni) prima che le subisce animali impupamento. Uno studio recente ha identificato una manipolazione genetica del recettore dell'ormone prothoraciotropic che triplica la durata del 3 ° stadio larvale instar 35. Questa manipolazione estenderà il periodo di tempo per studiare il recupero e la degenerazione dei neuroni dopo lesione significativamente, a 9 invece di 3 giorni. Questo può essere abbastanza lungo da osservare nuovi eventi, come riconnessione di un assone feriti con il suo bersaglio postsinaptico, soprattutto se la lesione è indotta vicina al termine sinaptica.
Divulgazioni
Gli autori dichiarano interessi finanziari concorrenti.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Science Foundation, (codice di autorizzazione IOS-0.842.701 a CAC) e il National Institute of Health (R00MH080599 a DA, R21 NS062313 a NC, e NS069844 a CAC). Vorremmo riconoscere James Schutt, Emily Han, e Leni Truong per il supporto tecnico e il Bloomington Stock Center per linee di volo. Tutte le chips sono state realizzate presso l'impianto di Lurie Nanofabrication presso l'Università del Michigan.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.5 mm Polyethylene tubing | Fisher Scientific | 14-170-11B | Polyethylene tubing, I.D. = 0.023 in O.D. = 0.038 in |
| 1 mm Polyurethane tubing | Fisher Scientific | BB521-63 | Polyurethane tubing, I.D. = 0.063 in O.D. = 0.125 in |
| Barb to barb connector | Bio Rad | 732-8300 | 0.8 mm barb to barb connector |
| 3-way Stopcock valve | Bio Rad | 732-8104 | Screw on valve for the syringe |
| Syringe (20 ml) | Fisher Scientific | 14-817-33 | Screw on 20 ml syringe for generating vacuum |
| Dispensing needles, 23 G (0.4 mm I.D., 0.6 mm O.D.) | McMaster-Carr | 75165A684 | Needle for outlet connection |
| Dispensing needles, 21 G, (0.6 mm I.D., 0.8 mm O.D.) | McMaster-Carr | 75165A679 | Needle for outlet connection |
| Halocarbon oil | Sigma | H8898 | Halocarbon oil 700 |
| Dumostar Number 5 Forceps | Roboz | RS-498 | For nerve crush |
| PDMS Kit (Base and curing agent) | Ellsworth | 184 SIL ELAST KIT 0.5KG | Dow Corning Sylgard 184 Silicone Encapsulant 0.5 kg Kit Clear |
| Glass Coverslips | Fisher Scientific | 12-544-C | 24 mm x 40 mm (thickness according to recommendation for your microscope objective) |
| Disposable Plastic Cup (9 oz) | |||
| Plastic coffee stirrer stick | |||
| Razor Blade | |||
| Grape juice agar plates | See http://cshprotocols.cshlp.org/content/2007/4/pdb.rec10925 for recipe |
Riferimenti
- Pilling, A. D., Horiuchi, D., Lively, C. M., Saxton, W. M. Kinesin-1 and Dynein are the primary motors for fast transport of mitochondria in Drosophila motor axons. Mol. Biol. Cell. 17, 2057-2068 (2006).
- Gunawardena, S., et al. Disruption of axonal transport by loss of huntingtin or expression of pathogenic polyQ proteins in Drosophila. Neuron. 40, 25-40 (2003).
- Miller, K. E., et al. Direct observation demonstrates that Liprin-alpha is required for trafficking of synaptic vesicles. Curr. Biol. 15, 684-689 (2005).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
- Fuger, P., Behrends, L. B., Mertel, S., Sigrist, S. J., Rasse, T. M. Live imaging of synapse development and measuring protein dynamics using two-color fluorescence recovery after photo-bleaching at Drosophila synapses. Nat. Protoc. 2, 3285-3298 (2007).
- Schmid, A., et al. Activity-dependent site-specific changes of glutamate receptor composition in vivo. Nat. Neurosci. 11, 659-666 (2008).
- Fuentes-Medel, Y., et al. Glia and muscle sculpt neuromuscular arbors by engulfing destabilized synaptic boutons and shed presynaptic debris. PLoS Biol. 7, (2009).
- Andlauer, T. F., Sigrist, S. J. . Building an imaging chamber for in vivo imaging of Drosophila larvae. , 476-480 (2012).
- Sandstrom, D. J. Isoflurane reduces excitability of Drosophila larval motoneurons by activating a hyperpolarizing leak conductance. Anesthesiology. 108, 434-446 (2008).
- Sandstrom, D. J. Isoflurane depresses glutamate release by reducing neuronal excitability at the Drosophila neuromuscular junction. J. Physiol. 558, 489-502 (2004).
- Mondal, S., Ahlawat, S., Rau, K., Venkataraman, V., Koushika, S. P. Imaging in vivo neuronal transport in genetic model organisms using microfluidic devices. Traffic. 12, 372-385 (2011).
- Ghannad-Rezaie, M., Wang, X., Mishra, B., Collins, C., Chronis, N. Microfluidic chips for in vivo imaging of cellular responses to neural injury in Drosophila larvae. PloS one. 7, (2012).
- Schmid, A., Sigrist, S. J. Analysis of neuromuscular junctions: histology and in vivo imaging. Methods Mol. Biol. 420, 239-251 (2008).
- Xiong, X., et al. Protein turnover of the Wallenda/DLK kinase regulates a retrograde response to axonal injury. J Cell Biol. 191, 211-223 (2010).
- Xiong, X., Collins, C. A. A conditioning lesion protects axons from degeneration via the Wallenda/DLK MAP kinase signaling cascade. J. Neurosci. 32, 610-615 (2012).
- Byrne, A. B., Edwards, T. J., Hammarlund, M. In vivo Laser Axotomy in C. elegans. J. Vis. Exp. (51), (2011).
- Williams, W., Nix, P., Bastiani, M. Constructing a Low-budget Laser Axotomy System to Study Axon Regeneration in C. elegans. J. Vis. Exp. (57), (2011).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875-881 (2009).
- Chudakov, D. M., Lukyanov, S., Lukyanov, K. A. Tracking intracellular protein movements using photoswitchable fluorescent proteins PS-CFP2. 2, 2024-2032 (2007).
- Gurskaya, N. G., et al. Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light. Nat. Biotechnol. 24, 461-465 (2006).
- Rao, S., Lang, C., Levitan, E. S., Deitcher, D. L. Visualization of neuropeptide expression, transport, and exocytosis in Drosophila melanogaster. J. Neurobiol. 49, 159-172 (2001).
- Fujioka, M., et al. Even-skipped, acting as a repressor, regulates axonal projections in Drosophila. Development. 130, 5385-5400 (2003).
- Rietdorf, J., Steitz, A., Heidelberg, E. Linear unmixing macro for ImageJ. European Advanced Light Microscopy Network. , (2004).
- Koon, A. C., et al. Autoregulatory and paracrine control of synaptic and behavioral plasticity by octopaminergic signaling. Nat. Neurosci. 14, 190-199 (2011).
- Yarali, A., Gerber, B. A Neurogenetic Dissociation between Punishment-, Reward-, and Relief-Learning in Drosophila. Front. Behav. Neurosci. 4, (2010).
- Kuo, C. T., Jan, L. Y., Jan, Y. N. Dendrite-specific remodeling of Drosophila sensory neurons requires matrix metalloproteases, ubiquitin-proteasome, and ecdysone signaling. Proc. Natl. Acad. Sci. U.S.A. 102, 15230-15235 (2005).
- Mondal, S., Ahlawat, S., Koushika, S. P. Simple Microfluidic Devices for in vivo Imaging of C. elegans, Drosophila. J. Vis. Exp. (67), (2012).
- Xiong, X., et al. The highwire ubiquitin ligase promotes axonal degeneration by tuning levels of nmnat protein. PLoS Biol. 10, (2012).
- Shin, J. E., et al. Dual leucine zipper kinase is required for retrograde injury signaling and axonal regeneration. Neuron. 74, 1015-1022 (2012).
- Watkins, T. A., et al. DLK initiates a transcriptional program that couples apoptotic and regenerative responses to axonal injury. Proc. Natl. Acad. Sci. U.S.A. 110, 4039-4044 (2013).
- Hammarlund, M., Nix, P., Hauth, L., Jorgensen, E. M., Bastiani, M. Axon regeneration requires a conserved MAP kinase pathway. Science. 323, 802-806 (2009).
- Guo, S. X., et al. Femtosecond laser nanoaxotomy lab-on-a-chip for in vivo nerve regeneration studies. Nat. Methods. 5, 531-533 (2008).
- O'Brien, G. S., Rieger, S., Martin, S. M., Cavanaugh, A. M., Portera-Cailliau, C., Sagasti, A. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J. Vis. Exp. (24), (2009).
- Stone, M. C., Nguyen, M. M., Tao, J., Allender, D. L., Rolls, M. M. Global up-regulation of microtubule dynamics and polarity reversal during regeneration of an axon from a dendrite. Mol. Biol. Cell. 21, 767-777 (2010).
- Miller, D. L., Ballard, S. L., Ganetzky, B. Analysis of synaptic growth and function in Drosophila with an extended larval stage. J. Neurosci. 32, 13776-13786 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon