Method Article
Imaging non invasiva e analisi di ischemia cerebrale in ratti Living Utilizzando Positron Emission Tomography con
In questo articolo
Riepilogo
Brain damage resulting from cerebral ischemia may be non-invasively imaged and studied in rats using pre-clinical positron emission tomography coupled with the injectable radioactive probe, 18F-fluorodeoxyglucose. Further, the use of modern software tools that include volume of interest (VOI) brain templates dramatically increase the quantitative information gleaned from these studies.
Abstract
L'ictus è la terza causa di morte tra gli americani di 65 anni di età o più anziani 1. La qualità della vita per i pazienti che soffrono di un ictus non riesce a tornare alla normalità in una grande maggioranza dei pazienti 2, che è dovuto principalmente alla attuale mancanza di un trattamento clinico per l'ictus acuto. Questo richiede la comprensione degli effetti fisiologici di ischemia cerebrale sul tessuto cerebrale nel tempo ed è un importante area di ricerca attiva. A tal fine, sono stati compiuti progressi sperimentali utilizzando topi come modello preclinico per l'ictus, in particolare, con metodi non invasivi quali 18 F-fluorodeossiglucosio (FDG) accoppiato con Positron Emission Tomography (PET) 3,10,17. Qui vi presentiamo una strategia per indurre ischemia cerebrale nei ratti da occlusione dell'arteria cerebrale media (MCAO) che imita ischemia cerebrale focale negli esseri umani, e di imaging i suoi effetti oltre 24 ore con FDG-PET accoppiato con i raggi X tomografia computerizzata (CT) con Albira PStrumento ET-CT. A VOI atlante modello è stato successivamente fuse ai dati ratto cerebrali per consentire un'analisi imparziale di suoi sub-regioni del cervello e 4. Inoltre, un metodo per la visualizzazione 3D del corso tempo FDG-PET-CT è presentato. In sintesi, vi presentiamo un protocollo dettagliato per l'avvio, quantificare, e la visualizzazione di un evento ictus ischemico indotto in una vita Sprague-Dawley di ratto in tre dimensioni con FDG-PET.
Introduzione
L'ictus è una delle principali cause di morte nei paesi sviluppati, ed è direttamente responsabile della morte di 1 su 19 americani 1. E 'stato stimato che circa 795.000 americani esperienza ictus ogni anno, di cui 87% di questi sono di natura ischemica 5. Durante un evento ischemico, continuo apporto di ossigeno e glucosio ai neuroni corticali è gravemente compromessa inducendo un ambiente ipossico, che porta alla riduzione della funzione cellulare in regioni cerebrali colpite. A seconda della gravità della corsa, flusso sanguigno cerebrale e l'assorbimento di glucosio varia spazialmente e temporalmente.
Danni a causa di ictus può essere identificata attraverso metodi non invasivi, come ad esempio 18 F-fluorodeossiglucosio (FDG) Positron Emission Tomography 6. FDG è un analogo del glucosio in cui il gruppo ossidrile in posizione 2 'è stato sostituito dal positroni emettendo 18 F isotopo. 18 F è advantageous causa della sua lunga, 110 minuti emivita, permettendo così di essere utilizzato per rilevare il consumo di glucosio nel cervello. FDG PET produce una mappa ad alta risoluzione quantitativa del consumo desossiglucosio all'interno del cervello 7 come 18 F tende ad accumularsi nelle regioni di alto consumo di glucosio, indica che tali tessuti sono molto metabolicamente attivi 8. Il 18 F nucleo subisce decadimento beta, rilasciando un positrone, che annienta rapidamente con un elettrone vicina, producendo raggi gamma, che vengono rilevati dallo strumento. FDG PET possono essere ripetute nello stesso individuo con almeno 10 18 F emivite, o circa 18 ore, tra una scansione, fornendo così un modo per studiare variazioni dell'attività cerebrale nel tempo nello stesso individuo.
Modelli animali preclinici, come i ratti, sono spesso utilizzati per valutare gli effetti di ictus e l'efficacia dei trattamenti per l'ictus. Poiché FDG PET è non invasivo, può essere usato per misuraregli effetti della corsa nel tempo, senza interrompere la fisiologia dell'animale. A seconda della posizione evento di ictus, diverse regioni del cervello possono essere colpiti. Tuttavia, con piccoli animali come i ratti, definire manualmente e quantificare l'attività in regioni specifiche del cervello di ratto può essere impegnativo. Al fine di confrontare l'attività metabolica del glucosio in regioni specifiche del cervello di ratto nel corso del tempo, i volumi di interesse (VOI) per quantificare devono essere costantemente delineati. A precise atlante del cervello di ratto è stato sviluppato per alleviare questo problema 9, ed è stato convertito in forma digitale per l'utilizzo in quantificazione dei dati FDG-PET preclinici. Qui vi presentiamo un metodo per classificare i danni ai tessuti ictus in modo coerente, modo metodico. Il metodo in dettaglio la procedura chirurgica per l'avvio di ischemia cerebrale in un modello animale, quantificando specifiche sotto-aree cerebrali colpite da ictus, e produrre una visualizzazione tridimensionale della estensione e la localizzazione di ictusdanni ai tessuti utilizzando le tecniche e gli strumenti adeguati. Utilizzando la metodologia descritta in questo studio, i ricercatori possono sempre avviare ischemia cerebrale nei ratti, effettuare l'imaging PET, e quantificare i cambiamenti in FDG utilizzando regioni cerebrali definite in modelli preclinici ictus nel corso del tempo.
Protocollo
Movimentazione degli animali e tutti gli esperimenti con loro sono stati rigorosamente effettuate secondo protocolli che sono stati approvati dalla cura degli animali e uso Comitato Istituzionale dell'Università di Notre Dame (protocollo numero 14-086).
1. Gli animali
- Animali e Stroke iniziazione: Ratti Usa maschile Sprague Dawley di peso compreso tra 220 e 270 g per tutti gli studi ictus.
- Anestetizzare ratti con 2,5% isofluorano (2 L / min a 100% O 2) usando un cono.
- Posto l'animale in decubito dorsale su una piastra elettrica. Tape le zampe anteriori.
- Shave ventralsurface di collo. Prep zona rasata con il 70% EtOH seguito dal 10% di soluzione di iodio Providone.
- Strumenti sterili sono utilizzati per questa procedura; guanti sono sostituiti dopo la preparazione dell'animale. Vengono impiegate tecniche di punta sterili.
- Usando forbici, effettuare una 2-2,5 cm un'incisione parallela alla trachea, 0,5 cm a destra della trachea. Utilizzando dissectio smussaton individuare la carotide.
- Utilizzare divaricatori per aiutare a visualizzare la nave. Inserire un micro morsetto sulla carotide comune (CCA).
- Individuare il primo punto di ramificazione che sarà l'arteria carotide esterna (ECA) e l'arteria carotide interna (ICA). Cauterizzare rami più piccoli collegati alla Corte dei conti, quali l'arteria occipitale.
- Legare la Corte dei conti in prossimità del ramo dell'arteria tiroidea con una sutura 4-0 seta. Le suture devono avere una lunghezza in più per consentire hemostats per tenere la sutura.
- Cauterizzare la Corte dei conti al di sopra della sutura (craniale). Per bloccare la sutura con i hemostats, tirare la ECA caudale e sarà parallelo al CCA.
- Individuare l'ICA e utilizzare un altro micro pinza per occludere questa arteria.
- Fare un piccolo foro nella ECA utilizzando piccole forbici primavera. Inserire il occlusore nella ECA e legare una sutura intorno al occluder per impedire il flusso di sangue.
- Rimuovere il micro morsetto sul ICA e avanzare il occluder fino ad avvertire resistenza.
NOTA Assicurarsi anticipi occlusore nel ICA e non l'arteria pterygopalatin. L'occlusore dovrebbe avanzare senza intoppi e la punta bianca non deve essere visto se il occluder è posizionato correttamente. - Rimuovere la micro pinza dal CCA. Tagliare ogni occlusore eccesso o sutura.
- Collocare 9 millimetri Clips Auto per chiudere l'incisione cutanea.
- Rimuovere l'animale da anestesia e permettere all'animale di risvegliare. Dopo 2 ore:
- Anestetizzare ratto con isoflurano.
- Rimuovere le clip ferita.
- Individuare la fine del occlusore e rimuoverlo dalla arteria cerebrale media tirando delicatamente fino alla punta bianca del occlusore viene a contatto con le suture. Non tirare tutta la via d'uscita, questo causerà sanguinamento.
- Sostituire le clip ferita per l'incisione.
- Rimuovere l'animale da anestesia e permettere all'animale di risvegliare.
2. Acquisizione di immagini
Eseguire tre PET e CT sbarattoli per ogni ratto. Prendete un pre scansione 1-2 giorni prima di indurre ictus, per fornire una base per 18 F-FDG. Scansione ogni ratto 1,5 ore dopo l'ictus, prima di riperfusione viene eseguita (immagine con occlusore ancora in animali). Scansione ogni ratto 26 ore dopo l'ictus (24 ore dopo la riperfusione) per quantificare i danni ai tessuti cerebrali a causa di lesioni ictus.
NOTA: Il punto di tempo di 24 ore menzionato nel resto del manoscritto si riferisce al tempo di post riperfusione quando sono stati analizzati i ratti.
- Anestetizzare topi sotto 2,5% gas isofluorane in camera di anestesia.
- Iniettare circa 500 uCi di 18 F-desossiglucosio (FDG) (200 microlitri di volume totale) in vena della coda di topo.
- Attendere 1 ora.
- Mettere ratto anestetizzato sul letto di ratto normale, sotto cono isofluorane anestesia. Misurare la distanza in mm tra il naso di ratto e bordo del letto di ratto per orizzontale offset.
3. Acquisizione di immagini
- Aprire Albira Suite software.
- Seleziona Acquirer.
- Nome nuovo studio.
- Sotto PET o SPECT fare clic su Aggiungi> Selezionare il protocollo PET. Fare clic su Aggiungi.
- In CT fare clic su Aggiungi> Selezionare il protocollo CT. Fare clic su Aggiungi.
- Clicca numero sotto Posizione iniziale in PET. Impostare il numero di distanza misurata in mm tra il naso di ratto e davanti al letto di ratto. Ripetere per CT.
- Impostare riserva di Rat e inserire il peso in grammi.
- Impostare Compound a FDG.
- Impostazione tempo di iniezione e iniezione Data e Dose.
- Fare clic sul pulsante Avvia Study.
NOTA: Al termine della scansione PET TAC, i dati verranno salvati automaticamente. - Aprire Albira Reconstructor.
- Change attesa per ultimi 10 o Tutti.
- Selezionare il nome del file di scansione.
- Fare clic su Aggiungi.
- Fare clic su Start ricostruzione. NOTA: Il file verrà salvato in formato microPET.
Analisi 4. Immagine
- Eseguire l'analisi immagine utilizzando il software di analisi PMOD in collaborazione con il W. Schiffer cervello Atlas.
- Aprire PMOD> Fusion.
- Passare alla scheda coregistrazione Preprocessing nella parte superiore dello schermo.
- Aprire il menu a discesa carico di riferimento al centro dello schermo e selezionare Nifti. Passare a C: //PMOD3.2/resources/templates/usertemplates. Selezionare Rat (W.Schiffer) -FDG.nii e fare clic su Apri.
- Aprire il menu a discesa Load ingresso a destra dello schermo e selezionare microPET. Passare alla desiderataFile di microPET. Selezionare e fare clic su Apri.
- Passare alla scheda coregistrazione manuale nella parte superiore dello schermo.
- Selezionare la quarta scheda a centro gruppo di schede a destra (Reslicing).
NOTA: Due pulsanti appariranno sulle scansioni microPET. - Utilizzare il rettangolo bianco aperto per ruotare le scansioni microPET e il rettangolo bianco pieno di spostare le scansioni microPET. Allineare le due scansioni. Per fare questo, individuare punti di riferimento quali le ghiandole Harderian, e top e funzioni cerebrali posteriori che possono essere utilizzati per abbinare la scansione microPET con il modello del cervello. Quindi, regolare la scansione microPET fino a quando non corrisponde con l'atlante del cervello (W. Schiffer).
NOTA: Per esempio, le ghiandole Harderian appaiono luminoso su entrambe le scansioni microPET e l'atlante cerebrali (W. Schiffer), e può essere utilizzato come riferimento per l'allineamento. - Se necessario, ruotare il microPET scansione di 180 ° nella vista coronale ed aumentare la scansione in modo significativo in the vista sagittale, insieme ad altre modifiche di orientamento minori.
- Passare alla scheda Fusion Schermo intero (VOI) nella parte superiore dello schermo.
- Selezionare Source A in alto a destra dello schermo.
- Passare a template> Atlas in fondo alla pagina.
- Selezionare Rat (W. Schiffer) dal menu a discesa.
NOTA: (opzionale) Tornare alla scheda coregistrazione manuale dove l'atlante dovrebbero apparire sovrapposto atlante del cervello (W. Schiffer). L'atlante possono essere utilizzati per contribuire ad allineare la scansione microPET e l'atlante del cervello (W. Schiffer). Dopo l'allineamento, tornare alla scheda Fusion Schermo intero (VOI). Un modello apparirà sul cervello, indicando quali saranno misurati sezioni del cervello per le statistiche VIO. - Seleziona origine B in alto a destra dello schermo.
- Selezionare il pulsante VOI statistiche in righ topt dello schermo.
NOTA: Viene visualizzato un foglio di calcolo. - Selezionare Salva.
NOTA: A Scrivi come apparirà la finestra [VOI Statistics]. - Selezionare Salva su file di sistema.
NOTA: A PMOD (salvataggio): scegliere apparirà la finestra dei componenti. - Nel campo Nome file, digitare il nome del file desiderato.
- Selezionare Salva.
- Eseguire l'analisi dei dati utilizzando Microsoft Office Excel 2010.
- Aprire Excel.
- Selezionare File> Apri.
- Cambiare il tipo di file da All Excel file per tutti i file.
- Passare ai file VIOSTAT salvati. Selezionare il file desiderato.
NOTA: apparirà un wizard di importazione. - Selezionare Fine. Se si utilizza un Mac, fare doppio clic sul file VOISTAT e si aprirà direttamente come file Excel.
- Selezionare la colonna contenente il VoiName campo (REgion). Copiare le informazioni e incollarlo in un nuovo file di Excel.
- Selezionare la colonna contenente i campi media e [1/1]. Copiare le informazioni e incollarlo nel nuovo file di Excel.
- Ripetere questa procedura per tutti i file VOISTAT.
- Inizia una nuova scheda per ogni set di dati.
- Tornare alla prima scheda. Selezionare una nuova cella. Calcolare il rapporto tra il lato destro di una sezione cervello al lato sinistro di una sezione del cervello dividendo il valore del lato destro del cervello dal lato sinistro del cervello. La sezione cervello appartenente al lato destro del cervello è elencata prima della sezione appartenente al lato sinistro del cervello. Ripetere questa operazione per tutte le sezioni del cervello.
- Selezionare una nuova cella. Utilizzare la funzione MEDIA per calcolare la media di ciascuno dei rapporti precedentemente calcolati in tutti i topi.
- Selezionare una nuova cella. Calcolare il SEM di ogni sezione del cervello utilizzando la funzione STDEV e dividendo it per la radice quadrata del numero di topi.
- Ripetere questa operazione per ogni set di dati.
Visualizzazione 5. Immagine
- Convertire immagini in formato analizzare file utilizzando software di analisi PMOD.
- Aprire PMOD> View.
- Passare alla scheda Visualizza nella parte superiore dello schermo.
- Aprire il menu a discesa Load a destra dello schermo e selezionare microPET. Passare alla microPET desiderata o il file CT. Selezionarlo e premere Apri.
- Aprire il menu a discesa Salva in alto a destra dello schermo e selezionare Analizza. Passare alla destinazione desiderata. Digitare il nome desiderato nel campo Nome file. Selezionare Salva.
- Creare sequenze di immagini con software di imaging VolView.
- Aprire VolView.
- Selezionare Apri file a sinistra dello schermo.
- Passare alla versione analisi dei file di dati CT per la scansione desiderata. Selezionarlo e premere Apri.
NOTA: Apparirà un Wizard Apri file. - Utilizzare le impostazioni predefinite premendo Avanti nella finestra pop-up.
- Selezionare la scheda Plugin a sinistra dello schermo.
- Aprire il menu Plugin discesa e selezionare Utility> Unisci Volumi.
- Deselezionare Rescale Components.
- Selezionare Assegna secondo ingresso.
- Passare alla versione analisi dei file di dati microPET per la stessa scansione. Selezionarlo e premere Apri.
NOTA: Apparirà un Wizard Apri file. - Utilizzare le impostazioni predefinite premendo Next in ogni schermata.
NOTA: La scansione microPET apparirà sovrapposto alla TC. - Selezionare l'impostazione Colore / Opacitàs scheda a sinistra dello schermo.
- Aprire il menu a discesa Componente in basso a destra dello schermo. Selezionare 1.
NOTA: Questo farà sì che la TAC è l'unica immagine affetti dalle seguenti istruzioni. - Nella sezione Scalar Colore Mapping, selezionare il punto di mezzo. Rimuovere trascinandolo fuori dell'area di slider.
- Selezionare il punto di sinistra.
NOTA: Viene visualizzata una finestra Color Picker. - Cambiare il colore del punto di nero.
- Selezionare il punto giusto.
NOTA: Viene visualizzata una finestra Color Picker. - Cambiare il colore del punto di bianco.
- Nella sezione Scalar Opacità Mapping, aggiungere un punto facendo clic in qualsiasi punto della casella.
- Regolare la sezione finché l'immagine CT visualizza solo lo scheletro del ratto.
- Selezionare Abilita Shading.
- Selezionare la Rscheda eview a sinistra dello schermo.
- Cambiare numero di fotogrammi da 72.
- Cambiare la rotazione X 360.
- Selezionare Crea.
- Passare alla destinazione desiderata. Creare una nuova cartella per memorizzare le immagini facendo clic destro su uno spazio vuoto e selezionando Nuovo> Cartella.
- Digitare il nome desiderato nel campo Nome file. Selezionare Salva.
NOTA: Viene visualizzata una finestra Grandezza costruttiva. - Selezionare OK.
- Volview genererà le immagini. Al termine, apparirà una finestra che indica "Il filmato è stato creato con successo!" Seleziona OK.
- Tornare alla scheda Impostazioni colore / opacità.
- Sotto Componente Peso (s), regolare il dispositivo di scorrimento per il componente 1 in modo che abbia la value di 0.
NOTA: Solo appare la scansione microPET. - Ripetere i passaggi 5.2.21-28 per creare una seconda sequenza di immagini.
- Tornare alla scheda Impostazioni colore / opacità.
- Sotto Componente Peso (s), regolare il dispositivo di scorrimento per il componente 2 in modo che abbia il valore di 0.
NOTA: Solo appare la TAC. - Ripetere i passaggi 5.2.21-28 per creare una terza sequenza di immagini.
- Generare i film di rotazione (mostrato in video) utilizzando il software ImageJ.
- Aprire ImageJ.
- Selezionare File> Importa> Sequenza Immagine.
- Individuare il file contenente le immagini che vedono solo i dati CT per la scansione pre. Selezionare la prima immagine e premere Select.
NOTA: Viene visualizzata una finestra Sequence Options. - Selezionare OK.
- Select File &# 62; Importa> Sequenza d'immagini.
- Individuare il file contenente le immagini che vedono solo i dati microPET per la scansione pre. Selezionare la prima immagine e premere Select.
NOTA: Viene visualizzata una finestra Sequence Options. - Selezionare OK.
- Selezionare File> Importa> Sequenza Immagine.
- Individuare il file contenente le immagini che vedono sia i dati CT e microPET per la scansione pre. Selezionare la prima immagine e premere Select.
NOTA: Viene visualizzata una finestra Sequence Options. - Selezionare OK.
- Selezionare Immagine> Stack> Strumenti> Combine.
NOTA: Viene visualizzata una finestra Combiner. - Selezionare il menu a discesa stack1. Selezionare lo stack che contiene i dati CT.
- Selezionare il menu a discesa stack2. Selezionare la pila che contiene il Midati croPET. Selezionare OK.
NOTA: Apparirà una nuova pila con entrambe le scansioni. - Selezionare Immagine> Stack> Strumenti> Combine.
NOTA: Viene visualizzata una finestra Combiner. - Selezionare il menu a discesa stack1. Selezionare lo stack che contiene le pile combinati.
- Selezionare il menu a discesa stack2. Selezionare la pila che contiene sia i dati CT ei dati microPET. Selezionare OK.
NOTA: Apparirà una nuova pila con tutte e tre le scansioni. - Tenere le pile insieme aperto. Ripetere i passaggi 5.3.2-16 per il posto di scansione di 1,5 ore e le pile di immagini di scansione 24 ore postali.
- Selezionare Immagine> Stack> Strumenti> Combine.
NOTA: Viene visualizzata una finestra Combiner. - Selezionare il menu a discesa stack1. Selezionare la pila che contiene tutti i dati di scansione pre.
- Selezionare la stack2 drop-down menu. Selezionare la pila che contiene tutti i dati di scansione dopo 1,5 ore.
- Controllare Combina verticalmente.
- Selezionare OK.
NOTA: Una nuova pila sia con l'analisi pre e scansione dopo 1,5 ore apparirà. - Selezionare Immagine> Stack> Strumenti> Combine.
NOTA: Viene visualizzata una finestra Combiner. - Selezionare il menu a discesa stack1. Selezionare lo stack che contiene le pile combinati.
- Selezionare il menu a discesa stack2. Selezionare la pila che contiene tutti i dati di scansione 24 ore dopo.
- Controllare Combina verticalmente.
- Selezionare OK.
NOTA: Apparirà una nuova pila con tutti i nove scansioni. - Selezionare File> Salva con nome> AVI.
- Selezionare OK.
- Passare alla destinazione desiderata. Digitare il nome desiderato nel nome del file Campo. Selezionare Salva.
Risultati
Ischemia cerebrale è stato avviato in vivo ratti Sprague-Dawley mediante occlusione dell'arteria cerebrale media, con successiva imaging nucleare eseguita per rilevare gli effetti. Ratti vivi sono state ripreso 24 ore prima dell'induzione ictus, così come 1,5 ore e 24 ore dopo l'ischemia, ciascuno con iniezioni indipendenti di circa 500 uCi di 18 F-FDG che decade completamente entro 18 ore. L'anello sistema Albira tre rilevatore utilizzato per questi studi ha una sensibilità del 9%, rendendo 500 pCi una dose ragionevole per i topi. Dati di imaging rappresentativi per PET e radiografici TC sono mostrati per un topo al pre 24 ore e 24 hr punti di tempo post-riperfusione in figura 1, superiore e inferiore, rispettivamente righe. Il trasversali (pannelli A e E), sagittale (pannelli B e F), e coronale (pannelli C e G) fette per ogni scansione vengono presentati con i dati FDG-PET colorate in un & #8220; rainbow "scala di intensità, e sovrapposto al CT in scala di grigi. Si noti che il CT è stato utilizzato per anatomica co-registrazione dei dati PET all'interno del cranio animale, e nessuna modifica radiodensity nel tessuto cerebrale sono stati notati durante questi esperimenti. In 24 ore ci fu un drastico calo in assorbimento del glucosio per l'emisfero ipsilaterale, suggerendo danni ai tessuti diffusa a causa della ictus ischemico indotto. Una rappresentazione 3D dei dati di sovrapposizione è presentato in Figura 1D e H. Quando ruotato sullo schermo, i dati resi forniscono una maggiore visualizzazione della diminuzione ictus indotto in FDG.
Al fine di quantificare le alterazioni cerebrali assorbimento di glucosio a causa di ictus in maniera spazio-temporale, un atlante del cervello VOI è stato applicato a pre-ictus al basale, 1,5 ore, e 24 ore (post-riperfusione) per ogni scansione. Ciò è stato realizzato usando il pacchetto software PMOD in combinazione con il W. Schiffer template cervello del ratto e Atlas. In primo luogo, PMOD è stato utilizzato per trasformare ogni set di dati PET cervello di ratto allo spazio adeguato e la geometria attraverso il manuale di co-registrazione tramite il movimento e gli strumenti Ruota nella scheda Reslicing. Si noti che lo strumento scala è disponibile per regolare la dimensione generale del cervello, se necessario, anche. Mentre l'uso dell'atlante Schiffer è superiore al disegno manualmente VOI all'interno dello spazio cerebrale, ci può essere errore sperimentale indotta da imprecisa fusione cerebrale. Pertanto, in alcuni casi un aumento del numero di animali può essere necessaria per ottenere una significatività statistica. Avanti, l'atlante del cervello W. Schiffer VOI stata applicata automaticamente per misurare l'accumulo di FDG, in unità di assorbimento standard, entro sub-regioni del cervello di ratto (Figura 2) definite. L'atlante cervello VOI possono essere utilizzati anche in modo iterativo con il modello del cervello standard per ottimizzare ulteriormente la fusione manuale dei dati sperimentali. Come l'evento stoke è stato isolato per l'emisfero cerebrale destro in ogni animale, il danno to ciascuna regione è stato quantificato calcolando un rapporto di attività assorbimento del glucosio tra regioni controlaterali (Figura 2). L'uso di questi rapporti fornisce una comoda normalizzazione tra giusto e emisfero sinistro, e rimuove la variabilità che possono verificarsi quando si confrontano i valori di intensità di segnale PET attraverso diverse scansioni. A 1,5 ore post-ictus, 18 fumaioli F-FDG non sono stati colpiti nella zona ischemica. Pertanto, non cambiamenti quantitativi sono stati osservati in assorbimento del glucosio tra gli emisferi controlaterale e ipsilaterale (Figura 3, blu e verde) barre. Questo potrebbe essere dovuto a iper-assorbimento di glucosio da parte della regione peri-ischemica o un aumento del metabolismo del glucosio a questo punto di tempo per compensare la perdita di cellulari ATP 10,11. Tuttavia, significativa riduzione nell'assorbimento del glucosio in specifiche regioni dell'emisfero ipsilaterale è stata osservata in più animali (n = 5) a 24 ore post-riperfusione (Figura 3, barre rosse). Othregioni del cervello er visualizzati poco o nessun danno nell'emisfero ipsilaterale.
In particolare, le regioni dell'emisfero ipsilaterale che costantemente esposto diminuita fumaioli FDG sono stati: amigdala, putamen caudato, uditivo, entorinale, lobo insulare, paracorteccia, e le regioni della corteccia somatosensoriale. Le lesioni corticali causati a causa di ictus sono associati con la perdita di connessioni neuronali e mappe funzionali alterati. Anomalie strutturali nell'amigdala a causa di ictus portare alla psicopatologia e cognitive disfunzione 12. Non è sorprendente che la regione caudato-putamen risente per FDG come il flusso sanguigno cerebrale nella parte laterale di questa regione è fornita dal occlusa dell'arteria cerebrale media 13. La patologia in questa regione del cervello dei roditori porta a compromissione apprendimento discriminare, elaborazione cognitiva, e le funzioni non-motorie 14. Incapacità di prendere FDG è stata osservata anche nella corteccia entorinale unad corteccia uditiva nel lobo temporale mediale dell'emisfero ischemica. Nel 2001, Davis et al. Ha riferito che il danno corteccia entorinale nei ratti porta ad integrazione sensoriale alterata e l'apprendimento spaziale persistente deificits 15. La disfunzione uditiva si verifica in ictus negli esseri umani, anche se di rado 16. Tuttavia, l'assorbimento di FDG dal collicolo inferiore che è una delle principali vie uditive non è stata influenzata da ictus nel nostro modello. E 'stato dimostrato che i ratti ictus MCAO indotte aumentano adrenalina, noradrenalina, e l'attività del nervo simpatico a causa infarto nella corteccia insulare, una delle regioni del nostro modello che ha mostrato scarsa FDG 17. Ciò potrebbe portare a cambiamenti nella funzione autonomica che interessano il sistema cardiaco. Poor FDG è stata osservata anche nella zona della corteccia somatosensoriale fronto-parietale. Infarto ischemico in questo settore è stato segnalato per causare anomalie strutturali e la perdita di connessioni talamo18. Limitata FDG è stata osservata anche nella corteccia visiva, che potrebbe portare a compromissione oculare predominio plasticità, come riportato nei neonati di ratto sottoposti ad ischemia ipossica 19. Tuttavia, è diminuita FDG non è stato osservato nel collicolo superiore una zona che si occupa di orientamento visivo motore 20. FDG nella zona dell'ippocampo è stata anche ridotta, una zona che è importante per la memoria spaziale e navigazione. È stato osservato che costantemente sottoregioni del mesencefalo, come collicolo superiore ed inferiore, tegmentale ventrale (VTA), nonché il bulbo olfattivo del proencefalo, e il talamo profonda non erano influenzati da occlusione l'arteria carotide centrale (Figura 3).
Presi insieme, questi risultati dimostrano che FDG-PET con TC fornisce una strategia di imaging praticabile, riproducibile e non invasiva con cui monitorare l'ischemia cerebrale nei ratti in modo longitudinale.
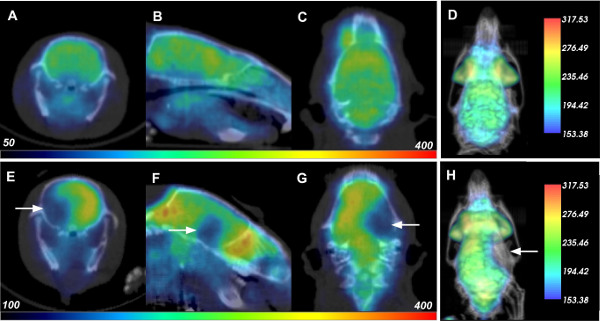
Figura 1:. PET-CT dati di ratti prima e dopo ischemia cerebrale Ogni riga visualizza la rispettiva trasversale (A, E), sagittale (B, F), coronale (C, G), e rese 3D (D, H) PET dati -CT di un ratto 24 ore prima (riga in alto) e 24 ore dopo la riperfusione (o 26 ore dopo l'induzione di ischemia cerebrale, in basso). Frecce bianche indicano posizione diminuito assorbimento di FDG a causa di danni ictus. Cliccate qui per vedere una versione più grande di questa figura.
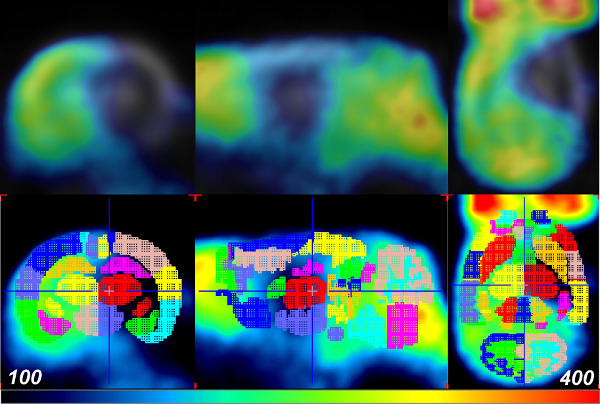
Figura 2: dati PET allineati con l'atlante del cervello W. Schiffer Rat utilizzando PMOD I dati FDG-PET.un ratto 24 ore dopo la riperfusione (o post-cerebrale ischemia 26 ore; riga in alto) si fonde con le VOI atlante modello del cervello per l'analisi (fila in basso). Colori indicano la VOI separata dell'atlante modello cervello. Cliccate qui per vedere una versione più grande di questa figura.

. Figura 3: Rappresentante analisi quantitativa di glucosio assorbimento in cervello di ratto dalla Sezione Rapporti di destra a emisfero sinistro segnale FDG PET in standard uptake unità da ogni regione del W. Schiffer Rat Brain Atlas segnalato per le scansioni sono state prese prima dell'evento di ictus ischemico (pre; blu), 1,5 ore (verde) e 24 ore (rosso) post-riperfusione (o 26 ore post-riperfusione). Barre di errore rappresentano errore standard per gli eventi di ictus cerebrale n = 5 ratto, ad ogni tempo. ** P ≤ 0,01, p *≤ 0.05 (paired t-test). Cliccate qui per vedere una versione più grande di questa figura.

Figura 4:. Illustrazione di MCAO Chirurgia La linea rossa è la occluder che viene inserito nell'arteria carotide esterna. L'ovale blu rappresenta l'area del cervello.
Discussione
Qui vi presentiamo una strategia dettagliata per l'induzione della corsa, l'imaging PET, e il cervello standard sub-regione di misurazione di danni ai tessuti in ratti Sprague-Dawley. Imaging di piccoli modelli animali, in particolare nella zona di ictus è benefico, come trattamento per l'ictus sia efficace dipende da un brevissimo tempo terapeutico. Qui vi presentiamo un modello di danno da riperfusione, in cui corsa è stata indotta tramite un occlusione dell'arteria cerebrale media, e di imaging condotto con FDG PET, a fianco di un CT a raggi X per riferimento anatomica. Misure irreggimentato di FDG all'interno sub-regioni del cervello è stata resa possibile da una precisa mappatura delle atlante modello VOI sul cervello di ratto all'interno del software di analisi dell'immagine PMOD. I valori Raziometrico FDG sono stati raccolti dividendo sub-regioni del cervello corrispondente in emisferi opposti, che permette una misura diretta di danni, mentre normalizzare le variazioni di segnale globale FDG PET tra animali diversi e tempi points. Queste misure sono in linea con l'effetto atteso di ictus sul cervello di ratto, dimostrando coerenza, significativa perdita di tessuto cerebrale assorbimento del glucosio in alcune regioni dell'emisfero ipsilaterale. Questa metodologia ha il potenziale per aumentare la nostra capacità di confrontare insiemi di dati FDG PET di animali sottoposti a molti tipi di traumi cerebrali, tra cui ictus ischemico. Standardizzando i volumi da quantificare attraverso gli emisferi del cervello e in più gli animali, questo metodo genera misure coerenti di diminuzione assorbimento tissutale di glucosio. Si noti che gli altri traccianti PET con assorbimento del cervello, come la 11 C-raclopride per i recettori D2, può essere utilizzata con questo protocollo come pure 21. Infine, si descrive un metodo per visualizzare un ictus ischemico nel cervello di ratto nel suo scheletro con elevata precisione anatomica in tre dimensioni. Poiché compromissione fisiologica e funzionale ictus indotta potrebbe essere transitoria o permanente, questo metodo non invasivo di immaginipermette ai ricercatori di valutare danni cerebrali nello stesso animale per un periodo di tempo. Esso fornisce un modo di segnare neurologicamente i ratti, ma anche di valutare i deficit neurologici a breve e lungo termine, nello stesso animale. La funzione template del software PMOD permette ai ricercatori con una certa quantità di precisione per mappare la zona ferita e forse in correlazione con sequele neurologiche e dei modelli comportamentali.
Per la quantificazione precisa dei danni ictus subregione del cervello, il passo fondamentale è l'allineamento dei dati PET con l'atlante del cervello di ratto all'interno PMOD. Incoerenze in allineamento può portare alla non corretta quantificazione delle sottoregioni cerebrali colpite da ischemia. Come descritto nel passaggio protocollo 4.1.7, è possibile utilizzare le ghiandole Harderian come punti di riferimento per allineare l'atlante del cervello con dati sperimentali PET. Effetti di volume parziale (PVE) sono una preoccupazione in questo tipo di analisi, e limiterà la risoluzione complessiva della struttura del cervello chepuò essere ripreso. Ricaduta segnale può verificarsi tra volumi adiacenti, o VOI stesso potrebbe essere troppo piccolo rispetto alla risoluzione dello strumento, riducendo così la precisione quantitativa del metodo 22. Il sistema Albira PET utilizzato in questi studi è dotato di tre anelli rivelatore e fornisce una risoluzione di 1,1 mm, che è evoluto dal corrispondente sistema di un anello che ha raggiunto 1,5 millimetri 23. BUVAT e collaboratori notare che PVE influenzerà misurazioni di tumori con diametro inferiore 2-3x la risoluzione del sistema a piena semilarghezza max (FWHM), che corrisponde ad un volume sferico di 5,6-18,9 mm 3 per il 3- anello Albira. Casteels et al. Recentemente dichiarato che volumi superiori a 8 mm 3 avranno effetti di volume parziale minimi per i moderni scanner PET pre-clinici con risoluzione nel range di 1,1-1,3 mm 24. L'atlante Schiffer è stato accuratamente costruito con questi parametri in mente, e utilizza 58 VOI, di cui 13 rientrano al di sotto della soglia dell'8 mm 3. Questi includono il VOI per emisferi destro e sinistro della corteccia prefrontale mediale (6.3 mm 3, R / L), il Par A Cortex (7,6 mm 3, R / L), il collicolo superiore (7.1 mm 3, R / L) , il VTA (5,5 mm 3, R / L), collicolo inferiore (5,7 mm 3, R / L), ghiandola pituitaria (5.9 mm 3), e il flusso di sangue CB (5.1 mm 3). Inoltre, le misurazioni della corteccia frontale (1,4 mm 3 R / L) saranno i più sensibili al PvE grazie alle sue piccole dimensioni.
Studi in animali più grandi come topi, che hanno un corrispondente aumento delle dimensioni dell'anatomia, avranno un maggior numero di sub-regioni cerebrali che possono essere quantificati attendibilmente rispetto ai topi. Tuttavia, questi metodi sono applicabili per l'imaging cerebrale nei topi, che hanno un proprio atlante del cervello disponibile in PMOD che si compone di 18 sottoregioni che sonodimensionati per minimizzare PVE. Inoltre, utilizzando il PET per identificare le regioni del cervello più piccolo di sono descritti in questo studio può richiedere l'uso di metodi alternativi. Il metodo qui descritto permette di quantificare irreggimentato ed efficiente di danni ai tessuti cerebrali nel tempo, segmentato per subregione del cervello, in topi vivi. Lesioni a causa di ischemia è dimostrato qui come esempio, ma la metodologia presentata per la quantificazione delle variazioni nell'attività cerebrale può essere applicata a qualsiasi altra condizione che colpiscono il cervello di ratto.
In conclusione, i dati FDG-PET-CT di piccoli animali possono essere acquisiti in modo non invasivo ed economico, e possono essere convenientemente utilizzati per piccoli animali di imaging in maniera quantitativa. Utilizzando la mascherina Schiffer del programma PMOD, aree ischemiche del cervello possono delineare ei dati misurati PET. Questo è uno strumento potente per il futuro studio di riorganizzazione del cervello, la riparazione, e la neurogenesi dopo ischemia cerebrale che promuoverà DEVELOPMEnt di neuro-terapie di disabili pazienti con ictus. Questa visualizzazione sarà anche particolarmente utile per valutare altri casi di trauma cerebrale, dove il danno tissutale può essere allineato dalla modalità di imaging separati.
Divulgazioni
WML is a consultant for Bruker Molecular Imaging
Riconoscimenti
This study was supported by a grant from Bruker Molecular Imaging (to WML) and from the NIH (Grant HL019982 to FJC).
Materiali
| Name | Company | Catalog Number | Comments |
| Albira PET SPECT CT | Bruker | 3D molecular imaging equipment | |
| Sprague Dawley Rats | Charles River Laboratories | 400 | Animal Subjects |
| 18-F-D-Glucose | Spectron | PET compound | |
| micro clamp | FST | 18055-03 | artery clamp |
| occluder #4037 | Doccol Corp. | 403712PK10 | surgical stroke induction |
Riferimenti
- Minino, A. M., Murphy, S. L., Xu, J., Kochanek, K. D. Deaths: final data for 2008. Natl Vital Stat Rep. 59, 1-126 (2011).
- Niemi, M. L., Laaksonen, R., Kotila, M., Waltimo, O. Quality of life 4 years after stroke. Stroke. 19, 1101-1107 (1988).
- Ter-Pogossian, M. M., Phelps, M. E., Hoffman, E. J., Mullani, N. A. A positron-emission transaxial tomograph for nuclear imaging. 114, 89-98 (1975).
- Schiffer, W. K., et al. Serial microPET measures of the metabolic reaction to a microdialysis probe implant. J Neurosci Methods. 155, 272-284 (2006).
- Roger, V. L., et al. Heart disease and stroke statistics--2012 update: a report from the American Heart Association. Circulation. 125, e2-e220 (2012).
- Heiss, W. D., et al. Progressive derangement of periinfarct viable tissue in ischemic stroke. J Cereb Blood Flow Metab. 12, 193-203 (1992).
- Foster, N. L., et al. Alzheimer's disease: focal cortical changes shown by positron emission tomography. Neurology. 33, 961-965 (1983).
- Bustamante, E., Pedersen, P. L. High aerobic glycolysis of rat hepatoma cells in culture: role of mitochondrial hexokinase. Proc Natl Acad Sci U S A. 74, 3735-3739 (1977).
- Toga, A. W., Santori, E. M., Hazani, R., Ambach, K. A 3D digital map of rat brain. Brain Res Bull. 38, 77-85 (1995).
- Yuan, H., et al. Saptiotemporal uptake characteristics of [18]F-2-Fluoro-2-Deoxy-D-Glucose in a rat middle cerebral artery occlusion model. Stroke. 44, (2013).
- Nemoto, E. M., Hossmann, K. A., Cooper, H. K. Post-ischemic hypermetabolism in cat brain. Stroke. 12 (5), 666-676 (1981).
- Sachdev, P. S., Chen, X., Joscelyne, A., Wen, W., Brodaty, H. Amygdala in stroke/transient ischemic attack patients and its relationship to cognitive impairment and psychopathology: the Sydney stroke study. Am. J. Geriatr. Psychiatry. 15, 487-496 (2007).
- Nagasawa, H., Kogure, K. Correlation between cerebral blood flow and histologic changes in a new rat model of middle cerebral artery occlusion. Stroke. 20, 1037-1043 (1989).
- Hauber, W., Schmidt, W. J. Differential effects of lesions of the dorsomedial and dorsolateral caudate-putamen on reaction time performance in rats. Behavioral Brain Research. 60, 211-215 (1994).
- Davis, A. E., Gimenez, A. M., Therrien, B. Effects of entorhinal cortex lesions on sensory integration and spatial learning. Nurs. Res. 50, 77-85 (2001).
- Hausler, R., Levine, R. A. Auditory dysfunction in stroke. Acta Otolaryngol. 120, 689-703 (2000).
- Cechetto, D. F., Wilson, J. X., Smith, K. E., Wolski, D., Silver, M. D., Hachinski, V. C. Autonomic and myocardial changes in middle cerebral artery occlusion: stroke models in the rat. Brain Res. 502, 5296-5305 (1989).
- Carmichael, S. T., Wei, L., Rovainen, C. M., Woolsey, T. A. New patterns of intracortical projections after focal cortical strike. Neurobiol. of Disease. 8, 910-922 (2001).
- Failor, S., et al. Neonatal cerebral hypoxia-ischemia impairs plasticity in rat visual cortex. J. Neurosci. 30, 81-92 (2010).
- Wurtz, R. H., Albano, J. E. Visual-motor function of the primate superior colliculus. Ann. Rev. Neurosci. 3, 189-226 (1980).
- Kuhn, F. P., et al. Comparison of PET template-based and MRI-based image processing in the quantitative analysis of C11-raclopride PET. EJNMMI Res. 4 (1), 7(2014).
- Soret, M., Bacharach, S. L., Buvat, I. Partial-Volume Effect in PET Tumor Imaging. J. Nuc. Med. 48, 932-945 (2007).
- Sanchez, F., et al. ALBIRA: A Small Animal PET/SPECT/CT Imaging System. Med. Phys. 40 (5), 051906(2013).
- Casteels, C., et al. Construction and Evaluation of Quantitative Small-Animal PET Probabilistic Atlases for [18F]FDG and [18F]FECT Functional Mapping of the Mouse Brain. PLOS One. 8 (6), e65286(2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon