È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Elettrochimica e Bioelectrochemically indotta recupero di ammonio
In questo articolo
Riepilogo
We demonstrate the extraction of ammonium from an ammonium-rich stream using an electrochemical and a bioelectrochemical system. The reactor setup, operation and data analysis are discussed.
Abstract
Streams such as urine and manure can contain high levels of ammonium, which could be recovered for reuse in agriculture or chemistry. The extraction of ammonium from an ammonium-rich stream is demonstrated using an electrochemical and a bioelectrochemical system. Both systems are controlled by a potentiostat to either fix the current (for the electrochemical cell) or fix the potential of the working electrode (for the bioelectrochemical cell). In the bioelectrochemical cell, electroactive bacteria catalyze the anodic reaction, whereas in the electrochemical cell the potentiostat applies a higher voltage to produce a current. The current and consequent restoration of the charge balance across the cell allow the transport of cations, such as ammonium, across a cation exchange membrane from the anolyte to the catholyte. The high pH of the catholyte leads to formation of ammonia, which can be stripped from the medium and captured in an acid solution, thus enabling the recovery of a valuable nutrient. The flux of ammonium across the membrane is characterized at different anolyte ammonium concentrations and currents for both the abiotic and biotic reactor systems. Both systems are compared based on current and removal efficiencies for ammonium, as well as the energy input required to drive ammonium transfer across the cation exchange membrane. Finally, a comparative analysis considering key aspects such as reliability, electrode cost, and rate is made.
This video article and protocol provide the necessary information to conduct electrochemical and bioelectrochemical ammonia recovery experiments. The reactor setup for the two cases is explained, as well as the reactor operation. We elaborate on data analysis for both reactor types and on the advantages and disadvantages of bioelectrochemical and electrochemical systems.
Introduzione
Recupero dei prodotti preziosi acque reflue guadagni importanza come preziose risorse diventano scarse e il trattamento senza recupero rappresenta solo un costo. Wastewater contiene sia l'energia e sostanze nutritive che possono essere recuperati, e il recupero di nutrienti può aiutare a chiudere il ciclo di produzione 1. Recupero di energia attraverso la digestione anaerobica è un processo ben consolidata, mentre il recupero dei nutrienti è meno comune. Recupero delle sostanze nutritive da flussi di rifiuti liquidi, come urine e letame è stato ampiamente studiato, ad esempio, attraverso la produzione di struvite e sverniciatura diretta di ammoniaca 2,3. Tuttavia, la necessità di aggiunta chimico è un inconveniente di questi processi 4. Presentiamo qui una tecnica per il recupero dei nutrienti cationici da flussi di rifiuti, compresi sia potassio e ammonio. La forma cationica di questi nutrienti permette ripristino tramite una membrana selettiva di ioni in un sistema elettrochimico. In questo caso, il electrochemicSistema al costituito da una camera di anodo (dove ossidazione avviene), una camera di catodo (dove la riduzione avviene) e una membrana selettiva di ioni per separare i compartimenti. Una tensione viene applicata attraverso la cella per produrre un flusso di corrente dall'anodo al catodo. Questa tensione può essere generato da una sorgente di alimentazione esterna per guidare ossidazione dell'acqua e reazioni di riduzione. In alternativa l'ossidazione anodica, ad esempio, di sostanze organiche, può essere catalizzata da batteri elettroattivi, richiedono meno potenza. Per chiudere il circuito e mantenere l'equilibrio di carica, una specie cariche devono migrare tra gli elettrodi per ogni elettrone generato. Trasporto ammonio dalla camera di anodo alla camera catodo attraverso una membrana a scambio cationico (CEM) può così compensare il flusso di elettroni 4,5.
La tecnica qui presentata non solo rimuove ammonio da flussi di rifiuti, ma consente anche il recupero. Totale azoto ammoniacale (TAN) esiste in equilibrio sia ammonium (NH 4 +) e ammoniaca (NH 3), e dipende dal pH e dalla temperatura 6. NH 4 + è abbondantemente disponibile a causa dell'alta concentrazione TAN e vicino pH neutro nella camera di anodo e questa specie cariche positivamente possono dunque essere guidato dalla corrente attraverso il CEM nella camera catodo. La corrente spinge la riduzione di acqua al catodo, che porta alla produzione di ioni idrossido e gas idrogeno. L'equilibrio TAN sposta a quasi il 100% di NH 3 a causa del pH elevato nella camera catodo (> 10.0). NH 3 è un gas che può essere facilmente trasferito tramite circolazione dell'aria dall'unità di stripping alla colonna di assorbimento in cui è intrappolato e concentrata in una soluzione acida.
Questa tecnologia ha il potenziale per ridurre la tossicità ammonio durante la digestione anaerobica dei flussi ricchi di N come concime, aumentando così il recupero di energia da tali flussi di rifiuti, mentre simultaneamentenutrienti recupero 4. Estrazione elettrochimica e bioelectrochemical di ammonio può anche essere applicato come tecnica di recupero nutrienti sui flussi di rifiuti ad alto contenuto TAN come urina evitando così i costi per la rimozione dei nutrienti in un impianto di trattamento 7.
Il protocollo presentato qui può servire come base per molti diversi esperimenti elettrochimici e bioelectrochemical, come si usa un reattore modulare. Diversi tipi di elettrodi, membrane e spessori del telaio possono essere combinati come spiegato nel protocollo di seguito. Lo scopo principale del protocollo è quello di fornire un mezzo per il confronto del recupero ammonio elettrochimica e recupero ammonio bio-elettrochimica utilizzando una cella di elettrolisi. I sistemi sono valutati in termini di efficienza di estrazione, potenza e riproducibilità.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Montaggio del reattore e collegamento delle unità stripping e assorbimento
- Raccogliere tutto il materiale necessario per la costruzione del reattore: elettrodi, telai e gomme (vedi elenco dei materiali). Tagliare con cautela tutte le parti per le stesse dimensioni per evitare perdite durante il montaggio del reattore.
- Fori nei compartimenti del reattore per adattarsi un maschio a connettore maschio. Perforare un foro supplementare al centro del lato di uno dei compartimenti reattore per adattare l'elettrodo di riferimento.
- Preparare uno stock di 1 MH 2 SO 4 per la colonna di assorbimento. Aumentare questa concentrazione necessaria per sopportare carichi elevati di ammoniaca.
- Assicurarsi che la membrana viene pretrattata secondo le istruzioni del produttore. Pretrattare il carbonio sentiva elettrodo immergendola in 2 CTAB mm (detergente) per 3 min. Sciacquare il carbonio feltro con acqua demineralizzata 8. L'anodo stabile per esperimenti elettrochimici non richiede una pretreatment.
- Stack le diverse parti del reattore in ordine secondo il tipo di reattore. Per il bioreattore: Perspex endplate, gomma, collettore di corrente in acciaio inox, grafite pretrattato sentiva, Perspex vano reattore, gomma, membrana a scambio cationico, gomma, materiale distanziatore, acciaio elettrodo maglia di acciaio, gomma, vano reattore Perspex, gomma, perspex endplate
- Stack i componenti del reattore per la cella elettrochimica come segue: Perspex endplate, gomma, IROX anodo attraverso la placca motrice, vano reattore Perspex, gomma, distanziale, gomma, membrana a scambio cationico, gomma, materiale distanziatore, acciaio elettrodo maglia di acciaio, gomma, reattore Perspex Vano, gomma, perspex endplate.
- Utilizzare Teflon per sigillare le porte di connessione del reattore. Inserire l'elettrodo di riferimento nella stessa cella come elettrodo di lavoro: l'anodo nel caso di una cella bioelectrochemical, il catodo o anodo, nel caso di una cella elettrochimica.
- Utilizzare i dadi ebulloni per chiudere il reattore. Serrare bulloni su lati opposti per equilibrare la pressione. Non utilizzare strumenti per chiudere il reattore dito-stretto è sufficiente a garantire un reattore completamente sigillato.
- Riempire il reattore con acqua per verificare se il reattore è a tenuta. Se appaiono le perdite, verificare se i bulloni siano serrati abbastanza o se una delle parti del reattore spostato durante il montaggio del reattore. Se non ci sono perdite, svuotare l'acqua dal reattore.
- Aggiungi anelli Raschig sia colonna striscia e l'assorbimento a riempire le colonne a metà strada.
- Calibrare la portata di tutte le pompe. Collegare i mangimi e ricircolo pompe al reattore e la pompa dell'aria alle unità spelatura ed assorbimento (Figura 1). Minimizzare la lunghezza del tubo, per quanto possibile.
- Riempire la colonna di assorbimento con 250 ml di 1 MH 2 SO 4, si dovrebbe coprire gli anelli Raschig. Assicurarsi che il flusso d'aria mescola l'acido bene quando la pompa viene attivata. Aumentare o diminuire il volume di acido basato sul disegno strippaggio colonna e la pompa di aria capacità.

Figura 1. Reattore configurazione per il sistema bioelectrochemical abilitazione all'estrazione di ammonio. Il sistema presentato qui funziona in continuo. Le linee continue rappresentano il flusso del liquido, linee tratteggiate rappresentano il flusso di gas. Cliccate qui per vedere una versione più grande di questa figura.
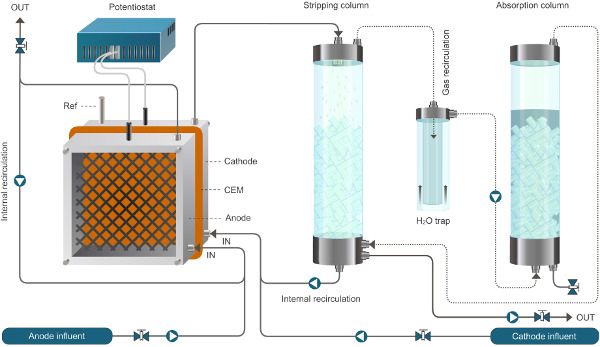
Figura 2. Reattore configurazione per il sistema bioelectrochemical abilitazione all'estrazione di ammonio. Il sistema presentato qui funziona in continuo. Le linee continue rappresentano il flusso di liquido, linee tratteggiate rappresentano il flusso di gas.ww.jove.com/files/ftp_upload/52405/52405fig2large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
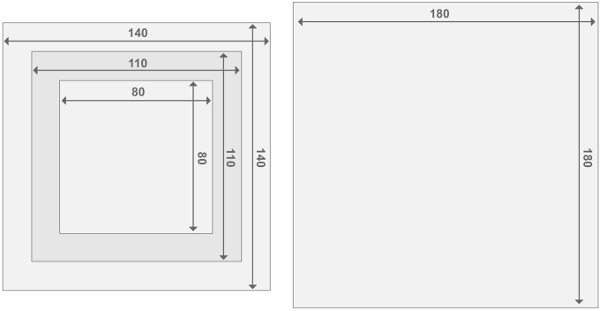
Figura 3. Progettazione delle strutture del reattore di perspex. Ogni reattore è composto da due reattori endplate e 2 compartimenti del reattore. Tutte le parti hanno uno spessore di 2 cm. I dettagli relativi alla dimensione di altri materiali si possono trovare nella lista dei materiali. Cliccate qui per vedere una versione più grande di questa figura.
2. Bioanode Estrazione Driven
- Preparazione del supporto.
- Preparare anolyte per il bioreattore come descritto nella Tabella 1 9. Aumentare la concentrazione di ammonio nel mezzo per simulare un flusso di rifiuti ricca di azoto.
- Per memorizzare il medium prima dell'uso, sterilizzare in autoclave il mezzo per assicurare la fonte di carbonio non si esaurisce attraverso la contaminazione. Preparare vitamine e oligoelementi in base alla tabella 1 e aggiungere dopo autoclave e il raffreddamento del mezzo.
- Lavare il mezzo da spurgo con azoto per almeno 30 minuti per eliminare l'ossigeno. Per fare questo, inserire un tubo o ago nel mezzo e accendere la corrente di gas di azoto.
- Preparare una soluzione conduttrice come catolita. In questo caso, utilizzare 0,1 M NaCl per consentire una produzione caustica.
| Componente | Importo | ||
| Na 2 HPO 4 | 6 g / L | ||
| KH 2 PO 4 | 3 g / L | ||
| NaCl | 0,5 g / L | ||
| NH 4 Cl | 0,5 g / L | ||
| MgSO4 · 7H 2 O | 0,1 g / L | ||
| CaCl 2 · 2H 2 O soluzione (14,6 g / l) | 1 ml | ||
| Acetato di sodio | 2 g / L (per start-up) | ||
| Trace Elements | 1 ml | ||
| Soluzione Vitamin | 1 ml | ||
| Trace Elements (1,000x) | g / L | Vitamine (1,000x) | g / L |
| CoCl 2 | 0.1 | biotina | 0,004 |
| Na 2 Moo 4 .2H 2 O | 0.01 | acido folico | 0.004 |
| H 3 BO 3 | 0.01 | piridossina cloridrato | 0.02 |
| Mg 2 Cl 2 6H 2 O | 3 | riboflavina | 0.01 |
| ZnCl 2 | 0.1 | cloridrato di tiamina | 0.01 |
| CaCl 2 .2H 2 O | 0.1 | acido nicotinico | 0.01 |
| NaCl | 1 | Pantotenato DL-calcio | 0.01 |
| Acido nitrilotriacetico | 1.5 | Vit B12 | 0.0002 |
| AlCl 3 .6H 2 O | 0.01 | p Acido -aminobenzoic | 0.01 |
| CuCl 2 | 0.01 | lipoico (tiottico) Acido | 0.01 |
| FeCl 2 | 0.1 | myo-inositolo | 0.01 |
| MnCl 2 .2H 2 O | 0.5 | cloruro di colina | 0.01 |
| Regolare a pH 6,5 con KOH | niacinamide | 0.01 | |
| cloridrato pyridoxal | 0.01 | ||
| ascorbato di sodio | 0.01 |
Tabella 1. Anolyte composizione per l'estrazione di ammonio bio-anodo guidato.
- Semina del bioreattore
NOTA: lavorare in condizioni sterili non è necessario per questo bioreattore, come una coltura mista inoculo viene utilizzato e condizioni reattore selezionerà per gli organismi elettroattivi specifici.- Preparare l'inoculo. Per questo bioreattore, preparare una miscela di 30 ml di effluenti dal bioreattori anaerobici attivi tra cui un fermentatore, Un bioanode, un digestore anaerobico e / o refluo. Raccogliere il composto in una siringa.
- Collegare un sacchetto pieno di gas N 2 alla bottiglia anolito per mantenere la pressione stabile pur non consentendo ossigeno per entrare. Mescolare la sorgente inoculo con un volume di anodico (qui, 100 ml di anodico per 30 ml di inoculo sorgente) per svuotare la siringa con inoculo nel flacone mezzo. Assicurati di ottenere il volume necessario per riempire il compartimento anodico.
- Utilizzando una siringa, riempire il compartimento anodico e catodico simultaneamente con le rispettive soluzioni. Collegare un sacchetto pieno di gas N 2 alla bottiglia anolita modo che la soluzione anolita può essere rimosso attraverso una porta di campionamento senza introdurre ossigeno. Chiudere la porta campione con un rubinetto tra i trasferimenti.
NOTA: Eseguire questo passo insieme con un collega per assicurarsi che entrambi i compartimenti del reattore sono riempiti contemporaneamente. - Quando entrambi i compartimenti del reattore sono pieni, accendere ilpompa di ricircolo ad un tasso di ricircolo di circa 6 L / hr.
- Collegare il cavo potenziostato tre elettrodi, utilizzando l'anodo come elettrodo di lavoro. Posizionare l'elettrodo di riferimento nel compartimento anodico.
- Accendere il potenziostato in modalità cronoamperometria utilizzando il software potenziostato. Selezionare un potenziale anodo fisso di -200 mV vs. Ag / AgCl.
- Esecuzione di un reattore continuo per l'estrazione di ammonio
NOTA: Come il biofilm si sviluppa, corrente sarà prodotto con il consumo di acetato. Come conseguenza di esaurimento acetato, la corrente scenderà (vedere la sezione Risultati, Figura 3).- Per cambiare alimentazione continua, attivare la pompa di alimentazione per l'anodo e catodo. La velocità della pompa determina il tempo di residenza idraulico (HRT). Qui, operare il reattore ad una HRT di 6 ore.
- Accendere la pompa dell'aria dell'unità nastro e l'assorbimento. Ricircolare l'aria in un circuito chiuso, o circolare in unanello aperto con l'aria ambiente. Configurazione del flusso d'aria può influenzare l'efficienza di assorbimento.
- Aggiornare i media tre volte alla settimana. Preparare anolita fresco e catolito come descritto nei passaggi 2.1.1-2.1.4.
- Dopo queste operazioni, collegare un sacchetto pieno di gas N 2 alla bottiglia di alimentazione chiusa, arrestare la pompa di alimentazione, mettere un morsetto sulla linea influente, cambiare le vecchie e nuove bottiglie e, infine, rimuovere le pinze e riavviare la pompa.
- Ogni volta che il mangime viene aggiornata, prendere 5 ml campioni liquidi dell'effluente e influente del anolito e catolita per la misura della conducibilità, pH, contenuto di acetato di ammonio e concentrazione.
- Quando si cambia l'alimentazione, anche prendere un campione 3 ml della colonna di assorbimento per controllare il pH e per l'analisi TAN. Quando il pH si avvicina 4, sostituire l'assorbente fresca soluzione 1 M di acido solforico per garantire un'elevata efficienza di assorbimento.
- Poiché la corrente prima aumenta e poi raggiungere un plateau, misurare l'assocontenuti tate nel influente anolita e degli effluenti per assicurare che questo non è causato da una limitazione del carbonio: le concentrazioni di acetato nella effluenti dell'anolita di sotto di 100 mg / L indicano limitazione di carbonio. Aumentare la concentrazione di acetato nel mangime in tal caso (Tabella 2).
- Se la stabilizzazione corrente non è causato dalle limitazioni acetato, aumentare gradualmente la concentrazione di ammonio nel mangime, e attendere la stabilizzazione della corrente per valutare l'efficienza di estrazione (Tabella 3).
NOTA: Poiché la concentrazione di ammonio viene aumentata, la tossicità di ammoniaca ed alta conducibilità possano impugnare la biofilm e la corrente alla fine goccia di conseguenza.
| Tempo | Quantità di acetato di sodio aggiunto al feed anodo (g / L) |
| Giorno 0 - Day 35 | 2 |
| 35 Day - Day 37 | 3 |
| Giorno 37 - Giorno 51 | 4 |
| Giorno 51 - Giorno 61 | 5 |
Tabella 2. Concentrazione di acetato di sodio nel anolita per l'estrazione di ammonio bioanode guidato.
| Tempo | Quantità di NH 4 HCO 3 aggiunto al feed anodo (g / L) | Fase |
| Giorno 0 - Day 16 | 2.26 | Io |
| Giorno 16 - Giorno 26 | 4.5 | II |
| Giorno 26 - Giorno 33 | 9 | III |
| Giorno 33 - Giorno 40 | 14.1 | IV |
| Giorno 40 - Giorno 47 | 20 | V |
| Giorno 47 - Giorno 54 | 25.4 | VI |
| Giorno 54 - Giorno 63 | 31 | VII |
Tabella 3. Concentrazione di ammonio nel anolita per l'estrazione di ammonio bioanode guidato. Le fasi sono indicate sul grafico densità di corrente (Figura 2).
3. elettrochimica Estrazione
- Preparazione dei supporti
- Preparare un flusso di acque reflue sintetica anolyte secondo la Tabella 4 4. Aggiungere solfato di ammonio per raggiungere una concentrazione finale di 1, 3 o 5 g N / L.
- Preparare una soluzione 0,1 M di NaCl per catolito.
| Componente | Importo |
| Na 2 HPO 4 .2H 2 O | 1,03 g / L |
| KH 2 PO 4 | 0,58 g / L |
| MgSO4 · 7H 2 O | 0,1 g / L |
| CaCl 2 .2H 2 O | 0,02 g / L |
| (NH 4) 2 SO 4 | seconda dell'esperimento, per ottenere 1/3/5 g N / L concentrazione finale |
Tabella 4. Anolyte composizione per l'estrazione di ammonio elettrochimica 4.
- Esecuzione di un reattore continuo per l'estrazione di ammonio
- Accendere la pompa di alimentazione per riempire i compartimenti reattore. Per accelerare il processo di aumentare temporaneamente la velocità della pompa.
- Ridurre la velocità della pompa per ottenere un HRT di 6 ore una volta che il reattore è riempito. Accendere la pompa di ricircolo ad una velocità di 6 L / hr. Prelevare un campione del influente (5 ml).
NOTA: Misurare la portata periodicamente durante l'esperimentoper assicurarsi che non varia. - Avviare l'unità nastro e l'assorbimento. Il funzionamento di questo apparecchio è lo stesso per il bioreattore.
- Accendere il potenziostato in modalità cronopotenziometria utilizzando il software potenziostato. Prima applicare una bassa densità di corrente di circa 0,5 A / mq a polarizzare la membrana e per determinare flusso di azoto per diffusione solo.
- Quando il sistema è stato polarizzato per 24 ore, applicare la densità di corrente necessaria per l'esperimento. Testare differenti densità di corrente, in genere vanno da 10 A / mq a 50 A / mq. Prelevare campioni di anodo e catodo effluenti, e la colonna di assorbimento prima di aumentare la densità di corrente.
NOTA: Dopo 3 cicli di HRT, il reattore dovrebbe avvicinarsi stato stazionario. - Una volta che il reattore ha raggiunto lo stato stazionario, prendere almeno 3 campioni su un percorso tempo. Prelevare campioni da anodo e catodo effluenti, e la colonna di assorbimento (5 ml). Annotare il volume di campionamento, la data e l'ora.
- A seconda della stabilità del influent dell'anodo, prendere un nuovo campione anodo influente se necessario. Ciò è necessario quando si usa reale acque reflue.
- Cambiare le condizioni di prova, come la densità di corrente applicata e concentrazione TAN. Dopo ogni modifica, lasciare che il reattore di stabilizzare per almeno 3 HRTS prima di prendere campioni.
- Quando il pH della colonna di assorbimento avvicina 4, sostituire l'assorbente fresca soluzione di acido solforico 1 M.
Analisi 4. Sample
- Misurare il pH e la conducibilità dei campioni nello stesso giorno di campionamento per ridurre imprecisioni dovute a perdita di ammoniaca volatile. Misurare pH e conducibilità utilizzando adeguatamente calibrate sonde pH e conducibilità.
- Se il campione non si misura immediatamente, conservare i campioni per l'analisi TAN (entrambi i reattori) e l'analisi degli acidi grassi (bioreattore) a 4 ° C. Filtrare i campioni del effluenti anodo bioreattore e influente attraverso 0,45 micron filtri per rispostare biomasse e contribuire a preservare gli acidi grassi. Riempire tutte le provette del campione al cerchio in modo da minimizzare la perdita di NH 3.
- Misurare azoto TAN dal metodo di distillazione a vapore standard o qualsiasi altro metodo affidabile per misurare TAN 10.
- Misurare acidi grassi come acetato di qualsiasi metodo affidabile, come cromatografia ionica o gascromatografia 11.
5. Analisi dei dati e calcoli
- Esportare il file di dati potenziostato dal software e importarlo in un foglio di calcolo. Calcolare le medie per ora per le variabili elettrochimiche per diminuire il numero di punti dati e liscia le curve durante la stampa li.
- Raccogliere tutti i dati misurati (pH, ammonio, VFA) in un file di dati per i calcoli. I calcoli sono discussi nella sezione risultati.
- Calcolare l'attuale produzione del bioreattore. Questo è meglio rappresentato come densità di corrente, che viene calcolato come segue (Equazione 1,12):
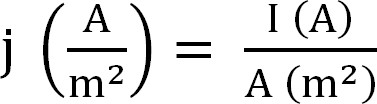 Equazione 1
Equazione 1
j con la densità di corrente, la corrente I assoluta, e A superficie proiettata la dell'elettrodo. In alcuni software è possibile avere questo calcolato automaticamente inserendo la superficie anodo prima dell'inizio dell'esperimento. - Calcolare i parametri relativi all'estrazione ammonio
- Calcolare il flusso di azoto. Normalizza flusso di azoto (N g / mq / d) alla superficie della membrana poi espressa come densità di corrente (I N). Utilizzare questo valore per calcolare la CE (Equazione 2, 3, e 4):
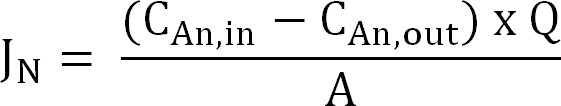 Equazione 2
Equazione 2
dove C An, a (g N / L) e C An, out (g N / L) sono le concentrazioni di ammonio misurate arrivando e il compartimento anodico,rispettivamente. Q (L / D) è la portata anodo e A (m 2) è la superficie della membrana (pari a anodo proiettata e la superficie del catodo). - Presentare il flusso di azoto densità di corrente (I N, A / m):
 Equazione 3
Equazione 3
dove z NH4 + (-) è la carica di NH 4 +, F la costante di Faraday (96.485 C / mol) e M il peso molecolare di azoto (14 g / mol). - Calcolare il rendimento corrente (CE,%) come:
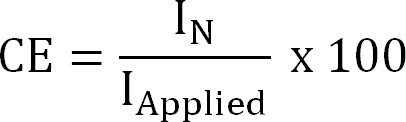 Equazione 4
Equazione 4
dove Applied (A / m²) è il applicata (estrazione elettrochimica) o misurato (estrazione bioelectrochemical) densità di corrente. - Calcolare il flusso teorico di azoto. Calcolare l'azoto massimo teoricoflusso (J N, Max, N g / mq / d) per una data applicazione attuale superficie e membrana (Equazione 5) come:
 Equazione 5
Equazione 5 - Calcolare l'efficienza di rimozione dell'azoto (RE,%). Fare riferimento alla percentuale di ammonio che viene rimosso dalla anolita come l'efficienza di rimozione. Calcolare dalla influente anodo e le concentrazioni TAN effluenti (equazione 6).
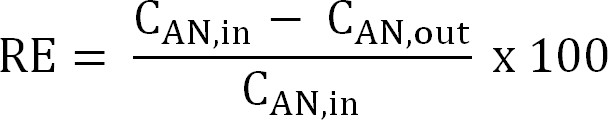 Equazione 6
Equazione 6 - Calcolare la massima efficienza di rimozione dell'azoto teorica (RE max,%) per un dato carico influent TAN e applicata corrente (Equazione 7):
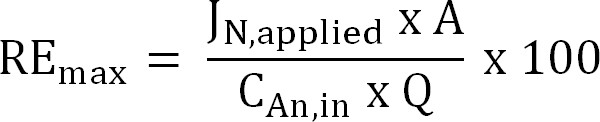 Equazione 7
Equazione 7
dove J N, applicata (g N m -2 d - 1) è la densità di corrente applicata espressa come un flusso di azoto.
- Calcolare il flusso di azoto. Normalizza flusso di azoto (N g / mq / d) alla superficie della membrana poi espressa come densità di corrente (I N). Utilizzare questo valore per calcolare la CE (Equazione 2, 3, e 4):
- Calcola gas / Rapporto liquido (Equazione 8):
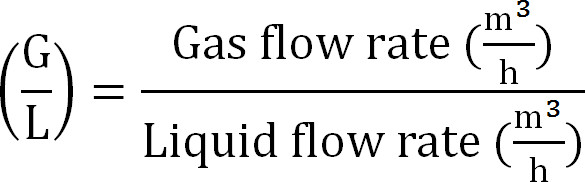 Equazione 8
Equazione 8 - Calcolare la capacità massima della colonna di assorbimento. Calcolare il carico N massima teorica alla colonna di assorbimento dal flusso massimo teorico di azoto J Nmax, la concentrazione TAN nella affluente (mol / L), il tempo di funzionamento t, la superficie della membrana A, e il volume di assorbenti V ( Equazione 9):
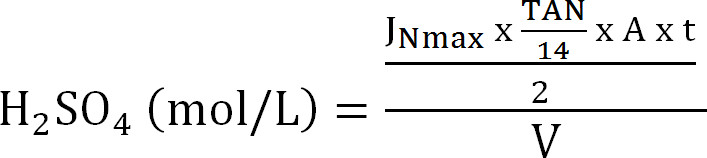 Equazione 9
Equazione 9 - Calcolare l'efficienza strippaggio SE (%) (Equazione 10):
 60; Equazione 10
60; Equazione 10 - Calcolare l'assorbimento di energia per l'estrazione di ammonio attraverso la membrana a scambio cationico (E N, espresso in kWh / kg N) (Equazione 11):
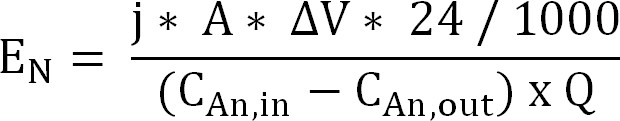 Equazione 11
Equazione 11
Con ΔV la differenza di potenziale misurata tra anodo e catodo. Nel caso del bioreattore, ΔV è stato calcolato come media per il periodo di campionamento, per il reattore elettrochimico della media per l'intera corsa è presa.
Access restricted. Please log in or start a trial to view this content.
Risultati
Cronoamperometria deriva dalla bioreattore
I risultati cronoamperometria, calcolata secondo l'equazione 1, mostrano un grafico tipico per un reattore continuo (figura 4). All'inizio dell'esperimento, l'anodo e il catodo sono gestiti in modalità ricircolo. Questo permette un biofilm di sviluppare e l'inizio della produzione corrente. Dopo 5 giorni di funzionamento, la densità di corrente ha raggiunto un massimo, seguito da una diminuzion...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo manoscritto fornisce gli strumenti necessari per creare una bioelectrochemical e una cella elettrochimica per il recupero di ammonio. I calcoli presentati nella sezione risultati forniscono i parametri per la valutazione delle prestazioni del sistema. I sistemi biologici e elettrochimici sono simili nella configurazione e la funzione. La differenza principale tra i due sistemi è la scelta di una corrente fissa per la cella elettrochimica contro un potenziale anodico fisso per l'installazione bioelectrochemic...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was supported by the BOF grant for SG from Ghent University. AL is supported by the Rutgers University NSF Fuels-IGERT. SA is supported by the European Union Framework Programme 7 project “ProEthanol 2G.” SA and KR are supported by Ghent University Multidisciplinary Research Partnership (MRP)—Biotechnology for a sustainable economy (01 MRA 510W). JD is supported by an IOF Advanced grant (F2012/IOF-Advanced/094). KR is supported by by the ERC Starter Grant “Electrotalk”. The authors thank Tim Lacoere for designing the TOC art figure, Robin Declerck for building the strip and absorption columns and Kun Guo for providing the inoculum source.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Carbon Felt 3.18 mm Thick | Alfa Aesar | ALFA43199 | Used as bioanode, 110 mm x 110 mm |
| Ti electrode coated with Ir MMO | Magneto Special Anodes (The Netherlands) | Used as stable anode for electrochemical tests | |
| Stainless steel mesh | Solana (Belgium) | RVS 554/64: material AISI 316L, mesh width: 564 micron, wire thickness: 140 micron, mesh number: 36,6 | Used as cathode, 110 mm x 110 mm |
| Stainless steel plate | Solana (Belgium) | inox 304 sheet, thickness: 0.5 mm | Used as current collector for the bioanode |
| Ag/AgCl Reference Electrode | Bio-Logic (France) | A-012167 RE-1B | |
| Potentiostat (VSP Multipotentiostat) | Bio-Logic (France) | ||
| EC Lab | Bio-Logic (France) | software for performing electrochemistry measurements | |
| Cation Exchange Membrane | Membranes International (USA) | Ultrex CMI-7000 | Pretreated according to the manufacturers' instructions |
| Turbulence Promotor mesh | ElectroCell Europe A/S (Tarm, Denmark) | EPC20432-PP-2 | spacer material, 110 mm x 110 mm |
| Connectors | Serto | 1,281,161,120 | Other sizes possible, dependant on tubing type and size of holes in frames |
| Strip and absorption column | In house design | ||
| Tubing | Masterflex | HV-06404-16 | |
| Gas bag | Keika Ventures | Kynar gas bag with Roberts valve | |
| Rashig Rings | Glasatelier Saillart (Belgium) | Raschig rings 4 x 4 mm | Put inside the strip and absorption column to improve the air/liquid contact. Available with many suppliers |
| Rubber sheet | Cut to fit on the perspex frames | ||
| Perspex reactor frames | Vlaeminck, Beernem | In-house design, see tab "reactor frames" in this file |
Riferimenti
- Verstraete, W., Van de Caveye, P., Diamantis, V. Maximum use of resources present in domestic "used water". Bioresource Technology. 100 (23), 5537-5545 (2009).
- Lei, X., Sugiura, N., Feng, C., Maekawa, T. Pretreatment of anaerobic digestion effluent with ammonia stripping and biogas purification. Journal of Hazardous Materials. 145 (3), 391-397 (2007).
- Siegrist, H. Nitrogen removal from digester supernatant-comparison of chemical and biological methods. Water Science and Technology. 34 (1), 399-406 (1996).
- Desloover, J., Abate Woldeyohannis, A., Verstraete, W., Boon, N., Rabaey, K. Electrochemical Resource Recovery from Digestate to Prevent Ammonia Toxicity during Anaerobic Digestion. Environmental Science & Technology. 46 (21), 12209-12216 (2012).
- Kim, J. R., Zuo, Y., Regan, J. M., Logan, B. E. Analysis of ammonia loss mechanisms in microbial fuel cells treating animal wastewater. Biotechnology and Bioengineering. 99 (5), 1120-1127 (2008).
- Emerson, K., Russo, R. C., Lund, R. E., Thurston, R. V. Aqueous ammonia equilibrium calculations: effect of pH and temperature. Journal of the Fisheries Board of Canada. 32 (12), 2379-2383 (1975).
- Kuntke, P., Sleutels, T. H. J. A., Saakes, M., Buisman, C. J. N. Hydrogen production and ammonium recovery from urine by a Microbial Electrolysis Cell. International Journal of Hydrogen Energy. 39 (10), 4771-4778 (2014).
- Guo, K., et al. Surfactant treatment of carbon felt enhances anodic microbial electrocatalysis in bioelectrochemical systems. Electrochemistry Communications. 39, 1-4 (2014).
- Guo, K., Chen, X., Freguia, S., Donose, B. C. Spontaneous modification of carbon surface with neutral red from its diazonium salts for bioelectrochemical systems. Biosensors and Bioelectronics. 47, 184-189 (2013).
- Standard Methods For The Examination Of Water And Wastewater. Rice, E. W., Greenberg, A. E., Clesceri, L. S., Eaton, A. D. , American Public Health Association. (1992).
- Andersen, S. J., et al. Electrolytic Membrane Extraction Enables Production of Fine Chemicals from Biorefinery Sidestreams. Environmental Science & Technology. 48 (12), 7135-7142 (2014).
- Harnisch, F., Rabaey, K. The Diversity of Techniques to Study Electrochemically Active Biofilms Highlights the Need for Standardization. Chemsuschem. 5 (6), 1027-1038 (2012).
- Clauwaert, P., et al. Minimizing losses in bio-electrochemical systems: the road to applications. Applied Microbiology and Biotechnology. 79 (6), 901-913 (2008).
- Atkins, P., De Paula, J. Elements of Physical Chemistry. , Oxford University Press. Oxford, UK. (2012).
- Aelterman, P., Freguia, S., Keller, J., Verstraete, W., Rabaey, K. The anode potential regulates bacterial activity in microbial fuel cells. Applied Microbiology and Biotechnology. 78 (3), 409-418 (2008).
- Kuntke, P., et al. Ammonium recovery and energy production from urine by a microbial fuel cell. Water Research. 46 (8), 2627-2636 (2012).
- Liu, H., Cheng, S., Logan, B. E. Power Generation in Fed-Batch Microbial Fuel Cells as a Function of Ionic Strength. Temperature, and Reactor Configuration. Environmental Science & Technology. 39 (14), 5488-5493 (2005).
- Gimkiewicz, C., Harnisch, F. Waste Water Derived Electroactive Microbial Biofilms: Growth, Maintenance, and Basic Characterization. JoVE. (82), e50800(2013).
- Ping, Q., Cohen, B., Dosoretz, C., He, Z. Long-term investigation of fouling of cation and anion exchange membranes in microbial desalination cells. Desalination. 325, 48-55 (2013).
- Guerin, T., Mondido, M., McClenn, B., Peasley, B. Application of resazurin for estimating abundance of contaminant-degrading micro-organisms. Letters in Applied Microbiology. 32 (5), 340-345 (2001).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon