È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Rilevazione di Exosomal Biomarker da campo elettrico indotto rilascio e di misura (Efirm)
In questo articolo
Erratum Notice
Riepilogo
Exosomes are microvesicular structures found within biofluids that potentially carry important disease discriminatory biomarkers. Here, a novel method is used to specifically extract exosomes and rapidly test the exosomal cargo for both RNA/protein targets following the disruption of exosomes using non-uniform electric cyclic square waves.
Abstract
Esosomi sono strutture microvescicolare che svolgono un ruolo di mediazione nella comunicazione intercellulare. È interessante studiare il carico interno di esosomi per determinare se trasportano malattie biomarcatori discriminatori. Per l'esecuzione di analisi exosomal, è necessario sviluppare un metodo per l'estrazione e l'analisi exosomes da biofluidi bersaglio senza danneggiare il contenuto interno.
Rilascio elettrico campo indotto e misura (Efirm) è un metodo per estrarre specificamente esosomi da biofluidi, scaricando il loro carico, e testare il loro contenuto di RNA / proteine interna. L'utilizzo di un CD63 specifici anticorpi microparticelle magnetico anti-umano, esosomi vengono prima precipitati da fluidi biologici. Dopo l'estrazione, a bassa tensione onde elettriche quadre ciclici (CSW) vengono applicati per distruggere la membrana vescicolare e causare carico scarico. Il contenuto del exosome viene ibridato al primer DNA o anticorpi immobilizzati su una superficie dell'elettrodo per quantification contenuto molecolare.
Il metodo Efirm è vantaggioso per l'estrazione di esosomi e scarico merci per analisi senza tampone di lisi. Questo metodo è in grado di eseguire il rilevamento preciso dei due bersagli di RNA e proteine biomarcatori nella exosome. Efirm estrae esosomi specificamente in base alle loro marcatori di superficie al contrario di tecniche basate dimensioni.
La microscopia elettronica a trasmissione (TEM) e test dimostrano la funzionalità del metodo per exosome acquisizione e l'analisi. Il metodo è stato applicato a Efirm exosomal analisi di 9 topi iniettati con le cellule H640 cancro del polmone umano (una linea cellulare trasfettata per esprimere il marcatore exosome umana CD63-GFP), al fine di testare il loro profilo exosome contro 11 topi che ricevono controlli saline. Elevati livelli di biomarkers exosomal (riferimento gene GAPDH e proteine marcatori superficie umana CD63-GFP) sono stati trovati per l'H640 iniettato topi in entrambi i campioni di siero e saliva. Inoltre, saliva e campioni di siero sono stati dimostrato di avere linearità (R = 0,79). Questi risultati sono suggestivi per la vitalità di biomarcatori exosome salivari per la rilevazione di malattie distali.
Introduzione
Ricerca Exosome è un settore emergente della ricerca che esamina microvescicole lipidiche che portano RNA 1, 2 DNA e proteine 3 cargo. Precedenti indagini exosome biologia hanno portato alla identificazione di esosomi in biofluidi come il sangue 4, 5 urine, latte materno 6, e 7 saliva. Studi hanno dimostrato che esosomi giocano un ruolo in diverse vie cellulari, meditazione remoto comunicazione tra diversi sistemi del corpo 8. A causa del ruolo esosomi giocano nella comunicazione intercellulare, si ipotizza che possano pacchetto obiettivi biomolecole (proteine, RNA e DNA) correlati con stati patologici. In vitro 3 e modello animale 9 studi sembrano confermare questa ipotesi. In indagando contenuti exosomal per la scoperta di biomarcatori, è necessario sviluppare una metodologia per l'isolamento selettivo exosome da biofluidi, expulsi indottosu di carico da esosomi, e la quantificazione di biomolecole exosome. Nella misura di questo lavoro, exosomes saranno definite come una struttura avente un diametro di circa 70-100 nm e possedendo superficie marcatore CD63.
I ricercatori in genere prima purificano exosomes di ultracentrifugazione 10 e poi elaborare il contenuto exosomal attraverso l'utilizzo di kit tampone di lisi. L'utilizzo di metodi tampone di lisi richiede tempi di incubazione che vanno da minuti a ore. Questo processo può potenzialmente danneggiare exosome carico e portare a campione degrado. Ad esempio, salivare RNA exosome rilasciato tramite tampone di lisi nell'ambiente extracellulare circostante possiede una emivita di sotto 1 min, rendendo la misurazione di exosomal post-RNA Lysis Buffer un compito particolarmente difficile senza l'aggiunta di reagenti stabilizzazione 11. L'effetto composto di aggiungere vari reagenti per la lisi e la stabilizzazione può introdurre agenti che complicano e interferire con la analysis di contenuti exosomal. Un approccio alternativo può essere utile per lo scarico rapidamente contenuti exosomal e conservare in modo sicuro il carico per la caratterizzazione.
In questo lavoro, si propone l'utilizzo di un campo elettrico non uniforme per il rilascio di contenuti exosomal. Campi elettrici sono stati conosciuti per portare la capacità di polarizzare e disturbare il doppio strato lipidico che forma membrane cellulari. Il nostro lavoro sperimentale esplora l'uso di non-uniforme onde quadre ciclici (CSW) per interrompere la struttura microvesicle di esosomi e rilasciando merci trasportate. Questo metodo utilizza tensioni in diverse centinaia di millivolt gamma, il che significa che la maggior parte delle biomolecole non saranno interrotte. Abbiamo dimostrato che l'utilizzo di un'onda ciclica quadrati è in grado di comandare il rilascio di salivare exosome contenuti mRNA nell'ambiente fluido circostante. Questa versione del contenuto exosomal è perfettamente integrato con un sistema di elettrodi che può essere usato per quantificare i livelli di espressione biomarker 12,13. Questo metodo proposto consente una rapida, sensibile, e tampone di lisi analisi prive di contenuti exosome.

Figura 1. Panoramica Efirm Workflow.. Il metodo Efirm è sostanzialmente divisa in tre principali fasi che sono necessarie per la purificazione e esosomi analisi.
Questo metodo di rilascio e di analisi dei contenuti exosomal basato CSW viene utilizzato in combinazione con microsfere magnetiche specifici CD63 per l'isolamento exosome. Queste perle di CD63-affinità consentono l'isolamento selettivo di esosomi da campioni salivari (e altri fluidi biologici). Dopo l'incubazione e l'estrazione dei esosomi utilizzando le perle magnetizzati, le perle sono migrati al sistema sensore elettrochimico per la CSW basato rilascio contenuto e parte l'analisi dell'esperimento. Figura 1 fornisce una panoramica del lavoroflusso del metodo Efirm.
Protocollo
1. Magnetic Exosome Estrazione basata su Bead
- Pipettare una soluzione ben miscelato di 5 ml di microparticelle magnetiche rivestite di streptavidina in 495 ml di tampone fosfato salino (PBS) in una provetta per risospendere le sfere. Lavare e risospendere le sfere con 500 ml di PBS per tre volte di utilizzare una griglia magnetica. La cremagliera è una matrice di magneti sul lato di un'unità abitativa che può contenere i tubi campione microcentrifuga.
- Per ogni lavaggio, prima lasciate che i tubi si siedono sulla griglia per 1 min, e quindi utilizzare un puntale per rimuovere con attenzione il buffer di surnatante senza disturbare le perline.
- Posizionare le provette su un rack regolare senza magneti a lato. Aggiungere 500 ml di PBS nei tubi, e utilizzare la pipetta per miscelare la soluzione e perline insieme. Poi mettere i tubi di nuovo sul sostegno magnetico per separare nuovamente le perle dalla soluzione.
- Eseguire questa rimozione di tampone via di magnetizzazione e risospensione in PBS untotale di tre volte. Questo esegue un lavaggio iniziale delle particelle magnetiche.
- Risospendere le sfere in 490 ml di tampone PBS, con il tubo posto sulla parte non magnetizzata del rack magnetica. Dispensare 5 ml di anticorpi anti-CD63 umano topo biotinilato a 1,0 mg / ml di brodo di concentrazione nella miscela di perline. Utilizzare la pipetta per mescolare le perline e anticorpi in soluzione.
- Posizionare i tubi microcentrifuga con tallone e miscela di anticorpi biotinilati su un rotatore campione. Impostare i parametri rotatori per il rotatore campione per rotazione reciproca a 90 ° inclinazione per 5 sec e vibrante a 5 ° per 1 sec. Ruotare i tubi miscela campione-bead questi parametri per 30 minuti a RT.
- Rimuovere l'anticorpo non legato dopo coniugazione.
- Dopo 30 min di rotazione a RT, posizionare i tubi nel rack magnetica per 5 min.
- Eseguire tre lavaggi di perline rimuovendo la fase liquida utilizzando una micropipetta e lavare con 500 μ; L di PBS. Dopo il lavaggio triple, risospendere le sfere in 490 ml di caseina-PBS e posto sulla parte non magnetizzata del rack.
- Estrazione Exosome utilizzando perline legate agli anticorpi.
- Etichettare ogni provetta con ID del campione mirato. Pipettare un campione di 10 ml di siero o saliva nella provetta. Usare la pipetta per mescolare il campione e sfere magnetiche pipettando più volte.
- Posizionare i tubi con campioni e anti-umane perline anticorpi CD63 sui rotatori e ruotare per 2 ore a temperatura ambiente. Utilizzare gli stessi parametri dei rotatori come descritto al punto 1.2.
- Dopo 2 ore di campione rotante, eseguire un lavaggio tripla magnetizzando di perline separati dalla soluzione, eliminando fase liquida con micropipetta, e risospensione perline in 500 ml di tampone Tris-HCl. Le perle risultanti sono oggi legati ai exosomes e sono pronti per il rilascio campo elettrico e misurazione.
2. elettrica campo indotto Rilasciato unnd Misura di Exosomal Content
- Iniziale prerivestimento di elettrodi con GADPH Primer
- Applicare una plastica bene ad un matrice di elettrodi per evitare contaminazione incrociata dei singoli elettrodi. Per questo esperimento, utilizzare un array di elettrodi 16-sensore con ciascun elettrodo unità nella matrice costituita da un lavoro, banco, ed elettrodo di riferimento in oro nudo.
- Preparare una miscela scorta di 100 sonde nM DNA, 0.3 M KCl, e pirrolo 10 mM pipettando reagenti azionari in un tubo di acqua ultrapura distillata. Mescolare bene nel vortex.
NOTA: Per questo studio, la sonda di DNA selezionata corrispondente al gene di riferimento GAPDH, che è noto per esistere all'interno esosomi. La sequenza di sonda utilizzata è: 5'-Biotin-AGGTCCACCACTGACACGTTG-3 '. Utilizzare questa miscela su tutti gli elettrodi. - Pipettare 60 ml di miscela monomerica sonda-DNA sulla superficie di ciascun elettrodo d'oro. Esaminate gli elettrodi per garantire che vi sia un'adeguata copertura della lavorazione, counter, e di riferimento elettrodi per la miscela liquida.
- Electropolymerize miscela monomerica sonda per creare uno strato di polimero conduttore sulla superficie dell'elettrodo applicando un'onda quadra (CSW) profilo ciclico campo elettrico alla superficie dell'elettrodo. Questo campo elettrico consiste nell'applicare 350 mV per 9 secondi e subito il passaggio a 950 mV per 1 sec. Applicare questa profilo ciclico onda quadra all'elettrodo per 10 cicli, per un totale di 100 secondi di campo elettrico applicato.
- Risciacquare superficie del sensore 3 volte con acqua distillata e asciugare con azoto gassoso per rimuovere il liquido dalla superficie dell'elettrodo. Assicurarsi che il liquido sia stato completamente rimosso dall'elettrodo.
- Exosome Cargo scarico
- Load 5 ml di 1 micron di una sonda detector in 495 ml di miscela complessa bead-exosome e utilizzare una pipetta per mescolare.
NOTA: La sonda rivelatore è una sequenza di DNA iniettore coniugato ad una molecola fluoresceina all'estremità 3 '. Il prob detectore sequenza utilizzata per questo studio corrisponde al GAPDH mRNA trovato all'interno esosomi. La sequenza della sonda rivelatore coniugato con fluoresceina è: 5'-GCAGTGGGGACACGGAAGGCC-fluoresceina-3 '. - Pipettare 60 ml di sonda e miscela complessa bead-exosome su superficie elettrodo d'oro con un gruppo di magneti sotto. Questo gruppo magnete consiste di sedici 2,54 millimetri di diametro magneti al neodimio allineati per corrispondere agli elettrodi di lavoro del sensore. Figura 2A illustra il posizionamento dei magneti e soluzione bead-exosome.
- Una volta caricato campione sulla superficie dell'elettrodo, applica 20 cicli del campo elettrico CSW con 9 sec a -300 mV e 1 sec a +200 mV (200 sec totale). Il carico exosomal che viene rilasciato si ibridano alle primer sulla superficie dell'elettrodo. Se marcatori superficiali del exosome sono oggetto di indagine, ignorare questa parte dell'esperimento. Figura 2B illustra questo processo.
- Wash-off gli analiti non legato sulla superficie dell'elettrodo di triplo risciacquo la superficie dell'elettrodo con acqua distillata. Essiccare l'elettrodo con gas azoto.
- Load 5 ml di 1 micron di una sonda detector in 495 ml di miscela complessa bead-exosome e utilizzare una pipetta per mescolare.
- Reporter anticorpi e lettura
- Aggiungere 60 ml di 150 unità / ml di anticorpi anti-fluoresceina coniugato con perossidasi di rafano (HRP in 1: 1.000 diluizione) diluito in caseina / PBS.
- Utilizzare un campo elettrico coniugazione spinti a complessi HRP anti-fluoresceina per il panino della sonda. Applicare -200 mV per 1 sec e +500 mV per 1 sec per 5 cicli alla superficie dell'elettrodo. La Figura 2A mostra la cattura e rivelatore complessi sonda sia una proteina e di acido nucleico.
- Triple superficie del sensore di lavaggio con acqua distillata e asciugare con azoto.
- A seguito del dilavamento di anticorpi anti-fluoresceina in eccesso non legato, aggiungere 60 ml di 3,3 ', 5,5'-Tetrametilbenzidina (TMB) substrato. Caricare questo substrato a ogni superficie del sensore con una pipetta multicanale.
- Eseguire lettura amperometrico della corrente misurando la corrente dell'elettrodo a -200 mV per 60 sec utilizzando un potenziostato elettrochimico capace di misurazione simultanea di 16 canali. Figura 2C è un esempio di profilo di corrente durante la lettura.
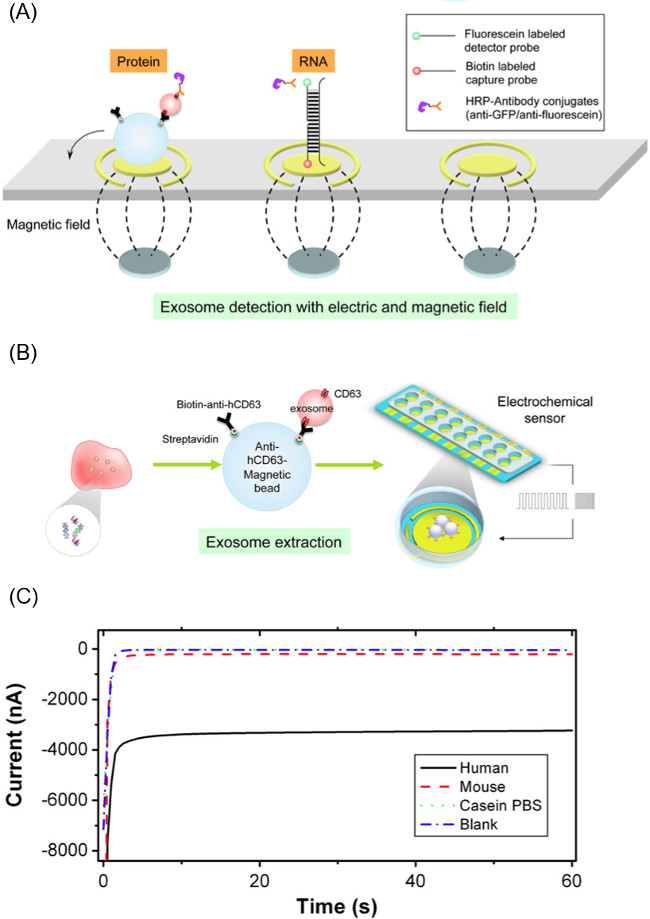
Figura 2. Componenti del Metodo Efirm. (A) Metodo di estrazione esosomi da BIOFLUID con CD63 anti-uomo rivestito microparticelle magnetiche e quindi lo scarico exosome carico con onde quadre ciclici applicate al complesso particelle exosome. (B) Schema di elettrodi biosensore di rilevazione dei bersagli di RNA / DNA / proteine dal exosome rilasciato. (C) Esempio rappresentativo di lettura amperometrica dalla metodologia Efirm, dove più consistente attuale corrisponde to livelli elevati di una biomolecola. Questa cifra è da Wei et al. 14 , cliccate qui per vedere una versione più grande di questa figura.
Risultati
Validazione di Exosome Cattura di Beads Uso TEM
Isolamento di esosomi da saliva utilizzando sfere magnetiche CD63 anti-umani è stato convalidato dopo protocollo di estrazione mediante microscopia elettronica a trasmissione (TEM) immagini. TEM mostra sfere magnetiche con granuli 70-100 nm immediatamente adiacenti (vedi Figura 3A, 3B e), in coerenza con il profilo noto di esosomi. Nessun 70-100 granuli nm sono stati osservati per le sfere magnetiche di saliva...
Discussione
Come i risultati indicano, CD63 anti-umana rivestite nanoparticelle magnetiche sono in grado di catturare specificamente piccole particelle che hanno una dimensione che varia 70-100 nm. Questa particella catturata è coerente con il profilo precedentemente osservata di esosomi. Inoltre, l'utilizzo del CSW bassa tensione in seguito alla cattura delle particelle è indicata per rimuoverli dalla superficie tallone e causare profili degradazione DNA simile a quello di un metodo tradizionale tampone di lisi base per il r...
Divulgazioni
David Wong è co-fondatore di RNAmeTRIX Inc., una società di diagnostica molecolare. PeriRx LLC sublicenza proprietà intellettuali relative alla diagnostica molecolare da RNAmeTRIX. David Wong è un consulente di PeriRx.
Riconoscimenti
Questo lavoro è stato sostenuto dal Centro nazionale per le risorse di ricerca e il Centro Nazionale per l'avanzamento Sciences traslazionale, National Institutes of Health, attraverso di Grant UL1TR000124 (FW); Felix & Mildred Yip Dotata cattedra e la Famiglia Fondo Barnes (a DTWW), il National Institute of Dental Research & craniofacciale dei National Institutes of Health in premio Numero T90DE022734 (MT). Il contenuto è di esclusiva responsabilità degli autori e non rappresentano necessariamente il punto di vista ufficiale del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| Helios 16-Channel Reader System with Chip Interface | Genefluidics, USA | RS-1000-16 | |
| 16x Sensor Chip, Bare Gold, pack of 5 chips | Genefluidics, USA | SC1000-16X-B | |
| Biotinylated anti-human CD63 Antibody | Ancell, USA | 215-030 | |
| Dynabeads MyOne Streptavidin T1 | Invitrogen, USA | 65601 | |
| Neodynium Magnetics (1/10" dia. x 1/32" thick) | K&J Magnetics, USA | DH101 | |
| Ultrapure Distilled Water | Life Technologies, USA | 10977-023 | |
| Mettler Toldeo 3 M KCl Solution | Fisher Scientific, USA | 1911512 | |
| Pyrrole | Sigma-Aldrich, USA | W338605-100g | |
| Anti-Fluorescein-POD, Fab fragments | Roche, Germany | 11426346910 | |
| 3,3′,5,5′-tetramethylbenzidine substrate (TMB/H2O2, low activity) | Neogen, Usa | 330175 | |
| Phosphate Buffered Saline Solution | Life Technologies, USA | 10010023 | |
| Casein/PBS | Fisher Scientific, USA | 37532 |
Riferimenti
- Rabinowits, G., Gerçel-Taylor, C., Day, J. M., Taylor, D. D., Kloecker, G. H. Exosomal MicroRNA: A Diagnostic Marker for Lung Cancer. Clinical Lung Cancer. 10 (1), 42-46 (2009).
- Thakur, B. K., et al. Double-stranded DNA in exosomes: a novel biomarker in cancer detection. Cell Research. 24 (6), 766-769 (2014).
- Lau, C. S., Wong, D. T. W. Breast Cancer Exosome-like Microvesicles and Salivary Gland Cells Interplay Alters Salivary Gland Cell-Derived Exosome-like Microvesicles In. Vitro. PLoS ONE. 7 (3), e33037 (2012).
- Bala, S., et al. Circulating microRNAs in exosomes indicate hepatocyte injury and inflammation in alcoholic, drug-induced, and inflammatory liver diseases. Hepatolog. 56 (5), 1946-1957 (2012).
- Dear, J. W., Street, J. M., Bailey, M. A. Urinary exosomes: A reservoir for biomarker discovery and potential mediators of intrarenal signalling. Proteomics. 13 (10-11), 1572-1580 (2013).
- Lässer, C., et al. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages. Journal of Translational Medicine. 9 (1), 9 (2011).
- Palanisamy, V., et al. Nanostructural and Transcriptomic Analyses of Human Saliva Derived Exosomes. PLoS ONE. 5 (1), e8577 (2010).
- Camussi, G., et al. Exosomes/microvesicles as a mechanism of cell-to-cell communication. Kidney International. 78 (9), 838-848 (2010).
- Lau, C., et al. Role of pancreatic cancer-derived exosomes in salivary biomarker development. The Journal of Biological Chemistry. 288 (37), 26888-26897 (2013).
- Théry, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and Characterization of Exosomes from Cell Culture Supernatants and Biological Fluids. Current Protocols in Cell Biology. 3 (22), (2001).
- Park, N. J., Li, Y., Yu, T., Brinkman, B. M. N., Wong, D. T. Characterization of RNA in Saliva. Clinical Chemistry. 52 (6), 988-994 (2006).
- Wei, F., et al. Bio/Abiotic Interface Constructed from Nanoscale DNA Dendrimer and Conducting Polymer for Ultrasensitive Biomolecular Diagnosis. Small. 5 (15), 1784-1790 (2009).
- Wei, F., et al. Electrochemical Sensor for Multiplex Biomarkers Detection. Clinical Cancer Research. 15 (13), 4446-4452 (2009).
- Wei, F., Yang, J., Wong, D. T. W. Detection of exosomal biomarker by electric field-induced release and measurement (EFIRM). Biosensors and Bioelectronics. 44, 115-121 (2013).
Erratum
Formal Correction: Errata: Detection of Exosomal Biomarker by Electric Field-induced Release and Measurement (EFIRM)
Posted by JoVE Editors on 1/01/1970. Citeable Link.
An erratum was issued for Detection of Exosomal Biomarker by Electric Field-induced Release and Measurement (EFIRM). The disclosures were updated.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon