Method Article
Super-Resolution Imaging di cellule Natural Killer immunologica Sinapsi su un vetro supportato Planar doppio strato lipidico
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
We describe here a combination of the glass-supported lipid bilayer technique of forming immunological synapses with the super-resolution imaging technique of stimulated emission depletion (STED) microscopy. The goal of this protocol is to provide users with the instructions necessary to successfully carry out these two techniques.
Abstract
The glass-supported planar lipid bilayer system has been utilized in a variety of disciplines. One of the most useful applications of this technique has been in the study of immunological synapse formation, due to the ability of the glass-supported planar lipid bilayers to mimic the surface of a target cell while forming a horizontal interface. The recent advances in super-resolution imaging have further allowed scientists to better view the fine details of synapse structure. In this study, one of these advanced techniques, stimulated emission depletion (STED), is utilized to study the structure of natural killer (NK) cell synapses on the supported lipid bilayer. Provided herein is an easy-to-follow protocol detailing: how to prepare raw synthetic phospholipids for use in synthesizing glass-supported bilayers; how to determine how densely protein of a given concentration occupies the bilayer's attachment sites; how to construct a supported lipid bilayer containing antibodies against NK cell activating receptor CD16; and finally, how to image human NK cells on this bilayer using STED super-resolution microscopy, with a focus on distribution of perforin positive lytic granules and filamentous actin at NK synapses. Thus, combining the glass-supported planar lipid bilayer system with STED technique, we demonstrate the feasibility and application of this combined technique, as well as intracellular structures at NK immunological synapse with super-resolution.
Introduzione
La sinapsi immunologica (IS) si trova ad una svolta importante per l'attivazione e la funzione 1 cella. È il mezzo principale con cui presentazione dell'antigene e l'immunità cellulo-mediata vengono effettuate. I primi studi microscopici di formazione di sinapsi utilizzato un sistema coniugato cellula-cellula 2. La limitazione principale con questo approccio è che la maggior parte dei coniugati saranno lette 'profilo', per così dire, limitando così vista dell'osservatore della struttura sinaptica stessa. Nel 1999, il laboratorio di Dustin affrontato questa limitazione utilizzando il vetro supportato doppio strato lipidico (SLB) tecnica 3, che era stato sperimentato in precedenza dal laboratorio 4,5 McConnel. Questo approccio smaltiti cellule presentanti l'antigene (APC), a una superficie planare lipide-oggetti sostenuto, in cui proteine potrebbero essere collegati e si muovono liberamente in due dimensioni. Utilizzando questo metodo, Dustin e colleghi sono stati in grado di scrutare direttamente su in tegli sinapsi utilizzando microscopia a fluorescenza ad alta risoluzione, e per la prima volta ottenere un aspetto "faccia a faccia" alla struttura del IS.
Con l'uso del sistema SLB, dettaglio con cui l'IS può essere visualizzata è limitata solo dalle limitazioni delle tecniche di imaging attuali 6-8. Utilizzando tecniche di illuminazione standard, la risoluzione minima (cioè, la distanza minima tra due oggetti distinti in cui possono essere distinti) è stata <200 nm sulla base del criterio di Rayleigh 9. Questo limite ostacola l'imaging molto fini, strutture di scala molecolare che compongono la sinapsi, e fino allo sviluppo di tecniche di imaging super-risoluzione 10-12, visualizzazione di queste strutture è stato limitato a immagini di cellule fissate mediante microscopia elettronica.
Con il recente avvento di una varietà di tecniche di super-risoluzione, come SIM (microscopia illuminazione strutturata), PALM (microscopia localizzazione fotoattivato), STORM (stocastica microscopia ottica ricostruzione), e STED 10-12, gli investigatori sono ora in grado di studiare queste strutture sinaptiche in dettaglio senza precedenti, che a sua volta ha fornito una comprensione sempre chiarito la IS. I vantaggi della microscopia STED sono stati descritti prima 13. Qui si descrive super-risoluzione di imaging con microscopia STED equipaggiato con la nuova concezione laser esaurimento 660 nm. Rispetto al tradizionale 592 nm laser esaurimento, il laser 660 nm consente una selezione più ampia di coloranti fluorescenti (vedi http://nanobiophotonics.mpibpc.mpg.de/old/dyes/), specialmente in questi fluorofori rosse.
Altre pubblicazioni hanno descritto imaging STED delle sinapsi delle cellule NK on legate agli anticorpi vetrini 13,14. Qui, il sistema di SLB è combinato con super-risoluzione STED microscopio per studiare la sinapsi delle cellule NK. Questa tecnica ha il vantaggio rispetto anticorpivetrini rivestiti di essere un mosaico di fluido, in cui le proteine di superficie incorporati possono muoversi liberamente in una superficie bidimensionale piatto (piano xy). Questo imita più fedelmente la superficie organica e mobile di una cellula bersaglio, e di conseguenza una migliore ricapitola la formazione di una sinapsi immunitario fisiologicamente rilevanti.
L'obiettivo di questo protocollo è quello di fornire all'utente finale con una descrizione dettagliata di come rappresentare il sinapsi immunologica delle cellule NK, combinando il sistema SLB e super-risoluzione STED microscopio. Essa fornirà all'utente finale con i provvedimenti necessari per: preparazione dei liposomi, costruire bistrati proteina-embedded, determinare la densità di proteine sui doppi strati lipidici, e acquisire immagini super-risoluzione usando la microscopia STED. Queste tecniche non sono limitati al campo della immunologia, e possono essere ampiamente utilizzati in una varietà di discipline.
Protocollo
1. Preparazione di liposomi
- Calcolare la quantità di soluzioni madre cloroformio-sospeso di 1,2-dioleoyl-sn-glycero-3-fosfocolina (DOPC) e 1,2-dioleoyl-sn-glycero-3-fosfoetanolamina-N-cap Biotinyl (biotina-PE) fare scorte diluiti alla concentrazione finale desiderata. Per concentrazioni finali di 400 mM e 80 mM DOPC fosfolipidi biotina-PE a 10 ml ciascuno, inizia ponendo 629 ml di 10 mg / ml e 88 ml DOPC 10 mg / ml biotina-PE in provette di vetro cromatografia separati.
NOTA: è importante pulire vetro Hamilton siringhe e provette per cromatografia in vetro con una soluzione (1 L 95% di etanolo di idrossido di 120 ml di acqua contenente 60 g di potassio, KOH) la pulizia, durante il trasferimento di soluzione madre di cloroformio-sospensione di DOPC e biotina-PE. - Essiccare il cloroformio con un flusso di argon nella cappa chimica. Sigillare il tubo cromatografia per parafilm.
- Sottoporre liposomi appena essiccato a vuoto spinto in un lyophilizer O / N per rimuovere qualsiasi residuo di cloroformio. Per il completamento dello stesso giorno, a secco per 60-90 min.
- Mentre le piste liofilizzatore, preparare qualche tampone di diluizione. Per questo protocollo, preparare 25 ml costituiti Tris 25 mM, pH 8,0; 150 mM NaCl; e 2% (in peso) n-ottil-β-D-glucopiranoside (OG) detergente. Mescolare i primi due ingredienti insieme, quindi spostare l'ossigeno con argon prima di aggiungere la polvere secca OG. Dopo la preparazione, filtrare la soluzione OG con membrana in acetato di cellulosa 0,2 micron, e conservare a 4 ° C.
- Inoltre, preparare due bottiglie tappo a vite di 1 L di tampone Tris-salino alle stesse concentrazioni, ma senza OG. Posizionare un ancoretta magnetica puliti acqua distillata in fondo di ogni. Preparare 6 litri supplementari del tampone Tris-salino. Rimuovere ossigeno da tutte le bottiglie con argon e metterli a 4 ° C e.
- Dopo liofilizzazione, sciogliere i lipidi essiccati nel buffer Tris-OG salina per ottenere una soluzione 4 mM di ciascuno. Seguendo l'esempiovolumi, aggiungere 2 ml al tubo DOPC, e 0,2 ml al tubo biotina-PE.
- Mescolare i lipidi biotina-PE con i lipidi DOPC. Questo migliora la mobilità della SLB, come la biotina accoppiato può compromettere la fluidità dei gruppi di testa fosfato. Per effettuare una concentrazione finale di 80 mM biotina-PE, miscela 0,2 ml di 4 mM biotina-PE e 1 ml di DOPC 4 mM. Quindi aggiungere 8,8 ml di tampone Tris-OG salina.
- Per una concentrazione finale di 400 micron DOPC, semplicemente mescolare 1 ml di DOPC 4 mm con 9 ml di OG Tris-salino.
- Riempire il sonicatore con acqua ghiacciata. Inserire il tubo di vetro contenente il fosfolipide diluito nel centro del sonicatore utilizzando un morsetto di utilità. Sonicare fosfolipide diluito per 10 minuti fino a quando la soluzione diventa chiara.
NOTA: Aggiungere il ghiaccio in bagno d'acqua sonicatore per mantenere bassa la temperatura dal ultrasuoni genera calore. - Riempire i tubi con argon per spostare l'ossigeno nell'aria sopra il liquido, e sigillare con parafilm.
2. Dialisi di liposomi
- Tagliare due tratti di tubo di dialisi secco (Peso molecolare cut-off: 12-14,000, diametro: 6,4 mm) di lunghezza appropriata (in questo esempio, 40 cm), uno per ogni diluizione fosfolipide, dal rotolo.
- Reidratare sezioni dei tubi, consentendo loro di ammollo in 200 ml di acqua distillata in un bicchiere di vetro per 2 min.
- Microonde questo per 5 min a un valore elevato, o almeno fino a quando l'acqua arriva ad ebollizione.
- Fare un nodo ad una estremità di ciascun tubo e risciacquare l'interno con pochi millilitri di tampone Tris-salino-OG. Successivamente, meticolosamente spremere tanto di questo tampone di lavaggio possibile per minimizzare la quantità di buffer residuo all'interno.
- In una cappa a flusso laminare, aggiungere i fosfolipidi diluiti in ciascuna provetta e serrare le estremità aperte con una piccola chiusura del tubo di dialisi in modo da escludere l'aria. Completa esclusione dell'aria richiederà il sacrificio di un piccolo volume di campione serraggio sotto l'&# 8220; linea di galleggiamento ".
- Immergere i campioni in bottiglie preparate in precedenza di tampone Tris-salino, senza OG. Spostare l'ossigeno in bottiglia con argon prima di ri-sigillatura e posto a mescolare O / N a 4 °.
- Trasferire il tubo in un nuovo flacone di tampone Tris-salino senza OG ogni 12 ore per almeno 3 volte.
- Poco prima della rimozione dei lipidi dializzati, preparare una serie di tubicini in cui aliquota lipidi riempiendo ciascuna con argon per spostare l'ossigeno.
- Dopo 36 h, prendere le bottiglie dialisi nella cappa a flusso laminare e rimuovere i tubi di dialisi dalle bottiglie. Avere un pannolino panchina o bicchiere a portata di mano per raccogliere il deflusso bagnato.
- Tagliare il tubo di dialisi sopra la clip, quindi rimuovere la clip e trasferire con cura la soluzione lipidica dializzata via pipetta in 1 ml aliquote in tubi pre-preparati riempite con gas argon sul ghiaccio.
- Aliquota della soluzione acquosa liposomi, utilizzare il flusso di argon per spostare l'ossigeno di nuovo in ogni tubo.
- Conservare i liposomi a 4 °. Non congelare.
3. Determinazione di anticorpi Densità sul doppio strato lipidico
- Preparare una serie di diluizioni di biotinilato, anticorpo fluorescenza marcata, 50 ml di volume per ogni diluizione, alle seguenti concentrazioni: 0 nM (vuoto), a 10 nm, 50 nm, 100 nm e 500 nm. (Di seguito indicato come "serie di campioni").
- Aggiungere 1 ml di perline di silice in 6 pozzetti di una piastra a 96 pozzetti v-bottom. Assicurarsi di scuotere le perle ben prima pipettare, in quanto tendono a stabilirsi.
NOTA: Se aver ordinato perline secco piuttosto che sospeso, seguire le istruzioni del produttore per diluire. - Per queste perle, aggiungere 2 ml di DOPC misto: fosfolipidi Biotinyl in un rapporto 1: 1. Fate questo per ogni bene.
- Pulse la piastra su un vortex a forza media 3 volte per 10 secondi ciascuna per favorire l'interazione con le perline e fosfolipidi.
- Aggiungere 150 ml di 5% casein ciascun pozzetto. Mescolare bene pipettando su e giù tre volte.
- Sia la piastra incubare nella soluzione di caseina per 10 minuti, poi lavare fuori. Per lavare, riempire ogni bene per un volume totale di 250 microlitri con HEPES Buffered Saline (HBS) con albumina sierica umana 1% (HSA). Centrifugare a 1000 xg per 2 min. Pipetta fuori e scartare i primi 200 ml di surnatante, e ripetere due volte per un totale di tre cicli di lavaggio.
- Aggiungere 50 ml di streptavidina a 333 ng / ml concentrazione. Pulse la piastra di nuovo 3x 10 sec, e lasciate riposare su un agitatore per 15 minuti. Lavare 3x come nel passaggio 6 per rimuovere streptavidina non legato.
- Aggiungere 50 ml di anticorpo biotinilato fluorescente dalla serie di diluizioni precedentemente preparato (vedi punto 3.1) per ciascun bene, e sostituire la piastra sul shaker per 20-30 min. Lavare 3x come nel passaggio 6 per rimuovere l'anticorpo non legato.
- Dopo l'ultimo lavaggio, risospendere le sfere in 100 ml di HBS / 1% HSA, poi il trasferimento ad un tubo FACS. Ripetere questa due volte perassicurare la rimozione efficiente di tutti perline dal pozzo, per un totale di 300 microlitri, e farlo per ogni pozzetto.
- Portare i tubi risultanti al citometro di flusso. E 'tempo di leggerli.
- Aggiungere 1 goccia dalla bottiglia "B" dal kit tallone calibrazione dell'intensità della fluorescenza (FIC) (di seguito denominato "serie standard") ad un tubo FACS, e diluire con 300 ml di HBS / 1% HSA.
- Leggere questo tubo, ma non registrare i dati appena ancora. Per ora, è sufficiente assicurarsi che le perle bianche siano azzerati. Effettuare un istogramma che mostra la fluorescenza delle perline misurati nel canale appropriato, quindi spostare la tensione del laser di eccitazione finché il picco è sul lato più a sinistra dell'istogramma.
- Rimuovere il tubo e aggiungere 1 goccia di ciascuno degli altri 4 tubi della serie (contrassegnata con 1 a 4) alla stessa provetta. Ora, mettere il tubo nella macchina di nuovo, e registrare i dati risultanti, che dovrebbe apparire come 5 cime distinte.
- Leggi ogni singolo tubo della serie di campioni.
- Utilizzando il software di analisi FACS, elaborare un cancello che copre l'intera larghezza di ogni picco nella serie istogramma standard al punto a metà-massimale. Questa è una porta per ogni picco. Fare lo stesso per ogni campione. Si noti la MFI (media di fluorescenza intensità) per ogni porta.
- Utilizzando un programma di foglio di ingresso i valori MFI misurati nel posto appropriato. Anche l'ingresso MESF (molecole di equivalenti Solubile Fluorocromo) Valori (numero medio di molecole fluorescenti rivestimento ciascuna sfera) per ogni bottiglia della serie standard. Queste informazioni possono essere trovate seguendo le indicazioni sulla plastica scuotono i tubi sono venuti in.
- Utilizzare il foglio sarà tracciare la MFI contro i valori Mesf, creando una correlazione lineare tra il numero di fluorofori e l'intensità misurata.
- Utilizzare il modulo di "proteine e le etichette 'nello spettrofotometro micro-volume per determinare il rapporto di colorante proproteina nella anticorpo marcato.
- Input dell'efficienza etichettatura della proteina di esempio, il diametro medio delle perline rivestite con lipidi, e il valore MFI per ogni voce. Il foglio utilizzerà automaticamente la formula dal grafico linea generata nel passaggio 3.16 per calcolare i valori Mesf per ogni diluizione di proteine e la densità di semina della proteina campione per ogni concentrazione.
4. isolando e coltivando NK cellule umane
- Aliquota 15 ml di sangue periferico o cappotto buffy in una provetta da 50 ml. Diluire questo sangue con PBS contenente 1% FBS nel rapporto di 1: 1.
- Aggiungere 13 ml di Ficoll delicatamente sul fondo del tubo con una pipetta 10 ml sierologica.
- Centrifugare questo tubo per 20 minuti a 1200 xg con l'acceleratore e la rottura off o le impostazioni più basse.
- Dopo centrifugazione, utilizzare una pipetta sierologica per raccogliere nuvoloso strato intermedio bianco fluttuante delle cellule mononucleate del sangue periferico (PBMC), which dovrebbe sedersi e l'intersezione tra una chiara strato superiore giallo e uno strato più torbida pallido color inferiore, entrambi i quali siedono sopra strato inferiore di globuli rossi (RBC). NOTA Non raccogliere eventuali globuli rossi nel raccogliere il PBMC.
- Posizionare le PBMC raccolti in un nuovo tubo conico da 50 ml, e portare a capienza con PBS contenente 1% FBS. Centrifugare nuovamente, questa volta con il freno e dell'acceleratore al massimo, per 5 minuti a 300 x g.
- Eliminare il surnatante e risospendere le cellule in 10 ml di PBS contenente 1% FBS.
- Contare le cellule, mentre centrifugazione ancora una volta con le stesse impostazioni come al punto 4.6.
- Eliminare il supernatante ancora una volta, e risospendere le cellule in R10 mezzo ad una densità di 10 milioni di cellule / ml.
- Prendere 30 milioni di cellule in una provetta di polistirene da 5 ml e isolare le cellule NK utilizzando un kit di separazione magnetica, seguendo le istruzioni del produttore. Dopo aver isolato, contare le cellule una più e risospendere ad una densità di 500,000 cellule / ml in terreno completo R10 (88%; RPMI 10% FBS, 1% HEPES; 1% di sodio piruvato) supplementato con IL-2 (100 U / ml). Cultura a 37 ° in un incubatore CO 2, e sostituisce media 2-3 volte a settimana.
5. Montaggio del Glass-supportata Planar doppio strato lipidico
- Preparare la soluzione Piranha 100 ml miscelando 30% di perossido di idrogeno con acido solforico a un rapporto di 1: 3 in un becher.
NOTA: Eseguire sempre il lavoro con agenti nocivi come l'acido solforico in una cappa correttamente designato. - In questa soluzione, immergere 2 rettangolari # 1.5 vetrini in soluzione piranha per 20-30 min.
NOTA: E 'indispensabile pulire i coprioggetti dai soluzione piranha. - Mentre i coprioggetti vengono puliti, prendere 1 tubetto di precedentemente preparato 400 mM lipidi DOPC e 1 tubetto di precedentemente preparato 80 micron lipidi biotina-PE. Trasportarli sul ghiaccio al serbatoio argon.
- Spostare l'ossigeno in una nuova provetta con argon,quindi aggiungere insieme la DOPC e biotina-PE in un rapporto 1: 1. Il volume specifico varierà in base alle esigenze sperimentali, ma deve essere di minimo 2 ml ciascuno. Spostare l'ossigeno nel tubo miscela ancora una volta con il gas argon, e singoli tubi reagenti e, prima di tornare a quest'ultimo di frigorifero.
- Dopo che sono finiti pulire, lavare accuratamente i coprioggetti con acqua distillata. Impostare i coprioggetti fuori ad asciugare per qualche minuto.
- Prelevare 1,5 ml di miscela liposomi preparato al punto 5.4 e Aliquotare in una singola goccia in una delle camere di corsia della camera di diapositiva. L'uso di 2 gocce per corsia è tipico, ma non necessario.
- Introdurre rapidamente e in modo efficiente il vetrino secca sopra le goccioline. Assicurarsi che le gocce sono sufficientemente distanziati in modo che non si fondono volta il vetrino è collocato. Inoltre, assicurarsi che le gocce rimangono circolare e ben definita, senza toccare i bordi delle pareti della camera. Premere con decisionein e attorno a ogni corsia per assicurare la tenuta stagna tra il vetrino e scivolo.
- Segnare le posizioni delle gocce con un pennarello
- Passare 100 ml di soluzione acquosa di caseina 5% attraverso la camera di bloccare il doppio strato. Cercate di fare in modo che non vi siano bolle nella camera di flusso.
- Iniettare 100 ul di streptavidina ad una concentrazione di 333 ng / ml in ogni corsia. Incubare per 10-15 minuti a temperatura ambiente. Successivamente, lavare eseguendo 3 ml di HBS / 1% HSA attraverso ogni corsia per rimuovere l'eccesso streptavidina.
- Aggiungere 100 ml di biotinilato fluorescente anti-CD16, come Alexa Fluor 568 alla concentrazione di proteine precedentemente determinato per essere più efficaci nel capitolo 3. Incubare al buio per 20-30 min. Lavare nuovamente eseguendo 3 ml di HBS / 1% HSA attraverso ogni corsia.
- Flusso 100 ml di D-biotina ad una concentrazione di 25 nM attraverso la camera allo scopo di impegnare qualsiasi streptavidina eccesso e quindi eliminare la possibilità di legame non specifico di streptavidin alle cellule.
- Contare le cellule NK e risospendere alla concentrazione di 500.000 / ml in HBS / 1% HSA.
- Mentre filatura le cellule, lavare la D-biotina dalla camera con un altro 3 ml di HBS / 1% HSA per corsia.
- Controllare la mobilità di ligandi sulla SLB di FRAP (FRAP) su una fluorescenza totale interna riflessione (TIRF) o la microscopia confocale prima di aggiungere le cellule NK.
- Una volta che le cellule hanno finito di filatura e sono state risospese alla concentrazione desiderata, aggiungere 100 microlitri per ogni corsia.
- Posizionare la camera in un incubatore CO 2 37 ° 5% per 30-60 min.
- Dopo questo periodo di incubazione, fissare le cellule con 4% paraformaldeide a temperatura ambiente per 10-20 min. Lavare eseguendo 3 ml di PBS attraverso ogni corsia per rimuovere la paraformaldeide.
- Aggiungere 400 microlitri tampone di bloccaggio (siero asino normale 5% e il 0,2% Tritron X-100 in PBS). Incubare a temperatura ambiente per 30 min.
- Stain F-actina e perforina dall'inserzionistading 200 ml di diluito falloidina fluorescenza marcata (1 unità / ml falloidina etichettato) e fluorescenza marcata anti-perforina monoclonale (500 ng / ml mAb anti-perforina). Incubare a temperatura ambiente per 1 ora.
- Lavare eseguendo 3 ml di PBS. La camera è pronta per l'imaging.
6. Imaging del NK Synapse su doppio strato lipidico con STED
- Attivare tutti i moduli hardware necessari.
- Avviare il software di analisi delle immagini. Attiva sia la scansione di risonanza e moduli STED. Dopo aver fatto queste selezioni, attendere circa 3-5 minuti per il software per iniziare.
- Fare clic sulla scheda "Configurazione" nella parte superiore dello schermo.
- Selezionare "Config Laser", quindi accendere la luce bianca e STED 592 nm laser.
- Scegliere l'obiettivo 100X, e allineare il raggio laser di eccitazione con il laser esaurimento 592 nm.
- Selezionare il modulo "Laser Config", spegnere il 592 esaurimentolaser, e accendere il laser esaurimento 660 nm.
- Posizionare il vetrino sul palcoscenico, sopra l'obiettivo. Portare le cellule legate alla regione delimitata doppio strato a fuoco utilizzando la lampada a luce bianca e gli oculari.
- Ritorna alla scheda "Acquisizione", direttamente a destra della scheda "Configurazione".
- Fare clic sulla scheda "Passa a Whitelight", quindi accendere quel modulo sulla e trascinare la linea laser di eccitazione per la lunghezza d'onda appropriata.
- Selezionare il rivelatore desiderato dalla lista di quelli disponibili, quindi impostare l'intervallo di rilevamento per comprendere la gamma appropriata di lunghezze d'onda.
NOTA: Non mettere mai il campo di rilevamento direttamente sotto il fascio di eccitazione. - Fare clic sul pulsante "Seqential" in-sinistra "Acquisisci" barra degli strumenti per aprire il dialogo di scansione sequenziale in fondo alla barra degli strumenti di sinistra. Questo consente all'utente di aggiungere più sequenze, ciascunacon un diverso fascio di eccitazione per un altro colore. Fare clic su "Tra Frames", e quindi impostare la frequenza di eccitazione, detector, e campo di rilevamento per ogni colore supplementare come nei passi 6.9 e 6.10.
- Una volta che tutte le impostazioni sono ottimizzate, premere "Start" per iniziare il processo di acquisizione.
- Applicare il software deconvoluzione gratuito (Huygens) con un ambiente progettato per STED deconvoluzione, come descritto in precedenza 13.
Risultati
La Figura 1 mostra il risultato della densità anticorpi sul doppio strato lipidico. Il principio è quello di utilizzare perline standard per rendere la curva standard di MESF contro IFM tramite citometria a flusso (A). Il MFI della serie di campioni è stato convertito in MESF utilizzando la curva standard. La densità anticorpi sul doppio strato lipidico è linearmente correlata con la concentrazione di anticorpo (B). Figura 2 mostra l'tripla colori STED immagine di NK sinapsi su vetro-supporto planare doppio strato lipidico. Anti-CD16 anticorpo sul doppio strato lipidico si accumula, innescando la formazione F-actina e la polarizzazione e la penetrazione della perforina attraverso la maglia F-actina sul pannello focale di sinapsi immunologica in cellule NK. Usando questo approccio combinato, si possono osservare le pulito microclusters di fluorescente anti-CD16 nel SLB, che rispecchia direttamente il raggruppamento di CD16 sulla cellula NK. Rispetto alla tradizionale immagine confocale, la struttura di CD16 central gruppo è più facilmente individuabile nell'immagine STED causa la fluorescenza ambiente impoverito. Inoltre, l'ultrastruttura del citoscheletro è visto con notevolmente migliorata risoluzione. In linea con precedenti osservazioni 16,17, i granuli litici perforina-positivi sono visti posizionati sopra le regioni a bassa densità di F-actina nell'immagine STED, un dettaglio fondamentale che è principalmente perde nell'immagine confocale.
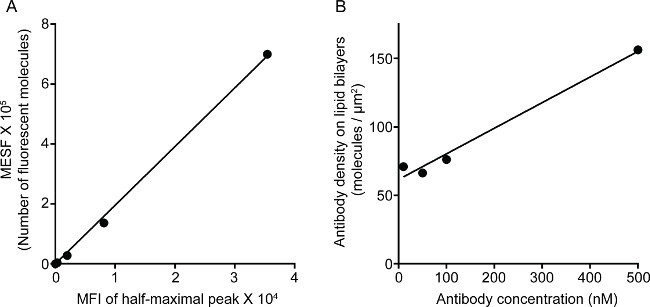
Figura 1. Densità di 3G8 anticorpi a doppio strato lipidico. (A) la correlazione lineare tra MESF e MFI per la serie standard. (B) la correlazione lineare tra la densità di proteine e la concentrazione per una serie di diluizioni del campione di proteine, che mostra il numero di fluorescenza marcata proteine monomeri per area unitaria in funzione della concentrazione crescente sul si lipidi rivestiteperline Lica.
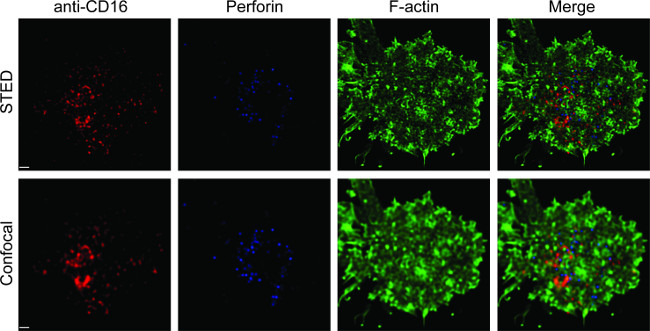
Figura 2. STED imaging NK sinapsi su planare doppio strato lipidico. Pile NK sono stati stimolati in SLB contenente biotinilato fluorescente anti-CD16 (rosso), fissi, permeabilizzate, e poi colorate con falloidina (blu) e anti-F-actina (verde). Una singola cellula è stato ripreso sotto la normale impostazione confocale, e quindi l'impostazione STED. Immagini confocale e STED stati deconvoluto utilizzando il software Huygens. Bar, 1 micron scala. Fai clic qui per una versione più grande di questa figura.
Discussione
La novità di questo studio è che combina la tecnica SLB con STED di studiare le sinapsi delle cellule NK. Precedenti studi hanno ripreso il doppio strato lipidico con TIRF di studiare cellule T sinapsi formazione 8 e segnalazione traffico molecola sulla membrana plasmatica 6. Altri hanno descritto STED imaging sinapsi delle cellule NK con anticorpi rivestita vetrini 13,14. Il metodo ibrido descritto qui ulteriormente basa su questi sforzi di imaging sinapsi delle cellule NK con la chiarezza migliorata offerta da super-Resolution Imaging sulla superficie doppio strato lipidico, che modelli migliori la superficie dinamica di APC.
Anche se SLB sono membrane artificiali prive di citoscheletro, zattere lipidiche, e altri leganti che le cellule bersaglio reali o APC possesso, questa tecnica può ricapitolare caratteristiche importanti come la mobilità e l'orientamento dei ligandi. Questo permette al sistema SLB per servire come un approccio riduzionista in dissezione tegli contributo dei singoli recettori e ligandi per formazione della IS e la dinamica di IS. La caratteristica più importante di SLB è che i ricercatori possono combinare questa tecnica con approcci di imaging ad alta risoluzione, come la microscopia confocale e TIRF. L'introduzione della microscopia STED aumenta ulteriormente questo vantaggio, fornendo approfondimenti senza precedenti in è la ricerca e le sue applicazioni cliniche.
Un potenziale critica di questo sistema è che la SLB non adeguato imitare il complesso superficie di un APC, dando così origine a caratteristiche anatomiche potenzialmente non fisiologiche nelle sinapsi risultanti. Se è vero che il repertorio limitato di molecole di superficie sul SLB non ricapitolare completamente la superficie eterogeneo popolato di APC, questo limite può anche essere vantaggioso in quanto permette investigatori per determinare l'influenza di recettore e ligando singoli sulla formazione sinapsi .
Tqui ci sono diversi passi decisivi nel processo. Tra i più critico è che l'ossidazione dei liposomi essere evitato con costante di argon per spostare l'ossigeno nel tubo e la soluzione, ad esempio nelle fasi 1.10, 2.6 e 2.11. L'ossidazione dei lipidi comporterà mobilità lipidi diminuito, impedendo così la capacità delle proteine di superficie di muoversi liberamente e partecipare strutturazione sinaptica. Allo stesso modo, è anche fondamentale per rimuovere tutto il cloroformio nel liposoma mediante liofilizzazione (passo 1.2). Nella determinazione della densità proteine nel doppio strato lipidico, è di importanza per disperdere dapprima le perline di silicio in una sospensione omogenea privo di cluster. Se necessario, sonicazione di perline può essere applicata. Nel montaggio della SLB, i primi passi (5,1-5,8) in cui i coprioggetti sono puliti, le gocce sono posti, e coprioggetto è apposto sono vitali. Un errore in qualsiasi di questi può necessitare di iniziare l'esperimento sopra (dall'inizio della sezione 5). Per questo motivo, èbuona norma pulire più vetrini che saranno necessari per risparmiare tempo in caso di un incidente.
Non-cluster è il problema più frequente quando si lavora con questo sistema. Se, quando la visualizzazione delle cellule nella fase finale, non si riesce a trovare nessuna sinapsi fluorescenti, ci sono alcuni passaggi che possono essere adottate. Un'altra macchia per il recettore della superficie cellulare affine può essere aggiunto alla camera per verificare che la cella non ha formato una sinapsi con il doppio strato, mentre le cellule possono aderire non specifico alla superficie coprioggetto vetro o doppio strato, proteine di superficie sinapticamente-coinvolti voglia apparire cluster distinte sul piano dell'interfaccia cellule doppio strato, mentre le proteine di superficie unengaged dovrebbero apparire come colorazione diffusa intorno al perimetro della cella. Qualora questo metodo fallire, si dovrebbe verificare le loro cellule tramite citometria a flusso per garantire che il particolare marcatore Lui spera di studiare è espresso in adeguata abbondanza sulla superficie cellulare. Alcuni prote superficieins sono noti per essere down-regolato su lungo termine nella cultura vivo.
Mentre questo protocollo dettagli specificamente come visualizzare NK formazione di sinapsi cellule, il sistema SLB può essere usato per studiare la formazione di sinapsi in qualsiasi immunocyte immaginabile semplicemente la sostituzione del legante primaria nel passaggio 5.11. Più ligandi possono anche essere aggiunti simultaneamente. Uno inoltre non è necessario utilizzare un sistema streptavidina-biotina per aderire le proteine di superficie all'interno del doppio strato. Nickel-NTA: interazioni istidina sono anche vitali. Tuttavia, a causa della elevata resistenza e la specificità della streptavidina: interazione biotina, nostro laboratorio preferisce questo sistema. Si può anche variare la concentrazione di cellule aggiunti sul doppio strato dalla densità prescritta al punto 5.13, nonché la durata del successivo periodo di incubazione per osservare sinapsi a diversi stadi di maturazione. Questo può anche essere fatto vivo, anche se questo ovviamente esclude la possibilità di visualizzare str intracellulareuctures (a meno che non siano già etichettati con tag fluorescenti fuso; il nostro laboratorio utilizza alcune di queste linee cellulari alterati). A causa dell'alto grado di personalizzazione possibile in questo protocollo, si può usare la tecnica di base SLB, insieme a immagini STED, per affrontare una gamma incredibilmente varia di domande in immunologia, biologia cellulare, biochimica, tra cui la dinamica dei lipidi di base 15, la formazione di sinapsi 16, intracellulare di segnalazione 17, e delle cellule metastasi tumorali 18.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
We thank Emily Mace and Malini Mukherjee for imaging and deconvolution analysis. Work in the Liu laboratory was supported in part by the Baylor-UTHouston Center for AIDS Research Core Support Grant number AI36211 from the National Institute of Allergy and Infectious Diseases, the Caroline Wiess Law Fund for Research in Molecular Medicine, Texas Children’s Hospital Pediatric Pilot Research Fund, and the Lymphoma SPORE Developmental Research Program from Baylor College of Medicine and the Methodist Research Institute.
Materiali
| Name | Company | Catalog Number | Comments |
| 18:1 (Δ9-Cis) PC (DOPC) 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti | 850375C | Liposome preparation |
| 18:1 Biotinyl Cap PE 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt) | Avanti | 870273C | Liposome preparation |
| Argon gas, compressed | Airgas | UN1006 | Liposome preparation |
| A lyophilizer | Labconco | Freezone 7740020 | Liposome preparation |
| Lyophilizer tubes | Labconco | 7540200 | Liposome preparation |
| Chromatography Columns | Santa Cruz | sc-205558 | Liposome preparation |
| 1 M Tris pH 8.0 | Ambion | AM9856 | Liposome preparation |
| 5 M NaCl | Ambion | AM9759 | Liposome preparation |
| Octyl-β-D-glucopyranoside | Sigma-Aldrich | O1008 | Liposome preparation |
| Dialysis tubing | Spectrum Labs | 132676 | Liposome preparation |
| 96-well V-bottom polystyrene plate (untreated) | Corning | 3896 | antibody density determination |
| Non-functionalized silica beads | Bangs Laboratories | SS06N | antibody density determination |
| FACS tubes | Fisher Scientific | 14-959-2A | antibody density determination |
| QuantumTM MESF beads | Bangs Laboratories | Variable | antibody density determination |
| Casein | Sigma-Aldrich | C0875 | Lipid bilayer preparation |
| HEPES buffered saline + 1% HSA | Homemade | Lipid bilayer preparation | |
| Streptavidin | Life technologies | 434301 | Lipid bilayer preparation |
| Fluorescently-labeled biotinylated protein | Homemade | Lipid bilayer preparation | |
| ibidi Sticky-Slide VI 0.4 | ibidi | 80608 | Lipid bilayer preparation |
| 25x75 mm glass coverslip | ibidi | 10812 | Lipid bilayer preparation |
| Hydrogen peroxide (30%) | Fisher Scientic | BP2633 | Lipid bilayer preparation |
| Sulfuric acid | Sigma-Aldrich | 258105 | Lipid bilayer preparation |
| D-Biotin | Invitrogen | B20656 | Lipid bilayer preparation |
| Lens paper | VWR | 54826-001 | For imaging |
| Type F Immersion Oil | Leica | 11 513 859 | For imaging |
| A Leica TCS STED microscope | Leica | For imaging |
Riferimenti
- Dustin, M. L., Long, E. O. Cytotoxic immunological synapses. Immunol. Rev. 235 (1), 24-34 (2010).
- Monks, C. R., Freiberg, B. A. K. u. p. f. e. r. H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Hafeman, D. G., von Tscharner, V., McConnell, H. M. Specific antibody-dependent interactions between macrophages and lipid haptens in planar lipid monolayers. Proc Natl Acad Sci USA. 78 (7), 4552-4556 (1981).
- Tscharner, V., McConnell, H. M. Physical properties of lipid monolayers on alkylated planar glass surfaces. Biophys J. 36 (2), 421-427 (1981).
- Crites, T. J., Chen, L., Varma, R. A TIRF microscopy technique for real-time, simultaneous imaging of the TCR and its associated signaling proteins. J. Vis. Exp. , (2012).
- Prins, K. C., Vasiliver-Shamis, G., Cammer, M., Depoil, D., Dustin, M. L., Hioe, C. E. Imaging of HIV-1 envelope-induced virological synapse and signaling on synthetic lipid bilayers. J. Vis. Exp. , (2012).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. , (2008).
- Michalet, X., Weiss, S. Using photon statistics to boost microscopy resolution. Proc. Natl. Acad. Sci. U. S. A. 103 (13), 4797-4798 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu. Rev. Biochem. 78, 993-1016 (2009).
- Lippincott-Schwartz, J., Manley, S. Putting super-resolution fluorescence microscopy to work. Nat. Methods. 6 (1), 21-23 (2009).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J. Vis. Exp. , (2014).
- Rak, G. D., Mace, E. M., Banerjee, P. P., Svitkina, T., Orange, J. S. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Leutenegger, M., Ringemann, C., Lasser, T., Hell, S. W., Eggeling, C. Fluorescence correlation spectroscopy with a total internal reflection fluorescence STED microscope (TIRF-STED-FCS). Opt Express. 20 (5), 5243-5263 (2012).
- Liu, D., Bryceson, Y. T., Meckel, T., Vasiliver-Shamis, G., Dustin, M. L., Long, E. O. Integrin-dependent organization and bidirectional vesicular traffic at cytotoxic immune synapses. Immunity. 31 (1), 99-109 (2009).
- Liu, D., Peterson, M. E., Long, E. O. The adaptor protein Crk controls activation and inhibition of natural killer cells. Immunity. 36 (4), 600-611 (2012).
- Wu, J. C., et al. Antibody conjugated supported lipid bilayer for capturing and purification of viable tumor cells in blood for subsequent cell culture. Biomaterials. 34 (21), 5191-5199 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon