Method Article
Oculare Test (EIT) per identificazione del pericolo di sostanze chimiche irritanti oculari utilizzando Ricostruito umana Cornea come epiteliale (RHCE) Tessuto Modello
In questo articolo
Riepilogo
Abbiamo sviluppato un test di irritazione oculare, che utilizza un modello di tessuto tridimensionale ricostruito epiteliali della cornea, come l'essere umano (RHCE). Il test è in grado di discriminare tra irritanti oculari e materiali corrosivi (GHS categoria 1 e 2 combinati) e quelli che non richiede etichettatura (GHS nessuna categoria).
Abstract
Per rispettare il settimo emendamento alla legislazione direttiva sui cosmetici e REACH EU, sono necessari metodi alternativi non animali convalidati per la valutazione affidabile e preciso di tossicità oculare nell'uomo. Per rispondere a questa esigenza, abbiamo sviluppato un test di irritazione oculare (IET), che utilizza un modello tridimensionale ricostruito umano cornea simile epiteliale (RHCE) tessuto che si basa su cellule umane normali. L'IET è in grado di separare sostanze irritanti e corrosive oculari (GHS Categorie 1 e 2 combinati) e quelli che non necessitano di etichettatura (GHS nessuna categoria). Il test utilizza due protocolli separati, uno progettato per prodotti chimici liquidi e un secondo protocollo simile per articoli di prova solidi. Il modello di predizione IET utilizza un unico periodo di esposizione (30 min per liquidi, 6 hr per solidi) e un singolo vitalità del tessuto cut-off (60,0% come determinato mediante saggio MTT). Sulla base dei risultati di 83 sostanze chimiche (44 liquidi e 39 solidi) EIT raggiunto 95,5 / 68,2 / e 81.8% sensitivity / specificità e accuratezza (SS & A) per liquidi, 100,0 / 68,4 / 84,6% e SS & A per i solidi, e 97.6 / 68.3 / e 83,1% per la generale SS & A. L'IET contribuirà in modo significativo alla classificazione della potenziale di irritazione oculare di una vasta gamma di prodotti chimici liquidi e solidi, senza l'uso di animali per soddisfare i requisiti di prova regolamentari. Il metodo EpiOcular IET è stato implementato nel 2015 negli indirizzi di test OCSE TG 492.
Introduzione
I prodotti di consumo come i cosmetici, detersivi, detergenti per la casa e comprendono una serie di sostanze chimiche che possono indurre gravi danni se si mettono in contatto gli occhi. Pertanto, le prove di questi agenti per l'irritazione degli occhi è richiesto dalle agenzie di regolamentazione degli Stati Uniti e dell'Unione europea per garantire la sicurezza dei consumatori 1. Una valutazione del potenziale di irritazione oculare di miscele e formulazioni è anche un requisito per il rispetto REACH (Registrazione, valutazione, autorizzazione e restrizione delle sostanze chimiche) La legislazione per l'etichettatura degli ingredienti cosmetici ai sensi della direttiva europea sui cosmetici per il trasporto di prodotti chimici, e per l'etichettatura dei pesticidi e prodotti per la casa 2. Attualmente, le agenzie di regolamentazione richiedono valutazione del pericolo oculare con il sistema mondiale armonizzato di classificazione ed etichettatura delle sostanze chimiche (GHS) 3. GHS si basa principalmente sulla prova di irritazione oculare Draize, il più utilizzato test di irritazione oculare in cui sostanze estranee e mixtures vengono introdotti direttamente nel sacco congiuntivale dell'occhio di coniglio 4. Secondo la classificazione GHS, GHS categoria 1 (corrosivi oculari) si riferisce per testare sostanze chimiche che causano gravi lesioni iniziale ai tessuti oculari o gravi danni agli occhi e la visione che non è completamente reversibile entro 21 giorni dopo l'esposizione 3,5. GHS categoria 2 si riferisce a testare le sostanze chimiche che producono cambiamenti significativi negli occhi che sono completamente reversibili entro 21 giorni di esposizione. Sostanze chimiche di prova che non sono corrosivi o irritanti sono indicati come GHS No Categoria.
Per più di 40 anni, l'esame degli occhi coniglio Draize è stato criticato per la sua mancanza di riproducibilità, sovrastima delle risposte umane, e l'uso di animali vivi 5-8. Queste preoccupazioni hanno spinto tante proposte per la raffinatezza, la riduzione e la sostituzione dei test in vivo 9. La necessità di alternative non animali convalidati è stata ulteriormente rafforzatacon l'adozione del settimo emendamento alla direttiva sui cosmetici, che ha vietato l'uso di animali nella valutazione della sicurezza dei prodotti cosmetici (nel 2005) e gli ingredienti (nel 2009) 2.
Dal 1996, il modello tessuto corneale come ricostruito è stato ampiamente utilizzato nell'industria cosmetica di valutare il potenziale di irritazione delle materie prime, formulazioni a base di tensioattivi, e miscele che sono progettati per l'uso in composto, o in prossimità del, l'occhio 10-13. L'utilizzo del modello di tessuto RHCE consente l'applicazione topica diretta del materiale di prova sulla superficie del tessuto nella sua forma non diluita nativa. In questo modo, le formulazioni non solubili in acqua possono essere testati senza diluizione con solventi. In risposta alle EURL di ECVAM (laboratorio di riferimento dell'Unione europea Centro europeo per la convalida dei metodi alternativi) richiesta di un metodo ampiamente applicabile, semplice, ed economico oculare Test (IET), che utilizza un single il tempo di esposizione ed è in grado di separare sostanze irritanti oculari e corrosive da materiali che non richiedono l'etichettatura è stato sviluppato (Figura 1) 14. Sulla base dei risultati di 83 chimici (44 liquidi e 39 solidi), l'EIT raggiunto 95,5 / 68,2 / e 81,8% di sensibilità / specificità e accuratezza (SS & A) per liquidi, 100,0 / 68,4 / e 84,6% SS & A per i solidi, e 97,6 / 68.3 / e 83,1% per la generale SS & A.
Nel 2007, uno studio di pre-validazione multi-laboratorio sponsorizzato dalla Cosmetics Europe (ex Colipa) sotto gli auspici del ECVAM EURL ha valutato la rilevanza e l'attendibilità dell'IET con l'obiettivo di portare al 15 formale di convalida. In questo studio, 298 prove indipendenti sono state effettuate in sette laboratori indipendenti. I risultati dello studio hanno dimostrato accordo 99,7% in previsione con bassi coefficienti di variazione in tutti i laboratori partecipanti 15. Di conseguenza, nel 2010 il protocollo IET è entrato formale EURL ECVAMprogramma di convalida. Lo studio di validazione utilizzato 104 sostanze chimiche di prova codificati, comprese le sostanze individuali e miscele chimiche, per cui i dati in vivo di riferimento (Draize dati irritazione agli occhi) erano disponibili. Sulla base del successo di questo lavoro, un progetto di linee direttrici OCSE è stata presentata nel 2014. Si prevede che l'IET contribuirà in modo significativo alla classificazione di irritazione oculare potenziale una vasta gamma di materiali secondo il sistema di classificazione ed etichettatura GHS dell'ONU.
Protocollo
1. Preparazione di RHCE tessuti per il trattamento - Giorno 0
- Al ricevimento del kit commerciale epiteliali della cornea, come l'essere umano (RHCE), controllare tutti i componenti del kit per l'integrità (per i dettagli Kit vedere standard Assay Kit Componenti (Tabella 1) e attrezzature e materiali necessari per eseguire il test IET (Tabella 2). Il il giorno di ricevimento, equilibrare i tessuti (in suo contenitore 24-pozzetti di spedizione) a temperatura ambiente per 15 min.
| Importo | Reagente | Condizioni | Fonte | Descrizione | Data di scadenza |
| 1 | Sealed 24-pozzetti dei tessuti EpiOcular (OCL-200) | 2-8 ° C | MatTek | Contiene 24 tissUES della coltura cellulare inserti, pacchetto su agarosio | 72 ore |
| 1 bottiglia, 200 ml | EpiOcular Assay media (OCL-200-ASY) | 2-8 ° C | MatTek | Medio basato DMEM | 21 giorni |
| 1 bottiglia, 100 ml | Ca ++ Mg ++ -Free Dulbecco's-PBS (DPBS) | RT | Sigma-Aldrich, D5652, o equiv. | Utilizzato per il risciacquo inserti | 1 anno |
| 4 | 6-pozzetti | RT | Falco | Usato per il mantenimento dei tessuti durante il protocollo del test | N / A |
| 2 | 12-pozzetti | RT | Falco | Utilizzato durante protocollo del test | N / A |
| 2 | 24-pozzetti | RT | Falco | Utilizzato per eseguire test MTT | N / A |
| 1 flacone, 0,5 ml | Acetato di metile (CAS # 79-20-9) | RT | Sigma-Aldrich, Cat # 186325 | Usato come PC nel test | 1 mese |
Tabella 1: Standard Assay Kit Components.
| Attrezzature / Materie | Necessario per: |
| Incubatore umidificato (37 ± 1 ° C, 5% CO ± 1 2, 90 ± 10% di umidità) | Tessuti incubazione prima e durante test |
| Cappa a flusso laminare | Lavoro sicuro in condizioni di sterilità |
| Pompa del vuoto (opzionale) | Aspirazione soluzioni a medio e |
| Piatto-reader fotometro (per piastre a 96 pozzetti) | Lettura OD |
| Tavola oscillante | Estrattoioni di formazano |
| Sterili, pinze smussato taglio | Manipolazione inserti di tessuto |
| Orologi da fermare | Tempi di applicazione di materiali di prova e altre operazioni temporizzate nel protocollo |
| Bagnomaria (37 ± 1 ° C) | Mezzi di riscaldamento e soluzione MTT |
| Mortaio e pestello | Grinding solidi granulari |
| Pipetta volumetrica (50 ml) | Applicazione di materiali e viscose e semisolide |
| Pipette regolabili (200 microlitri-2 ml) | Applicazione di materiali liquidi, terreno di coltura e MTT |
| Consigli Pre-sterilizzati (200 microlitri e 20 microlitri), Rainin Cat # HR-200F e HR-20F (o equivalente) | Applicazione di materiali liquidi, terreno di coltura e MTT |
| Suggerimenti orifizio largo pre-sterilizzati (250 microlitri), Rainin Cat # HR-250WS (o equivvalente) | Applicazione di materiali e viscose e semisolide |
| 8 oz / 220 ml i contenitori dei campioni, Falcon Cat # 3.540.200 (o equivalente) | Risciacquo tessuti |
| Sterili monouso siringhe (ad esempio 1 ml tuberkulin siringa Omnifix-F, B.Braun Melsungen AG, cat. No. 9161406V) | Consegna di ~ 50 mg materiali solidi (opzionale) |
| Ted Pella micro spatola / cucchiaio, Ted Pella Inc., Cat # 13504 (o equivalente, affilato cucchiaio o osso curette, ad esempio Aesculap, No: FK 623) | Consegna di ~ 50 mg materiali solidi |
| Ca ++ e Mg ++ tampone fosfato libero Dulbecco (Ca ++ Mg ++ Free-DPBS): Sigma-Aldrich, Cat # D5652 (o equivalente) | Risciacquo tessuti durante test |
| Sterile acqua deionizzata, il tessuto culturale di grado (qualità biologica o equivalente) | Usa come NC |
| 96 pozzetti piastre a fondo piatto, Falcon (o equivalente) | Per la lettura OD |
| Punta di cotone swap (sterile) | Per asciugare la superficie del tessuto (opzionale) |
| Nastro adesivo o Parafilm | Piastre di copertura durante l'estrazione formazano |
| Kit saggio MTT-100 | Contiene reagente MTT-tiazolil Blu Tetrazolium Bromuro (Sigma # M-5655) e isopropanolo estratto. |
Tabella 2: Attrezzature e materiali necessari per eseguire l'IET.
- In condizioni sterili, aprire il sacchetto contenente il 24 pozzetti con i tessuti RHCE e rimuovere la garza sterile. Controllare tutti i tessuti per le bolle d'aria tra il gel e inserire. Non utilizzare culture con le bolle d'aria sotto il rivestimento dell'inserto> 50% della superficie dell'inserto, tessuti difettosi o tessuti WHI ch sono completamente coperti di liquido.
- Etichettare i 6 pozzetti con l'articolo di prova o di codici di controllo e tempi di esposizione. Aliquota 1,0 ml di dosaggio medio (forniti con il kit), pre-riscaldato a circa 37 ° C, nei pozzetti di 6 pozzetti pre-etichettati.
- Utilizzare pinza sterile per rimuovere ogni inserto contenente il tessuto RHCE e posizionare l'inserto in 6 pozzetti etichettati. Durante questa fase, rimuovere eventuali agarosio trasporto residuo che aderisce ai lati esterni dell'inserto delicatamente blotting su carta da filtro sterile. Rilasciare eventuali bolle d'aria intrappolate sotto gli inserti.
- Pre-incubazione i tessuti RHCE in 6 pozzetti a condizioni di coltura standard (SCC, atmosfera umidificata con 5 ± 1% di CO 2 a 37 ± 1 ° C) per 1 ora.
- Dopo 1 ora, sostituire il saggio medio con 1,0 ml di fresco Assay medio preriscaldata a 37 ° C e incubare i tessuti RHCE in condizioni di SCC (di notte = O / N) (16-24 ore).
- Dopo l'O / N incubazione, applicare 20 l di Ca 2 + 2 + Mg di -free-Dulbecco tampone fosfato (DPBS, in dotazione) utilizzando un dispositivo di pipettamento appropriata. Se la DPBS non si diffonde attraverso i tessuti, delicatamente toccare l'inserto sul piatto per assicurare che i DPBS bagna l'intera superficie del tessuto.
- Incubare i tessuti RHCE a SCC per 30 ± 2 minuti.
Nota: Questo passaggio è necessario per l'idratazione dei tessuti e per imitare le condizioni in vivo.
3. Campioni Procedure di esposizione
- Applicare ogni articolo esame e di controllo per duplicare i tessuti RHCE (n = 2). La procedura di prova articolo dosaggio è diverso per liquidi e solidi. Topica applicare 50 ml di articoli di prova di liquido con una pipetta. Il tempo di esposizione per liquidi è di 30 min. Applicare 50 mg di articoli di prova uniformi usando un cucchiaio livellata (calibrato per tenere 50 mg di cloruro di sodio). L'extempo con esposizione per i solidi è di 6 ore.
Nota: I liquidi sono definite come sostanze fluide (ad esempio, liquidi, gel e creme) che possono essere applicati utilizzando un dispositivo di pipettamento. I solidi sono definiti come sostanze non-liquido (per esempio, polveri, materiali resinosi o cerosi) che non possono essere applicati con una pipetta.- Se lo stato fisico di articoli di prova non è facile determinare, posizionare le fiale con articolo di prova a bagnomaria per 15 min (37 ° C). Seguire il protocollo EIT per liquidi per quegli articoli di test che liquefanno a 37 ° C.
- Utilizzare una pipetta a spostamento positivo per i materiali particolarmente viscosi.
- Dosare il controllo negativo e controlli positivi e poi dosare gli articoli di prova.
- Applicare 50 ml di controllo negativo (NC) e il controllo positivo (PC) ai tessuti RHCE con una pipetta standard. La NC è acqua deionizzata sterile; il PC è acetato di metile (CAS # 79-20-9). Applicare il CN e il PC per 30 minuti quando la provaing articoli di prova liquidi e per 6 ore durante il test articoli di prova solidi.
4. Verificare Articolo esposizione - giorno 1
- Per il trattamento di articoli di prova di liquidi, seguire il programma di sincronizzazione indicata nella tabella 3. Lasciare 1 min intervalli tra le applicazioni di ogni articolo di prova per garantire la parità di esposizione per tutti i tessuti.
- Dopo il 30 ± 2 min DPBS pretrattamento, topica applicare 50 ml di NC e PC, e ogni articolo di prova liquido localmente sui tessuti RHCE che utilizzano un dispositivo di pipettamento appropriata.
- Applicare 50 microlitri del prodotto sperimentale liquido direttamente sul tessuto per coprire la superficie superiore. Tagliare il punto stretto della punta della pipetta di allargare il foro per i materiali viscosi. Per materiali molto viscosi, applicare l'articolo di prova di un dosatore (TV cilindro teste di diametro leggermente inferiore al diametro interno dell'inserto tessuto o una puntina di plastica), invertire il dosaggio device e posizionarlo sul tessuto in modo che l'articolo di prova uniformemente a contatto con la superficie del tessuto.
- Se articolo di prova non si diffonde attraverso il tessuto, toccare delicatamente l'inserto per assicurarsi che si diffonde su tutta la superficie del tessuto. Meccanica diffusione degli articoli di prova (ad esempio, con un puntale), non è raccomandato in quanto può danneggiare i tessuti.
- Incubare i tessuti a SCC per 30 ± 2 minuti.
- Per il trattamento di articoli di prova solidi - Giorno 1, seguire il programma di sincronizzazione di cui alla tabella 4 Lascia 2 min intervalli tra le applicazioni di ogni articolo di prova per garantire la parità di esposizione per tutti i tessuti..
- Dopo 30 ± 2 min DPBS pretrattamento, applicare 50 ml di NC e PC topica sui tessuti rhce utilizzando un dispositivo di pipettamento appropriata.
- Per applicazioni articolo di prova solido, rimuovere gli inserti (n = 2) dal pozzo e posizionarle su una superficie sterile (ad esempio, il coperchio di amPiastra ultiwell) per evitare un articolo di prova si rovescia nel mezzo.
- Usando un cucchiaio livellata, topica applicare circa 50 mg del prodotto sperimentale sulla superficie del tessuto; accertarsi che la superficie del tessuto è completamente coperto dal prodotto sperimentale. Se l'articolo di prova non si diffonde attraverso il tessuto, agitare l'inserto delicatamente da un lato all'altro per garantire che il tessuto è completamente coperto dal articolo di prova. Meccanica diffusione degli articoli di prova (ad esempio, con un puntale), non è raccomandato in quanto può danneggiare i tessuti.
- Se necessario, macinare polveri cristalline con un mortaio e pestello per garantire un migliore contatto tra l'articolo di prova e il tessuto.
- In alternativa, luogo polveri direttamente sulla coltura dei tessuti all'interno dell'inserto utilizzando una siringa da 1 ml con la testa tagliate. Polveri Stuff nella siringa quando il pistone è tratto indietro e quindi applicare premendo il pistone verso il basso.
- Se la parete esterna dell'inserto è contaminated ad esempio, da polveri, pulire le particelle con una garza sterile.
- Dopo somministrazione, tornare tessuti ai 6-pozzetti contenenti terreno di coltura e incubare a SCC per 6 ore ± 15 min.
5. risciacquo
- Preparare una serie di tre bicchieri puliti (150 ml) per articolo di prova e riempire ognuna con 100 ml di DPBS. Per ogni articolo di prova, utilizzare un diverso insieme di tre bicchieri.
- Alla fine del 30 ± 2 minuti di esposizione per materiali liquidi o 6 ore ± 15 minuti di esposizione per materiali solidi, rimuovere e scartare il dosatore se è stato utilizzato.
- Sollevare gli inserti contenenti tessuto RHCE fuori del mezzo afferrando il bordo superiore del 'collare' plastica con pinza sottile. Utilizzare pinze curve per facilitare la movimentazione e decantazione. Sciacquare i tessuti due alla volta tenendo inserti duplicati insieme da loro collari con pinze. Fate attenzione not danneggiare i tessuti con le pinze.
- Decantare il collaudo o controlli dalla superficie del tessuto su un materiale assorbente pulita (asciugamani di carta, garza, ecc)
- Immergere gli inserti nel primo bicchiere di DPBS, turbolenza in un movimento circolare in DPBS per circa 2 secondi, sollevare gli inserti in modo che essi sono per lo più pieni di DPBS, e decantare il liquido nella coppa. Ripetere questa operazione tre volte nel primo bicchiere.
- Risciacquare gli inserti in secondo e terzo beaker di DPBS tre volte ciascuno nello stesso modo.
- Decantare liquido residuo dell'inserto sul materiale assorbente. Ruotare l'inserto a un angolo di 45 ° (estremità aperta verso il basso) approssimata e toccare il labbro superiore al materiale assorbente.
Nota: Se non è possibile rimuovere tutto il materiale di prova visibile, nessun ulteriore risciacquo dovrebbe essere fatto per evitare danni ai tessuti causati da un uso eccessivo.
6. post-immersione
- Dopo il risciacquo,immergere immediatamente tessuti in 5 ml di Assay medio precedentemente riscaldati a RT in un 12-pozzetti pre-etichettato.
- Incubare i tessuti per 12 ± 2 minuti per materiali liquidi o 25 ± 2 minuti per materiali solidi immersi a temperatura ambiente per facilitare la rimozione di qualsiasi articolo in esame residua.
7. post-incubazione
- Alla fine del post-immersione durata dell'immersione, decantare il Assay medio dai tessuti e asciugare gli inserti su un materiale assorbente.
- Trasferire gli inserti nella piastra pre-etichettato 6-pozzetti contenenti 1 ml di caldo Assay Medium.
- Incubare i tessuti di 120 ± 15 min a SCC per materiali di prova liquidi.
- Incubare i tessuti per 18 ± 0,25 ore a SCC per materiali di prova solidi.
8. MTT Viability Assay - Giorno 1 (Protocollo per liquidi) e 2 ° giorno (Protocollo per solidi)
- Eseguire il saggio MTT dopo la post-incubazione di 12077; 15 min per liquidi e 18 ± 0,25 h per i solidi, rispettivamente.
- Preparare 1,0 mg / ml soluzione MTT e un'aliquota 0,3 ml della soluzione in ciascun pozzetto di una piastra a 24 pozzetti pre-etichettato.
- Utilizzare il kit di MTT commerciale (Tabella 5):
- 2 ore prima dell'uso, scongelare il concentrato MTT a temperatura ambiente. Unire 2 ml del concentrato MTT e 8 ml del diluente MTT per produrre 1,0 mg / ml soluzione MTT.
- Conservare la soluzione MTT a 4 ° C al buio fino al momento dell'uso. Non conservare la soluzione MTT per più di 1 giorno.
- Alla fine del post incubazione, rimuovere ciascun inserto dal 6 pozzetti e asciugare delicatamente su un materiale assorbente.
- Mettere gli inserti nella piastra 24 pozzetti contenente 0,3 ml di soluzione MTT. Rilasciare eventuali bolle d'aria intrappolate sotto gli inserti. Incubare la piastra per 180 ± 10 min a SCC.
- Estrazione MTT
- Dopo 180 ± 10 min di incubazione nella soluzione MTT, rimuovere ogni insertodalla piastra 24 pozzetti e asciugare la parte inferiore dell'inserto in un materiale assorbente.
- Per gli articoli di test liquido non coloranti (estrazione sommerso): Trasferire gli inserti in una piastra da 24 pozzetti pre-etichettato contenente 2,0 ml di una soluzione estraente (isopropanolo) in modo che sommerge l'inserto.
- Per i solidi e coloranti liquidi (non sommerso estrazione per evitare la contaminazione della soluzione estraente): Trasferire gli inserti in una piastra da 6 pozzetti pre-etichettato contenente 1,0 ml della soluzione di solvente (isopropanolo) in modo che non annulla l'inserto.
Nota: Eseguire la stessa estrazione non sommerso per i corrispondenti controlli negativi e positivi.
- Sigillare le piastre (ad esempio, con parafilm tra il coperchio e la piastra di bordo superiore dei pozzetti o con un foglio sigillante standard). Posizionare le piastre su una piastra agitatore orbitale e agitare per 2-3 ore a temperatura ambiente per estrarre il MTT.
- In alternativa, eseguire l'estrazione O / N a 2-876; C al buio senza agitare.
- Per gli articoli di prova liquido non coloranti (estrazione sommerso): Al termine del periodo di estrazione, decantare il liquido da ciascun inserire di nuovo nel pozzo e scartare gli inserti con i tessuti RHCE.
- Mescolare la soluzione di estratto e trasferire due 200 aliquote microlitri nei pozzetti di una piastra a 96 pozzetti pre-etichettati in base alla configurazione della piastra (Figura 2).
- Per i solidi e coloranti liquidi (estrazione non sommersa): Al termine del periodo di estrazione, scartare i tessuti (assicuratevi di non perforare i tessuti).
- Aggiungere 1,0 ml della soluzione di solvente in ciascun pozzetto della piastra da 24 pozzetti contenente la soluzione estratta dai tessuti. Mescolare la soluzione di solvente e trasferire due 200 aliquote microlitri nei pozzetti di una piastra a 96 pozzetti pre-etichettati in base alla configurazione della piastra (Figura 2).
- Determinare tha densità ottica (OD) dei campioni estratti ad una singola lunghezza d'onda tra 550 e 590 nm (deve essere coerente all'interno di un laboratorio) su un lettore di piastre o uno spettrofotometro.
- In caso di Solubilizzazione torbide causati da solidi insolubili, centrifugare le soluzioni note per misurare la densità ottica (raffreddare la centrifuga a 4 ° C per evitare l'evaporazione). In caso risciacquo non rimuove l'articolo di prova (TA) e TA interferisce con riduzione MTT, devono essere utilizzati controlli aggiuntivi. Si prega di fare riferimento a una SOP dettagliate per correggere la riduzione MTT 16.
- In caso di un TA è mostrato di possedere, o per sviluppare colore che può interagire con la misura MTT, un ulteriore test deve essere eseguito per determinare la quantità di colore legato a, e successivamente estratta dai tessuti. Si prega di fare riferimento a una SOP dettagliate per correggere gli articoli in esame colorate 16.
9. Calcoli per Tissue Viability di prova (tabella 6 e Figura 3) & #160;
- Calcoli generali
- Calcolare il valore medio di OD dei pozzetti di controllo vuoti (OD BLK) per ogni esperimento.
- Sottrarre OD Blk da ogni valore di OD dello stesso esperimento (P. dati corretti).
- Calcolare il valore medio delle due aliquote per ciascun tessuto (OD = corretta).
- Calcolare la vitalità percentuale di ciascuno dei due tessuti replicati per ciascun controllo e articolo di prova rispetto al controllo negativo medio (controllo al 100%).
Viabilità (%) = [corretto OD tessuti trattati / OD corretto controllo negativo] x 100% - Calcolare la differenza della vitalità (la differenza tra i due tessuti viabilità replicate).
- Calcolare la vitalità articolo di prova medio (TA vitalità) e classificare l'articolo di prova a seconda del modello di previsione.
10. previsione di modello (Figura 3)
- La vitalità del tessuto TA-trattata è> 60,0 rispetto al tessuto NC-trattati vESPONSABILITÀ, etichettare il prodotto sperimentale come non irritante (NI) (GHS No Categoria).
- La vitalità del tessuto TA-trattata è ≤ 60,0 rispetto alla vitalità del tessuto NC-trattati, etichettare l'articolo di prova come irritante (I) (GHS Categorie 1 e 2).
Nota: I risultati dei test dell'EIT sono considerati qualificata se:- il diametro esterno IET NC> 0.8 e <2.5;
- la vitalità del tessuto IET PC (%, rispetto al NC) è ≤50.0%;
- la differenza tra i due tessuti replicati (NC, PC e articolo di prova) è <20,0%.
Risultati
Risultati EIT rappresentativi condotti con 10 articoli di prova (TA) e controlli negativi e positivi sono presentati nella Tabella 6 e nella Figura 3. La media OD = 1.31 per il NC corrisponde alla vitalità del tessuto 100%, quindi il PC (media OD = 0.41) avevano vitalità del tessuto relativo del 31,2%. Quando il protocollo IET è stata eseguita in 15 esperimenti indipendenti valide in 7 laboratori utilizzando il protocollo un'esposizione liquida e in 8 esperimenti validi indipendenti in 4 laboratori, utilizzando il protocollo di esposizione solido, la vitalità media dei tessuti per il PC utilizzando il protocollo di liquido era 36,4 ± 4,0 % e 32,3 ± 6,4% per il protocollo solidi. In tutti i casi, i risultati del controllo positivo sono stati al di sotto del valore di taglio del 60,0% 15.
Come mostrato in figura 3, TA1, TA2, TA4, TA7 e TA8 aveva Viabilità tessuto> 60,0% e quindi sono stati classificati come "NI". TA3, TA5, TA6, TA9, e TA10 aveva Viabilità tessuto X04, 60,0% e, pertanto, sono stati classificati come "io". La differenza di vitalità del tessuto tra i tessuti duplicati era <20,0% per tutte le agenzie di viaggi, con l'eccezione di TA2. Pertanto, i risultati per tutti gli articoli di prova, con l'eccezione di TA2, sono stati considerati "qualificato" quando si sono incontrati tutti i criteri di accettazione dell'EIT (sezione 10.2). A causa della variabilità tra tessuti duplicati per TA2 nel primo esperimento, un secondo esperimento era necessaria per ottenere risultati EIT qualificati.
Il metodo di prova IET come qui descritto utilizzando il modello di tessuto RHCE è stato utilizzato per la valutazione di irritazione oculare in diversi studi di convalida multilaboratory, compresa la convalida formale EURL ECVAM / Cosmetici Europa 15,17-19. In tutti gli studi, l'IET ha dimostrato di essere riproducibile e fu in grado di identificare correttamente i prodotti chimici (sia le sostanze e miscele) che non richiede classificazione e l'etichettatura per irritazione agli occhi o lesioni oculari gravi accondo UN GHS 15,17-19. Il metodo di prova IET soddisfatto i criteri di accettazione del Group Management Validation (VMG) per irritazione agli occhi per la sensibilità, specificità e accuratezza complessiva e attualmente è in attesa di attuazione formale in sostituzione parziale in vivo coniglio Draize test 19.
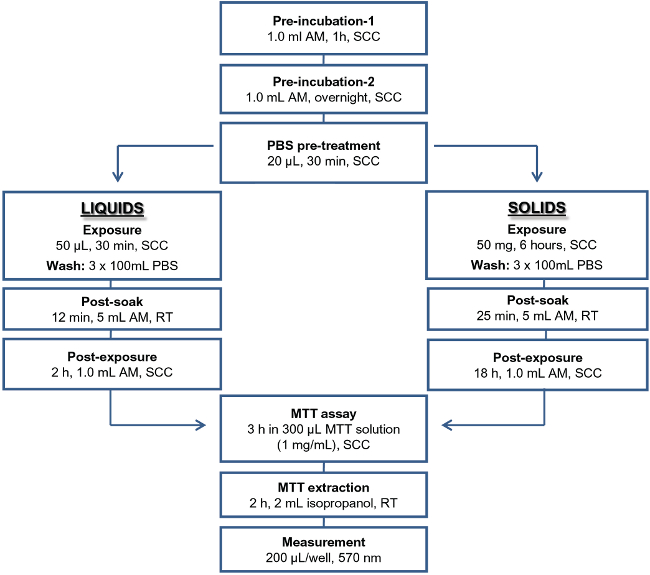
Figura 1: Schema di protocollo dell'IET per articoli di prova liquidi e solidi Abbreviazioni utilizzate: AM, terreno di coltura;. SCC, condizioni di coltura standard; PBS, Dulbecco Phosphate Buffered Saline; RT, temperatura ambiente.
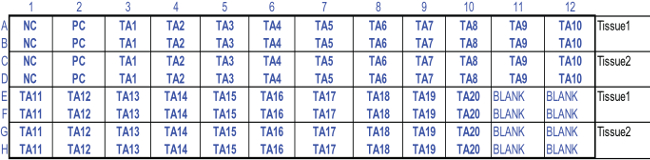
Figura 2:. La configurazione piastra da 96 pozzetti standardizzato per la prova di vitalità del tessuto MTT Due 200 microlitri aliquote sono TRAnsferred nei rispettivi pozzetti di una piastra a 96 pozzetti pre-etichettati. Abbreviazioni utilizzate: NC, controllo negativo; PC, controllo positivo; TA1-TA20, articoli di prova 1-20; Vuoto, soluzione estraente. 96- configurazione della piastra MTT viene utilizzato con foglio di calcolo Excel progettato per calcolare la vitalità del tessuto RHCE e risultati dell'EIT.
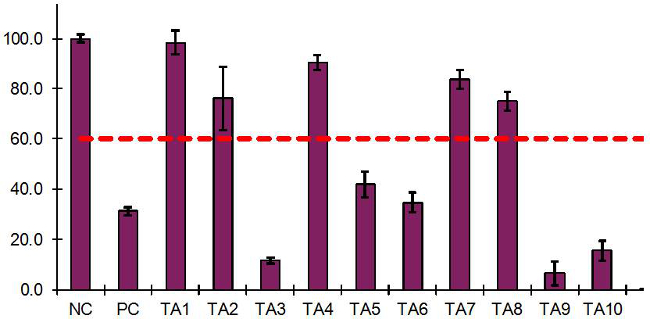
Figura 3: risultati dell'EIT ottenuti per gli articoli 10 prova, Carolina del Nord e dei controlli di PC che utilizzano il modello di tessuto RHCE Il grafico è generato da un foglio di calcolo di Excel progettato per presentare i risultati dell'IET.. Sostanze chimiche di prova che hanno ridotto la vitalità del tessuto ≤ 60,0% rispetto al NC sono classificati come sostanze irritanti ("I", TA3, TA5, TA6, TA9, e TA10) e prodotti chimici di prova che aveva vitalità del tessuto> 60,0% sono classificati come non-irritanti (" NI ", TA1, TA2, TA4, TA7, e TA8).
| Tempo per le fasi di lavoro di protocollo IET (un giorno di lavoro per un operatore) Iniziare | |||||||
| Ogni riga corrisponde ad una coppia di tessuti | |||||||
| Ordine di passi: | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Liquidi: | PBS | TA Esposizione | Post- Ammollo | Post- Incub. | MTT Reazione | MTT Estrazione | Misura |
| 30 min | 30 min | 12 min | 120 min | 180 min | 120 min | OD | |
| NC | 09:00 | 09:30 | 10:00 | 10:12 | 00:12 | 15:12 | dopo |
| PC | 09:01 | 09:31 | 10:01 | 10:13 | 00:13 | 15:13 | 17:30 |
| TA-1 | 09:02 | 09:32 | 10:02 | 10:14 | 00:14 | 15:14 | |
| TA-2 </ strong> | 09:03 | 09:33 | 10:03 | 10:15 | 00:15 | 15:15 | |
| TA-3 | 09:04 | 09:34 | 10:04 | 10:16 | 00:16 | 15:16 | |
| TA-4 | 09:05 | 09:35 | 10:05 | 10:17 | 00:17 | 15:17 | |
| TA-5 | 09:06 | 09:36 | 10:06 | 10:18 | 00:18 | 15:18 | |
| TA-6 | 09:07 | 09:37 | 10:07 | 10:19 | 00:19 | 15:19 | |
| TA-7 | 09:08 | 09:38 | 10:08 | 10:20 | 00:20 | 15:20 | |
| ng> TA-8 | 09:09 | 09:39 | 10:09 | 10:21 | 00:21 | 15:21 | |
| TA-9 | 09:10 | 09:40 | 10:10 | 10:22 | 00:22 | 15:22 | |
| TA-10 | 09:11 | 09:41 | 10:11 | 10:23 | 00:23 | 15:23 | |
Tabella 3:. Calendario del campione per la prova di articoli di prova liquidi passi Protocollo tra cui pre-bagnare i tessuti con DPBS, Applicazione degli articoli di prova (TA), risciacquo e post-immersione, periodo di post-incubazione, saggio MTT, Estrazione di MTT, e misurazione di MTT OD sono presentati in colonne. Tempi per i tessuti duplicati sono organizzate in righe. L'intero test test 10 agenzie di viaggi ed i controlli possono essere rifiniti in un giorno.
e_content ">| Ora di inizio per le fasi di protocollo dell'EIT (2 giorni di lavoro per un operatore) | |||||||
| Ogni riga corrisponde ad una coppia di tessuti | |||||||
| Giorno 1 | 2 ° giorno (giorno successivo) | ||||||
| Ordine di passi: | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Solidi: | PBS | TA Esposizione | Post- Ammollo | Post- Incubaction | MTT Reazione | MTT Estrazione | Misura |
| 30 min | 6 ore | 26 min | 18 ore | 180 min | 120 min | OD | |
| NC | 09:00 | 09:30 | 15:30 | 15:56 | 09:56 | 00:56 | dopo |
| PC | 09:02 | 09:32 | 15:32 | 15:58 | 09:58 | 00:58 | 15:30 |
| TA-1 | 09:04 | 09:34 | 15:34 | 16:00 | 10:00 | 13:00 | |
| TA-2 | 09:06 | 09:36 | 15:36 | 16:02 | 10:02 | 13:02 | |
| TA-3 | 09:08 | 09:38 | 15:38 | 16:04 | 10:04 | 13:04 | |
| TA-4 | 09:10 | 09:40 | 15:40 | 16:06 | 10:06 | 13:06 | |
| TA-5 | 09:12 | 09:42 | 15:42 | 16:08 | 10:08 | 13:08 | |
| TA-6 | 09:14 | 09:44 | 15:44 | 16:10 | 10:10 | 13:10 | |
| TA-7 | 09:16 | 09:46 | 15:46 | 16:12 | 10:12 | 13:12 | |
| TA-8 | 09:18 | 09:48 | 15:48 | 16:14 | 10:14 | 13:14 | |
| TA-9 | 09:20 | 09:50 | 15:50 | 16:16 | 10:16 | 13:16 | |
| TA-10 | 09:22 | 09:52 | 15:52 | 16:18 | 10:18 | 13:18 | |
Tabella 4: calendario del campione per la prova di articoli di prova solidi. Passi Protocollo tra cui pre-bagnare i tessuti con DPBS, Applicazione degli articoli di prova, risciacquo e post-immersione, periodo di post-incubazione, MTT assay, Estrazione di MTT, e misurazione di MTT OD sono presentati in colonne. Tempi per i tessuti duplicati sono organizzate in righe. L'intero test di prova di 10 agenzie di viaggi e dei controlli viene effettuata nel corso di un periodo di due giorni.
| Importo | Reagente | Condizioni di conservazione | Fonte | Descrizione | Data di scadenza |
| 1 flacone, 2 ml | MTT Concentrato (MTT-100-CON) | Al riparo dalla luce (-20 ° C) | MatTek | Congelati concentrato MTT | 2 mesi |
| 1 flacone, 8 ml | MTT diluente | 2-8 &# 186; C | MatTek | Per diluire MTT concentrato prima dell'uso nel test MTT | 2 mesi |
| 1 bottiglia, 60 ml | Isopropanolo (CAS # 67-63-0) | RT | Sigma-Aldrich | Soluzione solvente | N / A |
Tabella 5: MTT-100 Kit dosaggio dei componenti.
| Codice N ° | Tessuto | Dati grezzi | Blank dati corretti | media di OD | % Della vitalità | ||
| n | Aliq. 1 | Aliq. 2 | Aliq. 1 | Aliq. 2 | |||
| NC | 1 | 1.316 | 1.352 | 1.316 | 1.352 | 1.334 | 101.6 |
| 2 | 1.277 | 1.309 | 1.277 | 1.309 | 1.293 | 98.4 | |
| PC | 1 | 0,379 | 0,397 | 0,379 | 0,397 | 0.388 | 29.6 |
| 2 | 0,419 | 0,442 | 0,419 | 0,442 | 0,431 | 32.8 | |
| TA1 | 1 | 1.213 | 1.244 | 1.213 | 1.244 | 1.229 | 93.5 |
| 2 | 1.355 | 1.355 | 1.355 | 1.355 | 1.355 | 103.2 | |
| TA2 | 1 | 1.210 | 1.122 | 1.210 | 1.122 | 1.166 | 88,7 |
| 2 | 0,828 | 0,837 | 0,828 | 0,837 | 0,833 | 63.4 | |
| TA3 | 1 | 0,167 | 0,168 | 0,167 | 0,168 | 0,167 | 12.7 |
| 2 | 0.138 | 0.136 | 0.138 | 0.136 | 0,137 | 10.4 | |
| TA4 | 1 | 1.137 | 1.160 | 1.137 | 1.160 | 1.149 | 87.4 |
| 2 | 1.262 | 1.191 | 1.262 | 1.191 | 1.227 | 93.4 | |
| TA5 | 1 | 0.610 | 0,621 | 0.610 | 0,621 | 0,616 | 46.9 |
| 2 | 0.480 | 0,484 | 0.480 | 0,484 | 0,482 | 36.7 | |
| TA6 | 1 | 0,502 | 0,513 | 0,502 | 0,513 | 0.508 | 38.7 |
| 2 | 0,396 | 0,407 | 0,396 | 0,407 | 0,402 | 30.6 | |
| TA7 | 1 | 1.048 | 1.050 | 1.048 | 1.050 | 1.049 | 79.9 |
| 2 | 1.149 | 1.150 | 1.149 | 1.150 | 1.150 | 87.5 | |
| TA8 | 1 | 1.032 | 1.034 | 1.032 | 1.034 | 1.033 | 78.7 |
| 2 | 0,941 | 0.935 | 0,941 | 0.935 | 0,938 | 71.4 | |
| TA9 | 1 | 0,022 | 0,022 | 0,022 | 0,022 | 0,022 | 1.7 |
| 2 | 0,144 | 0.149 | 0,144 | 0.149 | 0.147 | 11.2 | |
| TA10 | 1 | 0.150 | 0.150 | 0.150 | 0.150 | 0.150 | 11.4 |
| 2 | 0.254 | 0.255 | 0.254 | 0.255 | 0.255 | 19.4 | |
| significare | Dif. | media di | Dif. | Dif. / 2 | Classificazione | ||
| di OD | di OD | Viabilità [%] | di Viabilità | ||||
| NC | 1.314 | 0.041 | 100.0 | 3.12 | 1.56 | NI | qualificato |
| PC | 0.410 | 0,043 | 31.2 | 3.23 | 1.62 | IO | qualificato |
| TA1 | 1.292 | 0.127 | 98.3 | 9.63 | 4.81 | NI | qualificato |
| TA2 | 0,999 | 0.333 | 76,1 | 25.36 | 12.68 | NI | D> 20 |
| TA3 | 0,152 | 0.030 | 11.6 | 2.32 | 1.16 | IO | qualificato |
| TA4 | 1.188 | 0.078 | 90.4 | 5.94 | 2.97 | NI | qualificato |
| TA5 | 0,549 | 0,134 | 41.8 | 10.16 | 5.08 | IO | qualificato |
| TA6 | 0,455 | 0,106 | 34.6 | 8.07 | 4.03 | IO | qualificato |
| TA7 | 1.100 | 0.101 | 83.7 | 7.65 | 3.82 | NI | qualificato |
| TA8 | 0,986 | 0,095 | 75,0 | 7.23 | 3.62 | NI | qualificato |
| TA9 | 0,085 | 0,125 | 6.4 | 9.48 | 4.74 | IO | qualificato |
| TA10 | 0,203 | 0,105 | 15.4 | 7.95 | 3.98 | IO | qualificato |
Tabella 6:. I risultati ottenuti dell'IET per 10 articoli di prova, Carolina del Nord e PC controlli I tavoli sono produced da un foglio di calcolo Excel progettato per calcolare la vitalità del tessuto e dei risultati dell'EIT. Sostanze chimiche di prova che hanno ridotto la vitalità del tessuto ≤ 60,0% rispetto al NC sono classificati come sostanze irritanti ("I", TA3, TA5, TA6, TA9, e TA10) e prodotti chimici di test che ha avuto la vitalità del tessuto> 60,0% sono classificati come non-irritanti (" NI ", TA1, TA2, TA4, TA7, e TA8).
Discussione
Abbiamo presentato l'oculare di prova (Figura 1) che è stato sviluppato per il modello di tessuto EpiOcular. L'IET è in grado di separare sostanze irritanti e corrosive oculari (GHS categorie 1 e 2), combinato con materiali che non richiedono etichettatura (GHS nessuna categoria), con alto grado di sensibilità e specificità 17. L'IET come presentato qui non discrimina tra GHS Categoria 1 da categoria 2 prodotti chimici. L'EIT è stato convalidato per la classificazione e l'etichettatura delle oculare potenziale di irritazione di una vasta gamma di sostanze chimiche, tra cui cosmetici e farmaceutici ingredienti. In concomitanza con altri test in vitro, l'EIT servire come un sostituto per l'occhio di coniglio test di irritazione in vivo.
L'IET utilizza due protocolli simili ma distinte per materiali liquidi e solidi, che variano nella durata dell'esposizione e periodi di incubazione post-esposizione (Figura 1). L'endpoint utilizzato nel IETè vitalità del tessuto, determinata con il saggio MTT, che è stato precedentemente utilizzato in validati modelli tessuti epiteliali umane 20,21. Per eseguire questo test, non è necessaria alcuna attrezzatura speciale oltre che delle apparecchiature standard di coltura cellulare. Dato l'elevato livello di riproducibilità-tessuto tessuto, n = 2 tessuti invece del solito raccomandato n = 3 servono. La possibilità di usare n = 2 tessuti è un aspetto critico del protocollo, in quanto permette ad un operatore esperto per processare simultaneamente due tessuti, riducendo al minimo la variabilità del test che possono sorgere a causa del diverso trattamento dei singoli tessuti 14. Inoltre, utilizzando n = 2 tessuti per articolo di prova, l'irritabilità di 10 sostanze di prova di uno stesso stato fisico (liquido o solido), insieme con i controlli positivi e negativi, può essere valutata utilizzando un kit (24 tessuti).
Altri punti chiave che garantiscono la classificazione affidabile di materiali sono specifiche per il controllo positivo substance (vitalità del tessuto ≤50.0%), la riproducibilità tra tessuti duplicati (differenza <20,0%), e letture OD controllo negativo (> 0,8 e <2,5).
Durante la prova IET, è importante rispettare il protocollo convalidato e al dosaggio suggerito e orari risciacquo (Tabelle 3 e 4), in quanto deviazione dal protocollo o cambiamenti nei periodi di incubazione può causare risultati alterata. Allo stesso modo, le deviazioni dal tempo 3 ore per MTT incubazione si tradurrà in letture diverse MTT e possono influire risultato del test.
Di tanto in tanto, una sostanza chimica di prova può avere proprietà ottiche o di altro tipo che possono interferire con il tessuto MTT viabilità saggio o la riduzione causa di MTT. Ad esempio, una sostanza chimica di prova può ridurre direttamente MTT in blu-viola prodotto di reazione, o può essere una sostanza colorata che assorbe la luce nella stessa gamma MTT formazan (~ 570 nm). Tuttavia, queste sostanze chimiche di prova saranno prESENT un problema solo, se al momento del saggio MTT, una quantità sufficiente di materiale è ancora presente (o assorbita) il tessuto. Per evitare questa interferenza, estese le procedure di lavaggio sono incorporati nel protocollo dell'IET. Se il risciacquo non rimuove il TA e TA interferisce con la riduzione MTT, controlli aggiuntivi devono essere utilizzati per individuare e correggere per esso. In breve, se si sospetta riduzione diretta MTT della sostanza chimica in esame, 50 ml (o 50 mg per i solidi) della sostanza chimica in questione è incubato per 3 ore con la soluzione MTT lavoro a SCC (NC, 50 ml di acqua deionizzata sterile, dovrebbe essere eseguire contemporaneamente). Se la soluzione MTT diventa blu-viola, l'articolo di prova si presume di aver ridotto la MTT. In questo caso la verifica funzionale mediante controlli tissutali freeze-ucciso deve essere eseguito per valutare se il materiale di prova è vincolante per il tessuto e porta ad un falso segnale di riduzione MTT. Se vi è la riduzione MTT sensibile del TA-esposto, controllo di tessuto ucciso(rispetto alla quantità nel tessuto vitale non trattato), la vitalità del tessuto medio del prodotto di prova deve essere corretto sottraendo la redditività media del controllo uccisi.
L'EIT sbaglia sul lato della sicurezza, come dimostrato dalla bassa incidenza di falsi negativi classificazioni 14,15,18. È importante sottolineare che nessuna delle categoria GHS 1 sostanze chimiche, che sono corrosivi per l'occhio e che rappresentano il più grave pericolo per gli occhi, sono stati classificati come non irritante in questo saggio 14,15,18,19. Infine, uno dei principali vantaggi del RHCE in metodo di prova in vitro è la possibilità di testare liquido pulito e materiali solidi (che non è possibile con le culture, bidimensionali cellulare in immersione).
L'IET contribuirà in maniera significativa a determinare il potenziale di irritazione oculare di una vasta gamma di materiali secondo il sistema di classificazione ed etichettatura GHS dell'ONU. La sostituzione degli animali per determinare oTossicità colare è stato un obiettivo della ricerca tossicologica per molti anni. Il metodo di prova EIT ha completato uno studio di validazione formale supportato da EURL ECVAM nel 2014 e la EpiOcular EIT è stato attuato negli indirizzi di test OECD l'OCSE TG 492 nel 2015.
Divulgazioni
Spese di pubblicazione per questo articolo sono stati versati da MatTek Corporation.
Riconoscimenti
Gli autori desiderano ringraziare il Dr. John Harbell per il suo sostegno scientifico e il tempo dedicato al progetto dell'IET. Gli autori desiderano anche ringraziare Beiersdorf AG (Germania), IIVS (USA), Mary Kay Inc. (USA), Avon Products Inc. (USA), Procter & Gamble / Cosmital (Svizzera), Laboratoire Pierre Fabre (Francia), Harlan Laboratories (Regno Unito), e LVMH Parfume (Francia) per la partecipazione a Multi-Centro internazionale Pre e alla convalida Studi del Irritazione agli occhi di prova 15.
Riferimenti
- National Toxicology Program (NTP) Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). Request for Ocular Irritancy Test Data From Human, Rabbit, and In Vitro Studies Using Standardized Testing Methods. Federal Register. 72 (109), 31582-31583 (2007).
- Regulation (EC) No 1907/2006 of the European Parliament and of the Council of 18 December 2006 concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH), establishing a European Chemicals Agency, amending Directive 1999/45/EC and repealing Council Regulation (EEC) No 793/93 and Commission Regulation (EC) No 1488/94 as well as Council Directive 76/769/EEC and Commission Directives 91/155/EEC, 93/67/EEC, 93/105/EC and 2000/21/EC. OJ. L396 (49), European Commission. 1-849 (2006).
- Globally Harmonized System of Classification and Labelling of Chemicals (GHS). , Fifth revised edition, United Nations. New York and Geneva. (2013).
- Draize, J. H., Woodard, G., Calvery, H. O. Methods for the Study of Irritation and Toxicity of Substances Applied Topically to the Skin and Mucous Membranes. J Pharmacol Exp Ther November. 82, 377-390 (1944).
- Adriaens, E. Retrospective analysis of the Draize test for serious eye damage/eye irritation: importance of understanding the in vivo endpoints under UN GHS/EU CLP for the development and evaluation of in vitro test methods. Arch tox. 88, 701-723 (2014).
- Balls, M., Botham, P. A., Bruner, L. H., Spielmann, H. The EC/HO international validation study on alternatives to the Draize eye irritation test. Toxicol in Vitro. 9, 871-929 (1995).
- Curren, R. D., Harbell, J. W. Ocular safety: a silent (in vitro) success story. Altern Lab Anim. 30, Suppl 2. 69-74 (2002).
- Wilhelmus, K. R. The Draize Eye Test. Survey of Ophthalmology. 45, 493-515 (2001).
- Curren, R. D., Harbell, J. W. In vitro alternatives for ocular irritation. Environ health persp. 106, 485-492 (1998).
- McCain, N. E., Binetti, R. R., Gettings, S. D., Jones, B. C. Assessment of ocular irritation ranges of market-leading cosmetic and personal-care products using an in vitro tissue equivalent. Toxicologist. 66, 243(2002).
- Niranjan, P., Dang, A. H., January, B. G., Gomez, C., Harbell, J. W. Use of the EpiOcular assay for preclinical qualification of formulas for human clinical studies. Toxicologist. 96, 249(2007).
- Yin, X. J. Prediction of ocular irritation potential of surfactants-based formulations at different concentrations using the EpiOcular model. Toxicologist. 108, 378(2009).
- Harbell, J., Curren, R. In vitro methods for the prediction of ocular and dermal toxicity. Handbook of Toxicology. , 2nd Edition, Informa Healthcare. (2001).
- Kaluzhny, Y. Development of the EpiOcular(TM) eye irritation test for hazard identification and labelling of eye irritating chemicals in response to the requirements of the EU cosmetics directive and REACH legislation. Altern Lab Anim. 39, 339-364 (2011).
- Pfannenbecker, U. Cosmetics Europe Multi-Laboratory Pre-Validation of the EpiOcular Reconstituted Human Tissue Test Method for the Prediction of Eye Irritation. Toxicol in vitro. , (2013).
- MatTek Corporation. EpiOcular™ Eye Irritation Test (OCL-200-EIT) for the prediction of acute ocular irritation of chemicals for use with Reconstructed Human EpiOcular Model (OCL-200-EIT). Protocol#MK-24-007-0055. , MatTek Corporation. (2014).
- Kaluzhny, Y. EpiOcular Eye Irritation Test (EIT) for Hazard Identification and Labeling of Eye Irritating Chemicals: Protocol Optimization for Solid Materials and Extended Shipment Times. Altern Lab Anim. 43 (2), 101-127 (2015).
- Kolle, S. N., Kandarova, H., Wareing, B., van Ravenzwaay, B., Landsiedel, R. In-house validation of the EpiOcular(TM) eye irritation test and its combination with the bovine corneal opacity and permeability test for the assessment of ocular irritation. Altern Lab Anim. 39, 365-387 (2011).
- Reconstructed Human Cornea-like Epithelium (RhCE) Test Method for Identifying Chemicals Not Requiring Classification and Labelling for Eye Irritation or Serious Eye Damage. Draft proposal for a new test guideline.. OECD Guideline for the Testing of Chemicals. , (2014).
- Evaluating the ocular irritation potential of 54 test articles using the EpiOcular Human tissue Construct Model. Toxicol. In Vitro. Blazka, M. E., Harbell, J. 42nd Annual Meeting of the Soc. of Toxicology, Salt Lake City, UT, , (2003).
- Kandarova, H. The EpiDerm Test Protocol for the Upcoming ECVAM Validation Study on In Vitro Skin Irritation Tests — An Assessment of the Performance of the Optimised Test. Altern Lab Anim. 33, 351-367 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon