È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Ortotopico impianto e periferico immunitario monitoraggio cellulare nel Modello II-45 Singenico Rat mesotelioma
In questo articolo
Riepilogo
La generazione di un modello di ratto ortotopico di pleurico mesotelioma maligno da impianto di II-45 cellule di mesotelioma nella cavità pleurica di topi immunocompetenti è presentato. Metodo citometria di flusso per analizzare sette sottoinsiemi di cellule immunitarie di questi animali da un campione di sangue di 25 ml è anche descritto.
Abstract
L'enorme aumento di interesse nei trattamenti immuno-based per il cancro, come i vaccini e gli inibitori checkpoint del sistema immunitario, e una maggiore comprensione del ruolo del microambiente tumorale in risposta al trattamento, collettivamente puntare l'esigenza di modelli ortotopici immuno-competenti per i test pre-clinici di queste nuove terapie. Questo documento dimostra come stabilire un modello di topo immuno-competenti ortotopico di pleurico mesotelioma maligno. La progressione della malattia di monitoraggio nei modelli ortotopici è confuso dalla posizione interna dei tumori. Per monitorare longitudinalmente progressione della malattia e il suo effetto sulle cellule immunitarie circolanti in questo e altri modelli di ratto di cancro, un unico tubo citometria a flusso saggio che richiede solo 25 ml di sangue intero è descritto. Ciò fornisce la quantificazione accurata dei sette parametri immunitari: linfociti totali, monociti e neutrofili, così come i sottoinsiemi di cellule T CD4 e CD8, cellule B e le cellule natural killer. Diversi Subsets di questi parametri sono utili in diverse circostanze e modelli, con il neutrofili rapporto dei linfociti, con il massimo di utilità per monitorare la progressione della malattia nel modello mesotelioma. Analizzare i livelli circolanti di cellule immunitarie che utilizzano questo metodo del tubo singolo può anche aiutare a monitorare la risposta ai trattamenti immuno-based e la comprensione dei meccanismi sottostanti che determinano il successo o il fallimento del trattamento.
Introduzione
Mesotelioma maligno (MM) è un tumore aggressivo che deriva da cellule trasformate nella membrana (Mesotelio) che riveste la cavità addominale e polmonare, cuore e gli organi riproduttivi interni, ed è il tumore primario più comune della cavità polmonare o pleura 1,2 . L'esposizione a fibre di amianto rappresenta l'80% di tutte le MM, e mentre sono stati introdotti anni fa il divieto di uso di amianto nella maggior parte dei paesi occidentali, il suo uso molto diffuso nella comunità ha lasciato un'eredità letale. L'Organizzazione Mondiale della Sanità ha stimato che 107.000 persone nel mondo muoiono ogni anno per malattie legate all'amianto, con tassi di mortalità continuano ad aumentare. Una nuova ondata di incidenza non professionale è anche emergendo e c'è poca comprensione di quando, ea quale livello questo raggiungerà il picco 3.
La maggior parte delle persone con MM viene diagnosticato tardi, quando la chemioterapia sistemica rappresenta una delle uniche opzioni valide 4. La maggior parte effective la chemioterapia e la corrente 'standard di cura' (pemetrexed in combinazione con cisplatino 5) è stato identificato più di 10 anni fa. Tuttavia il fallimento di questo trattamento è inevitabile e non ci sono provati opzioni della riga di secondo, lasciando i pazienti con una prognosi infausta e la sopravvivenza mediana di soli 12 mesi 2. Pertanto, non vi è un urgente bisogno insoddisfatto per trattamenti più efficaci. Nonostante l'esame di un numero di nuove terapie in studi clinici, nessuno ha portato a cambiamenti nella pratica. Ciò è dovuto in parte al basso (5%) trasferimento dei risultati pre-clinici, generalmente eseguiti in modelli murini xenotrapianto, per l'impostazione della clinica 6-8. Tali modelli non fedelmente ricapitolano i complessi aspetti del microambiente tumorale si verificano in posizioni non fisiologiche, spesso in assenza di un sistema immunitario funzionante 9.
Modelli ortotopici singenico creare un ambiente tumorale significativamente più realistico rispetto alla commonly usato modelli di xenotrapianto sottocutanei come i tumori si verificano nella posizione fisiologica corretta con un intatto 10,11 sistema immunitario. Le maggiori dimensioni del ratto esalta il suo uso come un modello di malattia roditore, soprattutto negli studi di droga in cui il sangue di serie trae sono necessari per valutare la risposta al trattamento e la tossicità 12. Inoltre, in modelli in cui il monitoraggio della progressione della malattia è difficile a causa della posizione dei tumori (come nella cavità pleurica), la possibilità di monitorare la progressione della malattia utilizzando fattori trovati in circolo è estremamente attraente. La generazione di un modello ortotopico singenici del mesotelioma pleurico utilizzando ratti immuno-competenti è descritto. Inoltre, un metodo semplice e relativamente non invasivo per monitorare la progressione della malattia pleurica misurando circolanti cellule immunitarie è anche descritto.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le procedure che coinvolgono gli animali sono stati eseguiti in conformità alle raccomandazioni del Codice di condotta australiano per la cura e l'uso di animali a scopi scientifici. Il protocollo per questo studio è stato approvato dal ospedale cura degli animali e Comitato Etico Royal North Shore. Femmina ratti Fischer 344 (F344, 150-200 g) sono stati mantenuti presso l'impianto di Kearns, Kolling Istituto in condizioni standard (cicli giorno / notte 12 ore di luce e il libero accesso a cibo e acqua).
Nota: Un diagramma di flusso per tutte le procedure sperimentali è presentato in Figura 1.
1. Preparazione di cellule per l'impianto
- Culture mesotelioma rat II-45 linea cellulare (noto anche come IL-45; derivato dall'introduzione peritoneale di amianto crocidolite) in RPMI 1640 (RPMI) supporto integrato con 10% di siero fetale bovino (FBS) e crescere in condizioni standard (37 ° C incubatore umidificato con 5% di CO 2). Maintain da passaging e sub-coltura di circa 01:50 due volte alla settimana in un pallone 75 cm 2.
- Preparare i reagenti per la coltura cellulare e delle aliquote caldo a 37 ° C. Reagenti necessari sono i media siero libero RPMI (SFM), RPMI con 10% FBS, tampone fosfato salino (PBS) e 0,5% tripsina-EDTA.
- Celle di coltura per l'impianto a circa il 70-80% di confluenza. Questo assicura che siano in fase di crescita lineare.
- Celle di raccolta scartando media, lavare una volta con 5 ml di PBS sterile e quindi aggiungendo 3 ml di 0,5% tripsina-EDTA.
- Fiaschi Rientro in incubatrice per circa 5 minuti fino a quando tutte le cellule diventano non-aderenti.
- Una volta che le cellule non sono aderenti, aggiungere 3 ml di RPMI con 10% FBS per inattivare la tripsina. Raccogliere e cellule centrifugare a 300 xg per 3 min.
- Lavare il pellet cellulare in 10 ml di SFM e centrifugare di nuovo a 300 xg per 3 min.
- Pellet Lavare nuovamente con 10 ml di gestione sostenibile delle foreste e centrifugare come sopra.
- Risospendere le cellule in 10 ml di SFM ed eseguire una conta di cellule utilizzando un emocitometro o strumentazione simile.
- Diluire le cellule in modo che il 100 microlitri contiene la quantità di cellule da impiantare.
Nota: La crescita tumorale è stata dimostrata alla dose partire da 100 cellule in 100 microlitri ma una dose standard è di 500.000 cellule in 100 microlitri. - Preparare cellule sufficiente in mezzi per il numero di ratti da impiantare (cioè, 100 microlitri / ratto), più almeno 0,5 ml extra per compensare le perdite di innesco e il volume morto dell'ago.
- Preparare sufficiente SFM (senza celle) da impiantare in ratti di controllo (ad esempio, 100 l / ratto), maggiorato di almeno 0,5 ml in più.
Nota: Le celle e SFM sono ora pronti per l'impianto. Essi dovrebbero essere tenuti a 37 ° C e impiantati in 2 ore di raccolta per mantenere la vitalità.
2. In vivo impianto di cellule
- Posizionare il ratto F344 (> 13 settimane di età) nella camera di induzione e anestetizzare con l'1,4% inalazione isoflurano (o il metodo in uso nella struttura). Una volta che il topo sembra essere mossa addormentato dalla camera di un cono (con 1,4% isoflurano scorre), posizionarlo sul dorso con petto rivolto verso l'alto (vista ventrale). Ciò permette gli organi interni di stabilirsi lontano dalla cavità toracica. Controllare riflessi secondo protocolli istituzionali per garantire il ratto è completamente anestetizzato.
- Shave il diritto regio costalis (petto) zona per rimuovere il pelo.
- Pulire la zona rasata con l'80% v / v di etanolo.
- Identificare il sito di iniezione: a destra, trova il 2 ° ghiandola partire cranica. Il sito di iniezione è di 0,5 cm dalla presente, tra il 3 ° e 4 ° costola dalla fine caudale della gabbia toracica. (Figura 2A).
- Mescolare delicatamente le cellule II-45 per sospendere di nuovo. Disegnare lentamente la sospensione cellulare (o SFM per ratti di controllo) in un 1 ml &# 160; siringa senza ago inserito. Se l'ago è fissato per l'elaborazione di cellule vi è la possibilità per le cellule di crescere lungo la linea di iniezione ago. Collegare un 23G x 1¼ ago. Prime l'ago e rimuovere eventuali bolle d'aria.
- Una volta che la siringa e l'ago sono pronti, inserire lungo a 20 mm e 5 mm di diametro distanziale sull'albero ago. Questo è utilizzato per evitare che l'ago penetri troppo in profondità nella cavità pleurica durante l'iniezione. Circa 5 mm-12 mm dell'ago esposto è sufficiente per la penetrazione attraverso le nervature senza ledere organi.
- Lentamente inserire l'ago tra le costole, disegnare di nuovo sulla siringa per assicurare un vaso sanguigno non è stato perforato (sangue dovrebbe apparire nella siringa) iniettare 100 cellule microlitri o SFM. (Figura 2B).
- Rimuovere l'ago e rotolare delicatamente il topo da un lato all'altro per diffondere le cellule nella cavità toracica.
- Posizionare il topo in una gabbia e verificare la presenza di recupero. The ratto dovrebbe essere sveglio entro 1 min e iniziando a muoversi.
- Ripetere l'operazione per ogni ratto con un nuovo ago. Riutilizzo lo stesso ago si tradurrà in crescita cellulare lungo la linea di iniezione dell'ago.
- Monitorare il benessere degli animali quotidiana.
- Eutanasia animali a endpoint eticamente definiti come disciplinato dalla commissione etica animale istituzionale. Gli endpoint etiche per i ratti in questi esperimenti sono stati la perdita di peso superiore al 10% o respiro affannoso.
3. Coda Vena Raccolta di sangue
- Se il sangue deve essere raccolto subito l'impianto post-cellule, mantenere il topo anestetizzato. Se il campionamento del sangue in un altro punto del tempo, anestetizzare il topo con l'1,4% inalazione isoflurano. Controllare riflessi secondo protocolli istituzionali per garantire il ratto è completamente anestetizzato.
- Posizionare il ratto su un lato e individuare una vena della coda laterale.
- Sterilizzare la coda con l'80% di etanolo e l'etichetta di un 0,5 ml di EDTA ctubo ollection.
- Per raccogliere il sangue, avviare sempre alla fine caudale coda (circa un terzo del cammino lungo). Questo permette ulteriori tentativi più vicino alla fine craniale della coda nel caso il primo tentativo non è riuscito. Mai ricampionamento caudalmente come questo può causare un coagulo di sangue.
- Posizionare un 23G x 1 ¼ ago parallelamente alla vena laterale e farlo scorrere in vena con un angolo basso in modo che penetra circa 10 mm (figura 3A).
- Nota: Se la vena è stato perforato con successo sangue sarà visibile alla fine fissaggio dell'ago (Figura 3B).
- Una goccia di sangue si forma sulla coda al sito della puntura. Raccogliere questo sangue con una pipetta e trasferimento nelle etichettati 0,5 ml (o più piccolo) tubo di raccolta EDTA. Per i test delle cellule immunitarie di 25 ml è sufficiente. Applicare una garza con la pressione di perforare sito fino a quando si arresta l'emorragia.
- Flick il tubo di sangue per mescolare il sangue e EDTA a prcoagulazione evento. Mantenere il tempo tra la raccolta del sangue e la miscelazione con l'EDTA più breve possibile per prevenire la coagulazione.
- Quando raccolta di sangue da più ratti negozio campioni EDTA di sangue in un rack a temperatura ambiente fino al momento dell'analisi. Sangue processo in 2 ore di raccolta.
4. Preparazione del campione per immunitario Profiling cellulare applicando il metodo di-Bead
Nota: Questo metodo piattaforma singola si basa sull'utilizzo in commercio tubi di conteggio assoluti che hanno un numero noto di perline per ogni campione. Questi tubi contengono pastiglie liofilizzate che si sciolgono durante la preparazione dei campioni, rilasciando le perline. Le perle sono fluorescente e gating sulla popolazione di sfere, conte assolute può essere calcolato.
- Assicurarsi che il campione di sangue intero EDTA è ben mescolato ponendolo su un miscelatore rotante lento per diversi minuti. Etichettare una provetta di conteggio assoluto per ogni campione. Un pellet contenente le perline dovrebbe essere visibile sotto tegli titolare tallone metallico sul fondo della provetta.
- Trasferire 25 ml di EDTA sangue intero in una provetta di conteggio assoluto etichettati. Il pellet tallone si dissolverà dopo l'aggiunta del sangue.
- Per ogni tubo aggiungere 20 ml di anti-ratto cocktail T / B / Natural Killer (NK), 10 ml di anti-ratto CD8a PE, 10 ml di anti-topo CD4 (dominio 1) FITC e 10 ml di anti-ratto CD45 PE / Cy7 (Figura 4A). Fluorofori sono definiti in Tabella 1.
- Centrifugare brevemente tubo (300 xg) per assicurare gli anticorpi e le cellule sono nella parte inferiore del tubo e non attaccato al lato del tubo. Vortex per miscelare e incubare per 15 minuti a RT.
- Per lisare i globuli rossi aggiungono 400 ml di 10 mM Tris, 0,15 M tampone cloruro di ammonio (pH 7.5) e agitare per mescolare. Lysis è completa quando il campione appare traslucido e non nuvoloso (figure 4B e C). La mancata lisare il campione completamente porterà ad aumentared fondo e falsamente elevati conteggi durante l'analisi mediante citometria a flusso.
5. citometria a flusso Trattamento dei campioni
Nota: eseguire su un colore 4 citofluorimetro.
- Aprire il software in modalità di acquisizione e un nuovo modello con 8 lotti come illustrato nella Figura 5.
- Regolare le impostazioni dello strumento a quelli elencati nella Tabella 1 e impostare cancello R1 (FITC [FL-1] contro APC [FL-4]), figura 5Ai) per contare le perline fluorescenti. Le altre porte non sono importanti in questa fase di acquisizione ma saranno necessari per l'analisi. Il conteggio assoluto sfere utilizzate in questo protocollo contengono coloranti fluorescenti e possono essere rilevati in qualsiasi canale, anche se sono più deboli nel canale blu.
- Utilizzando un campione di sangue di controllo preparato, vortice e poi caricare sul citometro e correre a bassa velocità (12 ml / min) su modalità di configurazione in modo da porte di acquisizione dati può essere regolata.
- Impostare l'acquisizione diraccogliere 10.000 eventi nella porta tallone R1.
- Impostare una cartella per registrare i dati e impostare il numero di file e file di esempio etichetta nel menu di acquisizione.
- Caricare il campione da analizzare sul citometro e impostare la velocità di flusso medio (35 microlitri / min). Eseguire ogni campione alla stessa portata. La portata può essere necessario variare a bassa (12 ml / min) o alto (60 microlitri / min), ma è generalmente appropriata medio. A questo ritmo ci vogliono circa 90 a 120 secondi per acquisire 10.000 eventi tallone per ciascun campione.
- Una volta che il campione è stato caricato guardare i grafici a dispersione per assicurarsi che gli eventi appaiono nella porta tallone R1. Inizialmente ci può essere una certa instabilità nella pressione del campione provocando deriva nelle trame dispersione. Attendere che questo si stabilizzi.
- Una volta stabilizzato, clicca su acquisire e consentire campione per l'esecuzione. Una volta che il citometro ha terminato l'acquisizione di 10.000 eventi tallone nella R1 citometro si fermerà l'acquisizione e salvare tutti i dati.
- Rimuovere il campione e gettare flusso tuessere. Il citometro è ora pronto per il campione successivo. Eseguire tutti i campioni e poi procedere alla modalità di analisi.
6. immunitario Analisi cellulare
Nota: le strategie di gating e algebra booleana vengono utilizzate per definire ogni popolazione cellulare. Booleana è un metodo di analisi logica based che consente più operazioni in un'unica definizione. Il software di analisi del citometro di flusso (ad esempio, BD CellQuest) consente l'utilizzo di booleana. Le equazioni sono usati per rappresentare attivamente per il notevole reattività negativa che assiste nella definizione della cella per identificare più specificamente ciascuna popolazione cellulare. 'Regioni' sono usati per definire una 'porta'. Regioni definiscono uno spazio bidimensionale 2 mentre porte possono essere composti di numerose regioni collegate da operatori algebrici (+, *, -, definito nella tabella 2).
- Passare il software di modalità di analisi. Un modello di analisi dovrebbe essere generato in modo che corrisponda Figura 5 con le trame e cancelli riportati.
- Analizzare ogni singolo file (ad esempio, ogni singolo campione) separatamente. Impostare cancelli R1 fino alla R9 e quindi impostare gli algoritmi per ogni tipo di cellula, come definito nella tabella 2 (mostrato anche in figura 5).
- Utilizzare il contatore statistiche cella per calcolare popolazioni di cellule individuali definiti da cancelli e algoritmi (Tabella 2 e Figura 5). Gli algoritmi regoleranno automaticamente i numeri di cellulari nel contatore statistiche cellulari.
- Calcola sottopopolazioni cellulari utilizzando la seguente equazione:
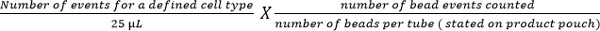
Nota: Numero di eventi cellulari contati (ad esempio, gli eventi di cellule T CD4) viene enumerato utilizzando l'equazione di cui sopra per indicare il numero di cellule per ml di sangue. Esempi sono mostrati in Figura 5.
Access restricted. Please log in or start a trial to view this content.
Risultati
Il metodo usato in questo documento per la generazione di un modello ortotopico di mesotelioma pleurico utilizzando cellule II-45 ha determinato animali soccombono a mesotelioma in tempi riproducibile e rapido, senza ratti morire a causa del metodo di impianto. Titolazione del numero di cellule impiantate determinato che 1x 10 3 cellule era il numero minimo richiesto per modello pienamente penetrante (100% attecchimento). Il diverso numero di cellule impiantate nei ratti cambiato il decorso della malattia sen...
Access restricted. Please log in or start a trial to view this content.
Discussione
Dettagli Questo documento un metodo per la generazione di un ratto singenici modello ortotopico di mesotelioma pleurico e un metodo semplice per monitorare la progressione della malattia attraverso longitudinale prelievo di sangue.
Il modello II-45 è stato sviluppato da esponendo ratti Fischer 344 alle fibre di amianto 13. Anche se questa esposizione rappresenta le vere dinamiche delle interazioni ospite-amianto sistema-immunitario per il mesotelioma patogenesi, ha un ritardo di ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
The syngeneic rat mesothelioma II-45 cell line was a kind gift from A/Prof. Emanuela Felley-Bosco, Zurich University.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| EDTA Collection tube (0.5 ml) | Greiner Bio One GmbH | 450480 | |
| Rat T/B/NK Cell cocktail | BD Pharmingen | 558509 | anti-Rat CD3 APC (IgM clone 1F4), anti-Rat CD45RA Fitc (IgG1 clone OX-33), anti-Rat CD161a PE (IgG1 Clone 10/78) |
| anti-RAT CD8a PE | Biolegend | 200608 | (IgG1vClone G28) |
| anti-Rat CD4 FITC (Domain 1) | Biolegend | 203406 | (IgG1 Clone OX-38) |
| anti-Rat CD45 PE/Cy7 | Biolegend | 202214 | (IgG1 Clone OX-1) |
| TruCount Tubes | Becton Dickinson | 340334 | Box of 50 absolute counting tubes |
| RPMI 1640 media | Life Technologies | 11875-119 | |
| foetal bovine serum (FBS) | Scientifix | FBS500-S (lot# 010101-1) | |
| trypsin-EDTA | Life Technologies | 15400-054 | |
| PBS tablets | Medicago AB | 09-9400-100 | |
| 23Gx1¼ Needle | Becton Dickinson | 302008 | |
| 1 ml Syringe | Becton Dickinson | 302 100 | |
| Fischer 344 Rat | Animal Resources Centre, Perth Australia | F344 | |
| I.S.O (Isoflurane USP) | Veterinary Companys Australia (VCA) | B7058 | |
| II-45 Rat Mesothelioma line | Zurich University | Note: The cell line was given as a gift and is not commercially available at the ATCC | |
| FACSCalibur 4 color | Becton Dickinson | 342975 | |
| TRIS-HCL | SIGMA | T3253 | |
| Ammonium Chloride | SIGMA | 9718 | |
| Anaesthetic Machine (The stinger) | Advanced Anaesthesia specialists | #00449 |
Riferimenti
- Kao, S. C., et al. Malignant mesothelioma. Intern Med J. 40 (11), 742-7450 (2010).
- Zucali, P. A., et al. Advances in the biology of malignant pleural mesothelioma. Cancer Treat Rev. 37 (7), 543-558 (2011).
- Olsen, N. J., et al. Increasing incidence of malignant mesothelioma after exposure to asbestos during home maintenance and renovation. Med J Aust. 195 (5), 271-274 (2011).
- Zucali, P. A., et al. Thymidylate synthase and excision repair cross-complementing group-1 as predictors of responsiveness in mesothelioma patients treated with pemetrexed/carboplatin. Clin Cancer Res. 17 (8), 2581-2590 (2011).
- Vogelzang, N. J., et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol. 21 (14), 2636-2644 (2003).
- Lowenstein, P. R., Castro, M. G. Uncertainty in the translation of preclinical experiments to clinical trials. Why do most phase III clinical trials fail? Curr Gene Ther. 9 (5), 368-374 (2009).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Yakisich, J. S. An Algorithm for the Preclinical Screening of Anticancer Drugs Effective against Brain Tumors. ISRN Pharmacol. 2012, 513580(2012).
- Basu, D., Herlyn, M. Defining microenvironments within mouse models that enhance tumor aggressiveness. Cancer Biol Ther. 8 (4), 380-381 (2009).
- Abolhassani, M., et al. Screening of well-established drugs targeting cancer metabolism: reproducibility of the efficacy of a highly effective drug combination in mice. Invest New Drugs. 4 (4), 1331-1342 (2011).
- Hudson, A. L., et al. Establishing a panel of chemo-resistant mesothelioma models for investigating chemo-resistance and identifying new treatments for mesothelioma. Sci Rep. 4, 6152(2014).
- Iannaccone, P. M., Jacob, H. J. Rats! Dis Model Mech. 2 (5-6), 206-210 (2009).
- Craighead, J. E., et al. Characteristics of tumors and tumor cells cultured from experimental asbestos-induced mesotheliomas in rats. Am J Pathol. 129 (3), 448-462 (1987).
- Hunter, S. D., et al. Lymphocyte subset analysis by Boolean algebra: a phenotypic approach using a cocktail of 5 antibodies and 3 color immunofluorescence. Cytometry. 15 (3), 258-266 (1994).
- Brando, B., et al. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42 (6), 327-346 (2000).
- Schnizlein-Bick, C. T., et al. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Clin Diagn Lab Immunol. 7 (3), 336-343 (2000).
- Gajkowska, A., et al. Flow cytometric enumeration of CD34+ hematopoietic stem and progenitor cells in leukapheresis product and bone marrow for clinical transplantation: a comparison of three methods. Folia Histochem Cytobiol. 44 (1), 53-60 (2006).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Kao, S. C., et al. High blood neutrophil-to-lymphocyte ratio is an indicator of poor prognosis in malignant mesothelioma patients undergoing systemic therapy. Clin Cancer Res. 16 (23), 5805-5813 (2010).
- Kao, S. C., et al. Validation of prognostic factors in malignant pleural mesothelioma: a retrospective analysis of data from patients seeking compensation from the New South Wales dust diseases board. Clin Lung Cancer. 14 (1), 70-77 (2013).
- Burt, B. M., et al. Circulating and tumor-infiltrating myeloid cells predict survival in human pleural mesothelioma. Cancer. 117 (22), 5234-5244 (2011).
- Weir, C., et al. Streptavidin: a novel immunostimulant for the selection and delivery of autologous and syngeneic tumor vaccines. Cancer Immunol Res. 2 (5), 469-479 (2014).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon