Method Article
Misurazione TCR-pMHC Binding
In questo articolo
Riepilogo
This manuscript describes how to conduct (single molecule) Förster Resonance Energy Transfer (FRET)- based assays to measure the binding dynamics between T-cell antigen receptor (TCR) and antigenic peptide-loaded MHC molecules as they occur within the immunological synapse of a T-cell in contact with a functionalized planar supported lipid bilayer.
Abstract
T-cells are remarkably specific and effective when recognizing antigens in the form of peptides embedded in MHC molecules (pMHC) on the surface of Antigen Presenting Cells (APCs). This is despite T-cell antigen receptors (TCRs) exerting usually a moderate affinity (µM range) to antigen when binding is measured in vitro1. In view of the molecular and cellular parameters contributing to T-cell antigen sensitivity, a microscopy-based methodology has been developed as a means to monitor TCR-pMHC binding in situ, as it occurs within the synapse of a live T-cell and an artificial and functionalized glass-supported planar lipid bilayer (SLB), which mimics the cell membrane of an Antigen presenting Cell (APC) 2. Measurements are based on Förster Resonance Energy Transfer (FRET) between a blue- and red-shifted fluorescent dye attached to the TCR and the pMHC. Because the efficiency of FRET is inversely proportional to the sixth power of the inter-dye distance, one can employ FRET signals to visualize synaptic TCR-pMHC binding. The sensitive of the microscopy approach supports detection of single molecule FRET events. This allows to determine the affinity and off-rate of synaptic TCR-pMHC interactions and in turn to interpolate the on-rate of binding. Analogous assays could be applied to measure other receptor-ligand interactions in their native environment.
Introduzione
Una comprensione più fondamentale di come le cellule T riconoscono antigeni richiede guardando al posto giusto, cioè, all'interno della sinapsi immunologica formato tra la cellula T e APC. Qui, cinetica di legame molecolari non solo sono determinate dalle proprietà intrinseche biochimiche dei partner di interazione coinvolti ma dipendono in larga misura parametri cellulari, che includono forze cellulari, architettura membrana e interazioni laterali tra proteine di membrana e vincoli geometrici specifici sinapsi 3. Approcci biochimici sono limitati in potere risolvente quanto richiedono l'interruzione di almeno una delle membrane sinaptiche coinvolte. Per questo motivo una metodologia di imaging basato FRET-è stato sviluppato per monitorare vincolante del TCR di pMHCs antigeniche 2. Qui le cellule T sono decorati con un ricombinante e il sito-specifico etichettati TCRβ-reattiva singola catena frammento di anticorpo (SCF V) e confrontati con il piano ar bistrati di vetro supportato lipidi (SLB), che ospitano MHC di classe II molecole caricate con un peptide antigenico fluorescente, molecole costimolatorie e proteine di adesione. Synaptic vincolante tra dye-marcato TCR e tingere marcati risultati pMHC in FRET, che possono essere monitorati su una massa e livello di singola molecola per fluorescenza a riflessione totale interna (TIRF) microscopia.
In questo articolo viene spiegato in dettaglio come utilizzare SLB per saggiare le sinapsi delle cellule T, verificare la loro integrità attraverso un cellule T saggio di calcio-flux funzionale, condotta FRET misurazioni in massa e con sensibilità singola molecola, e analizzare i dati acquisiti. Le raccomandazioni sono offerti per la produzione di proteine adeguatamente conformati necessarie per doppio strato funzionalizzazione. Per informazioni più specifiche per quanto riguarda la formazione di doppio strato e l'installazione di un microscopio TIRF adatto prega di fare riferimento a un accesso pubblico JoVE aggiuntivo di pubblicazione pubblicato back to back 4.
tenda "> Natura di SLBSLB Functionalizable possono essere facilmente generati dalle vescicole unilamellari (SUV) che contengono le due lipidi 1-palmitoil-2-oleoyl-sn-gylcero-3-fosfocolina (breve: POPC, 90-99%) e sn 1,2-dioleoyl- - glycero-3 - {[N (5-ammino-1-carbossipentil) iminodiacetico acido] succinil} (breve: DGS NTA-Ni, 1-10%). SUV sparsi su vetrini puliti per formare una contigua planare doppio strato 4. DGS-NTA-Ni serve ad ancorare le proteine polyhistidine-tag tramite complesso-formazione polyhistidine mediata con il sintetico NTA-Ni-gruppo contenente testa (Figura 1A). Per stabile associazione uno tipicamente sostituisce il dominio transmembrana e la coda citoplasmatica nativo della proteina di adesione ICAM-1 e la molecola di costimolazione B7-1 con un tag contenente dodici istidine (ICAM-1-12H, -12H B7-1) (Figura 1B) . La classe II molecola IE k peptide-caricato contiene due catena polipeptidica membrana-embedded (α e β)S. I transmembrana / domini citoplasmatici di entrambe le catene devono essere sostituiti con un tag contenente sei istidine ogni (IE k α β 6H 6H o IE k -2x6H). In alternativa, estendendo la α-catena con dodici istidine e lasciando il dominio extracellulare del β-chain untagged (dando luogo a IE k α β 12H 0H o IE k -12H) dà luogo a risultati soddisfacenti (Figura 1B).
Etichettatura site-specific di pMHCs
E 'importante per etichettare il pMHC stechiometricamente e sito-specifico per essere in grado di convertire i rendimenti misurati FRET in vincolante equilibrio costanti significative. Ciò può essere ottenuto mediante l'etichettatura chimica di un peptide sintetico che viene caricata nella fessura-peptide di legame di istidina-marcato ricombinante MHC di classe II molecole 2,5. Il peptide comprende tutti i residui del epitopo T-cellulare come well come una breve C-terminale linker (GGS), seguita da cisteina (ad esempio nel falena citocromo c (MCC) peptide ANERADLIAYLKQATK- GTECH, il linker è segnato in grassetto). Questo cisteina viene utilizzato per etichettare il peptide stechiometricamente con l'uso di derivati maleimide-dye. A questo punto particolare attenzione dovrebbe essere dedicata alla verifica dye accoppiamento quantitativa al peptide-cisteina contenenti. HPLC-purificazione della addotto peptide-dye è raccomandata e deve essere seguita da spettrometria di massa Elettrospray. Eventuali masse registrate corrispondenti al reagente peptide (senza tintura) riflettono l'etichettatura incompleta. Se questo è vero, il peptide-HPLC purificato deve essere sottoposto a turni consecutivi di colorante etichettatura fino a quando l'etichettatura è considerata quantitativa. Si noti che la spettroscopia di massa MALDI-TOF deve essere evitata in quanto questo metodo comporta la radiazione laser per il campione di ionizzazione. Questo trattamento disintegra fluorofori sensibili collegate prima messa peptide viene letto e quindi underrepre gradi senta di dye-coniugazione.
Etichettatura indiretta ma site-specific di TCR cellule legato con l'utilizzo di monovalente singola catena frammenti F V
E 'ancora difficile da collegare tinture per cellulare proteine di superficie associato di cellule viventi in modo site-specific. Per superare questo ostacolo per TCR-superficie esposta, una versione monovalente singola catena (SCF V) dai geni del TCRβ -reactive anticorpo monoclonale H57-197 2 è stato costruito. La struttura cristallina di questo anticorpo in complesso con il TCR permette di progettare razionalmente una versione, in cui un residuo di serina in prossimità del C-terminale del peptide associato MHC (cui è collegato il corrispondente partner di tintura FRET) è sostituito con un residuo di cisteina. Questo mutante cisteina serve poi come accettore per tinture coniugazione (Figura 2).
Metodologie di registrare FRET
nt "> valori FRET Bulk sono più adatti a verificare il rapporto tra scelte distanze inter-dye e FRET efficienza misurati in questo TCR-pMHC sistema 2 vincolante. Inoltre, le misure di FRET rinfusa rivelano differenze qualitative e quantitative in sinaptiche affinità TCR-pMHC ( vedere di seguito e la sezione protocollo 3.2). Vari approcci per quantificare l'efficienza FRET sono stati introdotti nella letteratura 6. In questo articolo viene registrata tramite FRET(a) recupero del donatore dopo accettore candeggio, e via
(b) sensibilizzati FRET emissione accettante.
Il primo metodo (a) richiede l'uso di un accettore FRET facilmente fotodecolorate, e un donatore, che è piuttosto fotostabile. Inoltre, è importante garantire che l'accettore fotodecolorate non è più in grado di tempra fluorescenza del donatore. Come lo stesso canale di rilevamento (donatore) è usato per la quantificazione, senza fattori di correzione di und senza aberrazioni cromatiche devono essere considerati, che rende questa metodologia semplice ed affidabile. Tuttavia, le misure quantitative non possono essere ripetuti nello stesso punto del campione e le variazioni di FRET non possono essere registrati nel corso del tempo. Per evitare effetti causati dalla diffusione molecolare o motilità cellulare un passo sbiancamento veloce dovrebbe mirare per, che riduce al minimo il tempo che passa tra il primo donatore FRET (prima accettore sbiancamento) e la seconda acquisizione immagine FRET donatore (dopo FRET accettore candeggio). Si raccomanda di utilizzare una potente fonte di luce laser del FRET accettore di eccitazione lunghezza d'onda al fine di minimizzare illuminazione e sbiancanti volte.
Al contrario, nel metodo di misura sensibilizzata emissione FRET (b) il donatore FRET è eccitato e l'emissione del accettore FRET è osservata nel canale FRET accettore. Le variazioni di segnale accettore FRET possono essere registrate nel tempo, ma di emissione del donatore FRET nel canale accettore rosso-spostato (termed bleedthrough) e FRET accettore cross-eccitazione tramite eccitazione del donatore devono essere determinati con precisione e sottratto dal canale accettore FRET registrato. Per questo i corrispondenti FRET donatore e ti agiti immagini accettore devono essere spazialmente allineati.
Rilevamento di singola molecola (sm) FRET eventi
Con l'uso di laser come sorgente di eccitazione, una macchina fotografica sensibile e microscopia TIRF rumore attenuato la fluorescenza di fluorofori singoli sia facilmente rintracciabile nel tempo. Simile è vero per la rilevazione di eventi smFRET intermolecolari. Tuttavia, le complicanze possono essere causati da bleedthrough donatore FRET e cross-eccitazione del accettore FRET, e, quindi, grande attenzione deve essere presa durante la regolazione delle densità fluoroforo nell'esperimento smFRET.
Nel protocollo di seguito (sezione del protocollo 4) il TCR è stato scelto come FRET donatore in alta abbondanza e pMHC come accettore FRET in condizioni di scarsa abbondanza. Per attenuare FRET donatore bleedthrough sufficientemente, decorare 10-30% dei TCR con SCF fluorescenti V e 90-70% dei TCR con SCF non fluorescente V. Qui il canale accettore FRET è stato scelto come canale di singola molecola, perché è confocale con la singola molecola FRET canale. Questo aiuta ad allineare eventi smFRET con singola molecola FRET accettori, che è alla base della convalida smFRET.
Estrazione off-tariffe sinaptiche attraverso misure smFRET
Photobleaching sia FRET donatore e accettore FRET devono essere contabilizzate quando si estrae l'emivita di interazioni di singola molecola FRET tracce. Il numero di FRET-segnali osservabili all'inizio del loro aspetto come singola coppia donatore-accettore N (0) si riduce nel tempo sia unbinding del photobleaching complesso e del recettore-ligando. Il numero di sopravvivere complessi in un dato momento N (t) può essere matematicamente espresso come segue:

Nel termine photobleaching exp (-t / τ candeggina) il tempo t è descritta dal prodotto del numero di osservazioni n e il tempo t illuminazione malato a causa della, modalità di osservazione discreta non continuo (cioè, sbiancamento si verifica solo durante illuminazione ). All'interno exp- cinetica termine (t / τ off) il tempo t è il prodotto del numero di osservazioni e n t ritardo per una singola osservazione FRET (cioè, unbinding cinetica accade continuamente). Equazione 1 può essere espresso come:
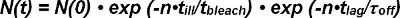
Il τ termine candeggina / τ ill describes il numero di osservazioni finché non si verifica sbianca ed è definito come il valore atteso candeggiare> della sua funzione esponenziale. Equazione 2 può essere semplificata come segue:

Il valore di aspettazione ritardo)> il numero di frame N (t) con osservabili FRET-eventi dopo il tempo t è determinata direttamente dall'esperimento. Dipende dal tempo impostabile tra osservazioni (t lag) scelti per l'esperimento ei valori sconosciute per τ off (l'inverso del off-rate k off) e candeggiare>, il valore di aspettazione di numero di osservazioni prima che si verifichi lo sbiancamento .
Pertanto, il calcolo del valore atteso lag)> per almeno due valori di t ritardo permette la determinazione sperimentale di candeggina> e T si spegne.
Estrazione valori sinaptici 2D-K D attraverso misurazioni basate FRET-
Misurazione TCR occupazione una, vale a dire il rapporto tra TCR legati e TCR totale, è fondamentale per la determinazione dei valori sinaptiche 2D-K D. Secondo l'equazione 4 questo termine è direttamente proporzionale alla misurata FRET cedere finché TCR serve come donatori FRET e pMHCs come accettori FRET.

con una capienza = TCR, C = fattore di conversione
C è una costante che dipende dal sistema FRET e fluorofori utilizzati. Può essere determinato sperimentalmente come mostrato di seguito. A può essere convertito in un 2D-K D secondo l'equazione 5 quando ildensità iniziale di ligandi TCR prima dell'aggiunta di cellule T a doppio strato è noto. Questo è a causa della elevata mobilità delle proteine SLB iscritti e anche perché SLB fornire un serbatoio quasi inesauribile di ligandi 2.

con [iniziale pMHC] = densità iniziale pMHC prima dell'aggiunta di cellule T
Con le equazioni 4 e 5 si può ora facilmente determinare il sinaptica 2D-K D tra TCR e pMHC. Questo è più affidabile fatto con le misure di FRET basati sul recupero dei donatori dopo accettore sbiancamento (vedi paragrafo 3.1 del protocollo).
Tuttavia, per misurare C il rapporto tra l'intensità FRET I Fret (corretto per lo sfondo, bleedthrough donatore FRET e FRET accettore cross-eccitazione) e TCR occupazione una deve essere determinato. Per questo, unoha bisogno di conoscere il rapporto R tra l'intensità media di fluorescenza di fluorofori singoli TCR-associati FRET donatore (ad esempio Cy3 o AF555) sm Mi struggo donatore e l'intensità media di singola molecola Fret eventi sm I tasto. R dipende dal sistema FRET in questione, e filtri di emissione telecamera utilizzato per il rilevamento della fluorescenza.
Il TCR occupazione a può poi essere determinata direttamente secondo l'equazione 6.

R = sm Mi struggo donatore / sm I Fret
R è stato determinato come 1,45 per il sistema H57 scFv- Cy3 / pMHC-Cy5 porta a:
a = massa Mi struggo / bulk I TCR-Cy3 • 1.45
Il rapporto tra l'occupazione e TCR un rendimento FRET può essere determinata FRET donatore recuperarey dopo accettore sbiancamento. Per questo entrambi i parametri sono tracciati uno contro l'altro per un numero TCR microcluster come mostrato nella Figura 4A .La pendenza della regressione lineare indica il fattore di conversione C (dall'equazione 4).
Come mostrato nella Figura 4A, C equivale per (a) V H57 scf - Cy3 / Cy5 pMHC-sistema FRET e (b) la configurazione del sistema microscopio applicato a 1.995. Il TCR occupazione a può essere facilmente dedurre come segue:
Occupazione TCR a = FRET cedere • 1.995
Protocollo
1. Produzione Proteine
1.1. Bilayer residente proteine: B7-1, ICAM-1, pMHC (ad esempio, IE k / peptide)
- -12H B7-1, ICAM-1-12H
- B7-1-12H Express e costrutti ICAM-1-12H in elevate quantità le proteine secrete native che utilizzano un sistema di espressione baculovirus.
- Purificare proteine da sovranatanti tramite cromatografia di affinità Ni-NTA, seguita da MonoQ cromatografia a scambio anionico e S200 cromatografia ad esclusione dimensioni.
- Etichettare una aliquota della proteina purificata con coloranti ammina reattiva come il NHS preparati succinimidyl-estere di Alexa Fluor 488 (o FITC), Alexa Fluor 555 (o Cy3), Alexa Fluor 647 (o Cy5).
- Dopo S200 cromatografia di esclusione dimensione determinare il grado etichettatura delle proteine monomeriche conformemente alle specifiche tecniche di tintura del costruttore il confrontando la assorbimento delle proteine a 280 nm e l'assorbimento della tintura a 488 nm (Alexa Fluor 488, CIC), 555 o 552 nm(Alexa Fluor 555 o Cy3) o 647 nm (Alexa Fluor 647 o Cy5).
Nota: Questo rapporto sarà successivamente necessaria per determinare la densità proteina sulla SLB dal segnale di fluorescenza massa della proteina marcata con colorante. - Conservare le proteine non etichettati e fluoroforo marcato a -20 ° C in PBS più il 50% di glicerolo.
- pMHC (qui: IE k -2x6H o IE k -12H)
- Ripiegare MHC classe II da corpi di inclusione espresse in E.coli in presenza di un molto più economico sostituto peptide UV-scindibile, che può successivamente essere quantitativamente scambiato con un fluoroforo peptide coniugato di scelta 5, 7.
- Purificare ripiegò complessi pMHC con tecniche standard (cromatografia Ni-NTA-affinità, MonoQ cromatografia a scambio anionico, filtrazione gel S200).
- Sostituire il peptide cleavable UV con peptide fluorescente 5, 7.
- Purificare fluorescente monomerico pMHC complessi finalmente per gel filtrazione S200. Un cromatogramma rappresentativo è mostrato in figura 3.
- Verifica quantitativa peptide caricamento mediante spettrofotometria.
- Conservare proteine a -20 ° C in PBS / 50% glicerolo.
1.2. Generazione di frammenti singola catena di anticorpi (SCF V s), l'introduzione di cisteine per l'etichettatura site-specific
- Ripiegare SCF V s da corpi di inclusione espresse in E.coli. Qui un protocollo ideato da Tsumoto e colleghi 8 è seguito in cui corpi di inclusione vengono dapprima dipana nella 6 M di cloruro di guanidinio, completamente ridotto e poi ripiegata nel corso di una settimana gradualmente diminuendo la concentrazione del cloruro di guanidinio-proteina svolgimento.
- Concentrato correttamente piegato SCF V utilizzando unità filtranti molecolari con un cut-off molecolare di 10 KDa.
- Purificare il concentrato mediante gel filtrazione S200.
- Etichetta monomerico SCF V in presenza di 0,05 mM tris (2-carbossietil) fosfina (TCEP) con Alexa Fluor 647 immediatamente dopo la purificazione. Eseguire la reazione di marcatura meglio ad un rapporto molare di proteine: tintura di non più di 1: 2 a temperatura ambiente per non più di 2 ore.
Nota: TCEP è un agente di riduzione fosforo based e non reagisce con maleimmidi a queste concentrazioni 9. Può quindi essere presente durante la reazione di marcatura mantenere il gruppo sulfidrilico spaiato ridotta fino reagisce con il derivato colorante maleimmide. - Purificare etichettato monomerico SCF V infine tramite gel filtrazione S75. Un cromatogramma rappresentativo è mostrato in figura 3.
- Determinare il colorante: rapporto di proteine spettrofotometricamente.
- Conservare proteine a -20 ° C in PBS / 50% glicerolo.
2. Misure di calcio Flux
- Prendere una fiala fresco contenente 50 mg fura-2-AM e scioglierlo in 50 microlitri DMSO privo di acqua.
- Spin down 10 6 T-cellule in una provetta a fondo rotondo 5 ml in polipropilene per 2 min a 250-400 g.
- Risospendere le cellule T in media di imaging 200 ml contenente la soluzione di Hank salina bilanciata più calcio / magnesio e 1% ovoalbumina a temperatura ambiente, aggiungere 1 ml di soluzione madre-AM fura-2 (diluizione 1: 200), mescolare la sospensione cellulare e incubare a temperatura ambiente per 30 min.
- Lavare le cellule T, una volta in un tampone di imaging. Per questo, riempire il tubo contenente le cellule con tampone di imaging a temperatura ambiente e agglomerare le cellule, come descritto al punto 2. Rimuovere il surnatante e risospendere il pellet cellulare in 200 microlitri di buffer di immagini (ad esempio, ad una densità cellulare finale di 5 x 10 6 cellule ml -1). Le celle possono essere utilizzati immediatamente per misure di calcio o conservati in ghiaccio fino a 3 ore.
- Cellule posto su una SLB funzionalizzato in tampone per immagini (37 ° C). Appena T-cellule iniziano contattare la SLB, acquisire la seguente serie di immagini ogni 15 a 30 sec per 30 min:
excitation a 340 +/- 5 nm, la rilevazione delle emissioni a 510 +/- 40 nm
eccitazione a 380 +/- 5 nm, la rilevazione delle emissioni a 510 +/- 40 nm
DIC (facoltativo)
Nota: i tempi di esposizione rispettivi dipendono dall'intensità della sorgente di luce di eccitazione. Risultati soddisfacenti si ottengono quando le intensità dei pixel di 340 nm (380 nm) ammontano canale a circa un quarto (una metà) del valore di intensità massimo possibile. Tenete a mente che i valori fura-2 eccitato a 340 nm aumenteranno e quelli eccitati a 380 nm diminuiranno dopo l'attivazione delle cellule T. - 20-25 min in corsa, aggiungere 50-100 microlitri di anticorpo preriscaldata anti-pMHC bloccaggio ad una concentrazione finale di 20-50 mg ml -1. L'anticorpo satura tutti pMHCs e di conseguenza le cellule T cesserà di riconoscere l'antigene e fermare fluxing calcio. Continuare la registrazione di immagini per altri 5 -. 10 min di acquisire la base della concentrazione intracellulare di calcio, che corrisponde allo stato non attivato delle cellule T < / li>
- Determinare il segnale medio fluorescenza di fondo a 340 nm e 380 nm di eccitazione entro una regione di interesse di almeno 1000 pixel, che non contiene cellule. Background-sottrarre tutti misurati fura 2-immagini eccitati a 340 nm e 380 nm e 340 nm calcolare / 380 rapporti di intensità nm di singole cellule o gruppi di cellule. Normalizza rapporti di intensità dividendo tutti i rapporti attraverso il rapporto dei cinque telai ultima volta (cioè, con completa anticorpi blocco della pMHC).
- Trama normalizzato Fura-2 rapporti contro il tempo. Nota: Quando le cellule e bistrati sono in buone condizioni, nm / 380 rapporti di intensità nm Fura-2 340 adottare valori tipicamente tra 2 e 5, 15-45 secondi dopo che le cellule hanno preso contatto con il doppio strato. Rapporti poi scendono a un valore compreso tra 1,6 e 2, dove rimangono costanti per almeno 20 minuti o più. I valori dovrebbero scendere a 1 solo dopo l'aggiunta di anticorpi anti-pMHC. Un esempio tipico è mostrato in Figura 5.
3.1. Decorazione TCR con il H57scF V
- Spin down 10 6 T-cellule in una provetta a fondo rotondo 5 ml in polipropilene per 2 min a 250-400 g.
- Decantare i media, film il pellet delicatamente e aggiungere 0,3 ml di SCF V (concentrazione ~ 1 mg / ml) alla sospensione cellulare. Per massa FRET misure impiegano solo Dye-etichettati scFv. Per singola molecola FRET misure utilizzano un mix di non marcato scFv (da 5 a 9 parti, non contiene cisteina spaiati) e Dye-etichettati scFv (1 parte, contiene una spaiato cisteina dye-coupled).
- Incubare le cellule in ghiaccio per 15 minuti e lavare le cellule due volte attraverso successive centrifugazione utilizzando tampone di imaging ghiacciato.
Nota: Le celle possono essere memorizzati su ghiaccio senza significativa perdita di SCF legato V (t 1/2 di SCF V dissociazione a 0 ° C ~ 4 ore 2). La purezza delle cellule T primarie derivate da TCR-transgenici (e facoltativamente anche Rag-1/2 carente topo) e stimolati in vitro è superiore al 98% in quanto le cellule T sono le uniche cellule proliferanti (fino a 7 divisioni cellulari) in risposta al peptide, che è stato aggiunto per la stimolazione alla cultura T-cellule. B-cellule vanno incontro ad apoptosi e non sono più in vita dopo 7-10 giorni di coltivazione. Poche cellule dendritiche sopravvivono ancora possono essere facilmente discriminati non solo a causa della loro morfologia distinta, ma anche perché non legano l'anti-TCR beta scFv frammento H57.
3.2. FRET misurazione tramite recupero donatore dopo accettore candeggio
Nota: Tenere presente che il tempo di dimezzamento di complessi TCR-H57 SCF V è pari a 4 ore sul ghiaccio, a 50 min a 22,5 ° C e di 6,8 minuti a 37 ° C (e di circa 4 ore in ghiaccio) 2. Finché il H57 SCF V funge da donatore FRET, rese FRET misurati non sono sensibili a H57 SCF V dissociazione, tuttavia, il rapporto segnale-rumore aumentacon un aumento di dissociazione H57.
- Preparare una SLB contenente AF647 / pMHCs Cy5-etichettati così come senza etichetta ICAM-1 e B7 secondo Axmann et al. 4.
- Sostituire il PBS della camera di imaging con mezzo di imaging contenente soluzione salina bilanciata con calcio / magnesio e 1% ovalbumina di Hank. Per questo pipetta 400 ml di buffer di immagini nel pozzo, si mescola accuratamente e rimuovere 400 microlitri dal pozzo. Ripetere questa procedura 3-4 volte. Non esporre il SLB all'aria in qualsiasi momento.
- Posizionare la camera di imaging sul palco microscopio e regolare la messa a fuoco fino a quando la fluorescenza (AF647, Cy5) SLB entra in vista chiara.
- Impostare illuminazione TIRF traducendo il fascio focalizzato paralleli all'asse ottico alla periferia del piano focale della oggettiva mediante spostamento di fase traslazionale del periscopio.
- Per ottimizzare i raggi laser di eccitazione in modalità TIRF, aggiungere le cellule T decorate con AF555 / Cy3 etichettato SCF V e far loro depositano sul SLB. Nota: Condizioni per illuminazione TIRF sono soddisfatte quando la membrana cellulare basale è a fuoco oltre al SLB e altre parti della cellula entrerà in vista quando concentrandosi verso l'alto. Tuttavia, se TIRF non è regolato correttamente, parti della membrana plasmatica delle cellule T fluorescente, che non sono in contatto con la SLB, apparirà come un anello. Se questo è il caso, la regolazione del fascio laser con fase traslazionale del periscopio fino ad ottenere l'illuminazione TIRF.
- Acquisire i seguenti sei immagini nell'ordine indicato e in rapida successione (Figura 6):
(i1, opzionale) luce bianca, per scattare una fotografia della cella,
(i2, opzionale) 647 nm di eccitazione (bassa potenza) per scattare un'immagine del accettore FRET (pMHC) prima dell'impulso di candeggina,
(i3) 514 nm di eccitazione (bassa potenza) per prendere l'immagine del donatore FRET (TCR) prima dell'impulso di candeggina,
(i4) 647 nm di eccitazione (alto potere) per foto-bleach accettore FRET, /> (I5) 514 nm di eccitazione (bassa potenza) per scattare una foto del donatore FRET (TCR) a seguito dell'impulso di candeggina,
(i6) 647 nm di eccitazione (bassa potenza) per verificare completa sbiancamento FRET accettante. - Mantenere il tempo trascorso tra le immagini (i3) e (i5) il più breve possibile per essere in grado di correlare le immagini per una successiva analisi. Mantenere FRET sbiancamento donatore al minimo impiegando l'eccitazione al livello più basso possibile di potenza, che consente ancora per una corretta l'imaging delle cellule T.
- Scegliere una regione di interesse (ROI), ad esempio, un intero sinapsi o un individuo microcluster TCR, determinare la sua intensità media (i3) (= I (3)) e in (i5) (= I (5)). Per sottrazione dello sfondo, scegliere un ROI della stessa dimensione di fuori del punto di illuminazione in (3) o (5) e determinare la sua intensità media (I (background)). Per determinare il rendimento FRET eseguire la seguente operazione:
g "/> (equazione 7)
Nota: Si deve notare che, in relazione al livello di FRET assoluto, può essere necessario per correggere candeggio donatore tra le immagini (i5) e (i3).
3.3. FRET misurazione tramite emissione sensibilizzata
- Eseguire donatore spaziale e allineamento canale accettore con l'uso di perline multicolori, che fluorescenti in tutti i canali di emissione. Lo spostamento spaziale tra i due canali a causa di aberrazione cromatica può essere determinata da singoli perle super posizionamento e deve essere applicato per la correzione di uno dei due canali per tutti i seguenti 2 colori immagine coppie 10.
- Determinare il grado di bleedthrough donatore con l'uso di un SLB contenente fluoroforo donatore FRET solo. E 'anche fattibile utilizzare cellule T FRET-donatore etichettati su un doppio strato lipidico con etichetta pMHC. Sfondo è determinato in primo luogo al di fuori del campo illuminato di vista e poi sottratto da entrambi i canali. In questo modo il ba media intensità SFONDO corretta di due corrispondenti ROI (canale donatore io e io accettatore di canale) sono determinati. Calcolare il coefficiente bleedthrough (BTC) come segue:
 (Equazione 8)
(Equazione 8)
Nota: Questo BTC è una costante per un certo colorante e set di filtri-combinazione. - Calcola l'immagine bleedthrough donatore FRET come segue:
 (equazione 9)
(equazione 9) - Determinare accettore cross-eccitazione eccitando una SLB contenente il fluoroforo FRET accettore solo (ad esempio, IE k / MCC-Alexa Fluor 647) prima con FRET luce di eccitazione del donatore (ad es., 514 nm) e poi con accettatore di luce di eccitazione (ad esempio, 647 nm). Utilizzare immagini di sfondo sottratto all'interno del canale FRET accettore per calcolare il coefficiente di cross-eccitazione (CEC) come segue:
ftp_upload / 53157 / 53157eq10.jpg "/> (equazione 10) - Come la CEC dipende dall'intensità laser utilizzato per l'eccitazione del donatore, determinare su ogni giorno di misurazione. Utilizzare il CEC risultante per calcolare l'immagine esclusivamente generata attraverso il cross-eccitazione.
 (equazione 11)
(equazione 11) - Calcola l'immagine FRET corretta per bleedthrough e cross-eccitazione come segue:
 (equazione 12)
(equazione 12)
Nota: il segnale FRET assoluto (ma non la resa FRET relativa) è sensibile alla dissociazione della H57 SCF V da membrane delle cellule T TCR bound. Per evitare la perdita eccessiva della sonda TCR-FRET, lo scopo di effettuare misurazioni a 37 ° C entro i primi 2 minuti dopo l'aggiunta delle cellule T a doppio strato. Misure con quantitativa (≥ 95%) etichettatura TCR sono possibili solo pari o inferiore a 22,5 ° C entro i primi 3 minuti dopoaggiunta di cellule T a doppio strato.
4. singola molecola FRET Misure
- Regolare la potenza di entrambi i laser per dare luogo ad un'intensità di 1-5 kW / micron 2 al campione. Per maggiori informazioni consultare Axmann et al. 4.
- Label cellule T come descritto sopra, con un mix di non marcato SCF V (5-9 parti) e Cy3 / AF555 marcato SCF V (1 parte). Nota: In questo modo solo una frazione del TCR è contrassegnato con il FRET-donatore. Questo riduce il numero di interazioni rilevabili, ma il rumore generato da bleedthrough donatore è anche diminuito in modo significativo (di circa il 5 1/2 a 10 1/2), che è fondamentale per la risoluzione individuale singola molecola FRET eventi.
Nota: La dissociazione della sonda H57 scFv dal TCR non influenza le misurazioni, come avviene in un intervallo di tempo molto più grande (minuti ad ore) che la dissociazione del TCR da SLB-bound pMHC (inferiori al secondo al secondogamma). - Inserire un SLB con pMHCs AF647 marcato così come ICAM e B7 sul palco microscopio e regolare la messa a fuoco in modo che il doppio strato entra in vista chiara.
- Opzionale: Inserire un diaframma a fessura nel pathway di eccitazione (come mostrato in Axmann et al. 4) per mascherare la maggioranza del campo dell'illuminazione tranne sinapsi. In questo modo greggi IE k / MCC (C) -Alexa Fluor 647 FRET molecole accettori possono muoversi nella zona di illuminazione.
- Aggiungere cellule T decorate H57 SCF V a doppio strato (con tampone di imaging), e attendere che le sinapsi appaiono nel campo visivo.
- Prendere in rapida successione una sequenza di 10 a 20 insiemi di immagine utilizzando il rilevamento 2 colori:
i1) di eccitazione 514 nm
i2) di eccitazione 647 nm - Esporre immagini da 1 a 5 msec e acquisire un insieme di immagini.
- Per valutare l'identità di singola molecola FRET eventi, applicare la stessa correzione per quanto riguarda bleedthrough donatore e accettore cross-eccitazione. Inoltre, singola molecola FRET eventi devono allinearsi con singole molecole accettori e dovrebbero apparire e scomparire in un solo passaggio (vedi anche figura 7).
- Off-rate determinazione
- Tracce record di singola molecola FRET eventi per diversi intervalli di tempo di acquisizione.
Nota: In questo esempio (in corsivo) off-rate tra il 5c.c7 TCR e IE k / K3 è misurata a 25 ° C con quattro differenti tempi di ritardo (42 msec, 490 msec, 1.007 msec, 1.989 msec). - Elenco FRET tracce in base alle loro lunghezze di traccia, come indicato nella tabella 1.
- Convertire la tabella 1 in un inverso funzione di decadimento cumulativa (tabella 2) come indicato (i numeri colorati sono presi dalla tabella 1).
- Per normalizzare la funzione di decadimento risultante, dividere il numero di tracce di tabella 2 dalla somma di tutte le tracce in quel particolare gruppo. Tracciare i valori normalizzati rispetto al numero di tempi. Quando omettendo l'ultimo intervallo di tempo, che contiene uno zero, i decadimenti possono essere lettiily dotato di una singola funzione esponenziale (Figura 8A).
- Come mostrato in Figura 8B, tracciare il valore atteso lag)>, cioè l'inverso negativo dell'esponente della funzione di decadimento sopra determinata contro il t lag ritardo impiegato (in questo esempio: x = t lag = 0,042 s e y = lag)> = 1 / 0,662 = 1.511, x = 0,49 s e y = 1 / 0,902 = 1.101, x = 1.007 s e y = 1 / 1.131 = 0,884, x = 1.989 s e y = 1 / 1.591 = 0,629).
- Fit τ off e candeggiare> basato su equazione 3. Questo può essere fatto utilizzando una funzione adatta non lineare di un programma di analisi scientifica dati come origine.
Nota: La soluzione migliore mostrato in questo esempio produce un τ off di 2,12 +/- 0,23 s e una candeggiare> di 1.53 +/- 0.06 sec. - Calcolare il halvita f dell'interazione t 1/2 off con t 1/2 off = τ off • ln (2) (in questo esempio: 1.47 s).
- Tracce record di singola molecola FRET eventi per diversi intervalli di tempo di acquisizione.
- Determinazione 2D-K D
- Determinare il fattore di conversione C per la coppia colorante FRET impiegato con l'utilizzo dell'equazione 6 e come indicato sopra (Figura 4A).
- Determinare le rese FRET per singoli microcluster TCR o interi sinapsi (figure 3B e 5).
- Usando l'equazione 4 convertire tutti i singoli rendimenti FRET in occupazioni TCR (Figura 4C).
- Applicare equazione 11 per convertire tutte le occupazioni TCR in 2D-K D s. Come è indicato qui di seguito, vincolante sinaptica è disomogenea. Una misura significativa per sinaptica K D s è la mediana (indicata in rosso) di tutti i microcluster misurati (Figura 4D).
- Calcolo del 2D-k su s
- Calcola k avanti con la legge di azione di massa con k on = k off / valori K D K D e la K determinato sperimentalmente via e.
Nota: Il k sinaptica off per l'esperimento mostrato nella Figura 4 (IE k / MCC interagendo con 5c.c7 TCR a 25 ° C) è 0,41 s -1. Quindi la trama K D (Figura 4D) possono essere convertiti in ak sulla trama, come illustrato nella figura 4E.
- Calcola k avanti con la legge di azione di massa con k on = k off / valori K D K D e la K determinato sperimentalmente via e.
Risultati
La registrazione di calcio intracellulare attraverso il fura-2 calcio colorante nonché l'analisi cellulare successiva per verificare la potenza stimolatorio e quindi la funzionalità di SLB sono mostrati in Figura 4. Come risulta evidente, i livelli di calcio aumentano in cellule T (espressa come normalizzata fura-2 340nm / 380nm rapporto con basale essere 1) immediatamente non appena si sistemano sulle SLB stimolanti. I livelli di calcio ritornano ai livelli basali poco dopo l'aggiunta di un anticorpo che blocca pMHCs da TCR impegno e che termina l'attivazione delle cellule T.
Figura 6 illustra un tipico esperimento coinvolge recupero donatore accettore FRET dopo candeggio, che viene impiegato per misurare la resa FRET e che serve per calcolare i valori 2D-K D (mostrato in Figura 4). Si prega di notare l'aumento di intensità dei donatori FRET, che rappresenta TCR etichettato via AF555, dopo una rapida e completa ablazione della FRET unSpecie cceptor (qui: AF647 associato con pMHCs). Inoltre è evidente il forte riduzione canale FRET, cioè, il canale FRET-accettore FRET sotto eccitazione donatore, dopo FRET accettore candeggio. Il segnale restante appena visibile corrisponde a preoccuparsi bleedthrough donatore. I rendimenti FRET all'interno dei singoli microcluster TCR o intere sinapsi sono calcolati sulla base dei valori di intensità misurati indicati (Figura 6B).
La figura 7 illustra una traiettoria e lasso di tempo di una singola molecola FRET evento visibili in due tempi. Come indicato sopra nell'introduzione tale comportamento è causato da entrambi decadimento sinaptica TCR-pMHC vincolanti e photobleaching. Per discriminare tra questi due contributi, i tempi di acquisizione sperimentali devono essere variato in durata: mentre fotoscolorimento rimane costante, le variazioni di lunghezza FRET traiettoria evento sono causati solo dalla cinetica di legame. Una quantificazione di tracelengths, w hich costituisce la base per il calcolo di fuori dei prezzi e candeggio mostrati nella Figura 7, sono forniti nelle tabelle da 1 a 3.
Determinazione del 2D-K D s richiede la registrazione di massa FRET rendimenti per FRET-donatori TCR etichettati. Con l'uso della costante C sperimentalmente dedotta (figura 4), una resa FRET misurato per un microcluster TCR o un'intera sinapsi può essere convertito nel TCR occupazione a, cioè il rapporto di TCR pMHC-impegnati e totali (Figura 4C) . Con note densità pMHC presenti sul SLB prima dell'aggiunta della cellula T, a valori possono essere utilizzati per determinare i valori 2D-K D (Figura 4D sinaptiche). On-tassi possono essere calcolate con la legge di azione di massa (2D-k on = 2D-k off / 2D-K D) dal sinaptica determinato off-rate e valori 2D-KD.
1 "src =" / files / ftp_upload / 53157 / 53157fig1.jpg "/>
Figura 1. schema schematica del sistema piano-oggetti sostenuto doppio strato lipidico (SLB). (A) SLB sono composte da POPC (90-99%) e il lipide sintetico DGS Ni-NTA (1-10%) e si formano spontaneamente quando le superfici di vetro pulito pagano con piccole vescicole unilamellari (SUV) costituito da lipidi corrispondenti. (B) Una volta formato, tali SLB possono essere funzionalizzati con solubili porzioni polyhistidine-tagged extracellulari derivati da pMHCs, costimolatorie B7-1 proteine e ICAM-1 proteine di adesione, per servire da APC per le cellule T. Per ulteriori informazioni sulla preparazione SLB fare riferimento a Axmann et al. 4. Cliccate qui per vedere una versione più grande di questa figura.

Figu re 2. Förster Resonance Energy Transfer basato test per quantificare TCR-pMHC binding in situ. (A) Struttura composita di un TCR complessata con un frammento di catena singola H57 impegnare un pMHC illustra l'approccio basato FRET-descritto. Si noti la breve distanza di circa 41 bis che separa i due fluorofori corrispondenti sottoposti FRET. Siti accettori per fluoroforo maleimmidi sono indicate in verde e rosso. (B) Il principio di rilevare interazioni TCR-pMHC in situ è illustrata. Solo SCF V -decorated TCR e pMHCs (qui k IE), che formano complessi specifici, dar luogo ad un segnale FRET misurabile. Cliccate qui per vedere una versione più grande di questa figura.
"/>
Figura 3. cromatogrammi della finale fase di filtrazione gel dando luogo a monomeriche SCF V s e peptide-caricato IE k -2x6H molecole. Assi X rappresentano il volume di ritenzione in ml, assi Y indicano assorbanza a 280 nm in unità arbitrarie (AU) . (A) H57 SCF V sito-specifico marcato con Alexa Fluor 555 maleimmide è stato sottoposto a cromatografia S75 separare colorante non reagito dalla proteina (fase 1.2.5). Frazioni corrispondenti a intervallo di ritenzione 14 a15 ml (linee tratteggiate) rappresentano etichettati monomero H57 SCF V. (B) IE k molecole -2x6H complessati con il titolare ANP-spazio peptide UV-cleavable era stato-UV irradiati, incubate con il sito-specifico Alex 647 maleimmide peptide marcato ed infine sottoposto a cromatografia S200 per separare le proteine peptide libero (passo 1.1.2.4). L'intervallo tra le linee tratteggiate contiene opportunamente piegato e pMHCs monomeriche. (A, B) 0,7 ml campione è stato applicato alla colonna all'inizio del rum (0 ml punto). Frazioni raccolte sono state concentrate. Il rapporto proteine-to-dye è stata determinata photospectrometry prima dialisi contro PBS / 50% glicerolo (per la conservazione a -20 °). Clicca qui per vedere una versione più grande di questa figura.
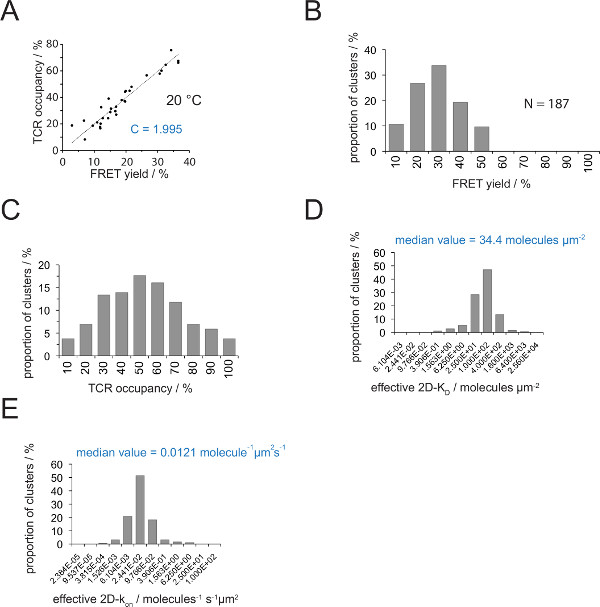
Figura 4. Determinazione 2D-K D s e 2D-k a s. (A) La correlazione tra il rendimento FRET sulla base del recupero dopo donatore accettore candeggio e occupazione TCR è stata misurata sperimentalmente. Occupazione TCR può essere determinato per le singole microcluster TCR come spiegato nel paragrafo 4.2. Una misura lineare di visualizzazione dei dati dalla linea, la pendenza che è uguale al rapporto tra C TCRoccupazione e la resa FRET. C è una costante specifica per il sistema FRET e fluorofori (Cy3 e Cy5 qui) impiegati. In questo esempio ha prodotto 1.988. (B) FRET dati di rendimento sono stati determinati per le singole microcluster TCR (N = 187, temperatura = 24 ° C) attraverso il recupero donatore accettore sbiancamento. Numeri inferiori barre dell'istogramma indicano il limite superiore all'interno dell'intervallo. (C) Conversione dei dati mostrati in (B) moltiplicando misurata FRET rese con la costante C determinato in (A). Numeri sotto barre indicano il limite superiore entro l'intervallo. (D) Istogramma (semi-logaritmica, base = 4) raffigurante la distribuzione di 2D-K D s misurato per i singoli microcluster TCR. La mediana 2D-K D è indicato in blu. Numeri sotto barre indicano il limite superiore all'interno dell'intervallo. (E) L'istogramma mostrato in (D) è stato convertito intoa 2D-k su -histogram (semi-logaritmica, base = 4) che impiega il k sinaptica off per 24 ° C (0,41 s -1). La mediana determinato 2D-k sul valore è indicato in blu. I dati sono stati originariamente pubblicati in Huppa et al. 2 e sono visualizzati qui in un nuovo formato. Cliccate qui per vedere una versione più grande di questa figura.

Figura 5. validazione funzionale di SLB impiegato per la stimolazione delle cellule T e di imaging. (A) TCR-transgenici esplosioni cellule T caricate con fura-2 sono stati confrontati con stimolante SLB ospitare pMHCs antigeniche, ICAM-1 e B-7. Cellular emissione fura-2 eccitato a 340 nm e 380 nm così come le immagini sono state registrate DIC. Come indicato, i valori del rapporto di intensità di emissione eccitate a 340 e 380 nm sono mostrati nel pannello di destra. L'aggiunta di pMHC anticorpi bloccanti 14 min nel periodo sperimentale si conclude con una diminuzione dei livelli intracellulari di calcio paragonabile a quella delle cellule T a riposo. (B) Un profilo tipico temporale di rapporti medi Fura-2 in T-cellule contatto SLB stimolazione è caratterizzata da un primo aumento del calcio intracellulare, che è da 2 a 4 volte superiore rispetto a quella delle cellule T non attivati o T-cellule prive dell'antigene dopo blocco mediata da anticorpi. Cerchi verdi indicano i punti temporali illustrati in (A). Cliccate qui per vedere una versione più grande di questa figura.
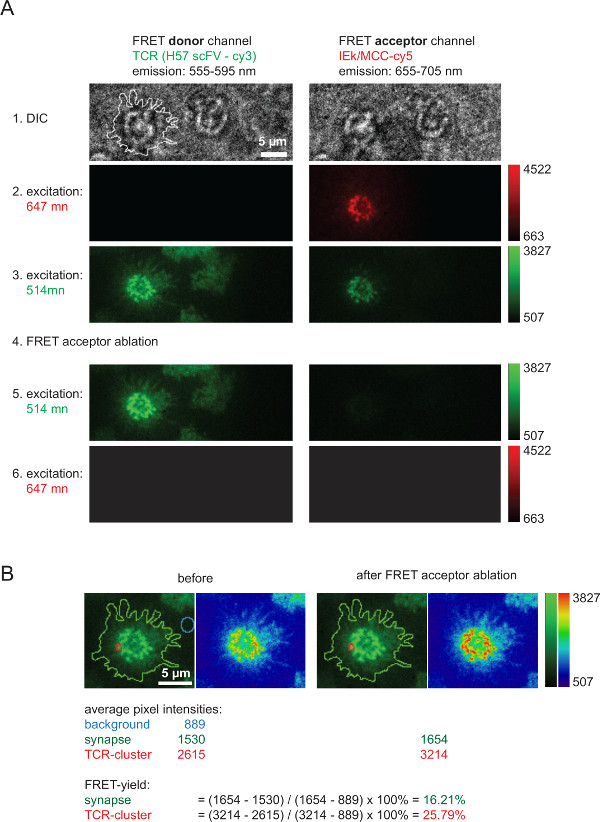
Figura 6. Bulk FRET rendimenti, come misurato attraverso il recupero dei donatori FRET dopo FRET accettatore sbiancamento. (A) si riporta un esempio di una tipica FRET misurazione sinaptica. Come è indicato sulla sinistra e sulla sommità di una serie di immagini è stato acquisito con l'uso di un divisore di fascio di emissione dando origine ad un donatore FRET e un canale FRET accettore (per informazioni più dettagliate sul beam splitter riferiscono Axmann et al 4). La linea mostrata nell'immagine DIC sinistra indica il limite della sinapsi T-cellule. Si noti la perdita di intensità all'interno del canale accettore FRET così è l'aumento di intensità nel canale donatore FRET dopo FRET accettore sbianca (fase 4). (B) FRET efficienza può essere quantificato come indicato per singole regioni sinaptici o per interi sinapsi. Per l'ispezione, le immagini prima e dopo FRET accettatore di sbiancamento sono riportati con l'uso di due tabelle di ricerca (LUT, verde e fisica). Cliccate qui per vedere una versione più grande di questa figura.
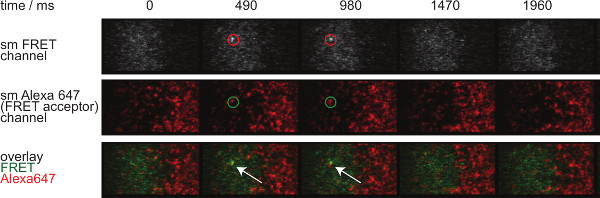
Figura 7. singola molecola FRET eventi appaiono e scompaiono passi insingle e sono perfettamente allineati con un unico fluoroforo accettore FRET. Viene mostrato il lasso di tempo di singola molecola evento FRET. Immagini sono state acquisite utilizzando una fotocamera retroilluminato EMCCD. Cliccate qui per vedere una versione più grande di questa figura.
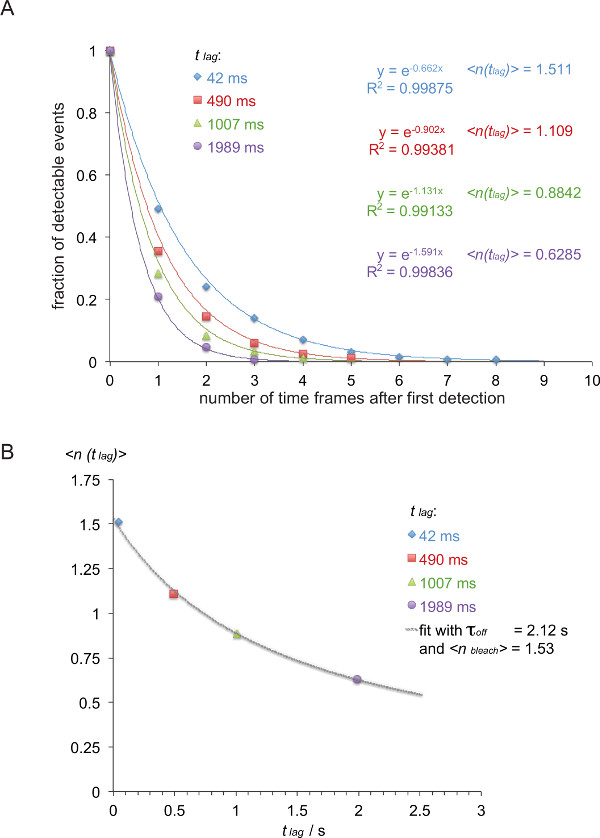
Figura 8. Determinazione τ off = 1 / k off da traiettorie smFRET misurati. (A) Le somme cumulative normalizzati di segnali FRET osservabili (derivati da H57 SCF V -AF555 decorate 5c.c7 TCR esplosioni transgenici cellule T che riconosce IE k / K3-AF647 a 24 ° C) per quattro differenti ritardi temporali (42 msec, 490 msec, 1.007 msec, 1,989 msec) sono stati tracciati in funzione del numero totale di osservazioni. Funzioni in forma mono-esponenziale danno luogo a corrispondenti l'inverso negativo dei valori di aspettativa ritardo)>. (B) valori di aspettazione sono stati tracciati contro i ritardi t lag e montati utilizzando l'equazione ritardo)> = τ off / {(t off / candeggina>) + t lag} cedere τ off e candeggina>. Clicca qui per vedere una versione più grande di questa figura.
Discussione
Misurazione interazioni proteina-proteina in situ è altamente auspicabile soprattutto quando si tratta di interazioni a bassa affinità, come TCR-pMHC vincolante 11. Questo perché il on-rate e la stabilità di tali interazioni sono significativamente influenzati dalle circostanze particolari avviene il legame. Approcci di imaging basato FRET-minimamente invasivi sono quindi in linea di principio perfettamente adatto per tali compiti, ma implicano una serie di ostacoli che devono essere superati prima. Il rumore generato da autofluorescenza cellulare limita la sensibilità delle misurazioni e deve pertanto essere mantenuto al minimo. Microscopia TIRF serve questa esigenza molto bene 12 ma richiede la funzionalizzazione di vetro diapositive, idealmente sotto forma di un planare-oggetti sostenuto doppio strato lipidico decorato con proteine di scelta 13-15. Un altro vantaggio di un approccio in parte di ricostituzione è che i partner FRET ricombinante doppio strato-residente può essere molto mORE facilmente etichettati in uno, site-specific modo quantitativo e razionale con fluorofori più piccoli e più brillanti di quanto sarebbe possibile con proteine di superficie espresso cellulari. TCR sono contrassegnati con ricombinante SCF V s, che non influenzano il riconoscimento delle cellule T, come è stato testato in precedenza 2. Inoltre, la composizione proteica della SLB, per esempio la densità pMHCs e la scelta dei fattori accessori può essere regolata alle proprie esigenze specifiche. Abbiamo già effettuato esperimenti con diverse densità di pMHCs stimolanti, ma non abbiamo rilevato differenze significative nella 2D-k off e 2D-K D 2.
Finora qui il riconoscimento di molecole MHC di classe II è stato trattato solo, soprattutto a causa della natura della loro cleft legame peptidico, che è aperto alle due estremità ed accoglie pertanto peptidi più grandi compreso un linker per il fissaggio fluoroforo. In alcuni casi tale approccio potrebbe funzionare anche per l'etichettatura MHC class io molecole 16, ma molta cautela da adottare per verificarne l'utilizzo negli esperimenti. La sensibilità di cellule T verso antigeni, che può essere misurata mediante saggi di proliferazione delle cellule T, così come la cinetica di legame pMHC-TCR misurata in vitro mediante risonanza plasmonica di superficie non dovrebbe essere influenzata dall'aggiunta del linker e fluoroforo per il peptide. In alternativa, MHC classe I assumono molecole possono essere etichettate in modo sito-specifico con l'introduzione di una cisteina spaiato all'interno della sequenza della catena pesante (osservazioni non pubblicate).
Con l'uso di opportune sonde molecolari alcuna interazione proteina-proteina sinaptica può in linea di principio essere studiato in modo qui descritto. Tali sonde, ad esempio, SCF V s o Progettato Proteine Ankyrin Ripeti (DARPins) 17, dovrebbero essere monovalenti e dovrebbe legare il loro obiettivo in modo stabile senza influenzare l'interazione di interessi. Naturalmente, informatio strutturalen è altamente desiderabile per la progettazione razionale della sonda ma non assolutamente necessario. Quando si stabilisce un nuovo paio di partner FRET, si consiglia di registrare ed analizzare FRET in massa prima. Siti di attaccamento etichette possono essere variate sensibilmente per massimizzare il segnale FRET e anche per verificare che i rendimenti misurati FRET variano in base alla distanza tra colorante. Una volta che il sistema è ottimizzato, singola molecola FRET segnali possono essere registrati limitando l'etichettatura del grande abbondanza FRET partner 10-30% e sbianca la bassa abbondanza FRET compagno fino a quando le singole molecole sono risolvibili nel campo dell'illuminazione.
Ultimo ma non meno importante si deve rilevare che SLB ravvicinamento alcuni, ma non tutti gli aspetti di una membrana plasmatica fisiologico. Qualità come membrana curvatura e flessibilità, compartimentazione dominio, riarrangiamenti citoscheletrici e motilità cellulare, nonché una elevata varietà di proteine di membrana di superficie espressi non sono rappresentate da SLB ma possono influenzare tegli elabora sotto inchiesta. Sarà necessario molto sforzo per essere investito per stabilire le modalità di imaging che permette di seguire in interazioni proteina-proteina con una risoluzione di singola molecola nelle sinapsi fisiologici, che sono inaccessibili per l'imaging TIRF.
Divulgazioni
The authors declare that they have no competing financial interest.
Riconoscimenti
MA è stato sostenuto da una borsa di studio di Schrödinger Fondo austriaco della scienza (FWF, J3086-B11) e ringrazia il Max-Planck-Società per il sostegno finanziario e amministrativo. GS e JH sono stati sostenuti dalla scienza e la tecnologia Fondo Vienna (WWTF, LS13-030).
Materiali
| Name | Company | Catalog Number | Comments |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Sf900 II | Life Technologies | 10227402 | insect cell media for baculo virus production |
| Insect-XPRESS with L-glutamine (Lonza) | Fisher Scientific | 10564038 | insect cell media for baculo virus expression |
| Sf9 cells | Life Technologies | 11496-015 | cells for virus production and expansion |
| High Five Cells | Life Technologies | B855-02 | cells for potein expression |
| LB-media | Fisher Scientific | 10000713 | bacterial expression |
| Centramate System | Pall | protein concentartion from large volumes | |
| Centramate cassette 10kDa cutoff | Pall | OS010T12 | protein concentartion from large volumes |
| Amicon Ultra-15 Centrifugal Filter Units | EMD Millipore | UFC900308 | protein concentartion |
| Amicon Ultra-4 Centrifugal Filter Units | EMD Millipore | UFC800308 | protein concentartion |
| Amicon Stirred Ultrafiltration Cell Model 200 mL | EMD Millipore | 5123 | protein concentartion |
| Äkta pure 25L | GE Healthcare | 29-0182-24 | protein purification |
| Superdex 200 10/300 GL | GE Healthcare | 17-5175-01 | protein purification |
| Superdex 75 10/300 GL | GE Healthcare | 17-5174-01 | protein purification |
| Mono Q 5/50GL | GE Healthcare | 17-5166-01 | protein purification |
| Ni Sepharose 6 Fast Flow | GE Healthcare | 17-5318-01 | protein purification |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Tricorn 10/20 column | GE Healthcare | 28-4064-13 | protein purification |
| Gilson HPLC system | Gilson | purificationof fluorochrome-coupled peptides | |
| Pursuit XRs C18, 5 µm particle size, 21.2*250mm column size | Agilent | A6000250X212 | purificationof fluorochrome-coupled peptides |
| Pursuit XRs C18, 5 µm particle size, 21.2*50 mm column size | Agilent | A6000050G212 | purificationof fluorochrome-coupled peptides |
| Cy3 maleimide | GE Healthcare | PA23031 | site-specific protein labeling via mutant unpaired cysteines |
| Cy5 maleimide | GE Healthcare | PA25031 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | site-specific protein labeling via mutant unpaired cysteines |
| Alexa Fluor 647 C2 Maleimide | Life Technologies | A-20347 | site-specific protein labeling via mutant unpaired cysteines |
| Fura-2, AM, cell permeant | Life Technologies | F-1221 | calcium-sensitive dye for cell labeling |
| dimethyl sulfoxide | Sigma Aldrich | 151874 | for dissolving fura-2 am |
| Hank's Balanced Salt Solution plus calcium/magnesium | Fisher Scientific | 10225362 | imaging buffer |
| PBS | Life Technologies | 14190-136 | |
| Bovine Serum Albumin lyophilized powder | Sigma Aldrich | A2153 | supplement for imaging buffer |
| 14-4-4S antibody | affimetrix eBioscience | 14-5980-81 | blocking antibody for H2-I-Ek (recognized by the 5c.c7, 2B4 and AND TCR) |
| 5 ml polypropylene round-bottom tube | Becton Dickinson | FALCON 352063 | |
| 0.22 μm Ultrafree-MC centrifugal filter unit | EMD Millipore | UFC30GV0S | |
| Syringe filter 0.2µm | Millipore | GVWP04700 | |
| TetraSpeck Microspheres, 0.1 µm, fluorescent blue/green/orange/dark red | Life technologies | T-7279 | |
| Microscope for fura-2-based calcium measurements | LEICA | DMI4000B | |
| Microscope for (single molecule) FRET measurements | LEICA/ZEISS/NIKON/OLYMPUS | for details please refer to parallel JoVE contribution by Axmann et al. | |
| planar supported lipid bilayers | for details please refer to parallel JoVE contribution by Axmann et al. | ||
| RPMI 1640, with L-Glutamine | Life Technologies | 11554416 | T-cell media |
| non-essential amino acid 100X | Hyclone | SH30238.01 | T-cell media supplement |
| penicillin/streptomycin/L-glutamine 100x | Life Technologies | 12000226 | T-cell media supplement |
| 2-mercaptoethanol | Sigma Aldrich | M6250 | T-cell media supplement |
| mouse interleukin-2 recombinant protein | BPS Bioscience | 90185-B | T-cell media supplement |
| Research Grade Fetal Bovine Serum | Hyclone | SV30160.03 | T-cell media supplement |
| Origin (analysis program) | OrigenLab | http://www.originlab.com/ | non-linear fitting of two parameters (tauoff, [ntlag]) |
Riferimenti
- Garcia, K. C., Adams, J. J., Feng, D., Ely, L. K. The molecular basis of TCR germline bias for MHC is surprisingly simple. Nat Immunol.. 10, 143-147 (2009).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature.. 463, 963-967 (2010).
- Huppa, J. B., Davis, M. M. The interdisciplinary science of T-cell recognition. Advances in immunology.. 119, 1-50 (2013).
- Axmann, M., Schuetz, G. J., Huppa, J. B. Single Molecule Microscopy on Planar Supported Bilayers. Journal of Vizualized Experiments J. Vis. Exp.. 101, e53158 (2015).
- Xie, J., et al. Photocrosslinkable pMHC monomers stain T cells specifically and cause ligand-bound TCRs to be preferentially transported to the cSMAC. Nat Immunol. 13, 674-680 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21, 1387-1395 (2003).
- Toebes, M., et al. Design and use of conditional MHC class I ligands. Nat Med. 12, 246-251 (2006).
- Tsumoto, K., et al. Highly efficient recovery of functional single-chain Fv fragments from inclusion bodies overexpressed in Escherichia coli by controlled introduction of oxidizing reagent--application to a human single-chain Fv fragment. J Immunol Methods. 219, 119-129 (1998).
- Ruegg, U. T., Rudinger, J. Reductive cleavage of cystine disulfides with tributylphosphine. Methods Enzymol. 47, 111-116 (1977).
- Ruprecht, V., Brameshuber, M., Schütz, G. J. Two-color single molecule tracking combined with photobleaching for the detection of rare molecular interactions in fluid biomembranes. Soft Matter. 6, 568-581 (2010).
- Dustin, M. L., Bromley, S. K., Davis, M. M., Zhu, C. Identification of self through two-dimensional chemistry and synapses. Annu Rev Cell Dev Biol. 17, 133-157 (2001).
- Axelrod, D. Cell-substrate contacts illuminated by total internal reflection fluorescence. The Journal of cell biology. 89, 141-145 (1981).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Kaizuka, Y., Douglass, A. D., Varma, R., Dustin, M. L., Vale, R. D. Mechanisms for segregating T cell receptor and adhesion molecules during immunological synapse formation in Jurkat T cells. Proc Natl Acad Sci USA. 104, 20296-20301 (2007).
- Varma, R., Campi, G., Yokosuka, T., Saito, T., Dustin, M. L. T cell receptor-proximal signals are sustained in peripheral microclusters and terminated in the central supramolecular activation cluster. Immunity. 25, 117-127 (2006).
- Purbhoo, M. A., Irvine, D. J., Huppa, J. B., Davis, M. M. T cell killing does not require the formation of a stable mature immunological synapse. Nat Immunol. 5, 524-530 (2004).
- Binz, H. K., Stumpp, M. T., Forrer, P., Amstutz, P., Pluckthun, A. Designing repeat proteins: well-expressed, soluble and stable proteins from combinatorial libraries of consensus ankyrin repeat proteins. J Mol Biol. 332, 489-503 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon