Method Article
Metodi di trasferimento Proprio localizzata di cellule o DNA in precoce post-impianto di embrioni di topo
In questo articolo
Riepilogo
We demonstrate a method for grafting cultured cells into defined sites of early mouse embryos to determine their in vivo potential. We also introduce an optimized electroporation method that uses glass capillaries of known diameter, allowing the precise delivery of exogenous DNA into a few cells in the embryos.
Abstract
Manipolazione e la cultura di embrioni precoci di topo è un potente ma in gran parte sottoutilizzato tecnologia aumentando il valore di questo sistema modello. Viceversa, coltura cellulare è stato ampiamente utilizzato in studi di biologia dello sviluppo. Tuttavia, è importante determinare se le cellule coltivate in vitro rappresentano veramente in tipi di cellule in vivo. Innesto cellule in embrioni, seguito da una valutazione del loro contributo durante lo sviluppo è un metodo utile per determinare il potenziale di cellule coltivate in vitro. In questo studio, si descrive un metodo per cellule innesto in un sito definito di embrioni di topo presto dopo l'impianto, seguita da coltura ex vivo. Introduciamo anche un metodo di elettroporazione ottimizzato che utilizza capillari di vetro di diametro noto, permettendo precisa localizzazione e regolazione del numero di cellule che ricevono DNA esogeno sia con alta efficienza di trasfezione e morte cellulare bassa. Queste tecniche, che non richiedono spattrezzature ecialized, rendono le manipolazioni sperimentali del gastrulazione e il mouse embrione precoce possibile organogenesi fase, permettendo analisi di impegno in sottopopolazioni di cellule in coltura e l'effetto di manipolazioni genetiche in situ sulla differenziazione delle cellule.
Introduzione
Colture cellulari è stato ampiamente utilizzato in studi di biologia dello sviluppo. Le cellule staminali embrionali di topo (CES) e le cellule staminali epiblasto (EpiSCs) possono differenziarsi in tutti e tre i foglietti embrionali in vitro e sono un modello utile per la differenziazione delle cellule ai primi di embriogenesi dei mammiferi. La derivazione di queste linee cellulari ha aperto la possibilità per la manipolazione in vitro e investigazione dettagliata degli eventi localizzati di segnalazione e le reti trascrizionali che operano durante la prima patterning embrionale. Resta però importante determinare la rilevanza in vivo di eventuali manipolazioni eseguite in coltura. Il potenziale in vivo di preimpianto ottenute dagli embrioni di topo CES è stata valutata con l'introduzione di nuovo in embrioni preimpianto (morule o blastocisti) 1. Tuttavia, EpiSCs che rappresentano le cellule in embrioni postimpianto epiblasto non possono integrare in modo efficiente in embrioni preimpianto 2,3. Il nostro previonoi scoperte hanno dimostrato che EpiSCs può efficacemente generare chimere e contribuire a tutti i foglietti embrionali, quando innestati in embrioni postimpianto 4. Così, il modo migliore per valutare le cellule coltivate in vitro è di introdurli al loro ambiente corrispondente in vivo.
L'elettroporazione è un metodo ampiamente utilizzato per trasportare molecole esogene in cellule bersaglio sia in vivo che in vitro. L'energia elettrica può generare un gran numero di pori nella membrana cellulare, che consente l'acido esogeno desossiribonucleico (DNA) o acido ribonucleico (RNA) per entrare nelle cellule. Una delle maggiori sfide per questa tecnica è quello di combinare la vitalità cellulare ottimale con alta efficienza electrotransfection 5,6. Per elettroporazione di acidi nucleici nei tessuti embrionali, placcati oro sono stati più comunemente usato elettrodi, permettendo il targeting di cellule in una vasta gamma spaziale 7-9. Per ottenere una più locatrasferimento genico zato, un elettrodo a forma di ago è stato utilizzato per ottenere un campo elettrico focale 10,11. Utilizzando questo metodo, gli autori hanno dimostrato che dopo l'elettroporazione, circa 30-60 cellule avevano preso il DNA costruire 11. Tuttavia, sembra che regolando con precisione il numero di cellule elettroporate rimane difficile con un elettrodo a larghezza fissa. La tecnica capillare elettroporazione è stata utilizzata per fornire plasmidi di singole cellule 12-14. Tuttavia, questa tecnica non è stata applicata per electroporating plasmidi agli embrioni ex vivo. Più di recente, un microdispositivi è stato segnalato a livello locale electroporate poche cellule distali viscerali endoderma (meno di 4 celle) all'inizio postimpianto embrioni di topo 15. Tuttavia, non è ancora noto se questo dispositivo può efficacemente bersaglio ectoderma e mesoderma ex vivo.
In questo studio descriviamo due nuovi metodi per valutare la funzione cellulare e genica nei primi mesi dopo-implantation embrioni. Per prima cosa dimostrare come innestare cellule coltivate in vitro in siti definiti negli embrioni precoci di topo per valutare il loro potenziale in vivo. L'integrazione delle cellule innestate e loro discendenti, tutti etichettati da un tag genetica (ad esempio, una proteina fluorescente verde (GFP), può essere ulteriormente esaminata mediante immunocolorazione di proteine specifiche del tessuto 4. In secondo luogo, si descrive un metodo migliorato per fornire precisione DNA siti localizzati nell'embrione tramite elettroporazione. Invece di utilizzare un elettrodo a forma di ago, abbiamo inserito un filo sottile all'interno di una punta fine capillare di vetro, e dimostrare che tale modifica può fornire DNA per un piccolo numero di cellule con alta efficienza e limitato cella della morte. Inoltre, abbiamo dimostrato che, utilizzando capillari di vetro di diverse dimensioni di apertura, possiamo controllare il numero di cellule elettroporate. Pertanto, crediamo che questo metodo può essere di grande utilità per studiare presto patterning embrionale coinvolgendo piccoli numeri ocellule f.
Protocollo
Tutti gli esperimenti sugli animali sono stati eseguiti in conformità con il Regno Unito per la casa regolamenti ufficio come specificato negli animali (Procedure Scientifiche) Act (1986) sotto licenza Progetto numero 60/4435. Per raccogliere embrioni a stadi di sviluppo specifici, accoppiamenti a tempo sono state istituite O / N. Mezzogiorno del giorno di trovare un tappo vaginale è stata designata giorno embrionale (E) 0,5.
1. Uno sguardo all'interno E7.5 o E8.5 post-impianto embrioni per Ex Cultura Vivo
- Sacrifica i topi di sesso femminile in gravidanza per dislocazione cervicale.
- Isolare l'utero con le forbici, tenendolo con una pinza, e metterli in un piatto 30 millimetri pieno di M2 di media.
- Strappare delicatamente le miometrio con due paia di pinza sottile.
- Staccarsi decidua, facendo attenzione a non forare le cavità extraembrionali.
- Rimuovere la membrana della Reichert pizzicando con una pinza e lentamente lo separa dal embrione.
- Controllare gli embrioni sotto una dissezionestereomicroscopio per garantire che il sacco vitellino, amnios e cono ectoplacental sono intatte.
- Trasferire gli embrioni ad un piatto pulito di M2 con una pipetta e posto su un 30 millimetri di plastica coperchio piastra di Petri sul ghiaccio (la 'piattaforma di ghiaccio') a embrioni parzialmente freddo.
- Se necessario, conservare embrioni in M2 su una piattaforma di ghiaccio fino a 1,5 ore, ad es., Durante la preparazione dei media o la manipolazione di piccoli lotti di ~ 3-4 embrioni a temperatura ambiente.
Nota: Il recupero e la dissezione di embrioni di roditori è stato descritto in dettaglio in precedenza 7,8,16.
2. Preparare il terreno di coltura degli embrioni
- Appena scongelare o siero ratto disponibile in commercio (vedi Glanville-Jones et al. 13 per le specifiche), o siero ratto preparati in casa secondo la Copp e Cockroft 16 che è stato inattivato il calore per 30 min a 56 ° C e congelato in 1 ml aliquote a -80 ° C
Nota: siero ratto disponibili in commercio è accettabile per i periodi di cultura di 24-36 ore, anche se il siero preparato in casa è, nella nostra esperienza, superiore per periodi di coltura fino a 48 ore. - Appena preparare un eccesso (ad es., 10 ml) di integratori definiti, rappresentati da Glasgow Minimum Essential Medium (GMEM), 1% non essenziale aminoacidi (NEAA), 2 mM di L-glutammina e 1 mm piruvato di sodio.
- Calcolare il volume di terreno di coltura che è necessario in base al numero di embrioni di ogni stadio che stanno per essere coltivati (vedi punto 3). Mescolare il siero di ratto con supplementi definite per compensare il 50% terreno di coltura (1: 1 (v / v) di siero di ratto: integratori definiti) e / o il 75% mezzo di coltura (3: 1 (v / v) di siero di ratto: definito integrazioni).
- Passare il terreno di coltura embrione attraverso un filtro da 0,45 um e aggiungere 10.000 UI / ml di penicillina e 10 mg / ml di streptomicina.
Nota: la soluzione L-glutammina e sodio piruvato appena scongelato è cruciale per lo sviluppo dell'embrione durante ex vivo della cultura.
- Per gli embrioni E7.5: cultura statico con piastre a 4 e in un incubatore fornita con 5% di CO 2 in aria a 37 ° C per 24 ore. Culture fino a due embrioni per pozzetto in 1 ml di 50% mezzo di coltura.
- Per E8.5 embrioni: utilizzare un rullo cultura apparecchiatura 8 ruotante a 35 giri / min incorporando gassatura continuo con 5% di CO 2 in aria a 37 C per 24 ore (1 ml di 50% terreno di coltura per embrione).
- Per embrioni E9.5: utilizzare apparecchio cultura rullo ruotante a 35 giri / min incorporando gas forniti con 5% di CO 2, O 2 40% 55% N 2 a 37 C per 24 ore (1 ml di 75% per coltura embrione).
Nota: gli embrioni Cultura raggio di 3 ore dopo eutanasia i topi come periodi prolungati in M2 influenzare negativamente lo sviluppo. Per il metodo di ex vivo coltura embrionale vedere Copp e Cockroft 16.
4. Grafting cellule coltivate in E7.5 o E8.5 embrioni di topo
- Fisicamente raschiare EpiSCs, che esprimono GFP ubiquitariamente, da una piastra di coltura 6 pozzetti utilizzando un puntale 20-200 microlitri e metterli in un piatto 30 millimetri contenente gli embrioni
Nota: Per inserire grumi di cellule negli embrioni, cellule devono essere fisicamente demolite anziché tripsinizzati. - Collegare un innesto capillare a mano tirato al tubo di aspirazione di fare una pipetta a bocca.
- Succhiare delicatamente la pipetta bocca per disegnare uno o più grumi di cellule di dimensioni> 20 cellule nel capillare innesto.
- Soffiare delicatamente le cellule, per disperdere in parte grandi gruppi.
- Selezionare un ciuffo cellula contenente ~ 10-20 cellule e succhiare nuovamente nel capillare innesto, mantenendolo vicino all'apertura del capillare. Fare attenzione a non spostare il gruppo di cellule dentro e fuori del capillare più volte, per evitare di rottura in pezzi più piccoli.
- Tenere l'embrione senza bloccare in posizione con un paio di pinze e inserire l'innestocapillare nella regione di interesse per creare un'apertura.
- Espellere delicatamente il gruppo fuori dal capillare innestare, lasciando il breve stringa di 10-20 cellule presentate nell'embrione.
- Ripetere la procedura di innesto per il numero desiderato di embrioni. Utilizzare lotti di 3-4 embrioni per convenienza.
- Lasciando embrioni nello stesso piatto di M2 media, immagine gli embrioni innestate con un composto a fluorescenza dissezione microscopio con fotocamera, tenere il tempo di imaging al minimo per evitare l'esposizione degli embrioni alla luce eccessiva e calore.
Nota: Determinare tempi di rilevamento empiricamente poiché dipendono dalle specifiche della fotocamera e microscopio, nonché la natura e l'intensità di fluorescenza del fluoroforo. - Trasferire l'embrione in una pastette con un volume minimo di M2 medio pre-equilibrata terreno di coltura (vedi sezione 3) subito dopo l'imaging.
Nota: Esaminare attentamente la morfologia degli embrioni dopo l'innesto. Solo la cultura Intact embrioni.
5. Handmade Elettroporazione Materiali e configurazione Apparatus (Preparare il seguito in anticipo degli Esperimenti elettroporazione):
- Per DNA pipette iniezione: tirare DNA pipette di iniezione con un estrattore micropipetta orizzontale. Pipette iniezione devono avere una punta fine con un'apertura inferiore a 10 micron per evitare danni ai tessuti quando si inietta il DNA nelle cavità embrionali.
- Per capillare di vetro elettroporazione: utilizzare un microforge per tagliare l'apertura di pipette di iniezione del DNA per un diametro interno di 20 o 30 micron. Per evitare danni cellulari quando il capillare è in contatto con l'embrione per elettroporazione, la punta del capillare di vetro deve essere tagliato in modo netto e non contenere taglienti, bordi rotti.
- Per elettrodi capillare mano (anodo) (Figura 1): inserire un filo di diametro di platino 0,2 mm in un capillare di vetro elettroporazione con un'apertura fissa di 20 o 30 micron di diametro a concentrarsi eletticorrente ric e consegnare il DNA plasmide di una piccola regione di interesse per l'embrione.
- Per elettrodo a forma di L a mano (catodo) (Figura 1): piegare un filo di diametro 0,2 mm di platino creando una forma a "L", con la parte orizzontale della "L" intorno 1 mm di lunghezza.
- Collegare ogni elettrodo di platino per un filo sottile isolato ed inserirlo in una porta microiniezione ago coperto da nastro isolante.
- Montare i porta-aghi sul portastrumenti micromanipolazione standard.
- Collegare il circuito come mostrato in Figura 1: collegare l'elettrodo capillare all'anodo dell'alimentatore; collegare l'elettrodo a forma di L all'anodo del multimetro; collegare il catodo del mulimeter al catodo dell'alimentatore.
6. elettroporazione E7.5 o E8.5 embrioni di topo
- Riempire il capillare di vetro elettroporazione con PBS entro 1-2 mm della parte superiore e inserire la straielettrodo di platino ght (anodo) nel capillare di vetro fino a raggiungere il fondo del capillare.
- Ancorare l'elettrodo a forma di L (catodo) sulla superficie di una capsula di Petri 30 mm riempita con PBS.
- Trasferire l'embrione da M2 medio nel piatto elettroporazione PBS-riempita.
- Inserire l'ago per l'iniezione da epiblasto laterale nella cavità amniotica dell'embrione. Utilizzando una pompa pneumatica pico, iniettare soluzione di DNA (pCAG-Cre: GFP o pCAG-GFP 1-1,5 mg / ml con 0,01% alimento verde colorante colorante) nella cavità fino a quando non è completamente pieno. Per gli embrioni E7.5-E8.5, è necessaria soluzione di DNA a meno di 5 ml per un embrione. Utilizzando il colorante verde come un indicatore, fare attenzione a non far scoppiare la embrione.
- Posizionare accuratamente l'embrione tra gli elettrodi e spostare l'elettrodo capillare per la posizione precisa in cui il DNA deve essere consegnato.
Nota: L'orientamento dell'embrione dipende dalla regione dove il DNA deve essere elettroporate. - Electropovalutare l'embrione utilizzando 200 volt (V) in 6 impulsi, ciascuno dei 50 ms di durata con un intervallo di 1 sec tra ogni impulso.
- Trasferire l'embrione pre-equilibrato subito terreno di coltura dopo l'elettroporazione. Se lo si desidera, ripetere il processo per il prossimo embrione.
Nota: Aggiungere il terreno di coltura in un contenitore sterile e metterlo in incubatrice cultura pre-equilibrare la media. - Per rilevare le cellule elettroporate 2 ore dopo la cultura, di trasferire gli embrioni per un ambiente pulito 30 millimetri piastra di Petri di M2 mezzo utilizzando un pastette. Immagine gli embrioni come nel passaggio 5,9 utilizzando un composto a fluorescenza dissezione microscopio.
- Trasferire gli embrioni di nuovo alla cultura con un pastette subito dopo l'imaging.
- Per rilevare cellule morte causate da elettroporazione, macchiare gli embrioni con una cella di colorante rosso lontano membrana impermeabile nucleare (1: 200 in embrione terreno di coltura) a 37 ° C per 10 min 2 ore dopo l'elettroporazione (opzionale)
- Per contare le cellule elettroporate, fissare la Embryos in 4% paraformaldeide (PFA) per 2-4 ore a 4 ° C, macchia il nucleo con un ultravioletti o lontano-rosso di contrasto nucleare fluorescente e immagine gli embrioni utilizzando un microscopio confocale (opzionale).
Nota: la crescita embrionale è influenzata negativamente se lasciato troppo a lungo in PBS. Pertanto, assicurarsi che il tempo impiegato per l'elettroporazione di ogni embrione è ridotto al minimo (<5 min per embrione).
Risultati
Innesto
EpiSCs che ubiquitariamente esprimono EGFP (R04-GFP, derivato da E6.5 epiblast, e C2, derivate in vitro da mESCs) 4 sono stati raschiati manualmente dal piatto cultura e innestate in diversi siti di embrioni E7.5 (Figura 2A). Gli embrioni sono stati coltivati ex vivo e analizzati dopo 24 ore. La distribuzione delle cellule del donatore è stata valutata mediante microscopia a fluorescenza. Se le cellule donatrici incorporate, hanno proliferato e loro derivati disperse all'interno embrioni host (Figura 2B). È stato osservato che innesti contenenti 10-16 cellule incorporate efficientemente negli embrioni host (Figura 2A, 2B) e, comunque, l'innesto più celle non comporta meglio chimaerism. Invece, le cellule innestate prodotte ciuffi prive di personalità giuridica (Figura 2C e 2D).
Elettroporazione
Per unssess l'efficienza del nostro sistema di elettroporazione, abbiamo consegnato GFP che esprimono plasmidi (pCAG-GFP e pCAG-Cre: GFP) a siti specifici nell'embrione. In linea con un precedente studio 11, le cellule GFP + sono state rilevate negli embrioni 1-2 ore dopo l'elettroporazione (Figura 2E e 2G). Quando le cellule epiblasto distali al tardo primitiva fase embrionale striscia sono stati elettroporate, cellule marcate hanno contribuito alla ectoderma neurale dopo 24 ore di cultura (Figura 2E e 2F). Questo risultato corrisponde bene alle mappe destino noti di cellule epiblasto in gastrulazione fase embrioni 17. Allo stesso modo, quando il plasmide di espressione GFP è stato elettroporate nella stria primitiva al E8.5 (2-5 somites), + cellule GFP contribuito al mesoderma parassiale (Figura 2G e 2H), in linea con le mappe destino note di fine linea primitiva 18 . Inoltre, abbiamo osservato il contributo a tutti e tre i foglietti embrionali da cellule elettroporate (Figura 2I-K),suggerendo che la procedura di elettroporazione non compromette il comportamento delle cellule in vivo. Tuttavia, abbiamo anche notato che mentre epiblasto (E7.5) o cellule stria primitiva (E8.5) sono stati presi di mira, alcune cellule endoderma sono stati elettroporate (Figura 3C e Tabella 1).
Uno dei principali vantaggi di utilizzare un elettrodo capillare è che il numero di cellule elettroporate può essere controllato, semplicemente cambiando il diametro della sua apertura. Per determinare il numero di cellule elettroporate, gli embrioni sono stati fissati 2 ore dopo l'elettroporazione e ripreso in wholemount su un microscopio confocale. Il numero di cellule GFP + è stato contato manualmente nei confocale z-stack. Tabella 1 mostra che, per una data fase, aumentando la dimensione del capillare di vetro da 20 a 30 micron risultati in uptake DNA apertura da più celle. Quando un singolo formato di apertura è stata confrontata tra stadi (E7.5 contro E8.5), sono stati trovati per essere elettroporate in quest'ultima fase più cellule. Questo effetto può essere dovuto ad una maggiore concentrazione di DNA presente nella cavità amniotica in E8.5. Poiché la soluzione di DNA è stato mescolato con il cibo colorante verde, possiamo usare il colore verde per valutare la concentrazione di DNA nella cavità amniotica. Nel microscopio, è chiaro che, se confrontato con embrioni E8.5, il colore verde dopo l'iniezione del DNA è molto più leggero nella cavità di embrioni E7.5. Sebbene la stessa concentrazione di soluzione di DNA è stato iniettato in E7.5 e E8.5 embrioni, più soluzione di DNA era nella cavità amniotica di embrioni E8.5 per riempire completamente perché sono più grandi delle dimensioni. Dopo aver estratto l'ago di iniezione, c'è sempre un certo grado di perdita di soluzione di DNA dalla cavità amniotica, e poiché il foro di puntura è più grande rispetto alla dimensione della cavità amniotica in embrioni precedenti, è probabile che non vi era proporzionalmente più perdite da E7.5 di embrioni E8.5, portando ad una concentrazione di DNA inferiore. Il diverso numero di trasfettatecellule potrebbero anche essere dovuto a diversi diametri o tensione transmembrana indotta (ITV) soglie di cellule in diverse fasi.
Un inconveniente di elettroporazione è la morte cellulare associato. Simile al tradizionale oro placcato o elettrodi aghiformi, elettroporazione usando un elettrodo capillare provoca anche la morte cellulare. Dopo l'elettroporazione regione bersaglio apparso colore più scuro rispetto alle regioni confinanti (Figura 3A e 3B), indicando che un certo grado di morte cellulare deve essere avvenuto in questa zona. Per determinare ulteriormente il numero di cellule morte causate dalla procedura di elettroporazione, gli embrioni sono state colorate con un colorante nucleare di cellule fluorescenti membrana impermeabile. I nuclei di cellule morte sono stati etichettati con una fluorescenza far-rosso colorante membrana impermeabile. La colorazione confermato che questa tecnica elettroporazione capillare traduce solo in un piccolo numero di cellule morte in prossimità del sito elettroporazione (Figura 3D e Table 1).
Abbiamo notato che, anche se le cellule morte appaiono nel sito elettroporazione, + cellule GFP e le cellule morte sono anche più esclusivo tra loro (Figura 3E e 3F). Inoltre, quando il epiblast laterale caudale a E8.5 stato elettroporate con pCAG-GFP e un'apertura capillare di vetro di 20μm, un gran numero di cellule GFP + è stata rilevata dopo 48 ore in coltura (figura 3G e 3H). Presi insieme, questi risultati suggeriscono la maggior parte delle cellule GFP + rilevate 2 ore dopo l'elettroporazione sono ancora vitale durante l'ulteriore cultura.
Abbiamo segnato il numero di cellule GFP + dopo 24 ore ex vivo della cultura. Sei embrioni sono stati elettroporate con pCAG-GFP a E7.5, utilizzando un'apertura capillare di diametro 20μm. 107 ± 31 (media ± DS) sono stati rilevati GFP + cellule / embrione. Poiché all'inizio della cultura (2 ore), 9 cellule sono state elettroporate in media per embrioni ( trong> Tabella 1), questo suggerisce che le cellule elettroporate sottoposti 3-4 divisioni in 2 ore. La cella media tempo di raddoppio da E7.5 a E8.5 embrioni è di circa 6-7 ore in tutte le cellule oltre a quelle nel nodo ventrale 19,20. Questo suggerisce che la procedura di elettroporazione non ostacoli la crescita delle cellule normali.
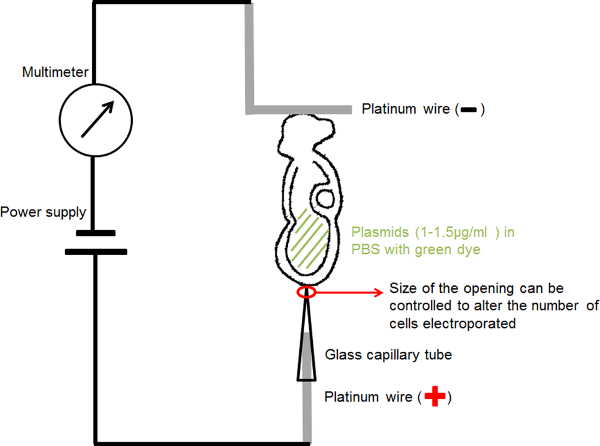
Figura 1. Schema che mostra la configurazione elettroporazione. La soluzione di DNA embrione contenente nella cavità amniotica è posizionato tra i due elettrodi. Corrente ai parametri scelti è stato fornito da un generatore di impulsi ad onda quadra (alimentazione). Un multimetro è stato collegato in serie per rilevare la corrente elettrica che l'embrione. Clicca qui per vedere una versione più grande di questa figura.
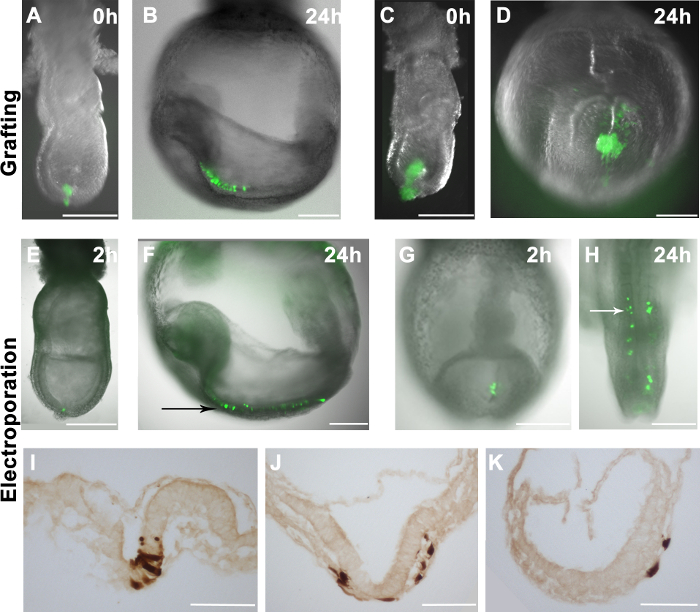
Figura 2. La distribuzione delle cellule trapiantate o elettroporate in embrioni di accoglienza. (AH) sovrapposizioni GFP fluorescenza (verdi) sulle immagini campo chiaro di embrioni wholemount (scala di grigi) (A) 10-16 GFP + EpiSCs sono stati innestati nella regione distale di un ritardo -streak embrione fase. (C) Una grande ciuffo di GFP + EpiSCs è stato innestato nella regione distale di un embrione fase intermedia striscia. (B e D) La distribuzione di EpiSCs cellule derivate (verde) negli embrioni di accoglienza (come mostrato nella A e C), dopo 24 ore di cultura. (B) GFP + cellule disperse in un embrione di accoglienza, suggerendo corretta integrazione delle cellule del donatore. (D) L'innesto più grandi grumi di cellule hanno determinato la formazione di gruppo non incorporata nell'embrione ospite. (EK) pCAG-Cre: GFP plasmide ele ctroporated in aree specifiche di embrioni di tipo selvatico. Electroporating regione distale di una fase embrionale gemma precoce (E) o stria primitiva di un 2-5 somite fase embrionale (G) ha comportato GFP + cellule in queste regioni 2 ore dopo la procedura. (F e H) La distribuzione di + cellule GFP negli embrioni di accoglienza dopo 24 ore di cultura, mostrando che le cellule elettroporate contribuiscono alla neuroectoderma (freccia nera) (F) e mesoderma parassiale (freccia bianca) (H). (IK) DAB immunostaining per le cellule GFP + mostrano che le cellule elettroporate possono dare luogo alla neuroectoderma (I), mesoderma (J) e endoderma (J e K), dopo 24 ore di cultura. Barra di scala (AH) = 250 m; barra della scala (IK) = 100 micron. Nota: Figure 1A e 1B sono ristampati dalla nostra precedente pubblicazione 4.href = "https://www.jove.com/files/ftp_upload/53295/53295fig2large.jpg" target = "_ blank"> Clicca qui per vedere una versione più grande di questa figura.
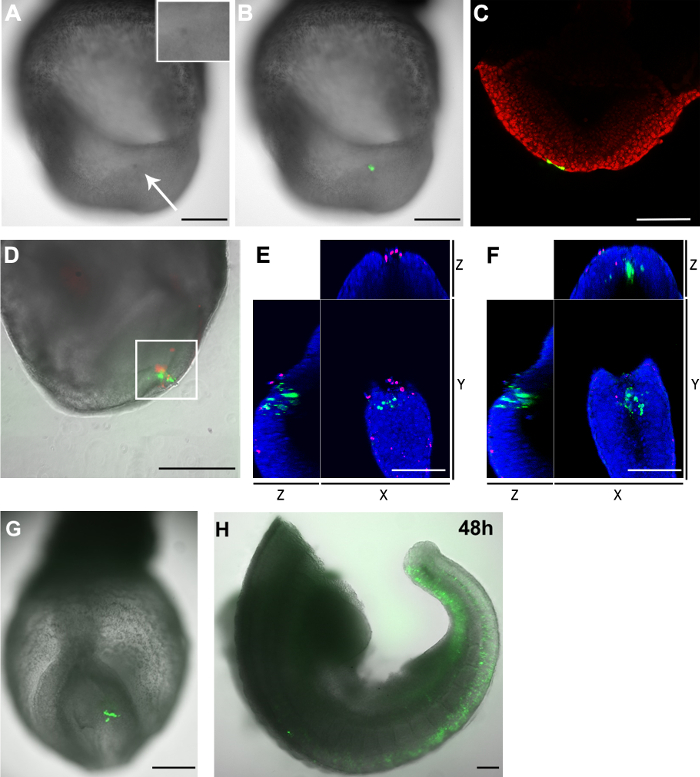
Figura 3. Distribuzione delle GFP + cellule e cellule morte negli embrioni dopo l'elettroporazione (AC) pCAG-Cre:. GFP plasmide elettroporate nelle caudali cellule epiblasto laterali di un E8.5 (2-5 palco somite) embrione (dimensione di apertura capillare :. 20 micron) (A) 2 ore dopo la procedura, la regione di destinazione ha un colore scuro (freccia bianca) rispetto ad altre parti dell'embrione. Inserto mostra un allargamento della regione elettroporate. (B) immagine Brightfield (scala di grigi) rivestito con il canale verde fluorescente che mostra le cellule elettroporate (verde). (C) A confocale Z-slice che mostra chedue cellule endoderma (verde) hanno preso il plasmide quando sono stati mirati cellule epiblasto laterali caudale. I nuclei delle cellule sono mostrati in rosso (DF) pCAG-Cre:. Plasmide GFP è stato elettroporate nella parte caudale del nodo di un embrione E8.5 (capillare formato di apertura: 30 micron). L'embrione è stato coltivato per 2 ore. Cellule elettroporate sono mostrati in cellule verdi e morti in rosso. (D) L'area elettroporate contiene sia GFP + cellule così come le cellule morte. L'area nella casella bianca è stato ulteriormente analizzato in un microscopio confocale. Conteggio manuale del z-stack ha dimostrato che vi sono stati 33 GFP + cellule e 23 cellule morte in questo settore. Solo due cellule erano entrambi positivi per entrambi i fluorofori. (E e F) vista XYZ di un confocale z-fetta della regione in scatola bianca in re mostrando cellule GFP + sono separati dalle cellule morte. I nuclei sono mostrati in blu (G e H) pCAG-Cre:. GFP plasmide è stato elettroporate in alcuni cells nel epiblasto laterali caudale di un embrione (E8.5 capillare dimensione di apertura: 20 micron) e ripreso dopo due (G) e 48 (H) ore ex vivo cultura Nota: (H) L'embrione è stato tagliato in due dopo la cultura. Le regioni testa e del cuore sono stati rimossi. Barra di scala (A, B, D, G e H) = 250 m; barra della scala (C, E e F) = 100 micron. Cliccate qui per vedere una versione più grande di questa figura.
| Diametro apertura del tubo capillare | Fase embrionale | Efficienza elettroporazione: no. embrioni contenenti cellule GFP + dopo 2h / no totale. embrioni di elettroporate (n. GFP + embrioni che si sono sviluppate normalmente dopo 24 o cultura 48h) | Numero medio di GFP + cellule per embrione ± deviazione standard (n = no. Di embrioni esaminati) | NumeroCellule GFP + endodermico per ogni embrione ± deviazione standard (n = no. Di embrioni esaminati) |
| 20μm | E7.5 (LS-LB) | 7/9 (7) | 9 ± 3 (n = 4) | 4 ± 2 (n = 4) |
| 30μm | E7.5 (LS-LB) | 13/15 (12) | 17 ± 2 (n = 4) | 6 ± 1 (n = 4) |
| 20μm | E8.5 (2-5 somiti) | 12/13 (10) | 21 ± 4 (n = 4) | 11 ± 4 (n = 4) |
| 30μm | E8.5 (2-5 somiti) | 2/2 (2) | 33 e 26 (n = 2) | 14 e 16 (n = 2) |
Tabella 1. efficienza Elettroporazione di pCAG-Cre: plasmide GFP in embrioni di topo.
Abbreviazione: LS, tardivamente stria primitiva; LB: fase tardiva nascere. Gli embrioni sono in scena secondoSvalutazioni e Davies 12
Discussione
Innesto
Il passaggio critico per gli esperimenti di innesto delle cellule è l'inserimento di una stringa di celle coerente idealmente in una singola azione, per evitare rottura del ciuffo. Questa tecnica richiede una certa pratica nel controllo pipetta bocca. Se le cellule del donatore incorporano bene nell'ospite, loro derivati si disperderanno nell'embrione. Per determinare ulteriormente se le cellule derivate donatore disperso differenziano opportunamente nell'ospite, immunocolorazione può essere eseguita su sezioni di embrioni. Se le cellule del donatore non sono compatibili con l'ambiente host, essi o non possono essere rilevati (come vengono espulsi dal embrione) o formano grumi non costituite in società gli embrioni dopo la cultura. Se sono state osservate sia le cellule disperse e grumi di cellule, questo può indicare che le troppe cellule sono stati innestati e cellule del donatore eccessivi che non possono interagire con le cellule ospiti circostanti provocato la formazione di gruppo. In questo caso, innesti aggiuntivi contenentiun minor numero di cellule può essere eseguita.
La maggiore limitazione della tecnica dell'innesto cellulare è che non è possibile determinare il potenziale pieno in vivo di cellule da topo ex vivo cultura su periodi di oltre 48 ore non è stata raggiunta. Tuttavia, se combinato con iniezione di cellule ecografico, può essere possibile trasferire cellule coltivate per gli embrioni in utero. Per riassumere, esperimenti sulle cellule innesti sono stati ampiamente utilizzati nel nostro gruppo e ci hanno dato preziosi indizi circa il potenziale in vivo di vari tipi cellulari 4,21,22. Si tratta di una tecnica di utilità generale per valutare il potenziale in vivo di cellule coltivate in vitro in embrioni precoci postimpianto.
Elettroporazione
Sebbene in questo studio abbiamo dimostrato solo che è efficiente utilizzare la tecnica capillare elettroporazione di indirizzare il epiblast, it è anche possibile indirizzare intenzionalmente altri strati germinali come cellule endoderma. Il passaggio critico per la tecnica capillare elettroporazione è ridurre al minimo il tempo impiegato per l'elettroporazione ogni embrione (<5 min per embrione) dal PBS è molto ottimale per gli embrioni precoci mouse. I nostri dati sopra ha dimostrato che, nella maggior parte delle aree nei embrioni, elettroporazione non influenza la crescita dell'embrione. Tuttavia, elettroporazione nel nodo causato anomalie dello sviluppo e ha portato alla morte prematura dell'embrione. Ciò è probabilmente dovuto a danni o la morte delle cellule che formano i centri di segnalazione importanti 23. Quindi, questa regione dovrebbe essere evitato con questa tecnica. Un ulteriore avvertimento è che, come indicato nella sezione dei risultati, mentre epiblasto o cellule stria primitiva stati presi di mira, alcune cellule endoderma sono stati elettroporate. Ciò può essere dovuto il DNA raggiunge il endoderma attraverso le lacune sotto l'epitelio epiblasto. Endoderma si compone di cellule epiteliali e nella nostra esperienza thESE cellule hanno una maggiore propensione a prendere il DNA. Pertanto, quando si applica questa tecnica per mappatura destino, è importante valutare quali cellule inizialmente occupano DNA.
Va inoltre notato che, sebbene pCAG-GFP e pCAG-Cre: plasmidi GFP possono essere forniti in modo efficiente utilizzando i parametri di elettroporazione mostrati in questo studio, l'efficacia di altri costrutti di DNA può variare e devono ottimizzazione individuale. Alterazioni concentrazione di DNA, tensione elettroporazione o il numero di impulsi possono essere effettuate se plasmidi risultano difficili da trasfettare.
In sintesi, il nostro sistema di elettroporazione capillare ottimizzato in modo efficiente e riproducibile consegnare GFP o Cre: plasmidi GFP in poche cellule in un embrione con la morte delle cellule limitato. Poiché questo metodo non richiede costose attrezzature o altamente specializzate, può essere di grande utilità per gli studi di monitoraggio cella o nel testare l'effetto dell'espressione ectopica o condizionale eliminazione of geni in embrioni precoci, se elettroporazione viene eseguita in embrioni aventi floxed alleli mutanti condizionali. Pertanto, questa tecnica elettroporazione fornisce uno strumento funzionale utile per comprendere su base cella per cella i ruoli di fattori cellulari intrinseca nel contesto di tipo selvatico localizzata ambienti embrionali.
Divulgazioni
The authors have no conflicts of financial or other interest to declare.
Riconoscimenti
We thank Filip Wymeersch and Anestis Tsakiridis for comments on the manuscript, staff in the SCRM animal unit for help with animal maintenance and Prof. Stuart Forbes for immunohistochemistry reagents. This work was supported by MRC grant Mr/K011200/1 and the China Scholarship Council
Materiali
| Name | Company | Catalog Number | Comments |
| Forceps | Dumostar | T5390 | |
| Dissecting stereomicroscope | Zeiss | Stemi 2000-C | |
| Stereomicroscope system with fluorescence | Nikon | AZ100 | |
| Inverted microscope with a digital camera | Olympus | Olympus BX61 | |
| Inverted confocal microscope | Leica Microsystems | Leica TCS SP8 | |
| Low melting point agarose | Life Technologies | 16520-050 | |
| Pasteur pipettes | Fisher Scientific | 11397863 | |
| 30mm Petri dishes | Fisher Scientific | 121V | |
| 4-well plates | Thermo scientific | 179820 | |
| M2 medium | Sigma-Aldrich | M7167 | |
| Phosphate Buffered Saline (PBS) | Life Technologies | 10010015 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | P6148 | |
| Pipettes | NICHIRYO | Nichipet | |
| tips | Greiner Bio One | 685280 | |
| Cell culture incubator | SANYO | MCO-17AIC | |
| Roller culture apparatus | BTC Engineering | ||
| Syringe filters 0.45µm, sterile | Sigma-Aldrich | 10462100 | |
| Glasgow Minimum Essential Medium (GMEM) | Sigma-Aldrich | G5154 | |
| non-essential amino acids (NEAA) | Life Technologies | 11140050 | |
| L-glutamine | Fisher Scientific | SH30549.01 | |
| Sodium pyruvate solution | Fisher Scientific | SH30239.01 | |
| Penicillin and Streptomycin 10.000UI/ml | Lonza | DE17-602E | |
| Gas Cartridge for Portable Meker Burner | COLEMAN | COLEMAN 250 | |
| Thin Wall Borosilicate Capillary Glass with Fillament, OD 1.0 mm, ID 0.78 mm | Harvard Apparatus | 640798 | |
| Aspirator tube assemblies for calibrated microcapillary pipettes | Sigma-Aldrich | A5177-5EA | |
| Flaming/Brown micropipette puller | Sutter Instrument Company | P-97 | |
| Microforge | De Fonbrune | BS030301 | |
| Pneumatic pico pump | World Precision Instruments | PV830 | |
| Microloader tips | Eppendorf | 5242956.003 | |
| ECM 830 square wave pulse generator | BTX | 45-0002 | |
| Green food coloring dye | Sigma-Aldrich | C.I. 42053 | |
| A far-red cell membrane-impermeable nuclear dye | Biotium | 40060-T | |
| pCAG-Cre:GFP | Addgene | #13776 | |
| pCAG-GFP | Addgene | #16664 | |
| Multimeter | Excel | XL830L | |
| Micromanipulators | Leitz | ||
| 0.2mm diameter platinum wire | Agar Scientific | E404-2 | |
| Anti-GFP antibody | Abcam | ab13970 | |
| Goat anti-Chicken IgY, HRP | Santa Cruz | sc-2428 | |
| Liquid DAB+ Substrate Chromogen System | Dako | K3467 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Life Technologies | D21490 | |
| A far-red fluorescence nuclear counterstain | Life Technologies | T3605 |
Riferimenti
- O'Hagan, A. R., Morton, R., Eid, N. Loss of asthma control in pediatric patients after discontinuation of long-acting Beta-agonists. Pulmonary med. , 894063 (2012).
- Brons, I. G., et al. Derivation of pluripotent epiblast stem cells from mammalian embryos. Nature. 448, 191-195 (2007).
- Tesar, P. J., et al. New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature. 448, 196-199 (2007).
- Huang, Y., Osorno, R., Tsakiridis, A., Wilson, V. In Vivo differentiation potential of epiblast stem cells revealed by chimeric embryo formation. Cell rep. 2, 1571-1578 (2012).
- Sadik, M. M., et al. Scaling relationship and optimization of double-pulse electroporation. Biophys. J. 106, 801-812 (2014).
- Kaestner, L., Scholz, A., Lipp, P. Conceptual and technical aspects of transfection and gene delivery. Bioorg. Med. Chem. Lett. , (2015).
- Soares, M. L., Torres-Padilla, M. E., Zernicka-Goetz, M. Bone morphogenetic protein 4 signaling regulates development of the anterior visceral endoderm in the mouse embryo. Dev. Growth Differ. 50, 615-621 (2008).
- Pierreux, C. E., Poll, A. V., Jacquemin, P., Lemaigre, F. P., Rousseau, G. G. Gene transfer into mouse prepancreatic endoderm by whole embryo electroporation. JOP. 6, 128-135 (2005).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev. Biol. 7, 107 (2007).
- Davidson, B. P., Tsang, T. E., Khoo, P. L., Gad, J. M., Tam, P. P. Introduction of cell markers into germ layer tissues of the mouse gastrula by whole embryo electroporation. Genesis. 35, 57-62 (2003).
- Khoo, P. L., Franklin, V. J., Tam, P. P. Fate-Mapping Technique: Targeted Whole-Embryo Electroporation of DNA Constructs into the Germ Layers of Mouse Embryos 7-7.5 Days Post-coitum. CSH protocols. 2007. , pdb.prot4893 (2007).
- Tawk, M., Bianco, I. H., Clarke, J. D. Focal electroporation in zebrafish embryos and larvae. Methods Mol Biol. 546, 145-151 (2009).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo--from single cells to the entire brain. Differentiation. 70, 148-154 (2002).
- Nolkrantz, K., et al. Electroporation of single cells and tissues with an electrolyte-filled capillary. Anal. Chem. 73, 4469-4477 (2001).
- Mazari, E., et al. A microdevice to locally electroporate embryos with high efficiency and reduced cell damage. Development. 141, 2349-2359 (2014).
- Copp, A. J., Cockroft, D. L. . Postimplantation mammalian embryos : a practical approach. , (1990).
- Tam, P. P., Behringer, R. R. Mouse gastrulation: the formation of a mammalian body plan. Mech. Dev. 68, 3-25 (1997).
- Wilson, V., Beddington, R. S. Cell fate and morphogenetic movement in the late mouse primitive streak. Mech. Dev. 55, 79-89 (1996).
- Tzouanacou, E., Wegener, A., Wymeersch, F. J., Wilson, V., Nicolas, J. F. Redefining the progression of lineage segregations during mammalian embryogenesis by clonal analysis. Dev Cell. 17, 365-376 (2009).
- Bellomo, D., Lander, A., Harragan, I., Brown, N. A. Cell proliferation in mammalian gastrulation: the ventral node and notochord are relatively quiescent. Dev. Dynam. 205, 471-485 (1996).
- Tsakiridis, A., et al. Distinct Wnt-driven primitive streak-like populations reflect in vivo lineage precursors. Development. 141, 1209-1221 (2014).
- Gouti, M., et al. In vitro generation of neuromesodermal progenitors reveals distinct roles for wnt signalling in the specification of spinal cord and paraxial mesoderm identity. PLoS biology. 12, e1001937 (2014).
- Beddington, R. S. Induction of a second neural axis by the mouse node. Development. 120, 613-620 (1994).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon