È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un metodo per valutare le proprietà di rinforzo di etanolo in ratti senza acqua privazione, Saccarina dissolvenza o di formazione accesso esteso
In questo articolo
Riepilogo
Questo protocollo descrive un nuovo metodo ed efficiente di avviare rapidamente operante rispondere per etanolo in ratti che, contrariamente a metodi standard, non richiede privazione di acqua o saccarina / saccarosio dissolvenza di avviare rispondere.
Abstract
metodi di auto-somministrazione per via orale operante sono comunemente usati per studiare le proprietà rinforzanti dell'etanolo negli animali. Tuttavia, i metodi standard richiedono la saccarina / dissolvenza saccarosio, privazione di acqua e / o di formazione esteso di avviare operante rispondere nei ratti. Questo documento descrive un nuovo metodo ed efficiente di avviare rapidamente operante rispondere per l'etanolo che è conveniente per gli sperimentatori e non richiede privazione di acqua o la saccarina / dissolvenza saccarosio, eliminando così il potenziale confondente di utilizzare dolcificanti in etanolo studi di auto-amministrazione operante. Con questo metodo, ratti Wistar tipicamente acquisire e mantenere auto-somministrazione di una soluzione di etanolo al 20% in meno di due settimane di allenamento. Inoltre, le concentrazioni di etanolo nel sangue ed i benefici sono correlati positivamente per una sessione di auto-somministrazione di 30 min. Inoltre, il naltrexone, un farmaco approvato dalla FDA per la dipendenza da alcol, che ha dimostrato di sopprimere l'etanolo autosomministrazionenei roditori, dose-dipendente diminuisce il consumo di alcol e la motivazione a consumare alcol per i ratti di auto-somministrazione di etanolo al 20%, convalidando così l'utilizzo di questo nuovo metodo per studiare le proprietà di rinforzo di alcol nei ratti.
Introduzione
Lo sviluppo di modelli animali per studiare gli effetti rinforzanti della droga si è dimostrato uno strumento importante per studiare la tossicodipendenza umana. Più specificamente, operante autogestione è un modello comportamentale ampiamente utilizzato che è uno dei mezzi più efficaci per valutare gli effetti di rinforzo positivi di una soluzione di etanolo oralmente consumata. Un problema presto con lo sviluppo di un tale modello è stato il gusto aversive primario di alte concentrazioni di etanolo per la maggior parte dei roditori, un fenomeno che è condivisa anche negli esseri umani con poca o nessuna esperienza con l'alcol 1. Un protocollo standard per superare questa barriera richiede privazione di acqua e / o la saccarina o saccarosio sbiadimento per l'acquisizione e la manutenzione di auto-somministrazione. Tuttavia, questi due approcci non sono vantaggiose. Essi richiedono lunghi periodi di formazione per avviare semplicemente rispondere per l'etanolo e di ottenere un tasso di successo relativo di acquisizione. L'uso di edulcoranti introduce anche una potenziale distorsionel'interpretazione dei dati autosomministrazione. Queste limitazioni non si applicano al seguente protocollo.
Brevemente, Samson e colleghi 2 hanno dimostrato che sciogliendo etanolo in una soluzione dolce del 20% di saccarosio e poi dissolvenza la dolcezza oltre 4 settimane di formazione deve avviare rispondere per 10% di etanolo in acqua. Inoltre, l'assunzione di etanolo affidabile è di solito realizzato in 6 a 8 settimane 1-3. Questo approccio è molto problematico. In primo luogo, richiede lunghi periodi di formazione prima investigatori possono cominciare a misurare etanolo auto-somministrazione. Al contrario, per via endovenosa di auto-somministrazione di cocaina o eroina richiede 0 - 1 giorni di formazione pre-droga su una leva alimentare la distribuzione in alimenti animali ristretto, e stabile di rispondere per droga si ottiene spesso in 10 - 12 giorni di 4,5. Un altro limite di questo metodo è il fatto che la saccarina e saccarosio sono altamente gratificante ratti e suscitare pattern di attivazione cerebrale sanaloghe sui di sostanze d'abuso, introducendo così il potenziale per confonde in etanolo autosomministrazione studia 6-9. Infine, i ratti che acquistano auto-somministrazione di una soluzione di etanolo con questo metodo spettacolo variabilità nella acquisizione e la risposta tasso di 1,10, con una parte sostanziale dei ratti costantemente esclusi dalle sperimentazioni a causa di acquisizione senza successo e / o tasso di risposta insufficiente.
Al contrario, con questo protocollo, vi presentiamo un metodo semplice ma efficace per l'acquisizione e il mantenimento di orale auto-somministrazione di un etanolo al 20% in soluzione acquosa che non necessitano privazione di acqua, di saccarosio / dissolvenza la saccarina o formazione accesso esteso. Una recente indagine ha scoperto che auto-somministrazione di etanolo orale mostra una curva dose-risposta rovesciata a forma di U con più alta assunzione di etanolo durante l'autosomministrazione ad una concentrazione di etanolo 20%, fornendo così un razionale per la selezione di una soluzione di etanolo al 20% nel nostro sperimdisegno ental 11.
Protocollo
Tutte le procedure sono condotte in conformità con la guida NIH per la cura e l'uso di animali da laboratorio.
1. Animal Care and Housing
- All'arrivo nella colonia, ratti maschi Wistar casa pesa 200 - 225 g all'arrivo a coppie in temperatura (21 ° C) e l'ambiente a umidità controllata con un ciclo luce-buio 12 h invertita.
Nota: In base alla logica degli esperimenti, i ratti possono essere alloggiati. - Lasciare i ratti per acclimatarsi al vivaio e il ciclo luce per almeno una settimana prima di iniziare un esperimento e gestirli tutti i giorni. Pesare gli animali una volta alla settimana.
- I ratti libero accesso a chow e acqua di rubinetto per la durata dell'esperimento (privazione di acqua non è necessario avviare rispondere 12). Effettuare tutti i test comportamentali durante la fase buia del ciclo luce-buio in una stanza buia test.
Nota: Anche se abitualmente uso adulti, giovani e ratti maschi Wistar (giorni postnatali 62 - 65), il pROTOCOLLO può teoricamente essere adatto per indagare altri ceppi di ratti, nonché le differenze di sesso e / o di età.
2. Formazione operante
- Si effettuano tutte le formazione comportamentale e test in camere operante identici misura 30,5 × 29,2 × 24,1 cm e contenente pavimenti a griglia e padelle rifiuti allineati con biancheria da letto (cambio tra gli animali per ridurre le tracce olfattive), ospitato in cubicoli suono attenuando dotate di aspiratori per la ventilazione .
Nota: I ratti sono formati da operante condizionata dal giorno 1 di formazione (una risposta su una leva è necessaria per ottenere un rinforzo) tra + 1 h e + 8 h del ciclo scuro. Non vi è alcun pre-esposizione ad alcool, né cibo o sagomatura fluido prima dell'allenamento di alcol. - Dotare ogni camera operante con le luci di stimolo, pompe siringa e due leve retrattili posizionati lateralmente ad una presa tazza liquido. camere di interfaccia e di controllo da parte di un computer utilizzando il software appropriato.
Nota:La maggior parte dei fornitori forniranno pacchetti di auto-amministrazione che contengono tutti i componenti necessari, nonché il software e le interfacce necessarie per controllare le camere. - Scrivere un programma operante condizionata che avvia il programma a rapporto fisso (FR) del 20% rinforzo etanolo (un programma operante in cui una risposta è rinforzato solo dopo un determinato numero di risposte) secondo le istruzioni del produttore. Ad esempio, in un rapporto fisso-1, ratti devono produrre una risposta per ottenere un rinforzo (vedere la sezione supplementare codice Files per un esempio di un programma FR1). Eseguire i seguenti comandi.
- Estensione due leve per segnare l'inizio della sessione e per segnalare la disponibilità di alcol.
Nota: Premendo la leva sulla leva associata con etanolo (attivo) è premiata con la consegna di un volume di 100 ml di etanolo al 20% in acqua nella adiacente bere bene e avvia una concomitante 5-s periodo di timeout segnalato dal illuminazione dellacue-luce sopra la leva. La cue-luce viene introdotto il giorno 1 della formazione. - Durante il periodo di time-out, record di rispondere anche se non ha alcuna conseguenza di linea. Registra le risposte dall'altro leva (inattivo), anche se non hanno mai conseguenze comportamentali. Nota: La leva inattiva serve come controllo per valutare il comportamento non specifico.
- Registrare il numero di risposte sulla leva attiva (tassi di risposta) e il numero del 20% di etanolo premi guadagnati.
- Dopo 30 min sono trascorsi, ritrarre le due leve per segnalare la fine della sessione e per segnalare la fine della disponibilità alcool.
- Salvare e archiviare tutti i dati.
- Estensione due leve per segnare l'inizio della sessione e per segnalare la disponibilità di alcol.
- Prima di iniziare la sessione di allenamento, verificare il corretto funzionamento di tutti i dispositivi in ciascuna camera operante (leve retrattili, dispensatore di liquidi).
- Preparare la soluzione di etanolo v / v 20% da 190 Proof (95%) di etanolo diluito in acqua di rubinetto.
Nota: Etanolo in soluzione può essere conservata a temperatura ambiente. Dipendentedel produttore, soluzioni magazzino etanolo può essere fino a 99,98%. Si noti inoltre che, mentre in manoscritti più pubblicati, le concentrazioni di etanolo sono generalmente presentate come volume / volume, alcuni li possono presentare in peso / volume. - Riempire la siringa con la soluzione di etanolo al 20% e fare in modo che non ci siano perdite o bolle d'aria nelle linee di infusione. spingere manualmente un piccolo volume di etanolo attraverso le linee di infusione per assicurarsi che l'etanolo viene erogato correttamente nella presa dalla prima risposta rinforzato. Asciugare la presa con un tovagliolo di carta e accertarsi che sia vuota prima di iniziare la sessione.
- Caricare il software che controlla il programma di FR del 20% di etanolo rinforzo
- Treno operant- e ratti droga ingenuo in un programma FR1 ad auto-somministrarsi il 20% di etanolo senza privazione di acqua durante le sessioni di 30 min.
- Trasportare i ratti dal vivaio alla sala prove utilizzando una gabbia di trasporto.
- Assegnare ogni ratto di una camera.Prendere ogni singolo ratto dalla gabbia di trasporto e metterlo nella camera di auto-somministrazione assegnato.
- Cercate di mantenere le condizioni dell'esperimento coerenti ogni giorno. Pertanto, verificare sempre i ratti nella stessa camera di auto-somministrazione o meno nello stesso tempo ogni giorno.
- Avviare il software che avvia il programma FR1 del 20% rinforzo etanolo.
- Alla fine della sessione, rimuovere i ratti dalle camere autosomministrazione e restituirli al vivaio.
- Per confermare manualmente che la soluzione alcol è consumato dagli animali, utilizzare un tovagliolo di carta e verificare se il recipiente è essiccato. In alternativa, utilizzare un 1 o 2 siringa mL e raccogliere il liquido rimanente nel recipiente di stimare il volume che non si consuma.
Nota: Per una misurazione più precisa (ma anche più costoso), è possibile dotare ciascuna camera con un sistema lickometer collegato alla presa tazza liquido che permette un conteggio preciso del leccares prodotta dai ratti durante la sessione autosomministrazione. - Pulire la griglia pareti e pavimento di ciascuna camera con un disinfettante superficiale.
- Dopo l'uso, mantenere le linee di infusione da loro pulizia con una soluzione di etanolo al 70%. Quando non in uso, inserire il tappo per evitare muffe e polvere.
- Dopo ogni sessione, raccogliere e analizzare i dati generati. Più in particolare, calcolare il numero medio di presse a leva attivi, il numero medio di premi alcool ottenuto nonché il numero medio di presse a leva inattive.
Nota: Nella maggior parte dei documenti, il consumo di alcol è anche presentata come l'assunzione di etanolo in g / kg (peso corporeo). assunzione etanolo può essere calcolato utilizzando la seguente formula:
Con il volume consumato (ml) - numero di premi guadagnati ± unitaria del volume / rendimento e la densità di etanolo a temperatura ambiente - 0.789 g / mL.
Ad esempio, se un ratto peso 400 g guadagnato 20 rewaRDS di soluzione al 20% v / v di etanolo: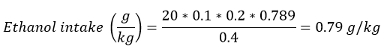
- Condurre sessioni 5/6 giorni a settimana fino a stabilizzazione di prestazioni (definito come un minimo di 15 sedute e nessun cambiamento superiore al 15% del numero totale di premi guadagnati durante gli ultimi 3 sessioni).
Nota: Una volta che i ratti hanno raggiunto una linea di base stabile sulla FR1, il programma di condizionamento operante può essere modificato in base alle istruzioni del produttore per aumentare il numero di risposte necessarie per ottenere un premio di alcol. L'a rapporto fisso può per esempio essere aumentata a FR2 o FR3 per minimizzare rinforzo accidentali. - Misurare le concentrazioni di etanolo nel sangue:
- Per confermare che i premi ottenuti in una sessione di autosomministrazione sono consumati dai topi, misurare le concentrazioni di etanolo nel sangue seguenti auto-somministrazione. Una volta che i ratti hanno raggiunto una linea di base stabile, raccogliere il sangue dalla vena della coda laterale subito dopola sessione. Inserire un ago G 23 nel vaso sanguigno e raccogliere 50 campioni di sangue microlitri utilizzando un tubo capillare.
- Trasferire i campioni di sangue di 50 ml 10 fiale spazio di testa ml e aggiungere 50 ml di 1: alcool isopropilico 1000 come standard interno. Preparare una curva standard 10-300 mg / dL dagli standard di etanolo. Campioni di processo con un campionatore a spazio di testa con una colonna cromatografica 13 secondo le impostazioni del produttore.
- rapporto progressive
- Utilizzare programmi progressivi rapporto (PR) per valutare la motivazione degli animali di consumare una ricompensa 14. PR è un programma operante in cui il numero delle risposte per verificarsi un rinforzo viene aumentata gradualmente (in altri termini, i ratti devono lavorare di più per ogni premio successive).
Nota: Contrariamente a FR sessioni, una sessione di PR non è a tempo e sarà terminata solo dopo 30 minuti è trascorso senza un rapporto di completamento.- Mettere i topi nelle loro caselle operante assegnate e permettereloro di reagire per 20% di etanolo in un programma PR di rinforzo: Mantenere tutte le condizioni sperimentali identici a quelli utilizzati nella pianificazione FR (vedi passo 2.3), tranne aumentare le esigenze di risposta o costo entro sessione (cioè, il numero di presse a leva richiesto sulla leva attiva per ricevere un singolo premio etanolo) secondo la seguente formula: 1, 2, 3, 4, 6, 8, 10, 12, 16, 20, 24, 28, 32 ... Nota: un esempio di programma di PR è fornita nella sezione supplementare Codice Files.
- Terminare la sessione di PR una volta 30 minuti è trascorso senza una ricompensa.
Nota: Il punto di interruzione è definito come l'ultimo requisito risposta completa durante la sessione PR.
- Utilizzare programmi progressivi rapporto (PR) per valutare la motivazione degli animali di consumare una ricompensa 14. PR è un programma operante in cui il numero delle risposte per verificarsi un rinforzo viene aumentata gradualmente (in altri termini, i ratti devono lavorare di più per ogni premio successive).
3. verificare la validità predittiva di un modello operante di alcol autosomministrazione
Nota: Una volta che i ratti hanno acquisito una linea di base stabile di auto-somministrazione (vedi punto 2), è possibile valutare la validità predittiva del modello datestare l'efficacia di naltrexone, un farmaco attualmente approvato dalla FDA per la dipendenza da alcol nel ridurre del 20% di etanolo auto-somministrazione. Si consiglia facendo questo test sul più alto FR raggiunta durante l'allenamento (FR2), quando le risposte sono affidabile alto. Una volta che la validità predittiva è stabilito, il modello può essere utilizzato per valutare nuovi farmaci candidati.
- Prima giornata di test, dare ratti iniezioni saline sottocutanee 30 minuti prima di sessioni di auto-somministrazione a loro abituarsi alla iniezione durante un minimo di due sessioni di auto-somministrazione consecutivi o fino a quando la risposta per l'etanolo non è influenzato dalle iniezioni di soluzione salina (definiti come nessun cambiamento superiore al 15% del numero totale di premi guadagnati nel corso degli ultimi 2 sessioni).
- Sciogliere naltrexone in soluzione salina e regolare il pH di raggiungere la neutralità per facilitare le iniezioni agli animali. Iniettare il farmaco ad un volume di 1,0 ml / kg 30 min prima di una sessione, utilizzando la via di somministrazione sottocutanea. Nota: Il litrotura fornisce una buona prova per la scelta della dose tra gli intervalli di 0,1 - 1 mg / kg, in modo da 0.1, 0.3 e 1 mg / kg sono utilizzati in questo protocollo.
Nota: La ricerca indica l'uso di entrambi i percorsi sottocutaneo e intraperitoneale di amministrazione per il naltrexone, anche se la loro potenza può variare con iniezione sottocutanea di essere 30 volte più potente che le iniezioni intraperitoneali 15. Per questo motivo, si consiglia di utilizzare la via sottocutanea, come l'uso di questo percorso per l'iniezione di naltrexone è stato convalidato e replicato da vari laboratori in un range di concentrazione compresa tra 0,1 e 1 mg / kg 12,15,16. - Durante il giorno di prova, iniettare topi in un ordine equilibrato / random in un disegno tra soggetti attraverso uno dei quattro cicli naltrexone dosaggio (0, 0,1, 0,3 e 1 mg / kg) 30 min prima della seduta autosomministrazione.
- Tra ogni ciclo di terapia, permettono ratti di washout del farmaco con un minimo di due sessioni di auto-somministrazione consecutivi o fino a rispondere peretanolo è tornato al basale. Nota: Di conseguenza, al termine della prova, tutti i ratti sono stati iniettati con ciascuna delle quattro dosi.
- Dopo questa fase, selezionare la dose più efficace (1 mg / kg) e testare l'effetto di naltrexone sulla motivazione degli animali di consumare alcol utilizzando una pianificazione rapporto progressivo (vedi punto 2.12).
Risultati
La figura 1 mostra il comportamento di autosomministrazione rappresentativo di ratti Wistar operant- e farmaco-naive (otto diverse coorti per un totale di 239 ratti) addestrati su un programma FR1 ad auto-somministrarsi il 20% di etanolo senza privazione di acqua o la saccarina / saccarosio dissolvenza durante le sessioni di 30 minuti. Con questo protocollo, i ratti avviare la leva premendo per ottenere un premio di etanolo molto rapidamente, già ottenendo più di 10 pr...
Discussione
Con questo protocollo, vi presentiamo un nuovo metodo per acquisire e mantenere stabile orale di auto-somministrazione di etanolo al 20% nei ratti che, contrariamente ai modelli classici di etanolo autosomministrazione, non richiedono l'uso di privazione di acqua, la formazione accesso esteso, o la saccarina / saccarosio dissolvenza 12. Inoltre, il naltrexone, un farmaco attualmente approvato dalla FDA per la dipendenza da alcol, diminuisce con successo alcol auto-somministrazione e la motivazione per con...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal Consiglio svedese per la ricerca.
Materiali
| Name | Company | Catalog Number | Comments |
| Extra Tall MDF Sound Attenuating Cubicle, Interior: 22"W x 22"H x 16"D | Med Associates Inc. | ENV-018MD | |
| Extra Tall Modular Test Chamber with modified Top, Waste Pan and Photobeam | Med Associates Inc. | ENV-007CT-PH | |
| Stainless Steel Grid Floor for Rat or Small Primate | Med Associates Inc. | ENV-005 | |
| Retractable Lever | Med Associates Inc. | ENV-112CM | 2 by SA chambers |
| Stimulus Light, 1" White Lens, Mounted on Modular Panel | Med Associates Inc. | ENV-221M | 2 by SA chambers |
| Dual Cup Liquid Receptacle with 18 ga Stainless Steel Pipes | Med Associates Inc. | ENV-200R3AM | |
| Single Speed Syringe Pump, 3.33 rpm | Med Associates Inc. | PHM-100 | |
| Liquid Delivery Kit | Med Associates Inc. | PHM-122-18 | |
| SmartCtrl 8 Input / 16 Output Package | Med Associates Inc. | DIG-716P2 | |
| MED-PC software | Med Associates Inc. | SOF-735 | |
| http://www.mednr.com/ | Med Associates Inc. | A website that is open-source and has been created to offer researchers a place to exchange MEDState Notation code | |
| Kendall Monoject 20 cc Syringes, Regular Luer Tip | VWR International | MJ8881-520657 | |
| Ethanol, Pure, 190 Proof (95%), USP, KOPTEC | Decon Labs | 2801 | |
| 0.9% Sodium Chloride Injection, USP | Hospira | 0409-4888-50 | |
| Naltrexone hydrochloride | Sigma Aldrich | N3136-1G | |
| 23 G BD PrecisionGlide Needles | BD | 305145 | |
| Minivette POCT 50 µL, K3EDTA | Sarstedt | 17.2113.150 | For capillary blood collection |
Riferimenti
- Koob, G. F., et al. Animal models of motivation for drinking in rodents with a focus on opioid receptor neuropharmacology. Recent developments in alcoholism : an official publication. of the American Medical Society on Alcoholism, the Research Society on Alcoholism, and the National Council on Alcoholism. 16, 263-281 (2003).
- Samson, H. H. Initiation of ethanol reinforcement using a sucrose-substitution procedure in food- and water-sated rats. Alcoholism, clinical and experimental research. 10, 436-442 (1986).
- Weiss, F., Mitchiner, M., Bloom, F. E., Koob, G. F. Free-choice responding for ethanol versus water in alcohol preferring (P) and unselected Wistar rats is differentially modified by naloxone, bromocriptine, and methysergide. Psychopharmacology. , 178-186 (1990).
- Koya, E., et al. Role of ventral medial prefrontal cortex in incubation of cocaine craving. Neuropharmacology. 56, 177-185 (2009).
- Karlsson, R. M., Kircher, D. M., Shaham, Y., O'Donnell, P. Exaggerated cue-induced reinstatement of cocaine seeking but not incubation of cocaine craving in a developmental rat model of schizophrenia. Psychopharmacology. , 45-51 (2013).
- Augier, E., Vouillac, C., Ahmed, S. H. Diazepam promotes choice of abstinence in cocaine self-administering rats. Addiction biology. 17, 378-391 (2012).
- Cantin, L., et al. Cocaine is low on the value ladder of rats: possible evidence for resilience to addiction. PloS one. 5, (2010).
- Lenoir, M., Serre, F., Cantin, L., Ahmed, S. H. Intense sweetness surpasses cocaine reward. PloS one. 2, (2007).
- Spangler, R., et al. Opiate-like effects of sugar on gene expression in reward areas of the rat brain. Brain research. Molecular brain research. , 134-142 (2004).
- Rassnick, S., Pulvirenti, L., Koob, G. F. SDZ-205,152, a novel dopamine receptor agonist, reduces oral ethanol self-administration in rats. Alcohol. 10, 127-132 (1993).
- Carnicella, S., Yowell, Q. V., Ron, D. Regulation of operant oral ethanol self-administration: a dose-response curve study in rats. Alcoholism, clinical and experimental research. 35, 116-125 (2011).
- Augier, E., et al. Wistar rats acquire and maintain self-administration of 20 % ethanol without water deprivation, saccharin/sucrose fading, or extended access training. Psychopharmacology. , (2014).
- Macchia, T., et al. Ethanol in biological fluids: headspace GC measurement. Journal of analytical toxicology. 19, 241-246 (1995).
- Hodos, W. Progressive ratio as a measure of reward strength. Science. 134, 943-944 (1961).
- Williams, K. L., Broadbridge, C. L. Potency of naltrexone to reduce ethanol self-administration in rats is greater for subcutaneous versus intraperitoneal injection. Alcohol. 43, 119-126 (2009).
- Czachowski, C. L., Delory, M. J. Acamprosate and naltrexone treatment effects on ethanol and sucrose seeking and intake in ethanol-dependent and nondependent rats. Psychopharmacology. , 335-348 (2009).
- Stromberg, M. F., Volpicelli, J. R., O'Brien, C. P. Effects of naltrexone administered repeatedly across 30 or 60 days on ethanol consumption using a limited access procedure in the rat. Alcoholism, clinical and experimental research. 22, 2186-2191 (1998).
- Stromberg, M. F., Casale, M., Volpicelli, L., Volpicelli, J. R., O'Brien, C. P. A comparison of the effects of the opioid antagonists naltrexone, naltrindole, and beta-funaltrexamine on ethanol consumption in the rat. Alcohol. 15, 281-289 (1998).
- Gonzales, R. A., Weiss, F. Suppression of ethanol-reinforced behavior by naltrexone is associated with attenuation of the ethanol-induced increase in dialysate dopamine levels in the nucleus accumbens. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 10663-10671 (1998).
- Biggs, T. A., Myers, R. D. Naltrexone and amperozide modify chocolate and saccharin drinking in high alcohol-preferring P rats. Pharmacology, biochemistry, and behavior. 60, 407-413 (1998).
- Beczkowska, I. W., Bowen, W. D., Bodnar, R. J. Central opioid receptor subtype antagonists differentially alter sucrose and deprivation-induced water intake in rats. Brain research. 589, 291-301 (1992).
- Cooper, S. J. Effects of opiate agonists and antagonists on fluid intake and saccharin choice in the rat. Neuropharmacology. 22, 323-328 (1983).
- Samson, H. H., Pfeffer, A. O., Tolliver, G. A. Oral ethanol self-administration in rats: models of alcohol-seeking behavior. Alcoholism, clinical and experimental research. 12, 591-598 (1988).
- Koob, G. F., Weiss, F. Pharmacology of drug self-administration. Alcohol. 7, 193-197 (1990).
- Schank, J. R., et al. The Role of the Neurokinin-1 Receptor in Stress-Induced Reinstatement of Alcohol and Cocaine Seeking. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. , (2013).
- Avena, N. M., Bocarsly, M. E., Rada, P., Kim, A., Hoebel, B. G. After daily bingeing on a sucrose solution, food deprivation induces anxiety and accumbens dopamine/acetylcholine imbalance. Physiology. 94, 309-315 (2008).
- Avena, N. M. The study of food addiction using animal models of binge eating. Appetite. 55, 734-737 (2010).
- Morgan, D., Sizemore, G. M. Animal models of addiction: fat and sugar. Current pharmaceutical design. 17, 1168-1172 (2011).
- Lenoir, M., Cantin, L., Vanhille, N., Serre, F., Ahmed, S. H. Extended heroin access increases heroin choices over a potent nondrug alternative. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 38, 1209-1220 (2013).
- Augier, E., et al. The mGluR2 Positive Allosteric Modulator, AZD8529, and Cue-Induced Relapse to Alcohol Seeking in Rats. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 41, 2932-2940 (2016).
- Bice, P. J., Kiefer, S. W. Taste reactivity in alcohol preferring and nonpreferring rats. Alcoholism, clinical and experimental research. 14, 721-727 (1990).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon