Method Article
Bioreattori fibra cava per
In questo articolo
Riepilogo
Il comportamento funzionale delle cellule in coltura può essere migliorata coltivando in più in vivo -come ambienti di coltura 3 dimensioni 16-21. Questo manoscritto descrive il set-up e il funzionamento di un sistema a fibra cava bioreattore per vivo -come mammiferi coltura di tessuti in.
Abstract
Tissue culture has been used for over 100 years to study cells and responses ex vivo. The convention of this technique is the growth of anchorage dependent cells on the 2-dimensional surface of tissue culture plastic. More recently, there is a growing body of data demonstrating more in vivo-like behaviors of cells grown in 3-dimensional culture systems. This manuscript describes in detail the set-up and operation of a hollow fiber bioreactor system for the in vivo-like culture of mammalian cells. The hollow fiber bioreactor system delivers media to the cells in a manner akin to the delivery of blood through the capillary networks in vivo. The system is designed to fit onto the shelf of a standard CO2 incubator and is simple enough to be set-up by any competent cell biologist with a good understanding of aseptic technique. The systems utility is demonstrated by culturing the hepatocarcinoma cell line HepG2/C3A for 7 days. Further to this and in line with other published reports on the functionality of cells grown in 3-dimensional culture systems the cells are shown to possess increased albumin production (an important hepatic function) when compared to standard 2-dimensional tissue culture.
Introduzione
Coltura tissutale è una tecnica consolidata per la crescita e / o manutenzione di celle che è stato utilizzato per oltre 100 anni 1,2. La convenienza di cellule che studiano e risposte ex vivo ha vasta portata vantaggi consentendo esperimenti che altrimenti sarebbe estremamente difficile se non impossibile, per esempio la generazione di linee cellulari geneticamente e l'uso di cellule reporter high throughput saggi di screening 3. Più recentemente coltura tissutale ha dato origine al campo dell'ingegneria dei tessuti, per la generazione di modelli in vitro e per la medicina rigenerativa. Con queste applicazioni, l'interesse dinamici sistemi di coltura 3 dimensioni (3D) è cresciuto significativamente.
Metodi di coltura 3D (definiti qui come substrato coltura 3D e / o l'introduzione di flusso dinamico direzionale) meglio ricapitolare in architettura l'ambiente cellulare in vivo, importante per ottenere unpiù funzione fisiologica-like. La capacità di estrarre, crescere, differenziare e le cellule di trapianto, con l'obiettivo di riparare tessuti malati e danneggiati è un campo di studio che ha un enorme potenziale per il beneficio del paziente e l'opportunità commerciale. Ad esempio l'uso di cheratinociti autologhi per il trattamento di ustioni (vedi 4) e l'uso di terapie basate sulle cellule per il trattamento di ictus (vedi 5). Allo stesso modo, il mercato per i modelli in vitro si estende scoperta di nuovi farmaci per applicazioni di medicina stratificati. La convenzione in coltura tissutale è la crescita di tipi cellulari dipendenti aderenti o ancoraggio sul (2D) superficie di un pallone di coltura tissutale 2-dimensionale. Mentre attualmente accettato come il gold standard in un ambiente di ricerca, di recente interesse per applicazioni di ingegneria dei tessuti ha messo in evidenza il fatto che l'attuale ambiente di coltura tissutale 2D è inadeguata per lo scale-up richiesto nella produzione di celle 6.
Per i tipi di cellule aderenti un scaffolè richiesta d, che variano a seconda dell'uso finale, sia in termini di composizione chimica e le proprietà meccaniche. Alcuni sistemi utilizzano ponteggi come inserti ben piatto, comprensivi di matrice altamente porosa formata da alta template emulsione fase interna (vedi 7) o fibre elettrofilate (vedi 8) che richiedono l'adattamento minimo da tecniche di coltura convenzionale 2D. Le celle possono essere seminate su microcarriers di composizioni diverse e coltivate in vasche agitati che forniscono nutrienti e molecole di segnalazione, e portano via i prodotti di scarto (trasporto di massa) attraverso un dinamico ambiente ben miscelato 9. Tuttavia, questi sistemi sono limitati nel loro ambiente in vivo -come e ulteriori miglioramenti possono essere fatti per quanto riguarda i costi di scale-up. Bioreattori fibra cava (HFBs) sono un sistema di coltura 3D che consistono di fibre fissi in un modulo con celle tipicamente seminate all'esterno delle fibre porose e supporto fornito attraverso il lume della fibra (recensione in 10) (Figura 1). HFBs offrono un vivo ambiente -come con le fibre mimano capillari sanguigni e schermatura le cellule dagli sforzi di taglio associati media delivery dinamico, consentendo velocità definito da applicare alle cellule tramite il flusso di fluido attraverso le luci laterali, se desiderato. Questo crea un sistema di coltura versatile con trasporto di massa superiore in cui densità elevata di cellule possono essere raggiunti 11. Il sistema HFB è adatto per la manutenzione dei tipi cellulari dipendenti ancoraggio ed è stato utilizzato per la cultura varie cellule compresi ratto isole pancreatiche di Langerhans 12, β-TC-3 topo linea cellulare insulinoma 12, epatociti umani primari 13, osso umano le cellule del midollo mononucleate 14, le cellule Madin Darby canine di rene (MDCK) 15 e cellule Caco-2 16 solo per citarne alcuni.
Oltre ai vantaggi del sistema di trasferimento di massa e di scale-up, cellule coltivate in 3D tissistemi di coltura Sue tendono ad essere più in vivo -come nella morfologia e più reattivo agli stimoli sperimentali. Per esempio ratto epatociti primari mostrano una morfologia più cubica, una maggiore vitalità, una maggiore induzione di attività enzimatica del citocromo P450-e una maggiore sensibilità alla tossicità paracetamolo, se coltivate in un ponteggio di polistirene disponibile in commercio rispetto alle cellule in coltura 2D 17. Utilizzando la stessa impalcatura linea cellulare HepG2 epatocarcinoma ha anche dimostrato di aumentare la produzione di albumina 18 e mostra una più vivo -come risposta al metotrexato rispetto a cellule coltivate 2D 19. Epatociti umani primari dimostrato dedifferentiation ritardato, una maggiore attività del citocromo P450-e della clearance per 4/5 composti testati in un sistema di coltura di perfusione 20. cellule staminali neurali umane neuroni e glia derivati coltivate in un ponteggio di polistirene disponibile in commercio esposte sia alta (potenziale d'azione) e bassa frequeNCY (potenziale campo locale) attività spontanea mentre nessuna attività neuronale è stata rilevata nelle cellule in coltura 2D 21. Cellule Caco-2 hanno dimostrato una maggiore differenziazione in un HFB rispetto alla cultura 2D misurata da un aumento della fosfatasi alcalina, γ-glutamiltransferasi e l'attività P-glicoproteina e più alta espressione di F-actina e Zona occludere-1 proteina 16. Nonostante i vantaggi, la coltura di routine delle cellule in sistemi diversi da una superficie pallone di coltura tissutale 2D viene ancora praticata in molti laboratori, sebbene il numero di pubblicazioni citano coltura cellulare 3D cresce (incremento di 8 volte negli ultimi 10 anni. Fonte : PubMed 'Risultati per Anno' strumento sondato con 'la cultura 3D').
Questo manoscritto descrive il set-up e condizioni di funzionamento di un sistema HFB per colture cellulari di mammifero e dimostra la sua utilità nella coltura della linea cellulare HepG2 epatocarcinoma / C3A. Lo scopo di questo metodo è quello di coltivare le cellule inuna in vivo -come sistema più cultura che mantiene abbastanza semplice per renderlo suscettibile di coloro che sono nuovi per sistemi di coltura 3D. La logica che sta dietro all'uso HFBs nell'applicazione descrivere qui, che è quello di migliorare la prevedibilità dei modelli di fegato è che è teoricamente possibile imitare una sinusoide epatica all'interno dell'ambiente HFB 22. Ciò non è attualmente possibile con altri sistemi di coltura.
Protocollo
1. fibre
- Fabbricazione delle fibre di inversione di fase di spin fusione (spinning). Dettagli di questo metodo si possono trovare in 23,24.
NOTA: Per questo lavoro le fibre sono prodotti internamente utilizzando un polimero proprietario non biodegradabile, NMP come solvente e H 2 O come non solvente. Dettagli di altri polimeri adatti possono essere trovati nella discussione. Le fibre utilizzate nel sistema qui descritto sono 1,05 millimetri di diametro esterno con un diametro del lume 600-700 micron. Le fibre sono porosi con diametri dei pori di misura 2,28 micron ± 1,5 micron (media ± deviazione standard). Questo è stato progettato per separare le cellule dal feed dei media nel lume della fibra, replicando la sinusoide di fegato o di vascolarizzazione di altri tessuti. Le fibre possono anche essere acquistati da fornitori di membrana quali Pall.
2. Modulo Fabrication
NOTA: I moduli utilizzati in questo studio sono fatti partire da 1 mm di spessore vetro borosilicato con 2 porte laterali(Figura 2A). Le fibre del modulo descritto presentano una superficie esterna del 4,95 cm 2, che è l'equivalente di circa la metà di un pozzetto di una piastra da 6 pozzetti.
- Moduli Siliconize prima del primo utilizzo rivestendo la superficie interna con Sigmacote (Tabella 1) e lasciando asciugare in una cappa aspirante. Autoclave (121 ° C, 1 atm, 20 min) per aumentare la durata del trattamento.
- Usando un bisturi tagliare fibre 75 mm di lunghezza e inserire tre fibre in ogni modulo lasciando ~ 7 mm di lunghezza in eccesso ad ogni estremità (Figura 3A).
- Inserire ~ 0,5 ml di colla di silicone (Tabella 1) in una barca pesatura. Utilizzare una punta P200 pipetta per raccogliere una piccola quantità di silicone e lavorare la colla nelle estremità del modulo attorno alle fibre per formare un tappo di 3-5 mm (figura 3B). Lasciare asciugare per> 3 ore.
- Usando un bisturi tagliare il filo di silicone con il modulo di vetro estremità (Figura 3C).
- avvolgere unpiccola quantità (~ 4 strati) di politetrafluoroetilene (PTFE) di nastro intorno una porta laterale.
3. Installazione del sistema e sterilizzazione
NOTA: il tubo della pompa e moduli con fibre non vengono sterilizzati in autoclave e sono sterilizzati con etanolo al 70%. Gli autori suggeriscono calibrare il tubo della pompa con la pompa da utilizzare. La seguente procedura viene eseguita in una cappa a flusso laminare.
- Autoclave (come sezione 2.1) tutti i componenti autoclavabili prima di set-up.
- Impostare
- Introdurre 10 ml di etanolo 70% nella bottiglia serbatoio e impostare il flacone serbatoio, tappo Q-serie, tubo di alimentazione, pompa e tubo della pompa (Tabella 1) come in figura 4.
- Liberamente posizionare un tappo sul porto lato PTFE-registrato. Far scorrere le estremità dei connettori dei moduli L / S16 sopra le estremità del modulo e la porta lato libero. Collegare una sezione di 40 mm L / S13 tubo al connettore del modulo più vicino alla porta laterale ridotta (Tabella 1) come in Figura 2B .
- Collegare il modulo alla tubazione della pompa, garantendo per orientare il modulo di modo che la porta lato ricoperto è più vicino alla pompa.
- Collegare la linea del permeato e la linea del retentato ai connettori del modulo e L / S14 del connettore a Y sulla bottiglia serbatoio (Tabella 1). Assicurarsi che il set-up assomiglia gli schemi in figura 4.
- Sterilizzazione
- Pompare etanolo attraverso il modulo a 800 ml / h (267 ml / h per fibra) per un tempo sufficiente per il trattamento di componenti unautoclaved per> 30 min (regolare volte se si utilizzano altri metodi di sterilizzazione; vedi 25).
- lavaggio
- Per lavare l'etanolo dal sistema, spegnere la pompa e svuotare il tubo. Innanzitutto, staccare il tubo della pompa dal tubo modulo adattatore. Tenere il modulo in alto per drenare l'etanolo dalla linea fibre e retentato, nella bottiglia serbatoio. Togliere il tappo di chiusura della porta lato dal modulo per drenare °e etanolo dal modulo stesso, e la linea del permeato. Rimontare il tappo di chiusura della porta laterale. Invertire il flusso dei mezzi sulla pompa per drenare il tubo della pompa e la linea di alimentazione di etanolo. Spegnere la pompa e ricollegare il tubo della pompa all'adattatore modulo.
- Svitare la bottiglia etanolo dal coperchio e sostituirlo con un flacone contenente 10 ml di terreno di coltura cellulare (come EMEM, GMEM, DMEM o RPMI) senza siero. Pompa il mezzo attraverso il sistema a 800 microlitri / hr finché la linea retentato è pieno di carta. Fissare la linea retentato forzare permeazione dei media attraverso le fibre per lavare il modulo. Lavare per ~ 2 ore.
4. Semina
NOTA: I media e gli integratori utilizzati in questo protocollo dovrebbero essere quelli che sono fissati per il tipo cellulare desiderato. Si prega di fare riferimento alla letteratura, la collezione europea di colture cellulari (ECACC) e American Type Culture Collection (ATCC) per ulteriori informazioni. Prima di questo metodo le cellule dovrebbero essere maintaINED secondo i protocolli stabiliti per il tipo cellulare desiderato. Per questo lavoro la linea cellulare HepG2 epatocarcinoma / C3A sottoclone sono stati mantenuti secondo le raccomandazioni dei distributori (ATCC).
NOTA: Il protocollo di semina presentato di seguito serve anche a pre-coltura modulo con terreno di coltura cellulare prima della crescita cellulare. Se un più ampio precoltura essere necessaria allora questo dovrebbe essere effettuata prima semina modulo drenando media lavata dal sistema, sostituendoli con terreni di crescita e permea questo attraverso il modulo per alcune ore. Vedere la sezione 7.5.2.1 per dettagli sulla sostituzione dei media nel sistema.
- Preparare una sospensione singola cella da tripsinizzazione secondo i protocolli stabiliti per il tipo cellulare desiderato. Un protocollo generale per una cultura T75 è il seguente:
NOTA: Il numero di cellule da utilizzare nella fase di semina dovrebbe essere empiricamente determinato per il tipo cellulare desiderato. I bioreattori qui descritti sono seminate in un cel 35 volte più altoDensità ls (cellule / cm 2) a quella adatta 2D plastica coltura tissutale per una cultura di 7 giorni.- Lavare le cellule aggiungendo 10 ml di tampone fosfato salino (PBS), aspirare, quindi aggiungere 3 ml 0,05% tripsina acido etilendiamminotetraacetico (EDTA) (sufficiente a coprire le cellule) e incubare a 37 ° C, 5% CO 2 per 5 min.
- Celle di raccolta in 7 ml mezzi di crescita integrate con siero fetale bovino al 10% (FBS) per neutralizzare la tripsina. Mescolare bene, aggiungere 10 ml alla camera di un emocitometro e contare le cellule.
- Centrifugare a 200 xg per 5 minuti per far sedimentare le cellule.
- Aspirare le cellule surnatante e risospendere a 4x10 6 / ml in terreni di crescita integrati come richiesto per il tipo cellulare desiderato.
- Spegnere la pompa e svuotare il tubo di alimentazione e il modulo come in 3.4.1.
- Staccare il modulo dai connettori del modulo e allegare tappi modulo (Tabella 1) pre-sterilizzati in etanolo al 70%, lasciando una porta lato libero.
- Trasferire ~ 500 microlitri della sospensione cellulare (2x10 6 cellule) (4.1.4) al modulo usando una siringa 18 ago G e 1 ml, avendo cura di evitare la formazione di bolle e di non danneggiare le fibre.
- Chiudere la porta di lato con una testata. Incubare le cellule a 37 ° C, 5% CO 2 per 2-4 ore con rotazione manuale del modulo di 180 ° ogni 5 min. In alternativa, i moduli possono essere collegati ad un rotatore tubo con una regolazione di miscelazione intermittente (Tabella 1).
- Dopo la semina, allegare un tappo su una porta di iniezione (Tabella 1) pre-sterilizzati in etanolo al 70%, e collegare questo alla porta lato PTFE-registrato. Rimuovere l'altro tappo porta laterale e svuotare lentamente le cellule iniettando aria nella porta di iniezione attaccato con un 27 G ago e siringa da 1 ml.
- Sostituire la porta di iniezione con una testata. Lentamente riempire il modulo con i media utilizzando la porta lato libero e un ago da 18 G con una siringa da 1 ml. Remove le testate modulo e allegare il modulo al tubo utilizzando i connettori del modulo.
- Sostituire la bottiglia mezzi di lavaggio con uno contenente 50 ml di mezzi di crescita e integratori seguito la procedura descritta in 7.5.2.1. Pompare i mezzi di crescita attraverso il sistema a 800 ml / h.
5. proliferazione
NOTA: Le fibre utilizzate nel sistema di ricerca qui descritto sono impostati a permeare a ~ 80 microlitri / h, con una velocità di avanzamento di 800 ml / h.
- Utilizzare le fibre a crescere le cellule per periodi fino a 7 giorni in un incubatore umidificato a 37 ° C, 5% CO 2.
NOTA: Il monitoraggio di nutrienti e metaboliti durante la fase di crescita può fornire informazioni utili sulla proliferazione, l'assorbimento metabolico e l'uscita delle cellule e livelli di nutrienti e metaboliti nei media. Per esempio glucosio utilizzo e produzione di lattato. I kit sono disponibili da vari fornitori in grado di quantificare questi fattori dal supporto (vedi Tabella 1 per quelli utilizzati in questo studio). porte di iniezione possono essere aggiunti al permeato e retentato tubi e supporti campione tramite un ago G 27 e la siringa e media possono essere prelevati dalla bottiglia serbatoio media. Questo dà informazioni nutrienti e metabolismo per l'ingresso e due flussi di uscita. Il campionamento deve essere effettuata in una cappa a flusso laminare. Sterilizzare porte di iniezione prima di campionamento in possesso di un rotolo di etanolo imbevuto blu contro la porta per> 30 sec.
6. escissione
Nota: Le fibre possono essere asportati dal modulo al termine di un esperimento per l'analisi.
- Scollegare e scaricare il HFB.
- Inserire un bisturi / micro lama (Tabella 1) lama tra il vetro e silicone. Ruotare il modulo in modo da tagliare il silicone dal vetro. Ripetere questa procedura su entrambe le estremità del modulo.
- Utilizzando la lama agganciare il tappo di silicone da un capo e tirare delicatamente. Assicurarsi che le fibre vengono con esso.
Analisi 7. cellulare
- il numero di cellule
NOTA: per le cellule C3A utilizzati in questo studio tutti i punti di tempo entro il periodo di sette giorni di crescita sono adatte per l'uso in questo calcolo, come i tassi di crescita non cambiano nel modo sostanziale le densità di cellule ottenuti in questo lasso di tempo.- Dopo l'escissione (sezione 6) immergere le fibre in PBS per lavare e tagliarle in una provetta da 1,5 ml contenente 0,5 ml di Tris EDTA (TE). Oggetto questo per due cicli di gelo-disgelo in una -80 ° C freezer. Misurare il contenuto di DNA usando PicoGreen e determinare il numero di cellule confrontando questo valore con una curva standard fornito con il tipo cellulare desiderato 26.
- i tassi di proliferazione cellulare
- Utilizzando i numeri di cellulare calcolati in due punti temporali diversi calcolare il tasso di crescita specifico μ (Equazione 1) dove Ln (X1) è il logaritmo naturale del numero di cellule al primo punto di tempo e Ln (X2) è il logaritmo naturale della cella numero al secondo punto di tempo.
μ = (Ln (X2) -ln (X1)) / ora (h) (1)
Da questo calcolare i tempi di popolazione raddoppio (DT) (equazione 2) dove μ è il tasso di crescita specifico.
Dt = Ln2 / μ (2)
- Utilizzando i numeri di cellulare calcolati in due punti temporali diversi calcolare il tasso di crescita specifico μ (Equazione 1) dove Ln (X1) è il logaritmo naturale del numero di cellule al primo punto di tempo e Ln (X2) è il logaritmo naturale della cella numero al secondo punto di tempo.
- La vitalità cellulare
- Dopo l'escissione (sezione 6) immergere le fibre in PBS per lavare e tagliarle in una provetta da 1,5 ml contenente 500 ml 0,05% tripsina acido etilendiamminotetraacetico (EDTA). Incubare a 37 ° C per 10 min.
- Mescolare e aggiungere 10 ml di sospensione cellulare a 10 microlitri trypan blu. Carico 10 ml SU UN emocitometro e contare il numero di morti (blu) e cellule vive.
- Imaging
- Dopo l'escissione immergere le fibre in PBS per lavare e usare le forbici per tagliarli in lunghezze più piccoli in un 24-pozzetti. Aggiungere 400 microlitri 4% paraformaldeide (in PBS) ed incubare a temperatura ambiente per 20 min.
- Lavare con PBS pipettando 400 ml e si spegne. Ripetere thipasso s con PBS fresco.
- Aggiungere 400 ml 4 ', 6-diamidino-2-phenylindole (DAPI) diluito in PBS a ca. 100 ng / ml ed incubare a temperatura ambiente per 20 min. Proteggere dalla luce.
- Lavare con PBS due volte (come 7.3.2) e una volta con H 2 O. Aggiungere un mezzo di montaggio a fluorescenza per coprire la fibra e l'immagine immediatamente per raccogliere i dati prima che i campioni secchi (DAPI ex / em; 359/461 nm).
- Prendere immagini in diversi piani focali e utilizzare il software 'focus stacking' (ad esempio, pila plug focheggiatore per ImageJ, qui di seguito) per rendere un'immagine composita che mostra una profondità notevolmente ampliato di campo. Questo è necessario perché le fibre non sono piatte.
- Scarica ImageJ (http://imageJ.nih.gov/ij/) e il plugin 'impilare-focheggiatore' (http://rsb.info.nih.gov/ij/plugins/stack-focuser.html).
- In ImageJ aprono le immagini per essere impilati. Poi nel menu 'Immagine' andare a 'Stacks' - 'Immagini per impilare'. Nel menu 'Plugins' andare a 'Stack focheggiatore'. Specificare un n per il kernel nxn. Prova ed errore con 'n' può essere richiesto al fine di generare un'immagine con po 'di rumore'. Valori compresi tra 11 e 77 tendono a lavorare bene.
- secrezione albumina
NOTA: Si tratta di un test su cellule di epatociti funzione e non una prova generale della funzione delle cellule.- Cellule Seed (HepG2 / C3A) sul 2D tessuto plastico cultura a 10.667 / cm 2 e coltivate per 6 giorni. HFBs Seed, come descritto nella Sezione 4 e crescere per 6 giorni.
- Dopo questo periodo la proliferazione cambiare il terreno di coltura (EMEM + 10% FBS, 1x glutammina e 1x penicillina / streptomicina) per la plastica coltura di tessuti e HFB ad un libero di Williams e supporti siero integrato con glutammina 1x e 1x penicillina / streptomicina per 24 ore:
- Scolate il modulo di tubi e HFB seguendo i passi di cui 3.4.1. Svitare la bottiglia serbatoio e sostituirlo con un flacone contenente il supporto Williams E. Pompare questo attraverso la HFB a 800 ml / h.
- Dopo 24 ore, prelevare campioni dei media. Quantificare l'albumina secreto dalle ELISA secondo le istruzioni del produttore (Tabella 1). Diluire campioni di supporti 1 a 10 a 1 nel 40 prima dell'uso per portare le concentrazioni di albumina nell'intervallo della curva standard.
Risultati
Cellulare semina è un passaggio fondamentale. La capacità delle cellule di aderire alla fibra in un set-up 3D è notevolmente inferiore a quella osservata per 2D plastica coltura tissutale. Ciò è probabilmente dovuto al tempo di contatto ridotta tra cellula e il substrato. Nel HFB cellule cadono attraverso il modulo durante le fasi statiche di semina. Questi sono considerevolmente più breve tempo rispetto a quella fase statica continua utilizzato in 2D. Le cellule devono eseguire connessioni al substrato in questo momento. Inoltre, a causa della natura curva delle fibre non c'è superficie piana per le cellule di riposare e fare collegamenti che ci sia in coltura 2D. Mentre questo può essere aggravato dalla chimica della fibra impiegata sappiamo che questo non è il caso per il polimero impiegato in questo studio (dati non mostrati). Aumentando il tempo di semina e densità di semina cellulare porta alla formazione di aggregati di cellule che cadono attraverso il modulo durante le fasi statiche ad una r veloceate di singole cellule e riduce ulteriormente il tempo di contatto tra le cellule e substrato. Aumentando il tempo comporta anche ingiallimento media come c'è un'alta densità di cellule e nessuno scambio media durante questa fase. Utilizzando le condizioni descritte nella sezione 4 tariffe di semina delle cellule del ~ 15% sono costantemente raggiunto con le cellule HepG2 / C3A (Figura 5A). Mentre questo può essere considerato una frazione a basso ci sono abbastanza cellule per generare fibre ben popolate in una questione di giorni (figure 5B e 6); dopo un periodo di proliferazione di sette giorni la densità cellulare raggiunta nel HFB si avvicina 3x10 5 / cm 2. Si tratta di una densità appropriata per molti saggi che utilizzano epatociti e possono essere considerati raggiungere confluenza.
I tassi di proliferazione conseguiti nel HFB sono più lente rispetto a quello ottenuto in coltura cellulare 2D (Figura 5C). Questo è unprobabilmente a causa della perdita di cellule nel flusso dinamico del sistema, come il conteggio delle cellule nei media sono bassi (media ± SEM: 20,343 cellule ± 3.674 cellule per 24 ore a confluenza, che è il 4% delle cellule totali) e questo non aumenta quando il tasso di permeazione è acceso fino a 400 ml / h (dati non riportati). È anche improbabile che sia dovuto ad una diminuzione della vitalità e conseguente perdita di cellule (Figura 5D e sotto). Essa può essere spiegato, almeno in parte dal fatto questa linea cellulare è stata clonale derivata da HepG2 e selezionato per la sua capacità di mostrare inibizione da contatto della proliferazione cellulare. Le cellule del HFB vengono seminate a 6x la densità delle cellule 2D che possono portare a tassi di proliferazione più lenti.
La vitalità rimane alto per tutto il HFB con cellule che espongono> 90%. Mentre vi è una leggera diminuzione nella vitalità all'estremità di uscita rispetto all'ingresso non è risultata significativa (t-test p = 0,22).
Monitoraggio del consumo di glucosio e la produzione di acido lattico è stato utilizzato per regolare il volume di avanzamento e il supporto del sistema. Utilizzando 800 ml / hr e un volume totale dei media di 50 ml del glucosio e livelli di acido lattico sono mantenuti al di sopra e al di sotto (rispettivamente) quelli visti nella cultura di plastica coltura di tessuti standard.
secrezione albumina è una funzione epatica chiave svolto dagli epatociti. E 'secreta nel siero in cui svolge diversi ruoli nel settore dei trasporti e l'omeostasi. La secrezione di albumina da parte delle cellule coltivate in HFB è 15 volte superiore rispetto a quella in cellule coltivate in 2D (Figura 7). Ciò dimostra le cellule sono funzionali nella HFB e almeno nel caso della secrezione di albumina, questa funzione è alto nel HFB.
jpg "/>
Figura 1. Il vivo -come ambiente in un HFB. Le cellule sono seminate sull'esterno delle fibre porose. Supporto viene fornito attraverso il lume della fibra, mimando un capillare di sangue. (A) sezione longitudinale di una fibra (non in scala). (B) Sezione trasversale di un reattore 3 di fibra. Si prega di cliccare qui per vedere una versione più grande di questa figura.

Figura 2. Il modulo HFB. (A) Le dimensioni del modulo utilizzato in questo studio. Le dimensioni sono state scelte per adattarsi 3 fibre e soddisfare le esigenze del progetto di ricerca in corso. I formati differenti possono essere prodotte e su misura per i singoli sistemi e fibre. (B) Una fotografia della module con connettori tappo e dei moduli allegati. Cliccate qui per vedere una versione più grande di questa figura.
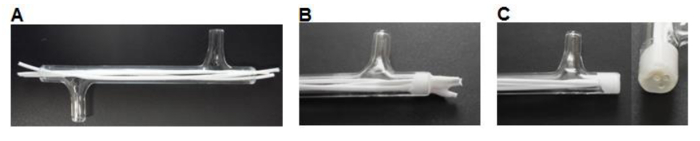
Figura 3. Modulo fabbricazione. (A) Fibre vengono tagliate a misura ed inserito nel modulo. (B) Le fibre sono incollati nel modulo, lasciati asciugare. (C) Le estremità sono tagliate a filo con il vetro. Cliccate qui per vedere una versione più grande di questa figura.
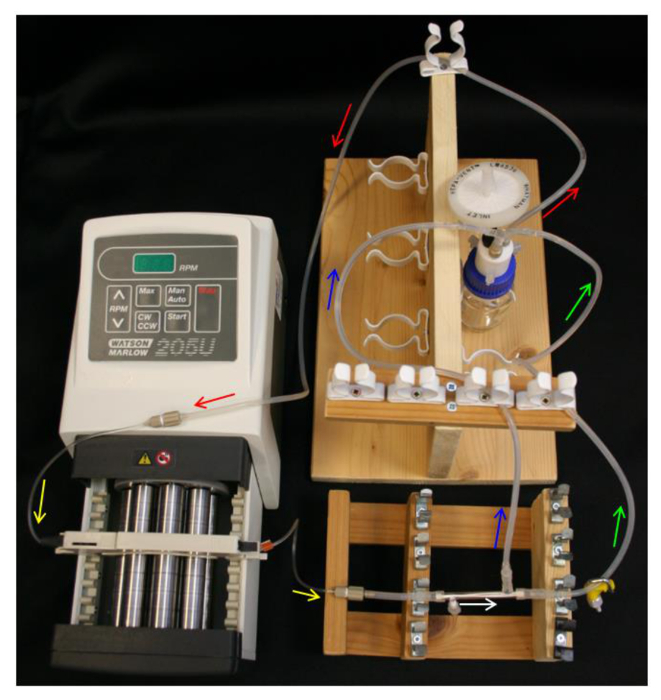
Figura 4. Sistema HFB set-up. Le frecce indicano la direzione del flusso multimediale. Rosso = tubo di alimentazione. Giallo = pompa tuessere. Bianco = Modulo HFB. Verde = tubo retentato con morsetto. Blu = permeano tubo. Cliccate qui per vedere una versione più grande di questa figura.
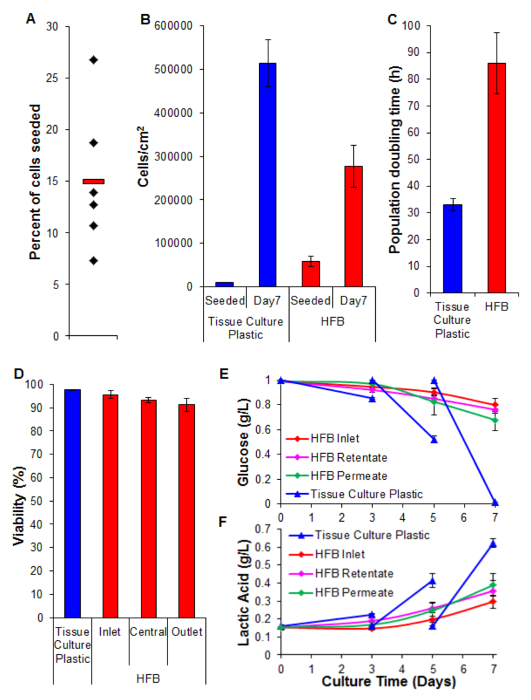
Figura 5. semina, la proliferazione, la vitalità e l'analisi biochimica. (A) per cento delle cellule seminate. Diamanti neri rappresentano i singoli HFBs. La barra rossa è la media. (B) Le cellule densità alla semina e dopo un periodo di proliferazione di 7 giorni. numero di cellule 2D sono stati determinati mediante tripsinizzazione e contando utilizzando un emocitometro. Il numero di cellule HFB sono stati determinati usando il test PicoGreen e una curva standard prodotta da cellule C3A 26. n = 5-6. Bar = SEM. (C) Popolazione raddoppio volte. n = 5-7. Bar = SEM. (D) efficienza determinato dal Trypun'esclusione blu alla fine di una proliferazione di 7 giorni. Inlet, centrale e uscita rappresentano regioni all'interno del HFB. n = 3-5. Bar = SEM. (E & F) consumo di glucosio e la produzione di acido lattico. Livelli sono stati monitorati la bottiglia serbatoio (ingresso) nonché il retentato e permeato sbocchi e compered alla cultura di routine su plastica coltura tissutale (supporti cambiato il giorno 3 e 5). n = 3-5. Bar = SEM. Clicca qui per vedere una versione più grande di questa figura.
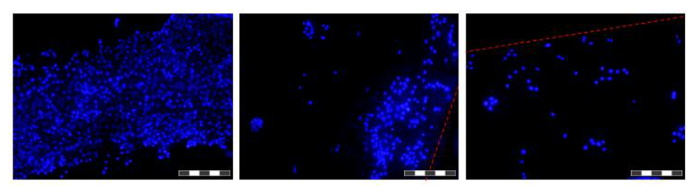
Figura 6. immagini di cellule coltivate sulle fibre in un HFB. Le cellule sono state seminate e coltivate per 48 ore prima di fibre sono stati asportati, lavate in PBS, fissati in paraformaldeide al 4%, lavate in PBS e nuclei colorati con DAPI. Ogni immagine è un composto di 12 'Focus impilati' imaGES Per aumentare la profondità di campo dell'immagine risultante. Aree di alta e bassa densità cellulare si trovano lungo la fibra a questo punto di tempo e sono mostrati. Dove confini attuali della fibra sono contrassegnate con una linea tratteggiata rossa. Le immagini sono state scattate su un microscopio a fluorescenza invertito. Immagine obiettivo = 10X. Bar = 200 micron. Cliccate qui per vedere una versione più grande di questa figura.
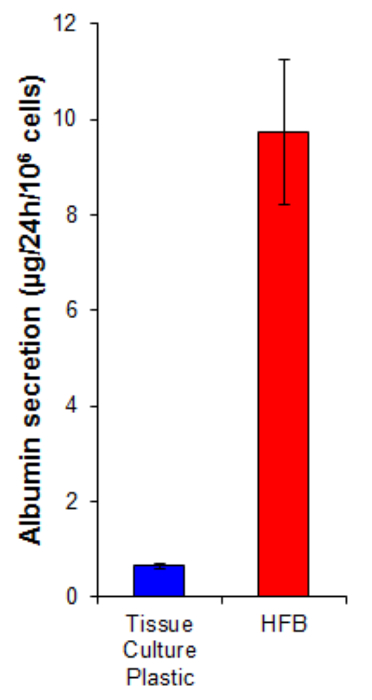
Figura 7. Albumina secrezione. Le cellule sono state seminate su plastica coltura di tessuti a 10.667 / cm 2 e nel HFB come descritto nella sezione 4. Le cellule sono state proliferato per 6 giorni. Dopo questo periodo la proliferazione del terreno di coltura dei tessuti in plastica e la cultura HFB è stato cambiato per un libero di Williams e supporti siero addizionato con glutammina e la penicillina / streptomycin per 24 ore. Campioni dei media sono state prese e un albumina quantificate con ELISA secondo la produce istruzioni (Tabella 1). n = 5-6. Bar = SEM. Clicca qui per vedere una versione più grande di questa figura.
| Sezione | Nome di attrezzature | Società | Gatto. No. | Note | immagini |
| 2 | Modulo HFB Glass | Soham scientifica | --- | Elemento personalizzato. | |
| 2.1 | Sigmacote® | Sigma-Aldrich | SL2 | ||
| 2.3 | Silicoset 151 | Intertronics | ACCSS151 | Silicuna colla. | |
| 2.5 | nastro in PTFE | Sigma-Aldrich | Z104388 | ||
| 3.2.1 | bottiglia Reservoir | Pescatore | 11972619 | ||
| cap Q-series | Kinesis | 00932Q-3V | PTFE le filettature degli adattatori e dado di raccordo. Fissare al tappo Q-serie. Collegare un capitolo 8.5 cm tubo PTFE fornito sotto l'adattatore 1 mm e una sezione 4 centimetri sotto l'adattatore 3 mm. |  | |
| Adattatore, Maschio, 1,0 millimetri ID | Kinesis | 008NB10-KD5L | |||
| Adattatore, Maschio, 3,0 millimetri ID | Kinesis | 008NB30-KD5L | |||
| raccordo Dado | Kinesis | U-350 | |||
| tubi in neoprene | Pescatore | 10366344 | Fissare il filtro Hepa a 6 cm di tubi di neoprene e collegare questo al 'dado di raccordo'. Collegare un 2x 30 sezioni mm di L / tubi S14 per i primi due barbe del connettore a Y e una sezione 3 centimetri di L / tubi S16 fino in fondo. Fissare questo per la sbavatura della scheda ID 3 mm. (Punto 3.2.1) |  | |
| HEPA-vent | Pescatore | 11374634 | |||
| Connettore a Y, spinato | Cole Parmer | UO-06.295-10 | |||
| L / tubi S16 silicone | Cole Parmer | UO-96.410-16 | |||
| L / tubi S14 silicone | Cole Parmer | WZ-96.410-14 | |||
| L / tubi S13 silicone | Cole Parmer | UO-96.410-13 | 80 cm per collegare l'adattatore spinato 1,0 millimetri sul cappuccio Q-serie alla pompa idromassaggio ing = tubo di alimentazione. | ||
| Pompa WM 205U / CA | Pescatore | 1248-6300 | |||
| WM tubo della pompa, in PVC, blu-arancio, 0,25 millimetri foro | Pescatore | 12416310 | PTFE la filettatura dell'adattatore maschio e collegare l'adattatore femminile. Lavorare il tubo della pompa su una delle barbe. Ripetere questo set-up all'altra estremità del tubo. (Punto 3.2.1) |  | |
| Adattatore, Maschio, 1,0 millimetri ID | Kinesis | 008NB10-KD5L | |||
| Adattatore, Femmina, 1,0 millimetri ID | Kinesis | 008NB10-KD2L | |||
| 3.2.2 | tappo Luer femmina | Cole Parmer | WZ-45.508-64 | tappi porta laterale. | blefig4.jpg "/>  |
| L / tubi S13 silicone | Cole Parmer | UO-96.410-13 | sezioni 40 mm per collegare il tubo pompa ad un connettore del modulo. | ||
| L / tubi S16 silicone | Cole Parmer | UO-96.410-16 | 3x 30 mm di L / S16 montato a 3x riduttori = connettori del modulo. (Sezione 3.2.2) | ||
| riduttore spinato 1/8 "x 1/16" | Cole Parmer | 30.616-43 | |||
| 3.2.4 | L / tubi S13 silicone | Cole Parmer | UO-96.410-13 | 55 sezione cm per collegare il retentato alla L / S14 del connettore a Y sul tappo Q-serie. |  |
| L / tubi S13 silicone | Cole Parmer | UO-96410-13 | sezione 45 cm a collegare il permeato alla L / S14 del connettore a Y sul tappo Q-serie. | ||
| Diritto unione spinato | Cole Parmer | WZ-30.612-43 | Attaccare alla fine della L / S13 che collegherà con L / S14 del connettore a Y. | ||
| 3.4.2 | morsetto | VWR | 229-0609 | ||
| 4.3 | Tubi in silicone 4 millimetri | Pescatore | FB68858 | Ripiegare una sezione di 40 mm tubi e fissare con una fascetta tappo = Modulo. (Paragrafo 4.3) |  |
| Fascetta | Pescatore | 12326377 | |||
| 4.4 | MACSmix tubo rotatore | Miltenyi Biotech | 130-090-753 | Un adattamento può essere richiesto di Attach moduli. | |
| 4.5 | porta di iniezione Leur | Thistle scientifica | IB-10820 | Attaccare il cappuccio terminale alla porta di iniezione. (Paragrafo 4.5) | |
| tappo Luer femmina | Cole Parmer | WZ-45.508-64 | |||
| 5 | Kit di acido L-lattico | Megazyme | K-LATE | ||
| 5 | Kit D-glucosio | Megazyme | K-GLUC | ||
| 6.2 | Scalpel / micro coltello | InterFocus | 10.315-12 | ||
| 7.4.3 | albumina ELISA | Bethyl Labs | E80-129 |
Tabella 1. Componenti del HFB set-up. La sezione di testo rilevanti per ogni componente è riportata nella colonna 1.
Discussione
Questo manoscritto descrive il set-up e il funzionamento di un sistema a fibra cava bioreattore (HFB) per colture cellulari di mammifero e la sua utilità è dimostrata in proliferanti linea cellulare di epatociti HepG2 / C3A. Il sistema è progettato per adattarsi sul ripiano di un incubatore standard ed il suo set-up è sufficiente per essere effettuata con qualsiasi cella biologo competente conoscenza tecnica asettica semplice.
Le fibre utilizzate nel sistema di ricerca qui descritto sono fabbricati in casa da inversione di fase di spin casting (spinning) utilizzando un polimero proprietario non biodegradabile. È possibile effettuare fibre mediante filatura da una varietà di materiali adatti per coltura cellulare, sia biodegradabili e non biodegradabili, per esempio; policaprolattone (PCL) 27, acido poli-L-lattide (PLLA) 28, poli (acido lattico-co-glicolico) (PLGA) 29, polisulfone (PSU) 12 e polietereterchetone (PEEK) 13. Ognuno ha diverse proprietà and deve essere scelto in base alle esigenze del sistema. Controllare la compatibilità della fibra impiegata con l'etanolo utilizzato nella fase di sterilizzazione. PLGA è noto per plastificare con etanolo che richiede un trattamento alternativo come antibiotico / antimicotico soluzione 25.
Le dimensioni dei moduli di vetro usati qui sono stati scelti in base alle esigenze della ricerca attuale. I formati differenti possono essere fatte da qualsiasi azienda vetro soffiato stimabile. Una considerazione dimensioni modulo è il numero di cellule, che è legata al numero di fibre nel modulo e portate probabili. Più cellule sono nel modulo della maggiori portate dovranno essere per mantenere condizioni di coltura favorevoli alla fine deflusso del bioreattore. Questo raggiungerà un limite come un certo punto e alcuni tentativi ed errori può essere richiesto con il monitoraggio delle condizioni dei media nel permeato modulo. Modellazione matematica può fornire alcune intuizioni le dimen modulo richiestesioni e portate 22.
Le dimensioni dell'apparato usato qui è stato progettato per adattarsi su un ripiano incubatore. La lunghezza del tubo è dettata dalla lunghezza necessaria per raggiungere tra i connettori consentendo anche abbastanza movimento dei componenti per consentire la configurazione e il funzionamento. Se è richiesto campionamento andamento temporale, ad esempio nel controllo delle condizioni di media nel modulo permeato poi fori di iniezione possono essere aggiunti al retentato e permeato linee per facilitare questo.
Un prerequisito per qualsiasi sistema di coltura cellulare è quello di mantenere in vita e in molti casi di crescita delle cellule. Alla luce di studi che dimostrano una maggiore in vivo -come fenotipo in cellule coltivate in sistemi di coltura 3D sembra anche importante fornire un ambiente che imita da vicino l'ambiente in vivo incontrato dalle cellule. Questo ultimo punto è spesso trascurato in coltura cellulare 2D a favore della convenienza di questo sistema la cultura offre. Tha HFB imita in reti capillari vivo fornendo nutrienti alle cellule attraverso il lume delle fibre. I prodotti di scarto vengono rimossi dal sistema dal flusso dinamico. Questo crea un vivo -come sistema per colture cellulari e uno che imita da vicino l'ambiente in vivo visto dagli epatociti, rendendo questo sistema una scelta migliore rispetto a 2D coltura tissutale di plastica per coltura di tali cellule. Ciò è confermato dal fatto che le cellule secernono 15 volte la quantità di albumina, una funzione epatica importante, nel sistema di coltura HFB rispetto a quelli coltivati in 2D plastica coltura dei tessuti.
Mentre il sistema HFB è adatto per la maggior parte se non tutti i tipi di cellule dipendenti di ancoraggio, l'esempio qui è per gli epatociti perché non vi è una reale necessità di essere in grado di cultura funzionale, più in vivo -come epatociti da utilizzare nello sviluppo di farmaci da parte dell'industria farmaceutica e nel fegato bioartificiale per il sostegno extracorporeadei pazienti con insufficienza epatica. La necessità di cellule più funzionali estende oltre questi esempi, tanto più il campo della medicina rigenerativa entra in una fase di lavoro traslazionale. I vantaggi di un ambiente più vivo in -come coltura non deve essere trascurato.
Divulgazioni
MJE is a founder and director of Cellesce Ltd which aims to provide bioprocessing solutions for tissue engineering-based research and industry.
Riconoscimenti
This work was funded by the National Centre for the Replacement, Refinement and Reduction of Animals in Research (NC3Rs) CRACK IT funding.
Materiali
| Name | Company | Catalog Number | Comments |
| Glass HFB Module | Soham Scientific | --- | Custom Item. (Section 2) |
| Sigmacote | Sigma-Aldrich | SL2 | (Section 2.1) |
| Silicoset 151 | Intertronics | ACCSS151 | Silicone Glue. (Section 2.3) |
| PTFE tape | Sigma-Aldrich | Z104388 | (Section 2.5) |
| Reservoir bottle | Fisher | 11972619 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Q-series cap | Kinesis | 00932Q-3V | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 3.0 mm ID | Kinesis | 008NB30-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Fitting Nut | Kinesis | U-350 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Neoprene tubing | Fisher | 10366344 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| HEPA-vent | Fisher | 11374634 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| Y-connector, barbed | Cole Parmer | OU-06295-10 | Attach the Hepa filter to 6 cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S14 Silicone tubing | Cole Parmer | WZ-96410-14 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 80 cm to connect the 1.0 mm barbed adapter on the Q-series cap to the pump tubing = Feed tube. (Section 3.2.1) |
| WM 205U/CA pump | Fisher | 1248-6300 | (Section 3.2.1) |
| WM pump tubing, PVC, blue-orange, 0.25 mm bore | Fisher | 12416310 | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw thread of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Female, 1.0 mm ID | Kinesis | 008NB10-KD2L | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Side port end caps. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 40 mm section to connect the pump tubing to a module connector. (Section 3.2.2) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| Barbed reducer 1/8"x1/16" | Cole Parmer | 30616-43 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 55 cm section to connect the retentate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 45 cm section to connect the permeate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| Straight barbed union | Cole Parmer | WZ-30612-43 | Attach to the end of the L/S13 that will connect with the L/S14 of the Y-connector. (Section 3.2.4) |
| Clamp | VWR | 229-0609 | (Section 3.4.2) |
| 4 mm Silicone tubing | Fisher | FB68858 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| Cable tie | Fisher | 12326377 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| MACSmix tube rotator | Miltenyi Biotech | 130-090-753 | An adaptation may be required to attach the modules. (Section 4.4) |
| Leur Injection port | Thistle Scientific | IB-10820 | Attach the end cap to the injection port. (Section 4.5) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Attach the end cap to the injection port. (Section 4.5) |
| L-lactic acid kit | Megazyme | K-LATE | (Section 5) |
| D-glucose kit | Megazyme | K-GLUC | (Section 5) |
| Scalpel / micro knife | InterFocus | 10315-12 | (Section 6.2) |
| Albumin ELISA | Bethyl Labs | E80-129 | (Section 7.4.3) |
Riferimenti
- Lewis, W. H. Experimental evidence in support of the theory of outgrowth of the axis cylinder. American J Anat. 6 (1), 461-471 (1906).
- Harrison, R. G. The development of peripheral nerve fibers in altered surroundings. Wilhelm Roux Arch Entwickl Mech Org. 30 (2), 15-33 (1910).
- Ding, L., et al. A genome-scale RNAi screen for Oct4 modulators defines a role of the Paf1 complex for Embryonic Stem Cell identity. Cell Stem Cell. 4 (5), 403-415 (2009).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering -In vivo and in vitro applications. Adv Drug Deliv Rev. 63 (4), 352-366 (2011).
- Sinden, J. D., Vishnubhatla, I., Muir, K. W. Prospects for stem cell-derived therapy in stroke. Prog Brain Res. 201, 119-167 (2012).
- Ouyang, A., Yang, S. -. T. A two-stage perfusion fibrous bed bioreactor system for mass production of embryonic stem cells. Expert Opin Biol Ther. 8 (7), 895-909 (2008).
- Carnachan, R. J., Bokhari, M., Przyborski, S. A., Cameron, N. R. Taloring the morphology of emulsion-templated porous polymers. Soft Matter. 2 (7), 608-616 (2006).
- Deshpande, P., et al. Simplifying corneal surface regeneration using a biodegradable synthetic membrane and limbal tissue explants. Biomaterials. 34 (21), 5088-5106 (2013).
- Storm, M. P., Orchard, C. B., Bone, H. K., Chaudhuri, J. B., Welham, M. J. Three-dimensional culture systems for the expansion of pluripotent embryonic stem cells. Biotechnol Bioeng. 107 (4), 683-695 (2010).
- Wung, N., Acott, S. M., Tosh, D., Ellis, M. J. Hollow fibre membrane bioreactors for tissue engineering applications. Biotechnol Lett. 36 (12), 2357-2366 (2014).
- Ellis, M., Jarman-Smith, M., Chaudhuri, J. B., Chaudhuri, J., Al-Rubeai, Bioreactor systems for tissue engineering: A four-dimensional challenge. Bioreactors for tissue engineering; principles, design and operation. , 1-18 (2005).
- Silva, A. I., Mateus, M. Development of a polysulfone hollow fibre vascular bio-artificial pancreas device for in vitro studies. J Biotechnol. 139 (3), 236-249 (2009).
- De Bartolo, L., et al. Human hepatocyte functions in a crossed hollow fiber membrane bioreactor. Biomaterials. 30 (13), 2531-2543 (2009).
- Schmelzer, E., Finoli, A., Nettleship, I., Gerlach, J. C. Long-term three-dimensional perfusion culture of human adult bone marrow mononuclear cells in bioreactors. Biotechnol Bioeng. 112 (4), 801-810 (2015).
- Tapia, F., et al. Production of high-titer human influenza A virus with adherent and suspension MDKC cells cultured in a single-use hollow fiber bioreactor. Vaccine. 32 (8), 1003-1011 (2014).
- Deng, X., Zhang, G., Shen, C., Yin, J., Meng, Q. Hollow fiber culture accelerates differentiation of Caco-2 cells. Appl Microbiol Biotechnol. 97 (15), 6943-6955 (2013).
- Schutte, M., et al. Rat primary hepatocytes show enhanced performance and sensitivity to acetaminophen during three-dimensional culture on a polystyrene scaffold designed for routine use. Assay Drug Dev Technol. 9 (5), 475-486 (2011).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Novel cell culture device enabling three-dimensional cell growth and improved cell function. Biochem Biophys Res Commun. 354 (4), 1095-1100 (2007).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Culture of HepG2 liver cells on three dimensional polystyrene scaffolds enhances cell structure and function during toxicological challenge. J Anat. 211 (4), 567-576 (2007).
- Vivares, A., et al. Morphological behaviour and metabolic capacity of cryopreserved human primary hepatocytes cultivated in a perfused multiwell device. Xenobiotica. 45 (1), 29-44 (2015).
- Smith, I., et al. Human neural stem cell-derived cultures in three-dimensional substrates form spontaneously functional neuronal networks. J Tissue Eng Regen Med. , (2015).
- Davidson, A. J., Ellis, M. J., Chaudhuri, J. B. A theoretical approach to Zonation in a bioartificial liver. Biotechnol Bioeng. 109 (1), 234-243 (2012).
- Mulder, M. . The basic principles of membrane technology. 2nd ed. , (1996).
- Ellis, M. J., Chaudhuri, J. B. Poly(lactic-co-glycolic acid) hollow fibre membranes for use as a tissue engineering scaffold. Biotechnol Bioeng. 96 (1), 177-187 (2007).
- Shearer, H., Ellis, M. J., Perera, S. P., Chaudhuri, J. B. Effects of common sterilization methods on the structure and properties of poly(D,L lactic-co-glycolic acid) scaffolds. Tissue Eng. 12 (10), 2717-2727 (2006).
- Forsey, R. W., Chaudhuri, J. B. Validity of DNA analysis to determine cell numbers in tissue engineering scaffolds. Biotechnol Lett. 31 (6), 819-823 (2009).
- Williamson, M. R., Coombes, A. G. A. Gravity spinning of polycaprolactone fibres for applications in tissue engineering. Biomaterials. 25 (3), 459-465 (2004).
- El-Salmawy, A., et al. Preparation and properties of pronectin F-coated biodegradable hollow fibres. J Artif Organs. 8 (4), 245-251 (2005).
- Meneghello, G., et al. Fabrication and characterization of poly(lactic-co-glycolic acid)/polyvinyl alcohol blended hollow fibre membranes for tissue engineering applications. J Memb Sci. 344 (1-2), 55-61 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon