È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Imaging Raziometrico del pH extracellulare nel dentale biofilm
In questo articolo
Riepilogo
Un colorante raziometrico pH-sensibile è utilizzato in combinazione con microscopio confocale a scansione laser e analisi di immagine digitale per monitorare pH extracellulare in biofilm dentali in tempo reale.
Abstract
Il pH di biofilm batterici sui denti è di importanza centrale per la carie dentale, una malattia con un'alta prevalenza in tutto il mondo. Nutrienti e metaboliti non sono distribuite in modo uniforme in biofilm dentali. Un complesso gioco di assorbimento da e per la reazione con la materia organica nel biofilm riduce i percorsi di diffusione di soluti e crea pendenze di molecole reattive, tra cui gli acidi organici, in tutto il biofilm. Metodi microscopici fluorescenti quantitativi, come l'imaging tempo di vita di fluorescenza o pH ratiometry, possono essere impiegati per visualizzare pH in diversi microambienti di biofilm dentali. pH ratiometry sfrutta una variazione del pH-dipendente nella emissione fluorescente di coloranti sensibili al pH. Calcolo del rapporto emissione a due diverse lunghezze d'onda permette di determinare pH locale in immagini microscopiche, indipendentemente dalla concentrazione del colorante. Contrariamente a microelettrodi tecnica permette il monitoraggio entrambi gradienti di pH verticali ed orizzontali in tempo reale condisturbare meccanicamente il biofilm. Tuttavia, la cura deve essere presa per distinguere con precisione tra i compartimenti extra-intracellulari e del biofilm. Qui, il colorante raziometrica, seminaphthorhodafluor-4F 5- (e-6) di acido carbossilico (C-SNARF-4) è impiegato per monitorare pH extracellulare in in vivo biofilm dentali coltivate di composizione delle specie sconosciuta. Al momento l'esposizione al glucosio il colorante è up-concentrato all'interno di tutte le cellule batteriche nei biofilm; è quindi usato sia come una macchia batterica universale e come indicatore di pH extracellulare. Dopo l'acquisizione di immagini al microscopio confocale, la biomassa batterica viene rimosso da tutte le immagini utilizzando il software di analisi di immagine digitale, che permette di calcolare esclusivamente pH extracellulare. pH ratiometry con il colorante raziometrico è particolarmente adatto per studiare pH extracellulare in biofilm sottili fino a 75 micron di spessore, ma è limitato al campo di pH tra 4,5 e 7,0.
Introduzione
Il metodo qui descritto permette di monitorare pH extracellulare in biofilm dentali nell'intervallo tra 4,5 e 7, utilizzando il colorante raziometrica seminaphthorhodafluor-4F 5- (e-6) di acido carbossilico (C-SNARF-4) in combinazione con microscopio confocale a scansione laser e analisi di immagine digitale. Il colorante fluorescente impiegata è sensibile al pH e visualizza un cambiamento nella sua emissione fluorescente a seconda dello stato di protonazione. L'emissione fluorescente dei picchi molecola protonata a 580 nm, e l'emissione della molecola deprotonata a 640 nm 1. Il rapporto tra le intensità di emissione fluorescente in due finestre di rilevazione comprendente i due picchi di emissione (576 - 608 nm ei 629 - 661 nm) riflette quindi pH nella fase liquida, indipendentemente dalla concentrazione di colorante. Con un pK a di ~ 6,4 colorante è adatto per visualizzare pH in ambienti moderatamente acide.
PH in biofilm batterici è di fondamentale importanza per tutti i processi metabolici.Nel caso di biofilm dentali, pH nella matrice extracellulare è il fattore di virulenza chiave per lo sviluppo della carie dentaria. Lunghi periodi con un basso pH al comando di interfaccia biofilm-dente per rallentare la demineralizzazione dello smalto di fondo 2. A causa della complessa architettura tridimensionale di biofilm, metaboliti, tra cui gli acidi organici, non sono distribuiti uniformemente in tutto il biofilm. Altamente e meno microambienti acidogeni possono essere trovati in prossimità spaziale 3.
Per decenni, i gradienti di pH verticali in biofilm sono stati registrati con l'aiuto di microelettrodi 4-6. Mentre offrono una buona risoluzione spaziale a causa della loro dimensione piccola punta, non sono particolarmente adatti per monitorare i gradienti orizzontali. Inoltre, l'inserimento dell'elettrodo disturba il biofilm meccanicamente. tecniche microscopiche a fluorescenza quantitative offrono il vantaggio di visualizzare variazioni di pH nei diversi settori di un biofilm, senza interferire meccanicance. Diversi campi microscopici di vista possono essere scelti liberamente e ripreso più volte per periodi prolungati 1,7-9. Tuttavia, quando si interpretano immagini microscopiche biofilm, è importante distinguere tra la fluorescenza derivante dalla biomassa microbica e fluorescenza derivante dallo spazio extracellulare. In condizioni acide, pH all'interno delle cellule batteriche è diverso da pH nella matrice extracellulare, come i batteri trasportano attivamente protoni attraverso la membrana cellulare a scapito di adenosina trifosfato 10. Nel contesto della carie dentale, pH batterica intracellulare non ha un impatto diretto sullo smalto sottostanti, mentre bassi valori di pH extracellulare porta alla demineralizzazione. Una media di pH nelle immagini microscopiche che contengono entrambe le aree prive di batteri e batteri porta a risultati errati. L'uso di altre macchie insieme con il colorante sensibile al pH per visualizzare la biomassa batterica e differenziare tra le aree extra ed intracellulari porta abil rischio di contaminazione fluorescente dello spazio extracellulare e false misurazioni 11.
La presente manoscritto descrive pertanto l'uso del colorante raziometrica in una duplice funzione; sia come marcatore pH e come una macchia batterica universale. Poiché il colorante è up-concentrato in cellule batteriche, la combinazione di confocale immagini microscopiche e un'accurata procedura di analisi di immagine digitale consente la determinazione del pH extracellulare nel campo tra 4,5 e 7,0 in biofilm dentali sottili.
Protocollo
Il protocollo sperimentale è stato esaminato e approvato dal Comitato Etico di Aarhus County (M-20.100.032).
1. confocale microscopica calibrazione del Raziometrico Dye
- Per l'acquisizione delle immagini, utilizzare un microscopio invertito confocale equipaggiato con un incubatore, un obiettivo ad immersione dell'acqua apertura 63X / 1.2-numerica, una linea laser 543 nm e un rivelatore META.
- Preparare tampone HEPES soluzioni madre (50 mm, portata a pH 4.5-8.5 in passi di unità 0,1 pH). Dispensare 100 ml di ogni soluzione nei pozzetti di una chiara-bottom piastra a 96 pozzetti per la microscopia a fluorescenza.
- Indossare guanti di nitrile quando si maneggia il colorante raziometrica C-SNARF-4. Preparare una 1 mM soluzione madre del colorante in dimetilsolfossido. Aggiungere 5 ml di soluzione madre di ogni pozzetto con tampone HEPES. Posizionare la piastra a 96 pozzetti sul microscopio.
- Accendere il microscopio. Aprire il software microscopio. Clicca i seguenti pannelli: Acquisire → Laser; Acquisire → MICRO; Acquisire → Config; Acquisire → Scan; Acquisire → Stage. Riscaldare l'incubatore a 37 ° C.
- Accendere la linea laser 543 nm cliccando sul laser a 543 nm e il tasto "On" nella finestra "Controllo Laser". Scegliere l'obiettivo di immersione in acqua apertura 63X / 1.2-numerico nella finestra "Microscope Control".
- Impostare il rilevatore META di monitorare simultaneamente la fluorescenza all'interno 576- a 608 nm (verde) e 629- a 661 nm intervalli di (RED) ( "Controllo Configurazione" → "ChS"). Regolare la potenza del laser ( "Controllo Configurazione" → "eccitazione"). Impostare il foro stenopeico per produrre uno spessore fetta ottica di 1,6 micron ( "Scan Control" → "Pinhole").
- Acquisire un'immagine di ogni soluzione tampone HEPES, 5 micron sopra il fondo di vetro della piastra a 96 pozzetti. Nota: Appena il piano focale è situato sotto il fondo di vetro, nessuna luce fluorescente può essere vistosullo schermo. Dopo ogni terza immagine, impostare la potenza del laser a zero e prendere una immagine di sfondo sottrazione.
- Eseguire l'esperimento di calibrazione in triplice copia (1,2-1,7).
- Determinare l'intensità della fluorescenza media e deviazione standard in tutte le immagini rosse e verdi.
- Calcolare il rapporto R ed errore standard della media, S R, per ogni immagine in base alle equazioni (1) e (2)
(1)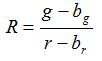
(2)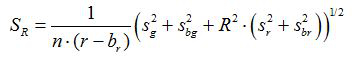
g, r, s g e s r sono le medie e le deviazioni standard nei rispettivi immagini verde e rosso. b g, b R, S bg e s br sono i valori corrispondenti per le immagini di sfondo. n 2 è il numero di pixel imaged. - Tracciare i rapporti calcolati per ciascun valore di pH dei tre esperimenti di calibrazione replica in un diagramma e costruire una curva montato da questa serie di punti dati (vale a dire utilizzando il software SigmaPlot 13). Fare una funzione matematica dalla curva montato in grado di convertire i rapporti in valori di pH 10.
- Calcolare il rapporto R ed errore standard della media, S R, per ogni immagine in base alle equazioni (1) e (2)
2. Raccolta di In Situ Grown dentale biofilm Campioni
- Selezionare volontari che soddisfano i criteri di inclusione ed esclusione rilevanti per lo studio. Fare impressioni alginato di loro arcata dentaria superiore e inferiore. Fare modelli del cast da queste impressioni e produzione di una stecca acrilico nella mandibola. Progettare la stecca con flange acrilici buccali collegati da un filo ortodontico linguale che permette al volontario di mordere normale occlusione 12.
- Recessioni Drill nelle flange buccali della stecca acrilico (Figura 1 ) Con l'aiuto di frese acriliche dentali per consentire l'inserimento di lastre di vetro per la raccolta biofilm. La profondità delle recessioni deve essere di almeno 1,5 mm, mentre la larghezza e la lunghezza delle recessioni possono variare a seconda del numero di lastre di vetro da inserire.
- Per la raccolta biofilm, lastre su misura non fluorescenti di vetro (4 x 4 x 1 mm 3) con una rugosità superficiale di graniglia 1200 al fine di imitare il modello di colonizzazione su smalto naturale 11.
- Sterilizzare le lastre di vetro in autoclave prima del montaggio. Montare le lastre di vetro con cera collante nelle depressioni nelle flange buccali di ciascun lato leggermente incassati alla superficie della superficie acrilica per proteggere il biofilm da forze di taglio esercitate dal movimento delle guance 11.
Nota: Il numero di lastre di vetro disposte in recessione può variare tra 3 e 14, a seconda dello scopo dello studio. - Inserire l'apparecchio in bocca del volontario. Istruire il VolunTeer di mantenere l'apparecchio intra-orale per tutto il periodo sperimentale. Istruire il volontario per immagazzinare l'apparecchio in un contenitore fermo ortodontico con un pezzo di tessuto carta bagnata (per mantenerlo umido) a temperatura ambiente durante lo spazzolamento dei denti e l'assunzione di cibo e bevande diverse dall'acqua. Istruire il volontario a non toccare le flange acrilici buccali con le lastre di vetro durante l'inserimento e la rimozione dell'apparecchio.
Nota: Il periodo sperimentale può variare a seconda dello scopo dello studio (un giorno a diverse settimane). - Rimuovere accuratamente le lastre di vetro dalla macchina al termine del periodo sperimentale. Rimuovere la cera adesiva intorno le lastre con un coltello e trasferirli con un paio di pinzette per un contenitore chiuso, il biofilm rivolta verso l'alto, fino all'analisi microscopica. Tenere il contenitore umido con fazzoletto di carta bagnata. Eseguire l'imaging pH entro poche ore dalla raccolta biofilm.
3. biofilm pH Imaging
- Prepararesoluzione salivare aggiungendo ditiotreitolo alla saliva raccolta secondo il metodo di de Jong et al. 13. Titolare la soluzione salivare a pH 7.0 e aggiungere il glucosio ad una concentrazione di 0,4% (peso / volume). Dispensare 100 microlitri per biofilm da analizzare in un 96-pozzetti con fondo di vetro per la microscopia. Aggiungere 5 ml di tintura raziometrico per pozzetto.
- Posizionare la piastra a 96 pozzetti sul palco microscopio. Accendere il microscopio e la linea laser 543 nm. Riscaldare l'incubatore a 37 ° C. Utilizzare le stesse impostazioni microscopio come per la calibrazione del colorante (vedere i passaggi 1,5-1,6). Attendere per 30 minuti, fino a quando la piastra a 96 pozzetti ha raggiunto la temperatura di lavoro.
- Pick up una o più lastre di vetro con un insieme sottile di pinzette e metterli nei pozzetti saliva pieno, una lastra per pozzetto, con i biofilm rivolti verso il basso.
- Acquisire le immagini singole ( "Scan Control" → "single") o Z-stack ( "Scan Control" → "Start") spanning la profondità dei biofilm in diversi settori. Per acquisire z-stacks scegliere il numero di fette di essere ripreso ( "Scan Control" → "Impostazioni Z" → "Num fette") e segnare la posizione z per la prima e l'ultima fetta nel software del microscopio ( "Scan Control "→" Impostazioni Z "→" Mark First "," Mark last ").
Nota: Z-stack con una profondità massima di 75 micron possono essere acquisite con un buon contrasto tra le aree extracellulari e intracellulari. - Per seguire variazioni di pH in un campo di vista microscopico nel corso del tempo, marcare la xy posizione nel software del microscopio ( "stage e di controllo messa a fuoco" → "Mark Pos") e prendere immagini ripetute in momenti successivi ( "Scan Control" → " Singolo"). Regolarmente prendere le immagini con la potenza del laser impostato a zero per sottrazione del fondo.
4. Analisi Digital Image
- per export le immagini microscopiche come file TIF, usano l'esportazione di file batch del software microscopio ( "Macro" → "Batch File Export"). Selezionare i file da esportare e salvare le immagini del canale rosso e verde in cartelle separate come TIF-files ( "Start Batch Export"). Rinominare i file in entrambe le cartelle dando loro numeri sequenziali.
- Importare la serie di immagini rosso e verde in software come Daime (analisi di immagine digitale in ecologia microbica) 14. Segmento le immagini del canale verde con soglie scelti individualmente luminosità (segmento → → segmentazione automatica di soglia personalizzate). Scegliere le soglie di luminosità con cura (tipicamente tra 20 e 80), in modo che tutti i batteri (più luminosa della matrice extracellulare), ma non la matrice saranno riconosciuti come oggetti durante la segmentazione. Verificare visivamente che le aree riconosciute come oggetti corrispondono bene alla biomassa batterica.
- Trasferire il livello di oggetto del g segmentatoimmagini reen canale alle immagini dei canali rosso corrispondenti (segmento → Trasferimento strato oggetto). Utilizzare la funzione Editor oggetti di rifiutare e cancellare tutti gli oggetti nelle immagini del canale rosso e verde. Ora solo la matrice extracellulare è lasciato nelle immagini biofilm. Esportare la serie immagine elaborata sotto forma di file TIF.
- Importare la serie di immagini in ImageJ (http://rsb.info.nih.gov/ij; v.1.47). Determinare l'intensità media di fluorescenza nelle immagini di sfondo scattate con il laser spento (Analisi → Istogramma). Sottrarre il fondo adeguato dalle immagini rosso e verde (processo → Math → Sottrai).
- Ancora in ImageJ, dividere la serie di immagini verde (G1) da solo (processo → Immagine calcolatrice). Quindi moltiplicare la serie immagine risultante (G2) con la serie di immagini verde (G1). Questo produrrà una serie di immagini (G3), dove NaN viene assegnato a tutti i pixel che appartengono a zone che sono state riconosciute come oggetti in Daime. Procedere in tlui stesso modo con la serie rosso immagine (R1 / R1 = R2; R2 x R1 = R3).
Nota: Poiché la biomassa batterica è stato rimosso dalle immagini nel passaggio 4.3, l'intensità fluorescente è 0 in queste aree. Fase 4.5 è necessario convertire il valore 0 per NaN, che permette di calcolo del rapporto nel passo 4.6. - Applicare il filtro 'Mean' (processo → → Filtri Media; raggio: 1 pixel) per compensare il rumore del rivelatore. Dividere la serie immagine verde dalla serie di immagini rosso (processo → Immagine calcolatrice). Ciò si traduce in un rapporto verde / rosso per ogni pixel rimanente nello spazio extracellulare delle immagini. Utilizzare falsa colorazione per la rappresentazione grafica dei rapporti nelle immagini (Tabelle Immagine → Lookup). Calcolare il rapporto medio per ogni immagine (Analisi → Istogramma).
- Convertire i rapporti di verde / rosso a valori di pH in base alla funzione montato sotto 1.9.2). Nota: Un esempio per dati di calibrazione e la curva a muro può essere visto in Schlafer etal 2015 11.
Risultati
Il metodo presentato consente pH extracellulare monitoraggio scende in differenti microambienti di biofilm dentali nel range di pH da 4,5 a 7 in tempo reale. Se le condizioni sperimentali sono scelti come descritto sopra, pH inizia a cadere in tutte le aree del biofilm poco dopo l'esposizione al glucosio.
Quando il pH in un biofilm gocce, cellule batteriche diventano visibili entro breve tempo (<1 min), come il colorant...
Discussione
Monitoraggio microscopico di pH biofilm fornisce diversi vantaggi, rispetto ad elettrodo o microelettrodi misurazioni 4-6. tecniche microscopiche permettono di determinare il pH con una risoluzione spaziale elevata e consentire catturare gradienti di pH orizzontali e verticali in biofilm senza disturbare il biofilm meccanicamente. I precedenti tentativi di monitoraggio del pH microscopico, tuttavia, non sono riusciti a distinguere tra il pH extracellulare e intracellulare nei biofilm 1,7,9. A causa...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare Javier E. Garcia e Lene Grønkjær per l'assistenza tecnica e Merete K. Raarup per le discussioni fruttuose. Questo lavoro è stato finanziato dalla Fondazione Aarhus University Research e Simon Spies Fondazione.
Materiali
| Name | Company | Catalog Number | Comments |
| Zeiss LSM 510 META | Zeiss | N/A | |
| C-Apochromat 63X water immersion objective | Zeiss | N/A | |
| XL Incubator | PeCON | N/A | |
| SNARF-4F 5-(and-6)-Carboxylic Acid | Life Technologies | S23920 | |
| Dimethyl sulfoxide | Life Technologies | D12345 | |
| HEPES | Life Technologies | 11344-041 | |
| Costar 96-well black clear-bottom plate | Fisher Scientific | 07-200-567 | |
| Custom-made glass slabs (4 x 4 x 1 mm3; 1,200 grit) | Menzel | N/A | |
| Alginate impression material | GC Corporation | N/A | |
| Acrylic Adjusting Logic Sets/set of acrylic dental burs | Axis Dental | LS-906 | |
| Orthodontic retainer containers | Spark Medical Equipment Co., Ltd | SK-WDTC01 | |
| Sticky wax | Dentsply | N/A | |
| Chewing paraffin wax | Ivoclar Vivadent AG | N/A | |
| Dithiothreitol | Sigma Aldrich | D0632 | Used during preparation of salivary solution |
| 0.45 µm and 0.2 µm syringe filters | Sigma Aldrich | CLS431220; CLS431219 | |
| daime | University of Vienna, Austria | http://dome.csb.univie.ac.at/daime | |
| ImageJ | NIH, Bethesda, Maryland, USA | http://imagej.nih.gov/ij/ |
Riferimenti
- Hunter, R. C., Beveridge, T. J. Application of a pH-sensitive fluoroprobe (C-SNARF-4) for pH microenvironment analysis in Pseudomonas aeruginosa biofilms. Appl. Environ. Microbiol. 71 (5), 2501-2510 (2005).
- Takahashi, N., Nyvad, B. Caries ecology revisited: microbial dynamics and the caries process. Caries Res. 42 (6), 409-418 (2008).
- Schlafer, S., et al. pH landscapes in a novel five-species model of early dental biofilm. PLoS. One. 6 (9), e25299 (2011).
- von Ohle, O. C., et al. Real-time microsensor measurement of local metabolic activities in ex vivo dental biofilms exposed to sucrose and treated with chlorhexidine. Appl. Environ. Microbiol. 76 (7), 2326-2334 (2010).
- Revsbech, N. P. Analysis of microbial communities with electrochemical microsensors and microscale biosensors. Methods Enzymol. 397, 147-166 (2005).
- Vanhoudt, P., Lewandowski, Z., Little, B. Iridium oxide pH microelectrode. Biotechnol. Bioeng. 40 (5), 601-608 (1992).
- Franks, A. E., et al. Novel strategy for three-dimensional real-time imaging of microbial fuel cell communities: monitoring the inhibitory effects of proton accumulation within the anode biofilm. Energy & Environmental Science. 2 (1), 113-119 (2009).
- Hidalgo, G., et al. Functional tomographic fluorescence imaging of pH microenvironments in microbial biofilms by use of silica nanoparticle sensors. Appl. Environ. Microbiol. 75 (23), 7426-7435 (2009).
- Vroom, J. M., et al. Depth penetration and detection of pH gradients in biofilms by two-photon excitation microscopy. Appl. Environ. Microbiol. 65 (8), 3502-3511 (1999).
- Bender, G. R., Sutton, S. V., Marquis, R. E. Acid tolerance, proton permeabilities, and membrane ATPases of oral streptococci. Infect. Immun. 53 (2), 331-338 (1986).
- Schlafer, S., et al. Ratiometric imaging of extracellular pH in bacterial biofilms using C-SNARF-4. Appl. Environ. Microbiol. 81 (4), 1267-1273 (2015).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J Oral Sci. 115 (6), 459-467 (2007).
- de Jong, M. H., van der Hoeven, J. S., van OS, J. H., Olijve, J. H. Growth of oral Streptococcus species and Actinomyces viscosus in human saliva. Appl. Environ. Microbiol. 47 (5), 901-904 (1984).
- Daims, H., Lucker, S., Wagner, M. daime, a novel image analysis program for microbial ecology and biofilm research. Environ. Microbiol. 8 (2), 200-213 (2006).
- Liu, Y. L., Nascimento, M., Burne, R. A. Progress toward understanding the contribution of alkali generation in dental biofilms to inhibition of dental caries. Int. J Oral Sci. 4 (3), 135-140 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon