Method Article
La valutazione primaria neurogenesi in
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo presenta un metodo conveniente e rapido per la visualizzazione di diverse popolazioni cellulari neuronali nel sistema nervoso centrale di embrioni di Xenopus mediante immunofluorescenza su sezioni.
Abstract
Primary neurogenesis is a dynamic and complex process during embryonic development that sets up the initial layout of the central nervous system. During this process, a portion of neural stem cells undergo differentiation and give rise to the first populations of differentiated primary neurons within the nascent central nervous system. Several vertebrate model organisms have been used to explore the mechanisms of neural cell fate specification, patterning, and differentiation. Among these is the African clawed frog, Xenopus, which provides a powerful system for investigating the molecular and cellular mechanisms responsible for primary neurogenesis due to its rapid and accessible development and ease of embryological and molecular manipulations. Here, we present a convenient and rapid method to observe the different populations of neuronal cells within Xenopus central nervous system. Using antibody staining and immunofluorescence on sections of Xenopus embryos, we are able to observe the locations of neural stem cells and differentiated primary neurons during primary neurogenesis.
Introduzione
Nei vertebrati, lo sviluppo del sistema nervoso centrale comprendente più fasi distinte ancora consecutivi. Il primo passo è l'induzione neurale, quando le cellule ectodermiche naive sono specificati verso un destino neurale, piuttosto che un destino epidermica. Diversi meccanismi di regolazione interconnessi sono coinvolti in questa fase in altri sistemi modello 1,2 Xenopus e. Questo processo è coordinato principalmente da fattori secreti prodotti dal mesoderma sottostante, come chordin, zucca, e follistatin 3-7. Dopo l'induzione neurale, un sottoinsieme di progenitori neurali uscire dal ciclo cellulare e cominciare a differenziare in un processo denominato neurogenesi come primario. Non tutti i precursori neuronali differenziano in questo momento. Le cellule precursori neurali restanti continuano a proliferare, mantenendo così il pool di cellule staminali necessarie per la continua crescita del sistema nervoso centrale durante tutto lo sviluppo e nell'età adulta.
questi proliferating cellule precursori neurali si caratterizzano per la loro espressione del SRY (regione sesso determinare Y) -box 3 (SOX3) gene 8-11. L'altra popolazione di cellule, che uscita il ciclo cellulare e impegnarsi per un destino differenziata, sono identificati con l'espressione del marker gene differenziazione, tubulina, beta 2B classe IIb (tubb2b, N-vasca) e mielina fattore di trascrizione 1 (myt1) 12-14. Tali cellule neuronali differenziate alla fine danno origine a diverse categorie di neuroni compresi, ma non limitati a, motore, internazionale, e neuroni sensoriali posizionati in aree distinte all'interno del tubo neurale 15-17.
Mentre gli sforzi significativi sono stati dedicati a scoprire i meccanismi regolatori che governano il patterning e il destino determinare gli eventi nel neuroectoderma anteriore, meno attenzione è stata effettuata sulla indagare gli eventi neurogene che si verificano in seguito allafase patterning iniziale. Infatti, trasduzione del segnale, regolamenti trascrizionali, nonché modificazioni post-traduzionali sono tutti coinvolti in questa fase successiva, controllando sia specifica sincronizzazione e lineage durante neurogenesi 18-20. Ulteriori indagini su questi meccanismi richiedono un metodo affidabile per visualizzare e distinguere le diverse popolazioni di cellule neuronali facilmente. La suddetta marcatori neurali, tra cui, SOX3, Myt1, e N-vasca, in grado di fornire un mezzo per identificare queste diverse popolazioni cellulari, fornendo così le basi necessarie per rivelare i meccanismi alla base del differenziamento neuronale 21-23.
Anche se l'etichettatura differenziale di popolazioni di cellule neuronali sono state dimostrate in altri organismi modello, relativamente pochi studi hanno sfruttato il sistema Xenopus al massimo in questo senso. Ciò è dovuto principalmente ad una scarsità di anticorpi compatibili che identificano in modo affidabile i vari neurpopolazioni di cellule onal del tubo neurale. Qui, si descrive un metodo per la visualizzazione di differenziazione neuronale nei primi embrioni di Xenopus mediante immunostaining, che fornisce un approccio robusto e conveniente per lo studio neurogenesi primaria in Xenopus. Questo protocollo dovrebbe fornire indicazioni sufficienti per i ricercatori interessati allo sviluppo precoce del sistema nervoso centrale Xenopus tra la fase 26 e la fase 45.
Protocollo
Tutti gli esperimenti sugli animali sono stati approvati dalla University of Manchester Animal Welfare Centre e sono stati coperti da un UK Home Office Progetto licenza.
1. Raccolta e la fissazione di Xenopus embrioni
- Preparare i reagenti e materiali per esperimenti.
- Preparare 10x di Marc Modified Ringers (MMR) sciogliendo 56,5 g di NaCl in acqua ultrapura circa 800 ml e l'aggiunta di soluzioni di riserva di 1 M KCl, 1 M MgSO 4, 1 M CaCl 2, e 1 M HEPES pH 7.4 per ottenere una concentrazione finale di 20 mm KCl, 10 mM MgSO 4, 20 mM CaCl 2, 50 mM HEPES. Aggiustare il pH a 7,4 per 10 M NaOH e quindi regolare il volume finale di 1 L.
- Sterilizzare la soluzione 10x MMR in autoclave a 121 ° C per 20 minuti su un ciclo liquido. Al momento di utilizzare, diluire con DDH 2 O per 0.1x concentrazione finale e aggiungere 20 mg / L di gentamicina per inibire la crescita microbica.
- Fare 10x soluzione TBS miscelando 24 g Tris-HCl, 5,6 g Tris-base, 88 g di NaCl e dissoluzione in circa 900 ml di acqua ultrapura. La soluzione finale avrà un valore pH circa 7,6. Regolare sia con 10 M NaOH o HCl concentrato per ottenere un pH finale di 7,6 e il volume finale a 1 L.
- Al momento utilizzando, fare TBS 1x diluendo 1 parte di 10x soluzione TBS con 9 parti di acqua ultrapura.
- Fare 10x MEM Salt sciogliendo 209,2 g MOPS in circa 800 ml di acqua ultrapura e l'aggiunta di soluzioni di riserva di 0,5 M EGTA e 1M MgSO 4 per ottenere una concentrazione finale di 20 mm EGTA, 10 mM MgSO 4. Aggiustare il pH a 7,4 per 10 M NaOH e quindi regolare il volume finale di 1 L.
- Sterilizzare la soluzione salina MEM in autoclave a 121 ° C per 20 minuti su un ciclo liquido (la soluzione può diventare gialla da pochi mesi di conservazione a temperatura ambiente o dopo che è stato autoclavato, ma questo cambiamento di colore non influenza l'uso ). Tuttavia, non utilizzare la soluzione dopo stoccaggio prolungato (più di 6 mesi).
- Fare 1x MEMsoluzione FA diluendo 1 parte di MEM sali, 1 parte di formaldeide al 37% con 8 parti di acqua ultrapura (v / v, stabile a 4 ° C per almeno 1-2 settimane).
- Preparare 4% paraformaldeide in TBS (per successiva colorazione coinvolgere phalloidin) sciogliendo 4 g di polvere di paraformaldeide in 100 ml di soluzione 1x TBS riscaldare la soluzione a 60 ° C e aggiungere qualche goccia di 10 M NaOH per assistere dissoluzione. Aliquota in 5-10 volumi ml e congelare a -20 ° C. Non ricongelare una volta scongelati.
ATTENZIONE: Paraformaldeide polvere è un irritante e tossico se inalato, quindi la fase di pesatura deve essere eseguita in una cappa aspirante. - Etichettare il maggior numero di fiale di vetro 4 ml con tappo a vite prima del prelievo.
- Preparare 15% di gelatina / 15% di saccarosio versando 20 ml di 40% gelatina di pesce (pre-riscaldamento in un bagno d'acqua a 50 ° C) in una provetta da centrifuga da 50 ml. Aggiungere 8 g di saccarosio e riempire il tubo alla linea 50 ml con 1x TBS.
- Posizionare il tubo di gelatina in un miscelatore rotante o un letto a rotazionemescolare notte a temperatura ambiente. Questa soluzione di gelatina è stabile a 4 ° C per 1 settimana. Non usare la soluzione scaduto e non congelare-disgelo.
- Preparare e Fix X. laevis o X. tropicalis embrioni coltivati a Stages desiderato.
- Cultura X. fecondato laevis o X. tropicalis embrioni in 0.1x MMR con gentamicina fino agli stadi desiderati.
NOTA: In generale, raccogliere gli embrioni tra fasi 23 e 40. In seguito la raccolta di embrioni dopo la tappa 40 è possibile, soprattutto quando si osservano crescita assonale dal midollo spinale, ma di tenere presente che il tempo supplementare di penetrazione gelatina può essere richiesto. Gli embrioni possono essere wild-type, transgenici, mutante, inibitore-trattata, Morpholino (MO) -injected, o elettroporate 23,24. - Raccogliere 20-50 embrioni in ogni flaconcino di vetro 4 ml, rimuovere il più media possibile e sostituirlo con MEMFA.
NOTA: Se la successiva colorazione coinvolge falloidina, utilizzare paraformaldeide al 4%invece di MEMFA poiché soluzioni formaldeide forniti commerciali di solito contengono fino al 10% di metanolo come stabilizzante che interferisce con falloidina colorazione. - Fissare notte a 4 ° C o, se in un'urgenza, a temperatura ambiente per 2 ore in un miscelatore rotante. Gli embrioni saranno stabili in soluzione di fissaggio per almeno 1 settimana a 4 ° C.
- Dopo la fissazione, lavare gli embrioni 3 volte per 20 minuti usando 1x TBS con 0,05% Triton X-100. Dopo l'ultimo lavaggio, rimuovere il più TBS-Triton possibile e aggiungere 3 ml di 15% di gelatina / 15% di saccarosio in ciascuna provetta.
- Porre i flaconi su un rullo bed notte a temperatura ambiente. Per gli embrioni di età superiore a 40 fasi, utilizzare almeno 24 ore di tempo di penetrazione. Dopo la penetrazione, procedere immediatamente alla sezione 2.2, il giorno successivo.
- Cultura X. fecondato laevis o X. tropicalis embrioni in 0.1x MMR con gentamicina fino agli stadi desiderati.
2. Montaggio e criosezionamento di Xenopus embrioni
- Preparare i reagenti e materiali per esperimenti.
- Prendete una scatola di charg positivamenteEd scivola, idealmente non aperto.
NOTA: Se aperto, mantenere le diapositive in una condizione asciutta (ad esempio una casella a secco) e consumare entro 1 mese a garantire la carica statica sui vetrini è mantenuta. Non utilizzare le diapositive scaduta dal campioni saranno cadere durante immunocolorazione. - Pre-raffreddare la camera di criostato a -30 ° C. Impostare i parametri dello strumento come -35 ° C per microtomo e 12 micron di spessore sezione. Installare la lastra di vetro di copertura di spessore sul palco e lasciare che il criostato stabilizzare almeno 30 minuti prima sezione inizia.
- Preparare pennelli pittura per lo spostamento di strisce di sezione, mantenere all'interno della camera criostato.
- Preparare le matite per la scrittura su vetrini, metterli a temperatura ambiente.
- Indossare guanti durante cryosection. Non usare le mani nude.
- Prendete una scatola di charg positivamenteEd scivola, idealmente non aperto.
- Montaggio Xenopus embrioni
- attenzione aspirare 5-10 embrioni fuori dal flacone di vetro usando una plastica o pipetta di vetro senza introdurre bolle d'aria. Trasferire gli embrioni inalla camera di montaggio e osservare sotto uno stereoscopio. Riempire la camera di montaggio con soluzione di gelatina per garantire la rigidità del blocco sezione.
- Disporre gli embrioni di cui alla figura 1 con un paio di pinze fine-tip. Contrassegnare l'orientamento delle teste disegnando una freccia sul bordo del vano con un pennarello compatibile criogenico. Per più gruppi di embrioni, annotare la descrizione di ogni gruppo sul bordo della corrispondente camera pure.
- Attenzione posizionare la camera orizzontalmente in una scatola della gomma piuma riempito a metà con ghiaccio secco e chiudere il coperchio. Osservare il congelamento camera di montaggio 5-10 min. Elaborare ogni camera di serie (cioè posizionare la camera precedente sul ghiaccio secco prima di procedere a quella successiva), così da lasciare tempo sufficiente per ciascuna camera di congelare e prevenire la casella ghiaccio secco per diventare sovraffollati.
NOTA: congelati camere di montaggio non hanno bisogno di stare in orizzontale e possono essere accatastati all'interno della scatola. - Procedere con criosezionamento o, se necessario, a mantenere i campioni congelati a -80 ° C per almeno 1-2 settimane senza perdere immunogenicità.
- Cryosection montata Xenopus embrioni
- Rimuovere un blocco campione congelato dalla camera premendo il fondo della camera con un bastoncino appuntito (ad esempio una matita).
- Aggiungere qualche goccia di medie tessuto-congelamento, (un polietilene glicole e alcool polivinilico contenenti medium) sul disco tenuta campione e montare il blocco campione con l'estremità anteriore degli embrioni punta verso l'alto (figura 2). Lasciare riposare il blocco montato- all'interno della camera criostato per circa 1 minuto o fino a quando il supporto del tessuto-congelamento diventa opaco.
- installare immediatamente il disco tenuta campione sul microtomo con il lato inferiore del blocco campione rivolto verso l'alto. Tagliare una porzione del blocco campione utilizzando una lama quando il blocco campione è ancora relativamente "soft" per ridurre la lunghezza di ogni sezione(se desiderato). Lasciare il disco tenuta campione sul microtomo per almeno 5 minuti per consentire la sua temperatura a raggiungere l'equilibrio.
- A poco a poco tagliare il blocco del campione verso il basso fino a quando le teste dei girini sono visibili attraverso la gelatina traslucida. Per aumentare la velocità di taglio, applicare un valore più alto (più spessa) della sezione spessore (ad esempio 20-25 micron), in questa fase (come ad esempio abilitando l'opzione "trim"), ma non troppo spesso, perché blocco campione può cadere dal disco partecipazione del campione . Osservare le prestazioni del criostato, come la nitidezza e l'angolo della pala in questa fase per garantire la produzione di una lunga striscia di sezioni successive.
- Una volta che le teste girino diventano visibili, regolare le impostazioni del criostato di nuovo al normale (ad esempio 10-12 micron) e pulire sia il microtomo e la fase utilizzando un pennello. Delicatamente fare 2-3 sezioni come un processo utilizzando l'impostazione volantino (non utilizzare l'impostazione motorizzata) per fare in modo che le fette finiti possono formare strIPS, non si sovrappongono o attaccare alla lama.
- Continua il taglio fino a quando le teste dei girini sono quasi esposti (puo 'avere bisogno di un po' di esperienza, ma realizzabile). Spazzolare tutte le sezioni residuo sul palco e la raccolta di sezioni campione avrà inizio.
- Fare circa 10-15 sezioni e far loro formano una lunga striscia.
- Capovolgere la lastra di vetro spessa copertura di lato e rimuovere delicatamente la striscia dalla lama con un pennello fine-tip e organizzare sul palcoscenico con una lunga asse parallelo alla lama.
- Sceglietene uno scivolo di carica positiva a temperatura ambiente, etichettarlo con una matita (che non verrà lavato via durante i successivi trattamenti di colorazione), premere rapidamente ma con fermezza sulla striscia con l'etichetta rivolta verso il basso e rimuovere il vetrino dalla camera criostato. Se fatto correttamente, la striscia deve aderire immediatamente alla slitta carica positiva (Figura 3A).
- Ripetere questo passaggio per avere 20-30 fette su ogni scivolatoe e disposti in parallelo (Figura 3B). Ciò è sufficiente a coprire l'intera regione del cervello di X. embrioni tropicalis e la maggior parte del prosencefalo e mesencefalo regioni di X. laevis embrioni.
- Far asciugare i vetrini per 10 minuti, procedere immediatamente o, memorizzare le diapositive in una scatola di scorrimento a -80 ° C per almeno 3-6 mesi senza perdere immunogenicità.
3. Immunocolorazione di sezionata Xenopus embrioni
- Preparare i reagenti e materiali per esperimenti.
- Preparare 0,05% TBS-Triton X-100 aggiungendo Triton X-100 in 1x TBS per ottenere una concentrazione finale di 0,05%. Questa soluzione è stabile a temperatura ambiente per 3-4 giorni. Non usare la soluzione scaduto.
- Preparare 5% di siero di capra inattivato al calore o 5% di BSA in TBST come tampone di bloccaggio. In primo luogo, calore inattivare il siero di capra / agnello ponendo circa 20-30 ml di siero in un bagno d'acqua a 65 ° C per 30-60 min. Aliquota in 1,5 ml centrifugatubi e congelare a -20 ° C. No ri-inattivazione è richiesto al momento dell'uso.
- Diluire il siero inattivato al calore o BSA in TBST per ottenere una concentrazione finale del 5% prima dell'uso.
- Preparare opportuni anticorpi primari in base alle diluizioni in tampone di bloccaggio (ad esempio 1: tubulina 250 anti-Myt1 26 / anti-acetilata: 500 anti-SOX3 10,25 / 1). Utilizzare circa 100 ml di soluzione di anticorpo in ogni diapositiva.
- Preparare anticorpi fluorescenti appropriate (ad esempio anti-topo / coniglio fluorescente rosso colorante coniugato anticorpi) in tampone di bloccaggio (di solito 1: 500).
- (Opzionale) rosso fluorescente colorante coniugato falloidina (1: 500) in miscela anticorpo secondario per rivelare rete di actina.
- (Opzionale) DAPI (0,5 mg / ml concentrazione finale) in miscela anticorpo secondario di visualizzare la localizzazione nucleare.
- Prendere il mezzo di montaggio anti-sbiadimento fuori dal freezer e scongelare in bagno d'acqua a temperatura ambiente.
- immunocolorazione
- Rimuovere i vetrini congelati da -80 ° C e metterli su un foglio di carta asciugamani all'interno di una cappa di ventilazione per almeno 1 ora per eliminare eventuali gocce d'acqua condensata, quindi cuocere le diapositive secchi su un blocco C di calore 85-90 ° con la fette rivolti verso l'alto per 15 minuti per attivare il meccanismo di adesione. Infine, i vetrini consentono raffreddare a temperatura ambiente (almeno 10 min).
- Riempire la vaschetta di colorazione con acetone puro e incubare i vetrini in acetone per 10 minuti per rimuovere gelatina di pesce. Se più diapositive devono essere trattati, disporle su una griglia colorazione. Asciugare le slitte trattate per 15 minuti in una cappa di ventilazione. Non riutilizzare il acetone.
- disegnare con attenzione un anello intorno i campioni sul vetrino con una penna PAP senza toccare i campioni. Assicurarsi che l'anello è chiuso in se stesso, altrimenti soluzione di anticorpi avrà una fuoriuscita durante la colorazione. Completamente asciugare l'anello penna PAP.
- Riempire un'altra vaschetta di colorazione con 1x TBS senza Triton X-100. Insert-le diapositive secchi nella vaschetta di colorazione e permettere la reidratazione per almeno 1 ora. Nel frattempo, preparare il tampone bloccante diluendo o siero di capra inattivato al calore o BSA a concentrazione finale 5% utilizzando 1x TBS con 0,05% Triton X-100.
- Fare una scatola bagnato ponendo 1-2 6 pozzetti all'interno di una scatola di cibo click-lock e riempire i pozzi a metà con acqua ultrapura. Estrarre i vetrini reidratati dalla vaschetta di colorazione e metterli orizzontalmente sui 6 pozzetti (senza coperchio piatto).
- Aggiungere con cautela 300-600 ml di tampone di bloccaggio all'interno dell'anello PAP. Sigillare la scatola bagnata bloccando il coperchio in posizione e incubare a temperatura ambiente per almeno 1 ora.
- Diluire gli anticorpi primari appropriati in tampone di bloccaggio. In generale, utilizzare 100-150 ml diluito soluzione di anticorpi per diapositiva. Se più diapositive vengono elaborati, scalare il volume proporzionalmente.
- Dopo il blocco, rimuovere con attenzione il tampone bloccante da diapositive tramite aspirazione e aggiungere velocemente psoluzione di anticorpi rimary per impedire secca-out, quindi sigillare la scatola umida e incubare a 4 ° C durante la notte.
- Il giorno successivo, rimuovere la soluzione dell'anticorpo primario dalle diapositive per aspirazione. Lavare le diapositive inserendo in vasetti di colorazione pieni di 1x TBS con 0,05% Triton X-100, per 3 volte, 15 minuti ciascuno. Nel frattempo, diluire gli anticorpi secondari fluorescenti appropriate con tampone di arresto (con o senza DAPI o falloidina).
- Aggiungere con cautela 100-150 ml di soluzione di anticorpo secondario sulle diapositive. Porre i vetrini all'interno della scatola bagnato e sigillare il coperchio. Incubare i vetrini per 1-2 ore a temperatura ambiente.
- Lavare le diapositive in vasi pieni di colorazione 1x TBS con 0,05% Triton X-100, per 3 volte, 15 minuti ciascuno. Al lavaggio finale, scongelare il mezzo di montaggio anti-sbiadimento in un bagno d'acqua a 50 ° C per 10 minuti se conservato a -20 ° C. Raffreddare la soluzione di montaggio a temperatura ambiente prima dell'uso.
- Aggiungere circa 20 ml (una goccia) di mezzo di montaggio suil vetrino e applicare un grande vetrino (almeno 22 mm x 64 millimetri) sui campioni. Osservare con fluorescenza o microscopio confocale all'interno montaggio postale 6 ore.
- Se l'imaging non può essere fatto nello stesso giorno, sigillare le diapositive utilizzando smalto e metterli dentro la scatola bagnato a 4 ° C durante la notte.
NOTA: Il mezzo di montaggio anti-sbiadimento gradualmente ottenere ossidato dopo pochi giorni (e girare marrone) per cui si raccomanda di prendere le immagini il più presto possibile.
- Se l'imaging non può essere fatto nello stesso giorno, sigillare le diapositive utilizzando smalto e metterli dentro la scatola bagnato a 4 ° C durante la notte.
Risultati
I risultati rappresentativi mostrano sezioni trasversali di fase 30 Xenopus embrioni a diversi livelli, vale a dire il prosencefalo, mesencefalo, romboencefalo, e del midollo spinale, colorate con diversi anticorpi (Figura 4). Come accennato, SOX3 marcato popolazione di cellule progenitrici neuronali individua in prossimità del lume del tubo neurale, mentre MyT1-etichettati neuroni primari differenziati migrano verso l'esterno e individuare vicino al livello marginale (lamina basale) del tubo neurale. Anti-acetil-tubulina etichette assoni nei neuroni differenziati, che possono essere osservati nell'intero tubo neurale.
-Side specifico silenziamento genico o sovraespressione è un metodo ampiamente utilizzato in neurobiologia valutare se modulando l'espressione di gene specifico (s) interrompe la crescita e la differenziazione delle cellule neuronali. In tali casi, sia Morpholinos (MOS) o costrutto di DNA (s) portante pro gene (s) promotore-driven sono iniettati in uno dei due blastomeri allo stadio a due cellule 23. In alternativa, possono essere iniettati nel ventricolo cerebrale seguita da elettroporazione, che si tradurrà in knockdown o sovra-espressione del gene desiderato (s) 27. In entrambi i casi, gli effetti saranno limitati ad un lato dell'embrione, rendendo il lato opposto dell'embrione come controllo interno non trattato.
Dopo la fissazione, il sezionamento, e immunostaining, gli impatti del silenziamento genico / sovra-espressione vengono quantificati contando e confrontando i numeri cellulari di diverse popolazioni a entrambi i lati della dell'embrione. Accumulando questi dati provenienti da diversi embrioni, l'analisi statistica può essere eseguita. Nei nostri risultati rappresentativi, nessuna perturbazione è stata fatta negli embrioni. Esempi di perturbazione gene e loro effetti sulle diverse popolazioni cellulari neuronali possono essere trovati nei riferimenti 20,23.
t "fo: keep-together.within-page =" 1 ">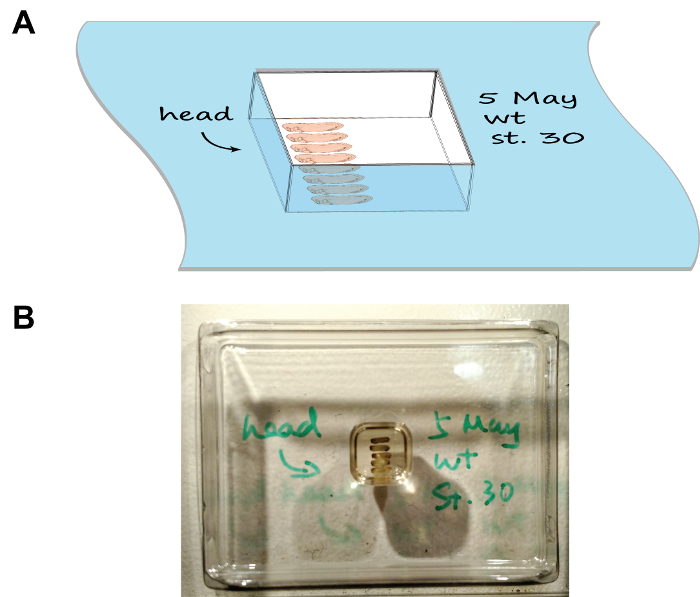
Figura 1:. Arrangiamento embrioni e l'orientamento nello stampo sezione (A) Un fumetto rappresentazione che mostra il sistema di montaggio, di notare il vassoio è stato etichettato con la data, la fase e l'orientamento degli embrioni. (B) Un'immagine che mostra l'aspetto naturale del sistema di montaggio. Cliccate qui per vedere una versione più grande di questa figura.
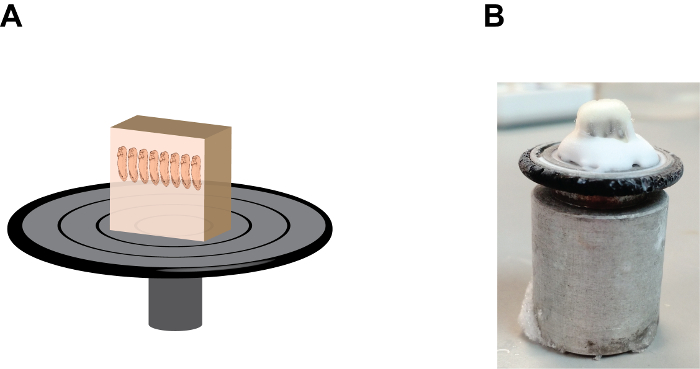
Figura 2:. L'orientamento e la posizione del blocco di gelatina sul disco campione tenuta (A) Un cartone rappresentazione che mostra l'assieme blocco sezione notare che gli embrioni sono in una posizione "heads up" e il blocco di gelatina è saldamente fissati onto il disco possesso campione medio tessuto-congelamento alla base (vedere Figura 2B). (B) Un'immagine che mostra l'aspetto naturale del gruppo di blocco sezione, si noti l'accumulo del mezzo tessuti congelamento tra il blocco di gelatina e il disco campione di partecipazione. Si prega di cliccare qui per vedere una versione più grande di questa figura.
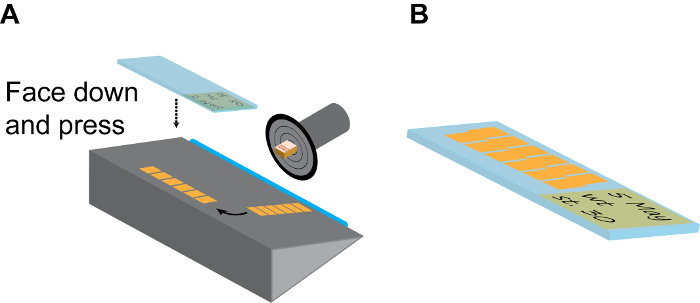
Figura 3:. Sezionamento continuo (A) Modello di una camera di sezione. Il disco tenuta campione deve essere ruotato e fissato nella posizione che il lato embrione è rivolto verso l'alto. Dopo un paio di (6-10) sezioni, la lunga striscia di piastrelle sezione continui vengono delicatamente separato dalla lama (blu) con un pennello sottile, e poi ruotato di 90 ° sulla piastra di supporto. Poi una stanza-Temp caricato positivamente diapositiva èsaldamente premuto sulla striscia sezione rivolta verso il basso e subito innalzato a strisce finiti raccolti. (B) Normalmente, ciascuna diapositiva può ospitare 2 linee parallele di strisce, come mostrato. Ricordarsi di effettuare resoconto dettagliato sull'etichetta diapositiva utilizzando matita. Fai clic qui per vedere una versione più grande di questa figura.
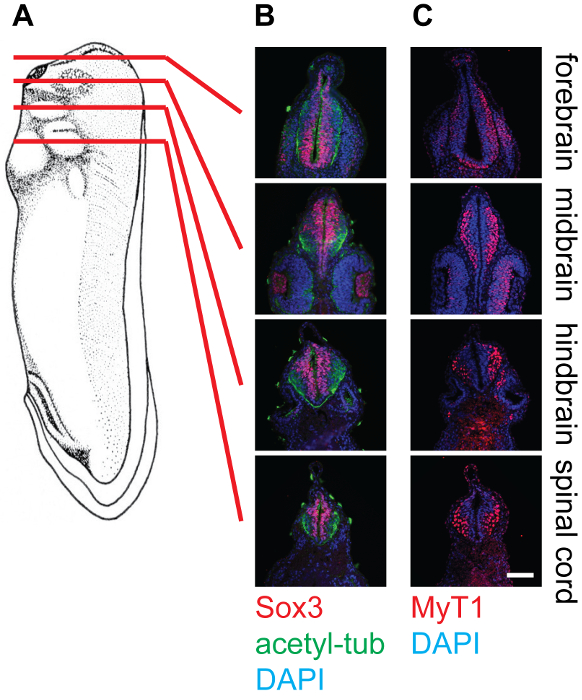
Figura 4: Sezione della fase 30 X. laevis girini e colorazione del tessuto neurale, 20X. (A) Schema che indicano le posizioni relative (prosencefalo, mesencefalo, romboencefalo, e midollo spinale) di piani di sezione sui girini Xenopus. (B) corrispondenti sezioni colorate con anti-SOX3 (Rosso), anti-acetilata-tubulina (Green), e DAPI (blu), che mostra le posizioni relative delle piscine di cellule staminali neurali e neurofilaments all'interno del tubo neurale. (C) corrispondente sezioni colorate con anti-MyT1 (rosso) e DAPI (blu), che mostra le posizioni relative dei neuroni primari differenziati all'interno del tubo neurale. Barra di scala = 20 micron. Cliccate qui per vedere una versione più grande di questa figura.
Discussione
Qui mostriamo un metodo conveniente ed efficiente per la visualizzazione neurogenesi primaria in embrioni di Xenopus. Questo metodo permette la valutazione di diversi tipi di cellule neurali, comprese le cellule staminali neuronali e neuroni primari differenziati utilizzando marcatori specifici del tipo di cellula.
Il protocollo è generalmente robusto molto elevata riproducibilità. Per gli embrioni che si trovano nelle fasi di pre-cova (vale a dire fino alla fase 28), si consiglia di rimuovere manualmente la membrana vitellina prima della fissazione in quanto ciò consente di embrioni uncurl completamente prima di fissazione. Ciò è particolarmente importante quando la raccolta embrioni relativamente fasi (prima della schiusa), poiché embrioni piegate sono estremamente difficile organizzare l'orientamento desiderato all'interno della camera di montaggio. Non abbiamo subito una perdita di immunogenicità dopo MEMFA o PFA fissazione quindi ulteriore passo antigene recupero non è necessario per questo protocollo. Inoltre, questoProcedura immunocolorazione può essere effettuata in campioni da cromogenica / ibridazione in situ fluorescente. In tale scenario, si consiglia di saltare la fase di trattamento K proteasi durante il protocollo in situ ibridazione. Dopo la reazione substrato cromogenico / fluorescenti, i campioni possono essere lavati con TBS e incorporati in soluzione gelatina di pesce in modo simile a campioni fissati MEMFA / PFA. Fiale del campione possono essere protetti dalla luce avvolgendo le fiale in un foglio di alluminio, se ibridazione in situ fluorescente sarà ripreso insieme a immunofluorescenza colorazione più tardi.
In alcuni casi, gli embrioni possono restringersi eccessivamente dopo la penetrazione gelatina. Questo è molto probabilmente causato da una fissazione insufficiente o insufficiente estrazione TBS-Triton. Assicurarsi che gli embrioni sono stati fissati in PFA / MEMFA per almeno 2-3 ore o preferibilmente durante la notte a 4 ° C. Se il problema persiste, aumentare il tempo di lavaggio di TBS-Triton a 3 per 1 ora.
Durante crio-sectioNing, la rigidità del blocco campione può variare in diversi lotti di gelatina di pesce hanno proprietà diverse. Questo problema può essere parzialmente compensato regolando la temperatura del microtomo. Una temperatura più bassa si tradurrà in un blocco "più duro" campione comunque sotto eccessiva bassa temperatura blocco campione diventa croccante e difficile sezione. Alcuni perfezionamenti o pratica (utilizzando i blocchi di esempio finte senza embrioni) prima di ogni sezionamento può essere utile prima di usare su campioni di particolare pregio.
Un problema comunemente incontrati durante sezionamento è sezioni sottili a volte tendono ad attaccarsi sulla lastra di vetro spessa piuttosto che rimanere piatta sul palco in acciaio. Questo può essere particolarmente interrompendo quanto interrompe costantemente il procedimento di taglio continuo. Tali casi sono di solito causati da uno dei due motivi: la camera di sezione e (soprattutto) la lastra di vetro di spessore non essere carica statica abbastanza freddo, o eccessivo sulla macchina e l'operator, soprattutto nella stagione secca. Il primo può essere risolto abbassando la temperatura della camera di sezione e lasciando la lastra di vetro entro i tempi supplementari (possibilmente durante la notte); e il secondo di terra quanto criostato. Collegamento la superficie metallica del criostato ad un rubinetto metallico o simile sistema di tubi di acqua fatta di metallo può essere un modo alternativo per liberare le cariche statiche. Dopo ogni utilizzo, la lastra di vetro di spessore deve essere lavato bene con un detergente non corrosivo (ad esempio detersivo), risciacquato con acqua ultrapura, spruzzato con etanolo puro, e avvolto in carta asciugamano per proteggere la superficie ei bordi dal danno.
Gli anticorpi elencati nel protocollo sono generalmente specifici e raramente incontrano adsorbimento non specifico o ad alto segnale di fondo. Va notato che, se si utilizza inattivato al calore siero di capra / agnello come agente bloccante, eccessivo calore inattivazione (come visualizzato dalla formazione di precipitante soffice nel siero) dovrebbeessere evitata poiché questo precipitante è molto interessante per anticorpi secondari e può contribuire ad una sorgente di alta sfondo.
È possibile, e talvolta desiderato, effettuare doppia colorazione per visualizzare differenti popolazioni di cellule neuronali simultaneamente. Tale doppia colorazione è possibile e in genere dà risultati soddisfacenti con le seguenti combinazioni: SOX3 / N-vasca o Myt1 / N-vasca. Tuttavia, doppia colorazione di SOX3 e Myt1 è complicata dal fatto che i due anticorpi sono entrambi di origine di coniglio. Abbiamo testato diversi kit di etichettatura diretti anticorpi, tuttavia sono stati osservati risultati soddisfacenti (basso livello di segnale-rumore), probabilmente a causa della mancanza di amplificazione del segnale da anticorpi secondari. Un possibile approccio per aggirare questo problema potrebbe essere quella di aumentare le linee transgeniche in Xenopus, come discusso di seguito.
Una delle principali limitazioni di questo protocollo è che, mentre questo protocollo potrebbe sufficientemente distinguish due piscine principali di cellule neuronali, vale a dire, il pool di cellule staminali neurali SOX3-esprimere e le Myt1-esprimono i neuroni differenziati, manca la capacità di rivelare diversi sotto-popolazioni di neuroni differenziati. Tali sub-popolazioni, che compreso, ma non sono limitati a, i neuroni motori primari, interneuroni e neuroni sensoriali, sono generalmente caratterizzati da loro differenzialmente espressi geni marcatori 28-30. Come accennato in precedenza, i recenti progressi nello sviluppo di multicolore in ibridazione in situ in combinazione con il metodo di rilevazione immunofluorescenza a base di anticorpi in embrioni di Xenopus possono colmare la lacuna per rivelare questi sotto-popolazioni di neuroni differenziati per il potenziale di indagine 31. In alternativa, come è stato dimostrato nei topi modello, sarebbe anche desiderabile per raccogliere un insieme più completo di anticorpi specifici per tipo di cellule per distinguere tali popolazioni cellulari diversi in Xenopus.
Èanche ricordare che, in aggiunta a questo metodo, i recenti progressi nella imaging ottico e analisi di immagine, quali la microscopia multiphoton, ricostruzione 3D, e segmentazione, possono essere applicati anche dopo valutazioni iniziali per ottenere osservazioni più complete di oociti di Xenopus e embrioni precoci, in particolare nell'ambito di una impostazione 32,33 dal vivo. Pertanto, per monitorare la proliferazione, la differenziazione, e il movimento delle cellule neuronali negli animali vivi, sarebbe desiderabile per stabilire una o più linee transgeniche che ospitano proteine fluorescenti guidati da specifici tipo di cellula promotore per consentire l'osservazione diretta di tali popolazioni cellulari nei primi mesi del Xenopus embrioni. La creazione di una X. Linea laevis con specifiche neuro promotore β-tubulina di guida tauGFP e le sue applicazioni hanno fornito un bell'esempio 23,34. Con le sequenze promotore pieni di entrambi SOX3 e myt1 caratterizzato nei vertebrati 35-37, è should essere relativamente facile stabilire linee transgeniche aggiuntivi in Xenopus che dovrebbero contribuire ampiamente sia alla comunità di Xenopus e un campo più generale della ricerca neurogenesi primario.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo il Prof. Michael Klymkowsky presso l'Università del Colorado a Boulder e il Prof. Nancy Papalopulu presso l'Università di Manchester per la fornitura gentilmente anti-SOX3 e anti-Myt1 anticorpi, rispettivamente. Ringraziamo i membri del laboratorio Papalopulu per i loro suggerimenti penetranti nello sviluppo di questo protocollo. Questo lavoro è stato supportato da due Healing Foundation Borse di studio per SZ e JL, due borse di studio che la fondazione di guarigione a SZ / EA e JL / EA, rispettivamente, un programma di sovvenzioni dal Wellcome Trust a EA (WT082450MA), e una sovvenzione istituzionale supporto strategico dal Wellcome trust [097.820 / Z / 11 / Z].
Materiali
| Name | Company | Catalog Number | Comments |
| gentamicin | Sigma-Aldrich | G1397 | |
| Tris-HCl | Sigma-Aldrich | T3253 | |
| Tris-base | Sigma-Aldrich | T1503 | |
| NaCl | Sigma-Aldrich | S7653 | |
| KCl | Sigma-Aldrich | 746436 | |
| MgSO4 | Sigma-Aldrich | 746452 | |
| CaCl2 | Sigma-Aldrich | 793639 | |
| HEPES | Sigma-Aldrich | H3375 | |
| MOPS | Sigma-Aldrich | RDD003 | |
| EGTA | Sigma-Aldrich | E3889 | |
| 37% formaldehyde | Sigma-Aldrich | F8775 | |
| Gelatin from cold water fish skin | Sigma-Aldrich | G7765 | |
| Sucrose | Sigma-Aldrich | S7903 | |
| Base Mould Disposable 15 Mm x 15 Mm x 5 Mm Simport | VWR | EMB-200-015A | |
| Base Mould Disposable 7 Mm x 7 Mm x 5 Mm Simport | VWR | EMB-200-010K | |
| Superfrost Plus slides | ThermoFisher | 12-550-15 | |
| Tissue Freezing Medium (OCT) | Leica | 14020108926 | |
| Cryostat | Leica | CM3050 | |
| Gloves | |||
| Dry Ice | |||
| Triton X-100 | Sigma-Aldrich | X100 | |
| 85-90 °C Heat block | |||
| PAP pen | Sigma-Aldrich | Z377821 | |
| Acetone, analytical grade | |||
| Staining jar with slide racks | |||
| Click-lock food box of appropriate size (has the capacity to hold 1-2 6-well plate inside) | |||
| anti-acetylated tubulin | Sigma-Aldrich | T7451 | |
| Anti-mouse IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 488 Conjugate) | Cell Signaling | 4408 | |
| Anti-rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 555 Conjugate) | Cell Signaling | 4413 | |
| Alexa Fluor® 647 Phalloidin | Cell Signaling | 8940 | |
| DAPI | Cell Signaling | 4083 | |
| ProLong Gold Antifade Mountant | Life Technologies | P36930 |
Riferimenti
- De Robertis, E. M., Kuroda, H. Dorsal-ventral patterning and neural induction in Xenopus embryos. Annual Rev Cell Dev Biol. 20, 285-308 (2004).
- Wilson, S. W., Houart, C. Early steps in the development of the forebrain. Dev Cell. 6, 167-181 (2004).
- Hemmati-Brivanlou, A., Melton, D. Vertebrate embryonic cells will become nerve cells unless told otherwise. Cell. 88, 13-17 (1997).
- Hemmati-Brivanlou, A., Melton, D. A. Inhibition of activin receptor signaling promotes neuralization in Xenopus. Cell. 77, 273-281 (1994).
- Fainsod, A., et al. The dorsalizing and neural inducing gene follistatin is an antagonist of BMP-4. Mech Dev. 63, 39-50 (1997).
- Piccolo, S., Sasai, Y., Lu, B., De Robertis, E. M. Dorsoventral patterning in Xenopus: inhibition of ventral signals by direct binding of chordin to BMP-4. Cell. 86, 589-598 (1996).
- Zimmerman, L. B., De Jesus-Escobar, J. M., Harland, R. M. The Spemann organizer signal noggin binds and inactivates bone morphogenetic protein 4. Cell. 86, 599-606 (1996).
- Koyano, S., Ito, M., Takamatsu, N., Takiguchi, S., Shiba, T. The Xenopus Sox3 gene expressed in oocytes of early stages. Gene. 188, 101-107 (1997).
- Rogers, C. D., Harafuji, N., Archer, T., Cunningham, D. D., Casey, E. S. Xenopus Sox3 activates sox2 and geminin and indirectly represses Xvent2 expression to induce neural progenitor formation at the expense of non-neural ectodermal derivatives. Mech Dev. 126, 42-55 (2009).
- Zhang, C., Basta, T., Jensen, E. D., Klymkowsky, M. W. The beta-catenin/VegT-regulated early zygotic gene Xnr5 is a direct target of SOX3 regulation. Development. 130, 5609-5624 (2003).
- Penzel, R., Oschwald, R., Chen, Y., Tacke, L., Grunz, H. Characterization and early embryonic expression of a neural specific transcription factor xSOX3 in Xenopus laevis. Int J Dev Biol. 41, 667-677 (1997).
- Bellefroid, E. J., et al. X-MyT1, a Xenopus C2HC-type zinc finger protein with a regulatory function in neuronal differentiation. Cell. 87, 1191-1202 (1996).
- Moody, S. A., Miller, V., Spanos, A., Frankfurter, A. Developmental expression of a neuron-specific beta-tubulin in frog (Xenopus laevis): a marker for growing axons during the embryonic period. J Comp Neurol. 364, 219-230 (1996).
- Oschwald, R., Richter, K., Grunz, H. Localization of a nervous system-specific class II beta-tubulin gene in Xenopus laevis embryos by whole-mount in situ hybridization. Int J Dev Biol. 35, 399-405 (1991).
- Chitnis, A., Henrique, D., Lewis, J., Ish-Horowicz, D., Kintner, C. Primary neurogenesis in Xenopus embryos regulated by a homologue of the Drosophila neurogenic gene Delta. Nature. 375, 761-766 (1995).
- Roberts, A. Early functional organization of spinal neurons in developing lower vertebrates. Brain Res Bull. 53, 585-593 (2000).
- Hartenstein, V. Early neurogenesis in Xenopus: the spatio-temporal pattern of proliferation and cell lineages in the embryonic spinal cord. Neuron. 3, 399-411 (1989).
- Hirabayashi, Y., et al. The Wnt/beta-catenin pathway directs neuronal differentiation of cortical neural precursor cells. Development. 131, 2791-2801 (2004).
- Munji, R. N., Choe, Y., Li, G., Siegenthaler, J. A., Pleasure, S. J. Wnt signaling regulates neuronal differentiation of cortical intermediate progenitors. J Neurosci. 31, 1676-1687 (2011).
- Bonev, B., Stanley, P., Papalopulu, N. MicroRNA-9 Modulates Hes1 ultradian oscillations by forming a double-negative feedback loop. Cell Rep. 2, 10-18 (2012).
- Bonev, B., Pisco, A., Papalopulu, N. MicroRNA-9 reveals regional diversity of neural progenitors along the anterior-posterior axis. Dev Cell. 20, 19-32 (2011).
- Munoz, R., et al. Regeneration of Xenopus laevis spinal cord requires Sox2/3 expressing cells. Dev Biol. , (2015).
- Zhang, S., Li, J., Lea, R., Vleminckx, K., Amaya, E. Fezf2 promotes neuronal differentiation through localised activation of Wnt/beta-catenin signalling during forebrain development. Development. 141, 4794-4805 (2014).
- Zhang, S., Li, J., Lea, R., Amaya, E., Dorey, K. A Functional Genome-Wide In Vivo Screen Identifies New Regulators of Signalling Pathways during Early Xenopus Embryogenesis. PloS one. 8, e79469(2013).
- Wang, T. W., et al. Sox3 expression identifies neural progenitors in persistent neonatal and adult mouse forebrain germinative zones. J Comp Neurol. 497, 88-100 (2006).
- Sabherwal, N., et al. The apicobasal polarity kinase aPKC functions as a nuclear determinant and regulates cell proliferation and fate during Xenopus primary neurogenesis. Development. 136, 2767-2777 (2009).
- Falk, J., et al. Electroporation of cDNA/Morpholinos to targeted areas of embryonic CNS in Xenopus. BMC Dev Biol. 7, 107(2007).
- Moreno, N., Retaux, S., Gonzalez, A. Spatio-temporal expression of Pax6 in Xenopus forebrain. Brain Res. 1239, 92-99 (2008).
- Kay, B. K., Shah, A. J., Halstead, W. E. Expression of the Ca2+-binding protein, parvalbumin, during embryonic development of the frog, Xenopus laevis. J Cell Biol. 104, 841-847 (1987).
- Park, B. Y., Hong, C. S., Weaver, J. R., Rosocha, E. M., Saint-Jeannet, J. P. Xaml1/Runx1 is required for the specification of Rohon-Beard sensory neurons in Xenopus. Dev Biol. 362, 65-75 (2012).
- Lea, R., Bonev, B., Dubaissi, E., Vize, P. D., Papalopulu, N. Multicolor fluorescent in situ mRNA hybridization (FISH) on whole mounts and sections. Methods Mol Biol. 917, 431-444 (2012).
- Canaria, C. A., Lansford, R. Advanced optical imaging in living embryos. Cell Mol Life Sci. 67, 3489-3497 (2010).
- Prouty, A. M., Wu, J., Lin, D. T., Camacho, P., Lechleiter, J. D. Multiphoton laser scanning microscopy as a tool for Xenopus oocyte research. Methods Mol Biol. 322, 87-101 (2006).
- Love, N. R., et al. pTransgenesis: a cross-species, modular transgenesis resource. Development. 138, 5451-5458 (2011).
- Kovacevic Grujicic, N., Mojsin, M., Krstic, A., Stevanovic, M. Functional characterization of the human SOX3 promoter: identification of transcription factors implicated in basal promoter activity. Gene. 344, 287-297 (2005).
- Wang, S., et al. Myt1 and Ngn3 form a feed-forward expression loop to promote endocrine islet cell differentiation. Dev Biol. 317, 531-540 (2008).
- Rogers, C. D., Archer, T. C., Cunningham, D. D., Grammer, T. C., Casey, E. M. Sox3 expression is maintained by FGF signaling and restricted to the neural plate by Vent proteins in the Xenopus embryo. Dev Biol. , 307-319 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon