Method Article
Preparazione core tessuto inclusi in paraffina fissati in formalina per entrambi RNA e DNA Extraction
In questo articolo
Riepilogo
Questo protocollo di estrazione modificato migliora RNA e DNA raccolti dalle regioni più precisamente mirati di interesse in blocchi di tessuto istopatologici.
Abstract
Formalin-fixed paraffin embedded tissue (FFPET) represents a valuable, well-annotated substrate for molecular investigations. The utility of FFPET in molecular analysis is complicated both by heterogeneous tissue composition and low yields when extracting nucleic acids. A literature search revealed a paucity of protocols addressing these issues, and none that showed a validated method for simultaneous extraction of RNA and DNA from regions of interest in FFPET. This method addresses both issues. Tissue specificity was achieved by mapping cancer areas of interest on microscope slides and transferring annotations onto FFPET blocks. Tissue cores were harvested from areas of interest using 0.6 mm microarray punches. Nucleic acid extraction was performed using a commercial FFPET extraction system, with modifications to homogenization, deparaffinization, and Proteinase K digestion steps to improve tissue digestion and increase nucleic acid yields. The modified protocol yields sufficient quantity and quality of nucleic acids for use in a number of downstream analyses, including a multi-analyte gene expression platform, as well as reverse transcriptase coupled real time PCR analysis of mRNA expression, and methylation-specific PCR (MSP) analysis of DNA methylation.
Introduzione
La ricerca genomica biomarcatore cerca di individuare correlati molecolari che riflettono in modo accurato e affidabile lo stato di malattia, e di farlo in un modo clinicamente utile. 1 lo sviluppo di biomarker fa affidamento su analisi retrospettiva di campioni di tessuto ben annotati-. campioni di tessuto malato e normali vengono memorizzate tessuto come fresco congelato in biobanche specializzate o come tessuto incluso in paraffina (FFPET) blocchi fissate in formalina in archivio clinici. Tessuto fresco congelato consente l'estrazione degli acidi nucleici di alta qualità ed è stato ampiamente utilizzato negli studi di genomica scoperta di biomarcatori. 2,3 Tuttavia, un minor numero di campioni di tessuto sono disponibili in biobanche e studiare come il tessuto presenta una polarizzazione verso i campioni più grandi, categorie insolite di malattia, ed i pazienti visto in centri specializzati con maggiori capacità di tessuto banca. 4 FFPET, al contrario, è il metodo di memorizzazione di default per i tessuti umani e animali malati. Mentre blocchi FFPET mantengono m cellulareorphology, il processo di fissazione legami incrociati altri costituenti cellulari di acidi nucleici. RNA e DNA reticolata sono recuperabili, ma solo in forme altamente frammentate degradate. 5,6 Tuttavia, questi frammenti di DNA e RNA sono suscettibili di analisi da una serie di saggi espansione, compresa l'espressione mRNA, ipermetilazione DNA, e sequenziamento mirato. 7,8 per sfruttare questa opportunità in grande quantità e varietà di FFPET disponibile per la ricerca, vi è una necessità di un protocollo di estrazione efficiente e affidabile.
Gran parte della ricerca biomarker nel tessuto si concentra sul cancro. Come altri tipi di tessuto malato, tessuto del cancro spesso mostra una significativa eterogeneità regionale nella conservazione delle cellule e tipo di cellula. Poiché la ricerca biomarker si basa sulla capacità di correlare costituenti del tessuto malato con caratteristiche molecolari, un punto critico di questo processo è la raccolta precisa di tessuto che è ben conservato e arricchito per la disease in fase di studio. In FFPET, due tecniche di arricchimento sono spesso utilizzati: microdissezione laser (LCM), e sezionamento microtomo. LCM consente altamente concentrata raccolta tessuto e può essere utilizzata per isolare, tipi cellulari ben conservate specifici tessuti eterogenei. 9,10 Tuttavia, LCM richiede attrezzature costose ed è tempo eccessivamente lunghi per un gran numero di campioni. Sezionamento microtomo è un processo più diffuso in cui sezioni sottili sono tagliate da blocchi FFPET. 11,12 sezioni microtomo taglio spesso includono tessuto che è eterogeneo nella conservazione delle cellule (ad esempio, contro necrotico ben conservato) e la composizione (ad esempio, il cancro vs. benigna parenchima), e quindi può portare alla omogeneizzazione delle caratteristiche molecolari migliori indagati separatamente. Pertanto, vi è la necessità di un metodo ad alta produttività che arricchisce di cellule di interesse. Un terzo metodo, l'isolamento di acidi nucleici da nuclei FFPET, fornisce questo arricchimento, è adatto per alta throughput protocolli, ed è stato utilizzato da altri per isolare RNA o DNA da nuclei di tessuto separati. 7,13,14
Un certo numero di protocolli pubblicati specifichi metodi di estrazione acidi nucleici da FFPET (Tabella 1). Tuttavia, i protocolli dove RNA e DNA sono estratte dal tessuto stesso sono stati ottimizzati per sezioni di tessuto microtomo, ma non per core di tessuto. 15,16 protocolli Allo stesso modo, pubblicati che offrono maggiore specificità dei tessuti, sia attraverso nuclei di tessuto o microdissections diapositive, specificare le procedure per l'estrazione del DNA, ma non RNA. 7,17 Qui, un protocollo ottimizzato per doppia estrazione di DNA e RNA sia dallo stesso tessuto di base è dimostrata. nuclei tessuto vengono raccolte con l'inserimento di microarray tissutale (TMA) punzoni in regioni di interesse mappati sui blocchi FFPET. La mappatura è eseguita annotando un vetrino da microscopio con un pennarello e trasferendo l'annotazione alla superficie della corrispondente FFPEBlocco T (Figura 1).
Prima lavoro che ha portato allo sviluppo di questo protocollo comprendeva un confronto dei diversi sistemi di estrazione di acido nucleico disponibili in commercio. In questo confronto, modifiche ai protocolli commerciali, come descritto di seguito forniti i massimi DNA e RNA rese e qualità (Selvarajah et al., In prep). Nuclei di tessuto sono più spessi di sezioni micron 5-10 micron tipicamente utilizzati in protocolli di estrazione FFPET 11,12,14,18 - 20, e possono contenere quantità più variabili di paraffina. Per compensare questo, deparaffinizzazione è stato migliorato ripetendo i trattamenti xilene e etanolo e con l'introduzione di una fase di omogeneizzazione motorizzato (Figura 1). Inoltre, i tempi di digestione proteinasi K sono stati allungati per aumentare il rendimento del DNA. Nel complesso, questo protocollo è costo-efficace e consente la creazione di legami tra le caratteristiche molecolari e istopatologiche della malattia a laRGE, le popolazioni ben caratterizzati. Il protocollo nel suo complesso può essere effettuata in modo affidabile entro 2 giorni, di cui 3 ore di hands-on tempo, con poca necessità di attrezzature specializzate o costoso.
Il protocollo step-by-step è seguito da una versione modificata del protocollo del produttore. 21 Si prega di vedere la tabella dei materiali / Attrezzature di reagenti specifici, attrezzature e produttori.
Protocollo
1. Tissue carotaggio
- Rivedere il vetrino da microscopio e delineare la regione (s) di interesse utilizzando un pennarello indelebile a punta fine. Tagliare un tratto di film di paraffina abbastanza grande da coprire la regione di interesse sul vetrino da microscopio. Mettere pellicola saldamente sul vetrino e avvolgere pellicola su spigoli per mantenere il film di scivolare. Utilizzando un pennarello indelebile a punta fine, delineare tutto il tessuto e la regione (s) di interesse all'interno del tessuto, mantenendo il toccando outline - ma fuori - regione (s).
- Rimuovere la pellicola e trasferirlo al blocco di tessuto corrispondente. Orientare la pellicola capovolgendo o ruotando in modo che il contorno di tutto il tessuto corrisponde alla forma osservata del tessuto nel blocco (Figura 1). Premere il tratto di film saldamente alla superficie del blocco per evitare lo slittamento.
- Utilizzando la punta del pennarello indelebile, rendere rientranze poco profonde ma visibili (~ 0,2 mm) lungo il contorno della regione (s) di unteresse, quindi rimuovere la pellicola. Carico 1 ml di candeggina, etanolo al 70%, e l'acqua in tubi separati 1,5 o 2,0 ml microcentrifuga.
- Pulire il pugno del recettore (rosso) dal punzone 0,6 millimetri impostare facendo scorrere il pugno su e giù parecchie volte, mentre la punta è immerso nella provetta contenente candeggina. Ripetere la stessa operazione con il 70% di etanolo e poi acqua (fondamentale per garantire che la candeggina viene rimosso).
- Premere il punzone nel tessuto, all'interno della regione di interesse ad una profondità di 3 mm e ritirare il punzone. Rilasciare il nucleo in un ridotto legame provetta da 1,5 o 2 ml spingendola fuori del punzone con lo stilo. Conservare i nuclei a -20 ° C (a lungo termine) o di 4 ° C per uso a breve termine.
- Pulire il pugno in base al punto 1.4 e proseguire con i successivi regioni o campione.
2. Deparaffinare I nuclei del tessuto FFPE
- Carryout deparaffinizzazione in 1,5 o 2 ml tubi con l'aggiunta di 1 ml di xilene al nucleo tessuti e vortex vigorosamente per 10 secondi. Heat per 3 minuti a 50 ° C.
- Centrifugare per 2 minuti a temperatura ambiente (RT) e la velocità massima (21.130 xg) e posto provetta in ghiaccio per 5 min (permette il residuo ceroso solidificare in alto).
- Rimuovere con cautela la paraffina accumulata intorno menisco con surnatante utilizzando un puntale e ripetere il trattamento xilene (punti 2.1-2.2).
- Aggiungere 1 ml di etanolo (100%) e vortex vigorosamente per 10 secondi. Centrifugare per 2 minuti a temperatura ambiente (velocità massima), e scartare con cura l'etanolo. Ripetere la stessa operazione una sola volta.
3. omogeneizzazione dei nuclei deparaffinate
- Risospendere le anime in 700 ml di etanolo (100%) prima omogeneizzazione. Utilizzando un omogeneizzatore tessuto motorizzato, macinare i nuclei in particelle dei tessuti sottili (~ 1 min a regolazione media). Pulire la sonda omogeneizzatore tra ogni campione per ridurre al minimo la contaminazione carry-over.
- Riempire provette da 15 ml con ~ 10 ml di candeggina, soluzione neutralizzante RNasi e il 70% di etanolo. Dopo homo campionegenization, lavare la sonda omogeneizzatore in ciascuna delle soluzioni di pulizia nell'ordine sopra indicato. Eseguire il omogeneizzatore sulla massima velocità durante la fase di lavaggio.
- Pulire la sonda con tessuti e lasciare la sonda si asciughi completamente prima di omogeneizzare il campione successivo. Ispezionare le lame della sonda per pezzi di tessuto residuo. Se trovato, pulire nuovamente la sonda. Cambiare le soluzioni detergenti (candeggina, etanolo, e la soluzione RNase neutralizzante) al giorno.
- Dopo omogeneizzazione, portare il volume campione ad 1 ml aggiungendo più 100% di etanolo (~ 300 microlitri). Centrifugare alla massima velocità per 15 min, aspirare accuratamente l'etanolo e pellet asciugare all'aria per circa 15-20 minuti prima di procedere con l'estrazione di RNA.
4. La digestione con proteinasi K
- Risospendere il pellet in 150 ml proteinasi K Digestion Buffer e scatti la provetta per allentare il pellet. Aggiungere 10 ml di proteinasi temperatura stabile K e mescolare muovendo (non farevortice tubo). Incubare il contenuto nel tubo a 56 ° C per 15 min con blanda agitazione.
- Lasciare tubo per incubare in ghiaccio per 3 min. raffreddamento completo è importante per la precipitazione efficace nel passaggio seguente. Centrifugare per 15 minuti alla massima velocità.
5. RNA separato dal DNA
- trasferire con cautela il surnatante, senza disturbare il pellet, per un nuovo 1,5 ml per la purificazione di RNA.
- Conservare il pellet per la purificazione del DNA (pellet può essere conservato per 2 ore a temperatura ambiente, fino a 1 giorno a 2-8 ° C, o per periodi più lunghi a -20 ° C).
6. RNA Purification
- Incubare il surnatante RNA contenenti a 80 ° C per 15 min (non superare questa volta). Successivamente, centrifugare brevemente la provetta per raccogliere gocce dall'interno del coperchio.
- Aggiungere 320 microlitri di buffer RLT per regolare le condizioni vincolanti, e mescolare pipettando. Successivamente, aggiungere 720 ml di etanolo (100%), e vortex.
- Trasferimento 600 ml di campione, tra cui l'eventuale precipitato che possono essersi formate, a colonna RNA di spin (fornito nel kit) collocato in un tubo di raccolta da 2 ml e mettere da parte il contenuto rimanente. Centrifugare per 15 sec a ≥8,000 xg, scartare il flow-through e riutilizzare il tubo di raccolta.
- Trasferimento campione rimanente su una colonna, comprese goccioline che possono essersi accumulati nel coperchio del tubo, centrifuga per 15 sec a ≥8,000 xg, e scartare il flow-through.
- Aggiungere 350 microlitri di buffer FRN alla colonna di spin e centrifugare per 15 secondi a ≥8,000 xg, scartare il flow-through e riutilizzare tubo di raccolta.
- Mescolare delicatamente 10 ml soluzione madre DNasi I con 70 microlitri di buffer RDD, aggiungere direttamente alla membrana Spin Column, e incubare a temperatura ambiente per 15 min.
- Aggiungere 500 microlitri Buffer FRN alla colonna di spin, centrifugare per 15 sec a ≥8,000 xg e salvare il flusso passante per l'uso nella fase successiva. Per migliorare il recupero dei piccoli RNA, posizionare la colonna di spin in unnuovo tubo di raccolta 2 ml e applicare il flow-through dal passaggio precedente alla colonna di spin.
- Centrifugare per 15 sec a ≥8,000 xg, scartare il flow-through e riutilizzare il tubo di raccolta in fase successiva. Aggiungere 500 microlitri Buffer RPE alla colonna centrifuga e centrifugare per 15 sec a ≥8,000 xg, scartare il flow-through e riutilizzare il tubo di raccolta nella fase successiva.
- Aggiungere 500 microlitri Buffer RPE alla colonna di spin e centrifugare per 15 sec a ≥8,000 xg ed eliminare il tubo di raccolta con il flusso continuo.
- Porre la colonna di spin in una nuova 2 ml tubo di raccolta, aprire il coperchio e centrifugare alla massima velocità per 5 min. Eliminare il Collection tube con il flusso continuo.
- Porre la colonna di spin in una nuova raccolta 1,5 ml, aggiungere 20 ml di acqua RNase-free direttamente sulla membrana Spin Column e incubare la provetta per 1 min a RT. Centrifugare alla massima velocità per 1 min per eluire l'RNA. Conservare il campione di RNA eluito a -80 ° C.
7. Purificazione del DNA
- Risospendere il pellet ottenuto durante l'estrazione RNA mediante graduale aggiunta di 45 microlitri di tampone di proteinasi K (400 mM Tris 7,5, 400 mM NaCl, 3 mM MgCl 2, 4% SDS); 45 microlitri H 2 O; e 400 mcg di alta potenza proteinasi K.
- Incubare la soluzione di cui sopra a 56 ° C per 24 ore (consigliato) o durante la notte. Performincubation a 90 ° C per 2 ore senza agitazione e brevemente centrifugare la provetta per raccogliere gocce dall'interno del coperchio.
- Lasciare che il campione di raffreddare a temperatura ambiente e poi aggiungere 4 ml RNasi A (100 mg / ml). Incubare il campione per 2 minuti a temperatura ambiente.
- Aggiungere 200 microlitri di buffer AL al campione e mescolare accuratamente con il vortex. Successivamente, aggiungere 200 ml di etanolo al 100%, e mescolare bene nel vortex. Trasferire l'intero campione alla colonna fornito rotazione, posto in un tubo di raccolta da 2 ml e centrifugare per 1 min a ≥8,000 x g.
- Eliminare il Collection tube con ilflusso continuo e posizionare la colonna di spin in una nuova 2 ml tubo di raccolta. Aggiungere 700 microlitri Buffer AW1 alla colonna di spin, centrifugare per 15 sec a ≥8,000 xg, scartare il flow-through e riutilizzare il tubo di raccolta.
- Aggiungere 700 microlitri Buffer AW2 alla colonna di spin, centrifugare per 15 sec a ≥8,000 xg, scartare il flow-through e riutilizzare il tubo di raccolta. Successivamente, aggiungere 700 ml di etanolo al 100% alla colonna di spin, centrifugare per 15 sec a ≥8,000 xg ed eliminare il tubo di raccolta con il flusso continuo.
- Porre la colonna di spin in un nuovo 2 ml tubo di raccolta, aprire il coperchio della colonna di spin, e centrifugare a massima velocità per 5 min. Eliminare il Collection tube con il flusso continuo.
- Porre la colonna di spin in un nuovo tubo di 1,5 ml di raccolta e aggiungere 25 ml di acqua riscaldata priva di nucleasi (50 ° C). Incubare colonna e il tubo a 50 ° C per 10 min. Centrifugare per 1 minuto alla massima velocità, aggiungere 25 ml di acqua priva di nucleasi (RT) per colonna e incubare per1 minuti a temperatura ambiente.
- Centrifugare per 1 minuto alla massima velocità (21.130 xg) e raccolto flow-through contenenti DNA genomico (circa 50 ml di DNA in totale). Conservare la colonna a -20 ° C (nel caso un'altra eluizione è necessaria in seguito).
Risultati
Questo protocollo rappresenta un metodo ottimizzato per recuperare DNA e RNA da campioni di tessuto, con modifiche di un sistema di estrazione commerciale progettato per sezioni di tessuto. Ottimizzazione incluso l'introduzione di omogeneizzazione dei tessuti, l'utilizzo di più potente proteinasi K per l'estrazione del DNA, e l'estensione di tempo del tessuto digestione. I grafici e le analisi statistiche inclusi 2-way ANOVA, regressione lineare e correlazione.
Ottimizzazioni di proteinasi digestione
Il kit commerciale includeva una soluzione stabile proteinasi K temperatura ambiente che è stato sostituito con un più potente proteinasi K, con conseguente maggiore resa DNA (Figura 2A). Per aumentare ulteriormente le rese di DNA, la digestione è stata estesa da 2 a 24 ore. Non sono state osservate differenze significative tra i due punti di tempo, ma la digestione 24 ore sembravano fornire rendimenti più coerenti in tutta samples. Tuttavia, ulteriori incubazione per 48 ore non ha migliorato ulteriormente il recupero del DNA (Figura 2B; p = 0,74).
Il recupero del DNA tipica dalla FFPE cancro alla prostata tessuto Campioni
Utilizzando il protocollo ottimizzato, RNA e DNA sono stati co-estratto da 333 prostata campioni di cancro FFPET che vanno da 3 a 14 anni di età del campione. Da ogni campione, 3 fili di tessuto (volume medio dei tessuti totale di 0,95 ± 0,13 millimetri 3) sono stati utilizzati come input. Mentre ci sono altri basati metodi gel-elettroforesi microfluidica che possono stimare le concentrazioni e fornire valutazioni della distribuzione delle dimensioni delle molecole di acidi nucleici, tali metodi non forniscono riproducibile acidi nucleici quantificazione, e non possono distinguere tra RNA e DNA come saggi flourometrically basati fanno. 22 E, poiché microfluidica basata risultati gel elettroforesi non sono affidabili per frammentatiacidi nucleici derivati da FFPET, 23 rendimenti degli acidi nucleici sono stati misurati fluorometrically (vedi elenco dei reagenti per i dettagli). La resa media era 2.270 ng di RNA e 820 ng di DNA (Figura 3A). Circa il 90% di tutti i campioni FFPET analizzati in questo studio ha prodotto ≥100 ng di DNA e ≥ 500 ng di RNA. È interessante notare, non vi era alcuna correlazione significativa tra l'età del campione FFPET e il recupero di acido nucleico (Figura 3B). Nel complesso, RNA e DNA rendimenti sono stati correlati attraverso campioni (R 2 = 0.39; p <0.0001), anche se più di due volte tanto l'RNA che DNA è stato recuperato da ciascun campione (Figura 3C).
Come il lavoro pilota e l'ottimizzazione è stata eseguita su tessuti della prostata, il passo successivo è stato quello di indagare le prestazioni di questo protocollo su alcuni altri tipi di tessuto d'archivio. A partire dalla rimossi chirurgicamente e campioni autoptici FFPET rappresentano esserefegato Nign (1 campione da 1 caso), i tumori del cervello (8 campioni da 1 caso), vescica (2 campioni da 2 casi), e della mammella (3 campioni di 3 casi), il protocollo ha prodotto> 100 ng di DNA e RNA da 90% dei campioni (Figura 3D). Mentre i rendimenti di acidi nucleici erano più bassi nei tessuti autoptici che nei tessuti chirurgici, risultati rappresentativi indicano che il protocollo produce rendimenti simili in tutta tumori derivati da diversi siti.
La valutazione di RNA e DNA integrità e le loro prestazioni Rappresentante in Analisi Downstream
analisi di espressione di RNA di 47 geni in 8 campioni di cancro alla prostata FFPET selezionati e un PC-3 campione linea di cellule di cancro alla prostata fresca (come controllo positivo) è stata effettuata utilizzando una piattaforma di espressione genica multianalita commerciale che è ottimizzato per FFPET. I conteggi mRNA in PC3 erano tipicamente più alti di quelli da FFPET samples (Figura 4A). Tuttavia, confrontando l'espressione relativa di tutti i geni, FFPET campioni di cancro alla prostata hanno mostrato profili di espressione simili a PC-3 RNA, che indica che entrambe le fonti di RNA sono adatti per l'espressione di RNA profiling.
Per dimostrare le prestazioni del DNA genomico estratto con questo protocollo, bisolfito-convertito estratti di DNA da campioni FFPET sono stati amplificati dalla metilazione specifica PCR (MSP). 24 'analisi MSP di ALU elementi ripetitivi, regioni altamente denaturato presenti in milioni di copie nel genoma umano, 25 è stato utilizzato come controllo metilazione genomica, e dovrebbe mostrare variazioni minime tra i campioni. Come mostrato in Figura 4B, c'era poco da nessuna variazione visto tra campioni diversi in livelli di metilazione ALU MSP. Inoltre, saggi MSP basate su GSTP1, un gene noto da hypermethylated nel cancro alla prostata, ma non in campioni benigni, 26 non hanno mostrato amplif rilevabileications nel DNA da campioni benigni. Come previsto, sono stati rilevati valori di soglia inferiore del ciclo di qPCR nel DNA da tessuti tumorali, che indica l'arricchimento di copie GSTP1 denaturato. L'utilità degli acidi nucleici recuperati da questo protocollo è stato ulteriormente testato in saggi tipici a valle, usando acidi nucleici recuperati dal fegato benigni e da un cervello (post mortem) e da due campioni di cancro al seno chirurgicamente rimosso. Entrambi espressione based e MSP saggi RT-qPCR buoni risultati sul cancro al seno e FFPET fegato, ma il saggio RT-PCR fallito per amplificare un mRNA altamente espresso dal campione tumore cerebrale post-mortem (Figura 4C), suggerendo che l'RNA era degradato, probabilmente a causa di fissaggio del tessuto in ritardo.
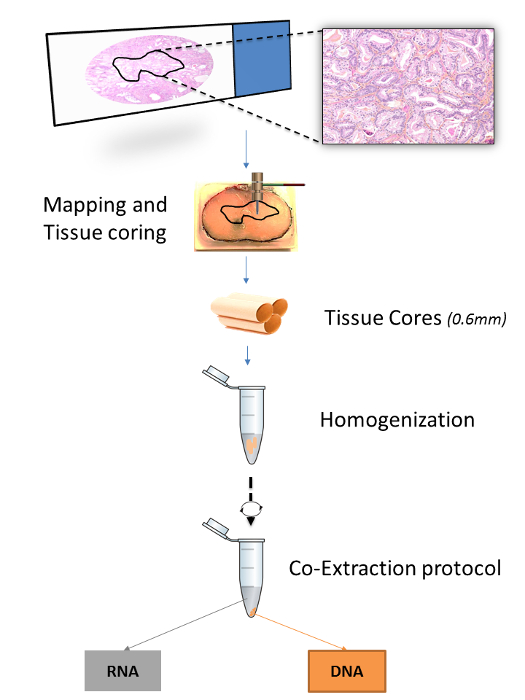
Figura 1:. Panoramica sulla procedura di estrazione per FFPET campioni La figura illustra come una zona di interesse in unblocco tessuto è mappata in base a selezione istopatologica da un vetrino da microscopio. Tre nuclei di tessuto 0,6 mm sono poi ottenuti da ciascuna area di tessuto utilizzando punzoni biopsia, omogeneizzati insieme e poi sottoposto ad estrazione sia di RNA e DNA. Si prega di cliccare qui per vedere una versione più grande di questa figura.
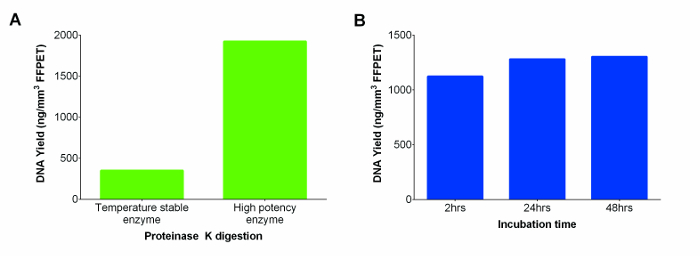
Figura 2: acidi nucleici (DNA e RNA) rese in ng / mm 3 di FFPET da due proteinasi K (temperatura stabile e alta potenza Enzimi), e testato in una serie di incubazione tempi per quest'ultimo (A) Prestazioni di proteinasi K. da diversi fornitori. estrazioni di DNA sono state eseguite su un campione rappresentativo FFPET usando temperatura enzima stabile in dotazione con il kesso contro un enzima più potente di un altro produttore. (B) Determinazione ottimale tempo di incubazione proteinasi K per massimizzare la resa del DNA. Prestazioni di alta concentrazione Proteinasi K digestione è stata valutata in tre diversi periodi di incubazione utilizzando 3 campioni FFPET. Barre di errore rappresentano errore standard della media (SEM). Cliccate qui per vedere una versione più grande di questa figura.
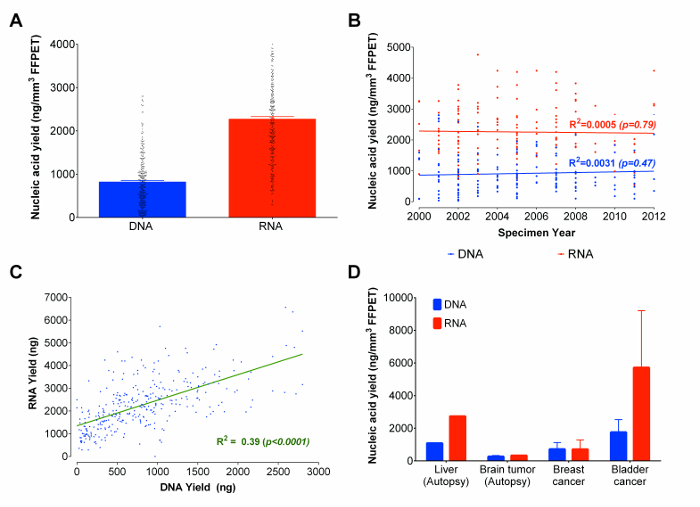
Figura 3:. Acidi nucleici (DNA e RNA) rese in ng / mm 3 di FFPET in totale, attraverso anni di esempio e tipi di tessuto rappresentativi (A) Totale recuperato acidi nucleici dal tessuto incluso in paraffina fissati in formalina. Gli acidi nucleici quantità presentati si basano sulle estrazioni di 333 campioni FFPET ucantare il protocollo ottimizzato. (B) tracciato di correlazione tra DNA totale recuperato e RNA e l'età dei campioni FFPET. I campioni FFPET estratti utilizzati sono stati ottenuti a partire dagli anni 2000 al 2012. (C) correlazione tra i rendimenti da DNA estratto contemporaneamente e RNA da 333 campioni di prostata. Vi è una correlazione positiva tra DNA e RNA rendimenti. (D) Dimostrazione del protocollo utilizzando tipi di tessuti d'archivio aggiuntivi. Il protocollo ottimizzato è stato usato per estrarre acidi nucleici da 14 cancro (seno, vescica e cervello) e campioni normali (fegato). Le barre di errore rappresentano SEM. Cliccate qui per vedere una versione più grande di questa figura.
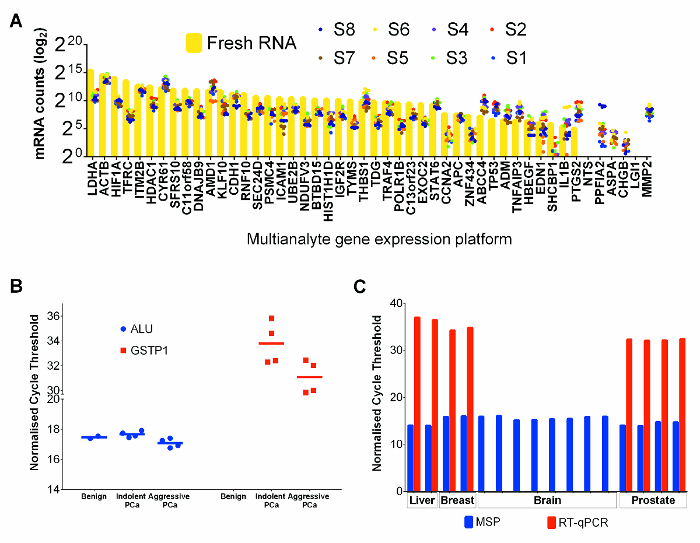
Figura 4: Prestazione di RNA e DNA co-estratto da Tissue core in applicazioni a valle. (A) mRNA conta per i tessuti tumorali FFPE prostata e per il fresco controllo della linea di cellule PC-3. Ogni punto rappresenta la media di 3 repliche tecniche estratti separatamente. I valori di RNA Fresh linea cellulare PC-3 sono illustrate da barre gialle e valori di tessuto FFPET sono rappresentati da puntini colorati. PCR specifici (B) metilazione sul DNA dei campioni FFPET cancro alla prostata. valori soglia ciclo sono stati ottenuti per 10 campioni eseguiti come previsto utilizzando 50 ng / reazione di DNA convertito bisolfito. ALU saggi MSP da tutti i campioni FFPET avevano valori di soglia ciclo simile (p> 0,67). saggi GSTP1 MSP hanno mostrato maggiore metilazione (ciclo soglia più bassa) i livelli nel cancro alla prostata rispetto a prostatica benigna. (C) la valutazione del DNA e RNA di qualità da tipi di tessuto aggiuntivi. espressione genica HPRT1 e geniche Alu saggi di metilazione sono stati eseguiti su acidi nucleici (DNA e RNA, rispettivamente), estratti da néMal di fegato (autopsia), e del cervello (autopsia) e della mammella (tutti FFPET). I risultati della prostata sono mostrati per confronto. Nota: risultati simili sono stati osservati da ogni tipo di tessuto, fatta eccezione per l'amplificazione di mRNA fallito da un campione autopsia. Ogni punto o la barra rappresenta un campione, e le barre di errore rappresentano SEM. Clicca qui per vedere una versione più grande di questa figura.
| nuclei Tissue | |||||||||||
| Ingresso Tissue (mm3) | Estratte acidi nucleici | Validazione | Controllo di qualità: DNA | Controllo di qualità: RNA | |||||||
| (# Di campioni) | Età del Campione (anni) | Resa totale (ng) | dimensione del frammento (bp) | PCR | Resa totale (ng) | dimensione del frammento (bp) | PCR | NanoString | |||
| Pikor et al. | 43 - 129 | DNA | Nessun dato | Nessun dato | Nessun dato | Nessun dato | |||||
| Montaser-Kouhsari et al. | 18 - 29,5 | RNA | 763 | 0-25 | 843 | Nessun dato | |||||
| Questo articolo | 1.71 | DNA e RNA | > 350 | 3-12 | 820 | 100 - 500 |  | 2270 | 100-500 |  | /ftp_upload/54299/check_mark.jpg "/> |
| Tissue Sezioni | |||||||||||
| tessuto di ingresso | Estratte acidi nucleici | Validazione | Controllo di qualità: DNA | Controllo di qualità: RNA | |||||||
| (# Di campioni) | Età del Campione (anni) | Resa totale (ng) | dimensione del frammento (bp) | PCR | Resa totale (ng) | dimensione del frammento (bp) | PCR | NanoString | |||
| Heikal et al. | 5 x 5 micron | DNA | 12 | 7-22 | 88-300 | 103-351 |  | ||||
| Chung et al. | 1 x 20 um | RNA | 9 | > 5 | 16.000 23.000 | 100-200 |  | ||||
| Antica et al. | 2 x 4 micron | RNA | 18 | Nessun dato | Unknown (621 ng / ml) | 80-202 + |  | ||||
| Ghatak et al. | 5 x 5 micron | DNA e RNA | 5 | 1 | 14 256 | <1030 |  | 16 000 | 109-400 + |  | |
| Hennig et al. | 1 x 10 micron | DNA e RNA | 210 | 1-25 | Nessun dato | Nessun dato |  | Nessun dato | Nessun dato |  | |
| Laser Capture Microdissezione | |||||||||||
| Ingresso Tissue (mm2) | Estratte acidi nucleici | Validazione | Controllo di qualità: DNA | Controllo di qualità: RNA | |||||||
| (# Di campioni) | Età del Campione (anni) | Resa totale (ng) | dimensione del frammento (bp) | PCR | Resa totale (ng) | dimensione del frammento (bp) | PCR | NanoString | |||
| Snow et al. | 1-2 | DNA | 110 | 0-2 | 430 | Nessun dato |  | ||||
Tabella 1:. Un confronto tra protocolli di DNA e RNA estrazione pubblicate per nuclei di tessuti, sezioni e microdissections cattura laser inclusi anche sono diversi valutazione endpoint molecolari di questi metodi che utilizzano PCR e Nanostring.
Discussione
Per l'estrazione di successo di DNA e RNA da regioni tessuto di interesse, carotaggio accurata è fondamentale. Questo protocollo descrive l'uso di un bisturi circolare per isolare 0,6 mm di diametro core e delinea il processo di trasferimento notazioni da vetrini da microscopio a corrispondenti blocchi FFPET. Modifiche al protocollo del produttore sono stati necessari per estrarre in modo efficiente gli acidi nucleici da nuclei, che sono circa 50 volte più spesso sezioni microtomo per cui il protocollo è stato destinato. Dal momento che i nuclei possono contenere più paraffina relativi a sezioni di tessuto, efficace deparaffinizzazione di anime attraverso passaggi xilene e trattamento etanolo ripetuti sono stati richiesti. Il successo delle operazioni di post-deparaffinizzazione dipendeva da una corretta meccanica core tessuto omogeneizzazione ed efficiente proteinasi K digestione. Ulteriore ottimizzazione della proteinasi K digestione può essere eseguita.
Vale la pena ricordare che questo metodo identiFIES aree di interesse sulla superficie del blocco, come individuati in corrispondenti diapositive istopatologici. Come il tessuto raccolti di base che possono essere di 3 o 4 mm di profondità, gli utenti di questo protocollo può essere preoccupato per quello che cellule o tessuti giacevano sotto la superficie del blocco. Mentre questa è una preoccupazione legittima, diversi studi (recensito in riferimento 27) hanno dimostrato che i campioni di tessuto rappresentano fedelmente la istologiche e molecolari di blocchi di tessuto patologico, in particolare quando due o tre esemplari nuclei sono campionati dalla zona di interesse.
Come il kit di estrazione commerciale modificato adottato in questo protocollo consente l'estrazione simultanea di entrambi DNA e RNA dal tessuto stesso, il protocollo di risparmiare prezioso materiale biologico e consente un confronto diretto tra i due risultanti acidi nucleici dallo stesso campione. Estrazione concomitante di RNA e DNA riduce l'esaurimento del lavoro e del tessuto della metà, e consente una precisa analisi integrata del gene esprESSIONE, così come le caratteristiche epigenetiche e genetiche riscontrate nel DNA. Poiché le rese sia di RNA e DNA di questi nuclei di tessuto rappresentativi tipicamente superare rispettivamente 600 e 300 ng, e poiché la maggior parte attuali applicazioni PCR e sequenziamento generazione successiva richiedono tipicamente 10-100 ng, la maggior parte dei campioni purificati mediante questo protocollo dovrebbe fornire adeguato materiale per diversi saggi a valle. Questo protocollo è stato dimostrato essere riproducibile attraverso laboratori indipendenti (Selvarajah et al., In prep.). RNA da questo protocollo era di qualità sufficiente per l'analisi di espressione genica utilizzando RT-PCR o una piattaforma multianalita popolare, e il DNA ottenuto buoni risultati in specifiche PCR metilazione. Futuri studi volti a valutare l'utilità degli acidi nucleici recuperati in prossima generazione di sequenziamento sono garantiti.
Pertanto, sono state apportate diverse modifiche al protocollo disponibile commercialmente, progettata per sezioni FFPET sottili, rendendola adatta for la co-estrazione di RNA e DNA da campioni FFPET 0,6 mm. Il protocollo ha dimostrato costantemente alti rendimenti in un'ampia coorte di campioni di cancro alla prostata e in un insieme limitato di campioni da tumori della mammella, del cervello e della vescica. Nel complesso, il protocollo dovrebbe consentire agli utenti di effettuare analisi a base genetica mirati di grandi collezioni di tessuti ben annotati-. È importante sottolineare che il protocollo consente efficiente di campionamento mirato di regioni di interesse in FFPET, relativamente poco hands-on tempo, e le rese sufficientemente alta per la maggior parte delle applicazioni a valle.
Divulgazioni
The authors declare no competing financial interests.
Riconoscimenti
This research was supported by a team grant from Movember/Prostate Cancer Canada to JMSB, DMB, PCP, and JL, and by the Ontario Institute of Cancer Research (JMSB, DMB, and PCP) and Motorcycle Ride for Dad Kingston/University Hospitals Kingston Foundation/Kingston General Hospital (DMB, PCP).
Materiali
| Name | Company | Catalog Number | Comments |
| Plastic paraffin film, "Parafilm 'M'" | Bemis | RK-06720-40 | Any generic paraffin film will work as a substitute |
| Sodium Hypochlorite, "Ultra Bleach" | Likewise | 53-2879-2 | Any generic bleach will work as a substitute. Hazardous material that can cause burns on contact. |
| Molecular biology grade absolute ethanol | Fisher BioReagents | BP2818-500 | Sigma-Aldrich E7023 suffices as a substitute |
| Molecular Grade H2O | G-Biosciences | 786-293 | Sigma W4502 suffices, as well as any other brand of molecular grade H2O |
| 0.6 mm Punch Set for Beecher Instruments | Estigen | MPO6[Yellow] | Make sure to use the red receiver punch from the set |
| Fine point permanent marker | Sharpie | 10365796S | Using the marker on FFPE tissues causes it to dry out quickly, so several may be required |
| FFPE tissue block | |||
| Stained tissue slide corresponding to FFPE block | |||
| 1.5 ml Micro-Centrifuge Tubes | Fisher BioReagents | 05-408-137 | |
| 2.0 ml Low binding tubes (LoBind Micro-Centrifuge Tubes) | Eppendorf | 22431048 | |
| 1.5 ml Low binding tubes (LoBind Micro-Centrifuge Tubes) | Eppendorf | 22431021 | |
| Histology Xylene | VWR | CA 95057-822 | Fisher Scientific X5-500 suffices as a substitute |
| Molecular Biology Grade 2-Propanol | Sigma | I9516 | |
| AllPrep FFPE DNA/RNA Kit | Qiagen | 80234 | Prepare buffers accodring to the AllPrep DNA/RNA FFPE Handbook21 |
| Buffers: RLT, FRN, RPE, ATL, AL, AW1, AW2, DNaseI solution | Qiagen | 80234 | Prepare buffers accodring to the AllPrep DNA/RNA FFPE Handbook21 |
| Temperature stable proteinase K | Qiagen | 80234 | |
| High potency proteinase K | Invitrogen | 25530-049 | Invitrogen 25530-015 suffices as a substitute |
| RNAse neutralizing solution (Rnase AWAY) | Molecular BioProducts | 7003 | |
| RNaseA 100 mg/ml | Qiagen | 19101 | |
| BD Integra Syringe 3 ml 21G x 1/2 | BD | 305274 | |
| Motorized tissue homogenizer (TissueRuptor) | Qiagen | 9001271 | Fisher Scientific 14-261-29 suffices as a substitute |
| -20 °C and -80 °C Laboratory Freezer | |||
| Micro-Centrifuge with rotor for 2 ml tubes | |||
| Digital Vortex Mixer | |||
| Pipettes and filter tips | |||
| Heating blocks or water baths | |||
| Tris Hydrochloride | Amresco | 0234 | |
| Sodium Chloride | Amresco | 0241 | |
| Anhydrous Magnesium Chloride | Sigma | M8266 | |
| Sodium Dodecyl Sulfate | Sigma | L4509 | |
| Acrodisc 25 mm syring filters with 0.45 µm Supor membrane | Pall | PN 4614 | |
| Syringe with retracting BD PrecisionGlide needle 3 ml | BD Integra | 305274 | |
| Hydrochloric Acid | BDH | 3026 | |
| Multianalyte gene expression platfrom (nCounter ® CAE codeset and Nanostring nCounter platform) | Nanostring nCounter platform, Nanostring | ||
| Fluorometric nucleic acid quantification (Qubit dsDNA HS Assay Kit and Qubit® RNA BR Assay Kit) | Invitrogen |
Riferimenti
- Kern, S. E. Why your new cancer biomarker may never work: recurrent patterns and remarkable diversity in biomarker failures. Cancer Res. 72 (23), 6097-6101 (2012).
- Klopfleisch, R., Weiss, A. T. A., Gruber, A. D. Excavation of a buried treasure--DNA, mRNA, miRNA and protein analysis in formalin fixed, paraffin embedded tissues. Histol. Histopathol. 26 (6), 797-810 (2011).
- Beltran, H., et al. Targeted Next-generation Sequencing of Advanced Prostate Cancer Identifies Potential Therapeutic Targets and Disease Heterogeneity. Eur. Urol. 63 (5), 920-926 (2013).
- Hoppin, J. A., Tolbert, P. E., Taylor, J. A., Schroeder, J. C., Holly, E. A. Potential for selection bias with tumor tissue retrieval in molecular epidemiology studies. Ann. Epidemiol. 12 (1), 1-6 (2002).
- von Ahlfen, S., Missel, A., Bendrat, K., Schlumpberger, M. Determinants of RNA quality from FFPE samples. PLOS ONE. 2 (12), e1261 (2007).
- Masuda, N., Ohnishi, T., Kawamoto, S., Monden, M., Okubo, K. Analysis of chemical modification of RNA from formalin-fixed samples and optimization of molecular biology applications for such samples. Nucleic Acids Res. 27 (22), 4436-4443 (1999).
- Pikor, L. A., Enfield, K. S. S., Cameron, H., Lam, W. L. DNA extraction from paraffin embedded material for genetic and epigenetic analyses. J. Vis. Exp. (49), (2011).
- Turashvili, G., et al. Nucleic acid quantity and quality from paraffin blocks: defining optimal fixation, processing and DNA/RNA extraction techniques. Exp. Mol. Pathol. 92 (1), 33-43 (2012).
- Espina, V., et al. Laser-capture microdissection. Nat. Protoc. 1 (2), 586-603 (2006).
- Hackler, L., Masuda, T., Oliver, V. F., Merbs, S. L., Zack, D. J. Use of laser capture microdissection for analysis of retinal mRNA/miRNA expression and DNA methylation. Methods Mol. Biol. 884, 289-304 (2012).
- Bonin, S., Stanta, G. Nucleic acid extraction methods from fixed and paraffin-embedded tissues in cancer diagnostics. Expert Rev. Mol. Diagn. 13 (3), 271-282 (2013).
- Bonin, S., et al. Multicentre validation study of nucleic acids extraction from FFPE tissues. Virchows Archiv. 457 (3), 309-317 (2010).
- Montaser-Kouhsari, L., et al. Image-guided Coring for Large-scale Studies in Molecular Pathology. Appl. Immunohistochem. Mol. Morphol. , (2015).
- van Eijk, R., Stevens, L., Morreau, H., van Wezel, T. Assessment of a fully automated high-throughput DNA extraction method from formalin-fixed, paraffin-embedded tissue for KRAS, and BRAF somatic mutation analysis. Exp. Mol. Pathol. 94 (1), 121-125 (2013).
- Ghatak, S., Sanga, Z., Pautu, J. L., Kumar, N. S. Coextraction and PCR Based Analysis of Nucleic Acids From Formalin-Fixed Paraffin-Embedded Specimens. J. Clin. Lab. Anal. , (2014).
- Hennig, G., et al. Automated extraction of DNA and RNA from a single formalin-fixed paraffin-embedded tissue section for analysis of both single-nucleotide polymorphisms and mRNA expression. Clin. Chem. 56 (12), 1845-1853 (2010).
- Snow, A. N., Stence, A. A., Pruessner, J. A., Bossler, A. D., Ma, D. A simple and cost-effective method of DNA extraction from small formalin-fixed paraffin-embedded tissue for molecular oncologic testing. BMC Clin. Pathol. 14 (1), 30 (2014).
- Torrente, M. C., et al. DNA extraction from formalin-fixed laryngeal biopsies: Comparison of techniques. Acta Otolaryngol. 131 (3), 330-333 (2011).
- Okello, J. B. A., et al. Comparison of methods in the recovery of nucleic acids from archival formalin-fixed paraffin-embedded autopsy tissues. Anal. Bochem. 400 (1), 110-117 (2010).
- Abramovitz, M., et al. Optimization of RNA extraction from FFPE tissues for expression profiling in the DASL assay. BioTechniques. 44 (3), 417-423 (2008).
- . . AllPrep DNA/RNA FFPE Handbook. , (2012).
- Laurent, L. C., et al. Meeting report: discussions and preliminary findings on extracellular RNA measurement methods from laboratories in the NIH Extracellular RNA Communication Consortium. Journal of Extracell. Vesicles. 4, (2015).
- . Methods of RNA Quality Assessment Available from: https://www.promega.ca/resources/pubhub/methods-of-rna-quality-assessment (2012)
- Herman, J. G., Graff, J. R., Myohanen, S., Nelkin, B. D., Baylin, S. B. Methylation-specific PCR: a novel PCR assay for methylation status of CpG islands. Proc. Natl. Acad. Sci. U.S.A. 93 (18), 9821-9826 (1996).
- Weisenberger, D. J., Campan, M., et al. Analysis of repetitive element DNA methylation by MethyLight. Nucleic acids research. 33 (21), 6823-6836 (2005).
- Yegnasubramanian, S. Hypermethylation of CpG Islands in Primary and Metastatic Human Prostate Cancer. Cancer Res. 64 (6), 1975-1986 (2004).
- Parsons, M., Grabsch, H. How to make tissue microarrays. Diagn. Histopathol. 15 (3), 142-150 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon