Method Article
Aggregate ottimizzazione Dimensione in pozzetti per sospensione a base cardiaco differenziazione delle cellule staminali umane pluripotenti
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
I metodi convenzionali per avviare la differenziazione cardiaca basato sospensione aggregato di pluripotenti umane deriva cellule (hPSCs) sono afflitti con la cultura eterogeneità rispetto alle dimensioni e la forma di aggregazione. Qui, descriviamo un metodo affidabile per la differenziazione cardiaca utilizzando i pozzetti di generare dimensione controllata HPSC aggrega coltivate in condizioni cardiache di promozione.
Abstract
Cardiac differentiation of human pluripotent stems cells (hPSCs) is typically carried out in suspension cell aggregates. Conventional aggregate formation of hPSCs involves dissociating cell colonies into smaller clumps, with size control of the clumps crudely controlled by pipetting the cell suspension until the desired clump size is achieved. One of the main challenges of conventional aggregate-based cardiac differentiation of hPSCs is that culture heterogeneity and spatial disorganization lead to variable and inefficient cardiomyocyte yield. We and others have previously reported that human embryonic stem cell (hESC) aggregate size can be modulated to optimize cardiac induction efficiency. We have addressed this challenge by employing a scalable, microwell-based approach to control physical parameters of aggregate formation, specifically aggregate size and shape. The method we describe here consists of forced aggregation of defined hPSC numbers in microwells, and the subsequent culture of these aggregates in conditions that direct cardiac induction. This protocol can be readily scaled depending on the size and number of wells used. Using this method, we can consistently achieve culture outputs with cardiomyocyte frequencies greater than 70%.
Introduzione
In colture cellulari in vitro può essere eseguita in un certo numero di modalità, ma viene in genere effettuata sia in condizioni aderenti bidimensionali o in condizioni di sospensione tridimensionali che ricapitolano più pienamente nei sistemi in vivo. Di conseguenza vi è una tendenza crescente in molti campi di ricerca per sviluppare metodi robusti per generare costrutti tessuti tridimensionali. Negli scenari in cui tipi e processi cellulari richiedono un supporto matrice extracellulare (ECM) superficiali e adesione segnali, tridimensionale coltura può essere attivata tramite costrutti ponteggi, dove le cellule sono coltivate su o in un esogeno supporto matrice 1. Cellule e processi che non richiedono l'adesione ad una matrice di supporto può essere effettuata in sospensione come sistemi unscaffolded composti principalmente o esclusivamente di cellule (che può quindi procedere a generare le proprie matrici endogeni) 2,3. Qui, vi presentiamo un protocollo per cardiaco differenziazione of cellule staminali pluripotenti umane (hPSCs - le cellule staminali in grado di diventare qualsiasi tipo di cellula del corpo, sia da fonti embrionali o altri) di dimensioni controllate, uniforme, aggregati unscaffolded.
Differenziazione delle hPSCs come aggregati di sospensione è afflitto da grandi variazioni nella dimensione aggregata sia all'interno di una corsa e tra corse. Questa variabilità è una conseguenza del metodo tipicamente impiegato per generare questi aggregati, che comporta la dissociazione meccanica di colonie di cellule. Per ridurre questa variabilità, un certo numero di approcci sono stati impiegati per controllare il numero di cellule per aggregato nonché diametro complessivo e uniformità. Gli esempi includono formazione di aggregati in provette da microcentrifuga 4 o come gocce appeso 5, micropatterning definiti bidimensionali colonie HPSC 6 che possono poi essere trasferiti alla sospensione, o centrifugazione di cellule in U o piastre multi-e V-bottom 7,8, 9. Tuttavia, tutti questi approaches sono limitati dalla loro basso rendimento della produzione di aggregati. Sistemi che basati impiegano un approccio simile ai sistemi piastra V-bottom, ma la dimensione più piccola dei pozzetti (in questo protocollo ciascuno avente una larghezza di 400 micron) permette la generazione di un numero maggiore di aggregati uniformi da un'unica cultura pozzetti (diametro standard di ~ 15,5 mm contenenti ~ 1.200 micropozzetti) di quella che sarebbe generato da una piastra di V-parte inferiore intero 10. La formazione di aggregati Ben-based è stato utilizzato in una serie di impostazioni tra cui la differenziazione di hPSCs a ectodermica 11, endodermico 12, 13 e mesodermiche extraembrionali 14 destino; condrogenesi da cellule staminali mesenchimali 15; generazione di supporti uniformi di screening tossicologico 16; e ricerche di mechanobiology 17.
Una sfida importante per lo sviluppo di protocolli di produzione robuste per la produzione di cardiom HPSC di derivazioneyocytes è stata la mancanza di riproducibilità in cardiaca efficienza differenziazione tra corse. Abbiamo precedentemente dimostrato che questa variabilità può essere attribuita alla eterogeneità nella popolazione a partire HPSC, che comprende sia le cellule auto-rinnovamento hPSCs e differenziante che esprimono geni associati con endoderma e neurali differenziazione 6,18. I segnali secrete da queste cellule differenzianti impatto induzione cardiaco. In particolare, endoderma extraembryonic promuove l'induzione cardiaco, mentre progenitori neurali inibiscono l'induzione cardiaco. Su HPSC aggregazione, cellule all'interno del differenziata complessiva e organizzare in modo che hPSCs indifferenziati sono circondate da uno strato di cellule endoderma extraembrionali che si sviluppano sulla superficie aggregata 13. Controllando dimensione aggregata, siamo in grado di modulare il rapporto tra cellule endoderma cardiache che inducono a hPSCs indifferenziate (superficie in rapporto al volume) e ottimizzare questo rapporto per l'induzione cardiaca massima 13.
Protocollo
1. Preparazione dei Componenti medie
- Preparare Wash Medium. Per 100 ml di DMEM / F12, aggiungere 1 ml di 100x penicillina / streptomicina (Pen / Strep), 1 ml di 100x L-glutammina, e 5 ml di sostituzione del siero.
- Preparare la chimica definita basale cardiaca induzione medio in base alle istruzioni del produttore.
- Preparare i seguenti reagenti azionari per i supporti che verranno utilizzati in questo protocollo.
- Acido L-ascorbico: Preparare una soluzione stock di 5 mg per ml in 4 ° C, acqua distillata ultrapura sterile in una provetta conica.
- Lasciare questa soluzione su ghiaccio e agitare la provetta periodicamente fino il soluto è completamente sciolto. Filtro-sterilizzare la soluzione Acido Ascorbico con un filtro siringa da 0,22 micron.
- Preparare 1 ml della soluzione di acido ascorbico e memorizzare questi aliquote a -20 ° C. Utilizzare una un'aliquota appena scongelato ogni mezzo di tempo è preparato.
- Il giorno di preparazione medio, Diluire 13 ml di monotioglicerolo (MTG) in 1 ml di Basal Cardiac induzione Medium. Eliminare inutilizzato, MTG diluito.
- Preparare 1 ml aliquote di transferrina (30 mg / ml) per conservare a -20 ° C. Conservare aliquote scongelato a 4 ° C per un massimo di 3 mesi.
- Preparare 4 mM di acido cloridrico (HCl) contenente 0,1% di sieroalbumina bovina (BSA). In una cappa aspirante, aggiungere 30 ml di soluzione 6,0 N HCl a 50 ml di acqua distillata ultra-pura. Filtro-sterilizzare la soluzione con un filtro a siringa da 0,22 micron. Aggiungere 2 ml di soluzione di BSA 25% alla soluzione 50 ml di HCl.
- Preparare tampone fosfato (PBS) contenente 0,1% di BSA. Aggiungere 20 ml di soluzione di BSA 25% per ml di PBS.
- Preparare umana proteina morfogenetica 4 (4-BMP) soluzione di riserva (10 ng / ml). Sciogliere 10 mg liofilizzato BMP-4 in 1 ml di 4 soluzione tampone mM HCl contenente 0,1% BSA. Preparare 50 ml aliquote per conservare a -20 ° C.
- Preparare umana Fibroblast Growth Factor 2 soluzione madre (bFGF)(10 ng / ml). Sciogliere 10 mg liofilizzato bFGF in 1 ml di tampone fosfato (PBS) contenente 0,1% di BSA. Preparare 50 ml aliquote per conservare a -20 ° C.
- Preparare fattore umano di crescita dell'endotelio vascolare (VEGF) soluzione madre (5 ng / ml). Sciogliere 5 mcg VEGF liofilizzato in 1 ml di PBS contenente 0,1% BSA. Preparare 50 ml aliquote per conservare a -20 ° C.
- Preparare Activin Una soluzione madre (10 ng / ml). Sciogliere 10 mg liofilizzati Activin A in 1 ml di PBS contenente 0,1% di sieroalbumina bovina (BSA). Preparare 50 ml aliquote per conservare a -20 ° C.
- Preparare inibitore di Wnt Production-2 (2-IWP) soluzione di riserva (10 mm). Sciogliere 2 mg IWP-2 in 429 ml dimetilsolfossido (DMSO). Preparare 10 ml aliquote per conservare a -80 ° C.
- Acido L-ascorbico: Preparare una soluzione stock di 5 mg per ml in 4 ° C, acqua distillata ultrapura sterile in una provetta conica.
- Preparare completa cardiaco induzione media. Per 100 ml di basale cardiaca induzione media, aggiungere 1 ml di 100x Pen / Strep, 1 ml di 100x L-glutammina, 500 ml di transferrina, 1ml di acido ascorbico appena scongelato, e 300 ml di MTG. Eliminare medio inutilizzato.
2. Preparazione del micropiastre
NOTA: Tutte le procedure devono essere eseguite in un armadio di sicurezza biologica.
- Aggiungere 0,5 ml di soluzione di risciacquo (componente kit) a ciascun pozzetto che verrà utilizzato sulla piastra. Per garantire che i contatti soluzione l'intera superficie interna ciascun micropozzetto, centrifugare la piastra a 840 g per 2 minuti.
- Incubare la piastra per 30 a 60 minuti a temperatura ambiente.
- Aspirare la soluzione di risciacquo dai pozzi. Lavare ciascun pozzetto due volte come segue: Aggiungere 1 ml di PBS a ciascun pozzetto, centrifugare la piastra a 840 xg per 2 minuti, quindi aspirare il PBS.
3. La formazione di HPSC aggregati nel micropiastre
NOTA: Tutte le procedure devono essere eseguite in un armadio di sicurezza biologica.
- Lavatoio medio a bagnomaria C 37 °.
NOTA: il volume richiesto = 1 ml x numero di pozzi di HpSC che sarà dissociato. - Dissociarsi hPSCs a singole cellule
NOTA: Questi passaggi descrivono la dissociazione delle cellule in coltura su 6 pozzetti - i volumi di reagente possono essere scalati proporzionalmente per i diversi formati di cultura.- Aspirare il terreno di coltura di ogni cultura HPSC bene per la dissociazione. Lavare ogni pozzetto con 1 ml di enzima dissociazione e quindi aspirare immediatamente l'enzima dissociazione da ogni pozzetto.
NOTA: residua enzimatica dissociazione dovrebbe essere sufficiente per dissociare le cellule. - Incubare la piastra a 37 ° C per 3 min.
- Aggiungere 1 ml di Wash medio di ogni bene e dissociarsi meccanicamente le cellule dalla superficie di coltura tissutale pipettando Medium Wash con una micropipetta P1000 sulla superficie coltura di tessuti. Se la dissociazione sembra essere ciuffi incompleti e cellule rimangono, passare la sospensione attraverso un filtro a questo punto.
- Trasferire la sospensione cellulare in una provetta conica da 15 ml e conservareil tubo in incubatrice mentre il conteggio delle cellule è effettuata nella fase successiva.
- Eseguire un numero di celle:
- Prelevare 10 ml di sospensione cellulare raccolte nel passaggio precedente. Aggiungere 30 ml di Trypan Blue e mescolare bene la sospensione pipettando.
- Trasferire 10 ml di cellule Trypan Blue-macchiato a ciascuna camera di un emocitometro e visualizzare al microscopio invertito con l'obiettivo 10X. Contare le cellule.
- Dai risultati di conteggio delle cellule, calcolare quanti pozzi possono essere seminati in 1,2 x 10 6 cellule per pozzetto della micropiastra. Calcola aggregazione medio richiesto per seminare le cellule a 1 ml per bene.
- Preparare mezzo di aggregazione. Per 10 ml di completo cardiaco induzione medio, aggiungere 0,5 ml di soluzione madre BMP4 (concentrazione finale = 0,5 ng / ml) e Y-27632 ROCK Inhibitor (concentrazione finale = 10 micron).
- Rimuovere il tubo conico contenente le hPSCs dal termostato e centrifuge la provetta a 200 xg per 5 min. Aspirare il mezzo di lavaggio e risospendere le cellule in terreno aggregazione ad una densità di 1,2 x 10 6 cellule per ml.
- Aspirare la soluzione di lavaggio PBS da ciascun pozzetto della micropiastra. Usando una micropipetta P1000, distribuire uniformemente e semi di 1 ml di sospensione cellulare a ciascun pozzetto nella piastra. Per seminare un gran numero di pozzi, vortice periodicamente la sospensione cellulare per evitare la sedimentazione.
- Centrifugare la piastra a 200 xg per 5 min. Osservare la lastra sotto il microscopio per confermare cellule sono filata a fondo di ciascun pozzetto.
- Incubare la piastra per 24 ore a 37 ° C in 5% CO 2, 5% O 2 (ipossica) incubatore.
- Aspirare il terreno di coltura di ogni cultura HPSC bene per la dissociazione. Lavare ogni pozzetto con 1 ml di enzima dissociazione e quindi aspirare immediatamente l'enzima dissociazione da ogni pozzetto.
4. cardiaca induzione Stage 1
- Un giorno dopo l'aggregazione (giorno 1), preparare il volume richiesto di Fase 1 di media induzione (per un piatto ben 24, volume = 1 ml x numero di pozzi). Per 1 ml di completoinduzione a media cardiaca, aggiungere 1 ml di BMP4 soluzione madre (concentrazione finale = 10 ng / ml), 0,5 ml di soluzione madre bFGF (concentrazione finale = 5 ng / ml), e 0,6 ml di Activin A (concentrazione finale = 6 ng / ml). Posizionare il mezzo a bagnomaria C 37 ° per almeno 15 min.
- Rimuovere la piastra di micropozzetti dal termostato. Gli aggregati sotto il microscopio. Rispetto al immediatamente aggregazione post-centrifuga, essi dovrebbero apparire intatta con bordi arrotondati (più rotondo e meno quadrata rispetto al giorno precedente).
- Rimuovere il surnatante senza disturbare gli aggregati all'interno dei pozzetti:
- Tenere la micropiastra orizzontale livello (es., Non inclinarlo). Per ciascun pozzetto nella piastra, inserire la punta di una micropipetta P1000 alla superficie del terreno di coltura e contro il bordo del pozzo.
- Lentamente rimuovere il supporto, facendo attenzione a non disturbare gli aggregati al fondo dei pozzetti. Dopo aver ridotto tegli livello medio di circa 1 a 2 mm dalla superficie dei pozzetti strutturato, inclinare lentamente la piastra di raccogliere media su un lato del pozzo (quando il volume è sufficientemente bassa, movimento fluido è molto ridotto ed è più facile evitare aggregati sempre sollevata dalle loro singoli pozzetti). Lentamente pipettare il supporto rimanente nel pozzo.
- Per aggiungere fresco Fase 1 induzione Media garantendo al tempo stesso gli aggregati rimangono nei loro singoli pozzetti: Disegna 1 ml della Fase 1 di media ad induzione con una micropipetta P1000. Tenere la punta della pipetta contro il bordo interno del pozzo e dispensare lentamente il mezzo contro la parete interna del pozzo. Ripetere l'operazione per i pozzetti rimanenti.
- Riportare la piastra per l'incubatore in condizioni di ipossia per 3 giorni.
5. cardiaca induzione Fase 2
- Il giorno 4, posto lavaggio medio (volume = numero di pozzetti x 2 ml) in un bagno di acqua a 37 ° C per almeno 15 min.
- Preparare il volume necessario di Fase 2 induzione media (volume = numero di pozzi x 1 ml): per ml di completo cardiaco induzione medio, aggiungere 2 ml di soluzione di VEGF magazzino (concentrazione finale = 10 ng / ml) e 0,5 ml IWP-2 soluzione madre (concentrazione finale = 5 micron). Posizionare il preparato mezzo induzione Fase 2 in un bagno d'acqua a 37 ° C per almeno 15 min.
- Usando una pipetta da 5 ml sierologica, raccogliere gli aggregati da ciascun pozzetto della micropiastra e raccogliere la sospensione di aggregazione in un tubo da 15 ml (raccogliere fino a 10 pozzetti per 15 ml di tubo).
- Lasciare gli aggregati di stabilirsi per 15 minuti in un incubatore ipossico.
NOTA: Questo passaggio è importante separare singole cellule e detriti cellulari dagli aggregati intatte. - Aspirare il surnatante con cura e risospendere gli aggregati in 10 ml di Wash medio pre-riscaldato per rimuovere le citochine induttivi residui (ad esempio, Activin A è una molecola di segnalazione potente, anche a bassissima concentrations).
- Centrifugare gli aggregati a 50 xg per 2 min. Aspirare il surnatante. Risospendere gli aggregati in pellet nel pre-riscaldato a induzione 2 Media.
- Trasferire la sospensione aggregato ad una piastra 24 pozzetti attacco ultra-bassa (ULA) a 1 ml per bene. Osservare gli aggregati al microscopio più uniforme, gruppi di cellule strette. Incubare in condizioni di ipossia fino al giorno 6.
6. cardiaco induzione Fase 3
- Il giorno 6, preparare il volume necessario di Fase 3 induzione media (volume = numero di pozzi x 1 ml). Per 1 ml di Complete cardiaco induzione medio, aggiungere 2 ml soluzione VEGF magazzino (concentrazione finale = 10 ng / ml), e 0,5 ml di soluzione madre bFGF (concentrazione finale = 5 ng / ml). Posizionare preparati induzione a media Fase 3 in un bagno d'acqua a 37 ° C per almeno 15 min.
- Utilizzare una pipetta 5 ml sierologica per trasferire gli aggregati a 15 ml provette coniche, mettendo in comune fino a 10 ml di aggregaziones per provetta.
- Lasciare 10 minuti per gli aggregati di stabilirsi. Aspirare il surnatante e risospendere gli aggregati nella Fase 3 di induzione medio pre-riscaldato. Usando una pipetta da 5 ml sierologica, ridistribuire gli aggregati in un 24-pozzetti ULA a 1 ml per bene.
- Il giorno 10, preparare il volume necessario di Fase 3 induzione media (volume = numero di pozzi x 1 ml) come da Passo 6.1.
- Utilizzare un 5 ml pipetta sierologica per trasferire gli aggregati a 15 ml provette coniche, mettendo in comune fino a 10 ml di aggregati per provetta.
- Lasciare 10 minuti per gli aggregati di stabilirsi. Aspirare il surnatante e risospendere gli aggregati nella Fase 3 induzione media. Usando una pipetta da 5 ml sierologica, ridistribuire gli aggregati in un 24-pozzetti ULA a 1 ml per bene.
- Incubare in condizioni di ipossia per due giorni. Il giorno 12, inizierà incubando le cellule a livelli di ossigeno normossia per il resto del periodo di coltura (37 ° C, 20% O 2, 5% CO 2).
NOTA:Dopo questo punto di tempo, le cellule non sono coltivate in condizioni di ipossia. - Ripetere questo completo cambio medio (i punti 6.2 e 6.3) ogni 4 giorni, a partire giorno 14 fino alla raccolta delle cellule (in genere, le concentrazioni di cardiomiociti di picco si osservano dopo giorno 14 di differenziazione).
7. flusso Analisi Citometria di cardiaca Troponina T (cTnT) Espressione Frequenza di uscita Micropiastra Cultura
- Dissociare il aggregati come segue:
- Utilizzare un 5 ml pipetta sierologica per trasferire 1 e di aggregati di un tubo da 15 ml. Centrifugare gli aggregati a 50 xg per 2 minuti ed aspirare accuratamente il surnatante.
- Aggiungere 1 ml di fresco disciolto soluzione 1 mg / ml Collagenasi tipo II agli aggregati. Trasferire la sospensione di aggregazione in una provetta da 1,5 ml microcentrifuga. Incubare gli aggregati di Collagenasi di tipo II notte a temperatura ambiente.
- Il giorno seguente, utilizzare una micropipetta P1000 a dissociarsi delicatamente gli aggregatiin una sospensione singola cella omogenea. Se gli aggregati non facilmente dissociano, risolvere gli aggregati, aspirare il surnatante, e incubare gli aggregati in 700 ml di dissociazione enzimatica per 1-2 minuti a temperatura ambiente. Delicatamente pipetta gli aggregati 1 a 2 volte con una micropipetta P1000 a dissociarsi.
- Diluire l'enzima di dissociazione: Aggiungere 700 ml di Wash mezzo contenente 14 ml di 1 mg / ml di soluzione DNAsi. Prelevare 10 microlitri di eseguire una conta cellulare e centrifugare la sospensione rimanente utilizzando una microcentrifuga da banco a 300 xg per 2 min.
- Eseguire un numero di celle: Colorare il campione di conteggio 10 microlitri con un uguale volume di Trypan Blue e contare con un emocitometro.
- Rimuovere il tubo di 1,5 ml microcentrifuga contenente le restanti cellule dal microcentrifuga. Aspirare il surnatante e risospendere le cellule, ad una concentrazione di 200.000 a 500.000 cellule per 100 ml, in Hanks Balanced Salt Solution contenente2% siero fetale bovino (HF).
- Per ogni condizione, trasferire 100 l di sospensione cellulare per pozzetto a 2 pozzetti di una piastra a 96 pozzetti (un pozzo sarà macchiato con l'anticorpo cTnT e l'altro sarà il controllo anticorpo secondario).
- Centrifugare la piastra a 300 xg per 2 min. Rimuovere il surnatante con una micropipetta multicanale.
- Fissare le cellule: Aggiungere 200 ml di soluzione di fissaggio (componente del kit) per pozzetto e incubare la piastra per 15 minuti a temperatura ambiente.
- Centrifugare la piastra a 300 xg per 2 min. Utilizzare una micropipetta multicanale di ritirare con attenzione il surnatante dai pozzetti. Smaltire il surnatante in un contenitore per rifiuti paraformaldeide.
- Lavare le cellule fissate due volte: Aggiungere 200 ml di HF in ogni pozzetto. Centrifugare la piastra a 300 xg per 2 min. Aspirare il surnatante, e ripetere la fase di lavaggio, ancora una volta. Cellule fisse possono essere conservate per un massimo di una settimana in alta frequenza a 4 ° C.
- Permeabilize le cellule:
- Centrifugare la piastra a 300xg per 2 min.
- Aggiungere 100 ml di soluzione permeabilizzazione (componente del kit) per ciascun pozzetto ed incubare la piastra a temperatura ambiente per 5 min.
- Centrifugare la piastra a 300 xg per 2 minuti e aspirare il surnatante.
- Preparare una master mix di anti-cTnT in HF alla concentrazione ottimale per un dato numero di lotto (La diluizione ottimale deve essere determinata per titolazione e in genere varia da 1: 500 a 1: 2.000).
- Per ogni condizione (2 pozzi per condizione), aggiungere 100 ml di master mix per un bene (campione colorato) e 100 ml di HF pianura verso l'altro bene (controllo anticorpo secondario). Incubare le cellule a 4 ° C per 30 min.
- Centrifugare le cellule a 300 xg per 2 min. Aspirare il surnatante e aggiungere 200 ml di HF per pozzetto. Ripetere questa fase di lavaggio ancora una volta.
- Preparare una master mix dell'anticorpo secondario. Trasferire un volume di HF che corrisponde a 100 l per ogni bene (controllo anticorpo secondario ecTnT-macchiato) da trattare. Aggiungere 1 ml di anticorpo secondario di capra anti-topo-APC per 200 ml di HF (diluizione 1: 200).
- Colorare i campioni. Aggiungere 100 ml di soluzione colorante in ogni pozzetto (sia il controllo anticorpo secondario e pozzi anti-cTnT-macchiati). Incubare le cellule al buio a 4 ° C per 30 min (mantenere placca coperta o al buio dopo l'aggiunta di anticorpo secondario fluorescente per evitare photobleaching).
- Centrifugare le cellule a 300 xg per 2 min. Aspirare il surnatante e aggiungere 200 ml di HF per pozzetto. Ripetere questa fase di lavaggio ancora una volta.
- Trasferire i campioni da 5 ml flusso fondo tondo citometro tubi di analisi ed eseguire citometria a flusso per il segnale nel canale APC utilizzando i protocolli standard per lo strumento 19.
Risultati
aggregati dimensioni controllate di hPSCs possono efficacemente essere formati usando il sistema microtiter, dipendente soltanto dalla concentrazione di cellule e la superficie micropozzetto. Dopo una breve centrifugazione, i numeri appropriati di cellule (1.000 in questo protocollo) sono riunite in ciascun pozzetto (Figura 1A). È importante sottolineare che queste cellule ristabilire connessioni intracellulari entro 24 ore, e non dovrebbero più riempire il pozzo, ma appaiono come aggregati compatti con bordi lisci (Figura 1B). Questi aggregati forniscono i materiali di partenza per un'ulteriore differenziazione verso un destino cardiaco. Se le cellule non riescono a formare ammassi stretti, questo suggerisce possibile morte cellulare dopo dissociazione e riaggregazione, e l'idoneità delle concentrazioni singole passaging cellulare e inibitore ROCK per una particolare linea cellulare dovrebbe essere esaminato. I seguenti tre giorni in pozzetti mostrano piccolo cambiamento nella morfo aggregatalogia, anche se alcuni la crescita è evidente. Quando viene rimosso dai pozzetti, aggregati dovrebbero mantenere il loro turno, la morfologia fitto ed essere di dimensioni simili l'uno all'altro (Figura 1C). Cultura in ULA piastre da 24 pozzetti permetterà l'ulteriore espansione e la crescita cellulare.
Di giorno 8, dopo l'esposizione prima alla segnalazione Activin, e l'inibizione Wnt, gli aggregati inizieranno ad apparire come aggregati più grandi e più luminosi (Figura 1D). Durante questo periodo, considerevole detriti cellulari sarà evidente al fondo di ogni pozzetto e rimosso permettendo aggregati di stabilirsi prima di rimuovere media. Di tanto in tanto, molti aggregati si fonderanno insieme. Questo non inibisce la differenziazione degli altri aggregati nel pozzo, anche se queste "aggregati super" tendono a non mostrare i cambiamenti morfologici osservati con aggregati più piccole e sono meno probabilità di subire differenziazione completa.
"Jove_content" fo: keep-together.within-page = "1"> risultati differenziazione Continua a notevoli cambiamenti morfologici agli aggregati con una maggiore dimensione e la comparsa delle regioni fibrosi organizzati. Di giorno 12, aggregati contraenti possono essere osservati. Questi saranno sempre costituiti da grandi cellule trasparenti e spesso includono una vasta matrice extracellulare di fuori dell'aggregato (Figura 2). Mentre le contrazioni aggregati a livello indicano una differenziazione di successo, espressione marcatore cardiaco può anche essere osservato in aggregati che non appaiono a contrarsi. Dopo la dissociazione di aggregati e immunomarcatura, la maggioranza delle cellule sarà positivo per la cTnT marcatore cardiomiociti mediante citometria di flusso (Figura 3). L'espressione di questo marcatore è stabile nelle cellule e può essere osservato in aggregati più tardi il giorno 19 di differenziazione.
1.jpg "/>
Figura 1: Timeline di HPSC differenziato verso un destino cardiaco Subito dopo l'aggregazione, le cellule quasi riempire ciascun pozzetto (A).. Il giorno dopo, gli aggregati appaiono condensati e liscia (B). Questa morfologia persiste anche quando gli aggregati vengono rimossi dai pozzetti e piastrate in piastre e (C). Di giorno 8, aggregati iniziano ad espandersi e appaiono di colore più chiaro (D). Barra di scala:. 250 micron Clicca qui per vedere una versione più grande di questa figura.
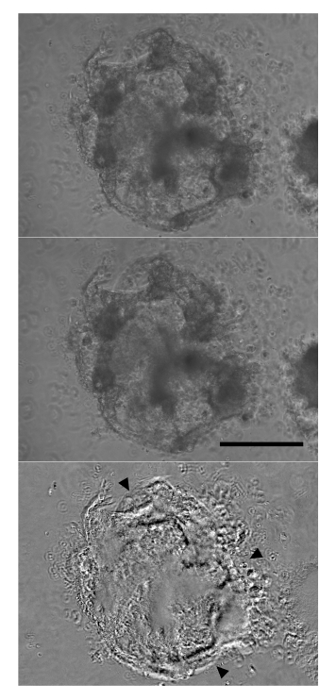
Figura 2: Aggregati Inizia contraente da Giorno 12 di differenziazione Dopo sei giorni in Cardiac induzione Stage 3 Media, sono state osservate forti contrazioni a livello aggregato (pannello superiore:. Rilassarsizione, pannello centrale: contrazione). Il pannello inferiore è derivato da sottraendo i pannelli superiori e medie, con la maggior parte delle differenze significative appaiono come nero o bianco (punte di freccia). Barra di scala:. 250 micron Clicca qui per vedere una versione più grande di questa figura.
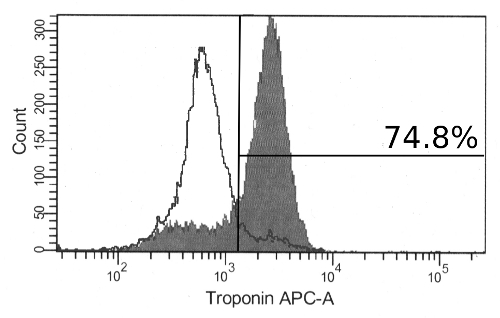
Figura 3:. Immunomarcatura per cardiaca Troponina T differenziata hPSCs Al giorno 17, la maggior parte delle cellule sono positivi per la troponina cardiaca T mediante citometria di flusso (istogramma pieno). Anche dimostrato sono cellule colorate con anticorpo secondario da solo (istogramma vuoto). Cliccate qui per vedere una versione più grande di questa figura.
Discussione
È stato osservato che la differenziazione cardiaca efficiente di cellule staminali pluripotenti è un processo altamente variabile. Mentre non è sorprendente che diverse linee cellulari presentano diverse inclinazioni di capacità di differenziazione specifici tipi cellulari, è stato osservato che cardiaca efficienza differenziazione oscilla drasticamente tra replica eseguito usando la stessa linea cellulare 6. Il protocollo qui descritto affronta una delle principali fonti di questa variabilità controllando direttamente il numero di cellule di ingresso per ogni aggregato. Per ridurre ulteriormente la variabilità tra le esecuzioni, si raccomanda che le linee HPSC adattati per singolo passaging cellule sono utilizzati, in quanto questa forma di HPSC sviluppo e il mantenimento dei risultati nelle popolazioni pluripotenti più coerenti rispetto alle frequenze di espressione di marcatori pluripotenza (ad esempio, Oct4, Nanog, Tra-1-60, ecc.).
Il protocollo come scritto qui specifica una dimensione complessiva di 1000 cellule per Oinduzione cardiaco ptimal dalla linea di cellule staminali embrionali HES-2. Per applicare questo protocollo per diverse linee cellulari, è fondamentale che una schermata iniziale dimensione aggregata essere effettuata per determinare la dimensione aggregata ottimale delle cellule line-specifica. Anche se non influisce direttamente le procedure da seguire qui, ricordiamo al lettore che i cambiamenti nella dimensione degli aggregati e della densità delle cellule generale dovrebbero influenzare l'apporto di ossigeno. Questo può diventare una considerazione rilevante in applicazioni a valle. Inoltre, la morte cellulare per apoptosi è una preoccupazione durante la dissociazione hPSCs a singole cellule. Pertanto, è fondamentale per garantire che inibitore ROCK è presente durante l'aggregazione delle cellule forzata nei pozzetti. Infine, è fondamentale che il giorno 4 di differenziazione aggregati sono ben lavati per rimuovere tracce Activin A, presente nella induzione 1 Medium, prima risospensione in induzione 2 Medium. Dopo il giorno 4 di differenziazione, Activin A promuove la differenziazione endoderma a scapito della mesoinduzione derma 20.
L'applicazione principale di questa tecnica è quello di schermare formati aggregati che promuovono differenziazione cardiaca efficiente. Tuttavia, uno dei limiti della tecnica attuale è che esso è impegnativo per la produzione su scala cardiaca a livelli clinicamente rilevanti utilizzando micropiastre. Scale up di differenziazione cardiaca è tipicamente effettuata in condizioni di coltura di massa in bioreattori sospensione agitata 21. Pertanto, una volta che il sistema di micropozzetti è stato utilizzato per determinare gli intervalli accettabili di granulometria all'induzione cardiaca efficiente, il passo successivo per scalare è determinare velocità bioreattore girante che possono generare la dimensione aggregata cella desiderata.
Una delle differenze significative di questa tecnica rispetto ad altri metodi per la differenziazione cardiaca aggregate basato è che consente indagini dirette in modulando gli effetti di segnalazione endogena in aggregati nonchéla co-coltura di tipi induttivi / inibitori di tessuto con le hPSCs nell'aggregato 13. Questi tipi di indagini possono informare lo sviluppo dei processi di produzione su larga scala cardiaco.
Divulgazioni
M.U. has a financial interest in the underlying microwell technology.
Riconoscimenti
We thank Dr. Peter Zandstra, in whose laboratory this protocol was developed, and Drs. Mark Gagliardi and Gordon Keller who provided assistance in establishing the initial methods on which this process was based. Protocol development was supported by an Ontario Graduate Scholarship in Science and Technology to C.B. and a grant from the Heart and Stroke Foundation of Ontario to Peter Zandstra.
Materiali
| Name | Company | Catalog Number | Comments |
| Biological safety cabinet | |||
| Pipette aid | |||
| Serological pipettes (5 to 25 ml) | |||
| Aspirator | |||
| Aspirator or Pasteur pipettes | |||
| 15 and 50 ml conical tubes | |||
| Fume hood | |||
| 0.22 µm syringe filter | |||
| 5% CO2, 5% O2, and humidity controlled cell culture incubator | Hypoxic (low oxygen) incubator | ||
| 5% CO2, 20% O2, and humidity controlled cell culture incubator | |||
| Low speed centrifuge with a swinging bucket rotor fitted with a plate holder | |||
| P2, P20, P200, and P1000 micropipettors and associated tips | |||
| Inverted microscope with 4X, 10X and 20X phase objectives | |||
| Ultra-Low Attachment (ULA) 24 well plates | Corning/Costar | 3473 | |
| 1.5 ml microcentrifuge tubes | |||
| Bench-top microcentrifuge | |||
| L-Ascorbic Acid | Sigma-Aldrich | A4403 | |
| Sterile Ultrapure distilled water | Sigma-Aldrich | W3500 | |
| Vortex | |||
| Ice | |||
| -20 °C freezer | |||
| Monothioglycerol | Sigma-Aldrich | M6145 | Toxic; Aliquoting of MTG is strongly recommended to minimize oxidation due to repeated opening. Aliquots can be stored at 4 °C for up to 3 months, -20 °C is recommended for long-term storage. |
| StemPro-34 Medium | Thermo Fisher Scientific | 10639-011 | Basal Cardiac Induction Medium; The supplement is stored at -20 °C and the basal medium at 4 °C. |
| Transferrin | Roche | 10652202001 | |
| BMP-4 | R&D Technologies | 314-BP | |
| bFGF | R&D Technologies | 233-FB | |
| VEGF | R&D Technologies | 293-VE | |
| Activin A | R&D Technologies | 338-AC | |
| IWP-2 | Reagents Direct | 57-G89 | |
| Phosphate buffered saline (PBS) | Thermo Fisher Scientific | 14190 | |
| Bovine Serum Albumin (BSA) | Thermo Fisher Scientific | 15561 | |
| Hydrochloric acid | Sigma-Aldrich | 258148 | Corrosive |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| DMEM/F-12 | Thermo Fisher Scientific | 12660 | |
| 100x Penicillin/Streptomycin | Thermo Fisher Scientific | 15140 | |
| 100x L-glutamine | Thermo Fisher Scientific | 25030 | |
| Knockout Serum Replacement | Thermo Fisher Scientific | 10828010 | |
| TrypLE Select | Thermo Fisher Scientific | 12563 | Dissociation enzyme |
| Hemocytometer | |||
| Trypan Blue | |||
| Aggrewell 400 plates | StemCell Technologies | 27845 | Microwell Plates |
| Aggrewell Rinsing Solution | StemCell Technologies | 7010 | Microwell Rinsing Solution |
| Y-27632 ROCK Inhibitor | Tocris | 1254 | |
| Collagenase Type II | Sigma-Aldrich | C6885 | |
| Hank's Balanced Salt Solution | Thermo Fisher Scientific | 14025092 | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 12483 | |
| 96 well plate (for FACS staining) | |||
| Intraprep Permeabilization Reagent | Beckman Coulter | IM2389 | Kit with 2 parts: Fixation Solution and Permeabilization Solution; Toxic |
| cTnT antibody | Neomarkers | MS-295 | |
| goat anti-mouse-IgG APC antibodyThermoFisher | Molecular Probes | A865 | |
| 5 ml round bottom flow cytometry tubes | FACS machine dependent |
Riferimenti
- Wintermantel, E., et al. Tissue engineering scaffolds using superstructures. Biomaterials. 17, 83-91 (1996).
- Lazar, A., et al. Formation of porcine hepatocyte spheroids for use in a bioartificial liver. Cell Transplant. 4, 259-268 (1995).
- Sachlos, E., Auguste, D. T. Embryoid body morphology influences diffusive transport of inductive biochemicals: a strategy for stem cell differentiation. Biomaterials. 29, 4471-4480 (2008).
- Johnstone, B., Hering, T. M., Caplan, A. I., Goldberg, V. M., Yoo, J. U. In vitro chondrogenesis of bone marrow-derived mesenchymal progenitor cells. Exp. Cell Res. 238, 265-272 (1998).
- Steinberg, M. S. Does differential adhesion govern self-assembly processes in histogenesis? Equilibrium configurations and the emergence of a hierarchy among populations of embryonic cells. J. Exp. Zool. 173, 395-433 (1970).
- Bauwens, C. L., et al. Control of human embryonic stem cell colony and aggregate size heterogeneity influences differentiation trajectories. Stem Cells Dayt. Ohio. 26, 2300-2310 (2008).
- Koike, M., Kurosawa, H., Amano, Y. A Round-bottom 96-well Polystyrene Plate Coated with 2-methacryloyloxyethyl Phosphorylcholine as an Effective Tool for Embryoid Body Formation. Cytotechnology. 47, 3-10 (2005).
- Ng, E. S., Davis, R. P., Azzola, L., Stanley, E. G., Elefanty, A. G. Forced aggregation of defined numbers of human embryonic stem cells into embryoid bodies fosters robust, reproducible hematopoietic differentiation. Blood. 106, 1601-1603 (2005).
- Burridge, P. W., et al. Improved human embryonic stem cell embryoid body homogeneity and cardiomyocyte differentiation from a novel V-96 plate aggregation system highlights interline variability. Stem Cells Dayt. Ohio. 25, 929-938 (2007).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PloS One. 3, e1565 (2008).
- Kozhich, O. A., Hamilton, R. S., Mallon, B. S. Standardized generation and differentiation of neural precursor cells from human pluripotent stem cells. Stem Cell Rev. 9, 531-536 (2013).
- Ungrin, M. D., et al. Rational bioprocess design for human pluripotent stem cell expansion and endoderm differentiation based on cellular dynamics. Biotechnol. Bioeng. 109, 853-866 (2012).
- Bauwens, C. L., et al. Geometric control of cardiomyogenic induction in human pluripotent stem cells. Tissue Eng. Part A. 17, 1901-1909 (2011).
- Golos, T. G., Giakoumopoulos, M., Garthwaite, M. A. Embryonic stem cells as models of trophoblast differentiation: progress, opportunities, and limitations. Reprod. Camb. Engl. 140, 3-9 (2010).
- Markway, B. D., et al. Enhanced chondrogenic differentiation of human bone marrow-derived mesenchymal stem cells in low oxygen environment micropellet cultures. Cell Transplant. 19, 29-42 (2010).
- Fey, S. J., Wrzesinski, K. Determination of drug toxicity using 3D spheroids constructed from an immortal human hepatocyte cell. Toxicol. Sci. Off. J. Soc. Toxicol. 127, 403-411 (2012).
- Wallace, L., Reichelt, J. Using 3D culture to investigate the role of mechanical signaling in keratinocyte stem cells. Methods Mol. Biol. Clifton NJ. 989, 153-164 (2013).
- Ungrin, M., O'Connor, M., Eaves, C., Zandstra, P. W. Phenotypic analysis of human embryonic stem cells. Curr. Protoc. Stem Cell Biol. , (2007).
- Bhattacharya, S., et al. High efficiency differentiation of human pluripotent stem cells to cardiomyocytes and characterization by flow cytometry. J. Vis. Exp. JoVE. , e52010 (2014).
- Nostro, M. C., et al. Stage-specific signaling through TGFβ family members and WNT regulates patterning and pancreatic specification of human pluripotent stem cells. Dev. Camb. Engl. 138, 861-871 (2011).
- Niebruegge, S., et al. Generation of human embryonic stem cell-derived mesoderm and cardiac cells using size-specified aggregates in an oxygen-controlled bioreactor. Biotechnol. Bioeng. 102, 493-507 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon