È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Three-Dimensional Cultura Assay per esplorare Cancer Cell invasività e formazione di tumori Satellite
In questo articolo
Riepilogo
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Abstract
colture cellulari di mammifero in monostrati è ampiamente usato per studiare i vari processi fisiologici e molecolari. Tuttavia, questo approccio per studiare le cellule in crescita genera spesso artefatti indesiderati. Pertanto, coltura cellulare in un ambiente tridimensionale (3D), spesso utilizzando componenti della matrice extracellulare, emerso come un'alternativa interessante per la sua somiglianza al nativo nel tessuto vivo o organo. Abbiamo sviluppato un sistema di coltura cellulare 3D utilizzando due compartimenti, cioè (i) un vano centrale contenente cellule tumorali annegate in una recitazione gel di collagene come tumore macrospherical pseudo-primaria e (ii) un vano privo di cellule periferiche in un gel di fibrina, cioè un componente della matrice extracellulare diverso da quello utilizzato nel centro, in cui le cellule tumorali può migrare (anteriore invasione) e / o formare tumori microspherical rappresentano tumori secondari o satellitari. La formazione di tumori satellite nel compartimento periferico ènotevolmente correlata all'aggressività noto o l'origine metastatica delle cellule tumorali native, che rende questo sistema di coltura 3D unica. Questo approccio coltura cellulare può essere considerata per valutare invasività cancro delle cellule e la motilità, interazioni cellula-matrice e come un metodo per valutare le proprietà anti-cancro droga.
Introduzione
Indagare le caratteristiche fondamentali e biomediche di invasione delle cellule tumorali / migrazione e la successiva creazione di metastasi è oggetto di un intenso lavoro di ricerca 1,2. Metastasi è la fase finale di cancro e la sua gestione clinica resta sfuggente. Una migliore comprensione di metastasi a livello cellulare e molecolare consentirà lo sviluppo di terapie più efficaci 3.
Diverse proprietà di cellule metastatiche possono essere esplorate in vitro 4 compreso il loro stemness e potenziale per acquisire uno stato di transizione (per esempio, epithelioid-mesenchimale transizione) di migrare e invadere all'interno e dal tumore primario 5. Tuttavia, la valutazione in vitro di processi / metastasi invasione è stata una sfida poiché esclude praticamente il contributo del sangue / circolazione linfatica. colture organotipiche che incorporano frammenti di tumore in gel di collagene hanno Precesornione stato utilizzato per monitorare l'aggressività del cancro. Anche se la complessità dei tumori è conservata (ad esempio, la presenza di cellule non cancerose), frammenti di tumore sono esposti a limitata diffusione media, la variazione di campionamento, e ad una crescita eccessiva di cellule stromali 6. Un metodo alternativo consiste nel crescere cellule tumorali all'interno dei componenti della matrice extracellulare (ECM), che imita l'ambiente cellulare tridimensionale (3D). La proliferazione di linee cellulari di cancro al seno in un gel di collagene e / o una matrice membrana basale-derivato è tra gli esempi meglio caratterizzati di coltura cellulare 3D. Utilizzando specifici ambienti di coltura cellulare 3D, il gruppo disorganizzato osservata per le cellule del cancro al seno coltivate in condizioni standard può essere invertito per la formazione spontanea di acini mammaria e strutture tubolari 7-10. Inoltre, la formazione di sferoidi tumorali multicellulari derivate da cellule tumorali adenocarcinoma congregata con tecniche diverse (ad esempio, appeso gocce, sferoidi galleggiante, agar embedment) ora costituisce la coltura delle cellule 3D test più comunemente usato 11-13. Tuttavia, questo test è limitata dal ristretto insieme di linee cellulari tumorali che possono formare sferoidi e dal breve periodo a disposizione per studiare le cellule in queste condizioni.
In questa tecnica visualizzata, abbiamo qui introduciamo un sofisticato test di coltura cellulare 3D in cui le cellule tumorali di interesse sono incorporati in un gel di collagene per consentire la formazione in vitro di un tumore pseudo-primario che può essere alternativamente rivestita con una matrice di membrana derivate interrato. Una volta formato, il tumore pseudo-primaria viene poi inserita in una matrice acellulare (gel di fibrina nel presente caso), che permette alle cellule tumorali di attraversare l'interfaccia tra i due compartimenti matrice (vedi Figura 1). È interessante notare che le strutture di tumore-come secondarie provenienti dal tumore pseudo-primaria con le cellule tumorali aggressive appaiono nelgel di fibrina. Tale sistema di coltura 3D offre la flessibilità necessaria per indagare, ad esempio, farmaci antitumorali, espressione genica e cellula-cellula e / o interazioni cellula-ECM 14-16.
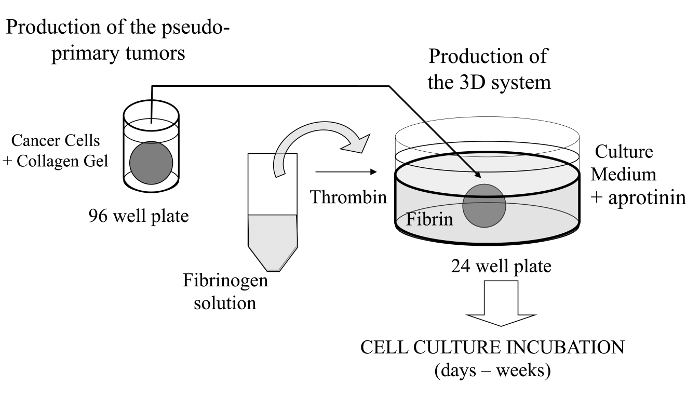
Figura 1:.. Panoramica del metodo di sintesi schematica del metodo per generare il sistema di coltura cellulare 3D come modello per lo studio del cancro Cliccate qui per vedere una versione più grande di questa figura.
Protocollo
NOTA: Non etica considerazione dal momento che le cellule tumorali umane e animali sono stati acquistati o gentilmente forniti da noi.
1. Fare collagene spine (Pseudo-primaria del tumore)
- Preparare una dispersione di collagene. Collagene di tipo I da tendini coda di topo (RTT) possono essere estratti sia e sterilizzati come riportato in precedenza 17, o acquistati. Disperse collagene liofilizzato RTT (3,25-3,50 mg / ml in 0,02 N acido acetico) utilizzando un miscelatore (impostazione alta velocità; cinque 2 min funzionamenti) per una miscelazione uniforme.
- Harvest (tripsina-EDTA, di solito) e utilizzare esclusione trypan blu per il conteggio delle cellule vitali con un emocitometro. Regolare la densità cellulare desiderato (5 x 10 4 cellule per spina).
- Preparare tutte le soluzioni (NaOH, siero fetale bovino, DMEM 5x, NaHCO 3) separatamente (Tabella 1) in condizioni sterili e mantenere refrigerata in ghiaccio. Nota: L'ordine di aggiunta dei vari soluzioni è importante per evitare shock osmotici o acidi nelle cellule.
- Eseguire dispersione cella (1,25 x 10 6 cellule) nella soluzione di collagene finale (5 ml) più rapidamente possibile. Mescolare bene (pipettando su e giù) evitando bolle d'aria, e quindi distribuire rapidamente 200 microlitri della soluzione pronta all'uso in ciascun pozzetto di una piastra a 96 pozzetti. colpire delicatamente la piastra multi-bene sulla superficie della cappa di coltura cellulare di lavoro per rimuovere le bolle d'aria e diffondere uniformemente la soluzione all'interno dei pozzetti.
- Dopo aver riempito fino tutti i pozzetti (questo passaggio richiede circa 15-20 minuti per ogni piastra a 96 pozzetti), memorizzarlo in incubatrice.
- Incubare la piastra a 37 ° C da 2 ore a notte. Il collagene gelificazione (cioè, fibrillogenesi) si verifica entro 30 min. Aggiungere terreno di coltura (100 ul / pozzetto) alla cultura per eseguire una notte di incubazione.
2. Primo strato di fibrina gel
- Fibrinogeno preparazione della soluzione.
NOTA: Lo stesso lotto di gel di fibrina dovrebbe idealmente essere utilizzato per Resul più riproducibilets, formazione di gel di fibrina come può variare tra i diversi lotti di fibrinogeno liofilizzato commerciale.- Usare sempre una soluzione di fibrinogeno preparati al momento. Portare il fibrinogeno liofilizzato a temperatura ambiente prima di aprire il flacone per evitare la formazione di cristalli di idrati.
- Progressivamente sciogliere il fibrinogeno in pre-riscaldato (37 ° C) soluzione salina bilanciata di Hank (HBSS) con Ca 2+ / Mg 2+ ad una concentrazione di lavoro di 3 mg / ml (non preparare un eccesso del 15% del volume finale minima necessaria : ad esempio, 17.25 mg a 5,75 ml di soluzione 5 ml).
- Aggiungere pre-riscaldato a gocce HBSS in un primo momento per solubilizzare frammenti di fibrinogeno. Abbattere i frammenti più grandi con una spatola nel bicchiere. Agitare il bicchiere di volta in volta a facilitare la miscelazione. Non usare una piastra di agitatore durante la procedura. Sciogliere la polvere rimanente pipettando sospensione su e giù.
- Conservare la soluzione di fibrinogeno tiepida mentre sterilizing la soluzione passa attraverso un filtro di 0,22 micron. Nota: se il HBSS non è abbastanza caldo o il fibrinogeno non completamente dissolto, la soluzione può intasare il filtro. Se del caso, sostituire il filtro una o due volte, che possono ridurre la concentrazione di fibrinogeno, e la rigidità quindi coagulo di fibrina.
- Sospendere le cellule di interesse (ad esempio, cellule endoteliali) in soluzione di fibrinogeno pronta per l'uso durante la regolazione il volume finale, quale procedura alternativa.
- Preparare le soluzioni di trombina.
- Preparare una soluzione madre in DDH 2 O (50 NIH unità / ml), quindi sterilizzarlo con un filtro 0,22 micron.
- Utilizzare un rapporto / trombina fibrinogeno ≥1: 0,0075 (v / v) per generare il gel di fibrina.
- Generazione del gel di fibrina.
- Tenere il fibrinogeno e trombina sterili soluzioni stock su ghiaccio durante tutte le fasi successive. I gel di fibrina possono formare in piastre da 24 pozzetti.
- Prontamente sovrapposizione °e la superficie di ciascun pozzetto con la soluzione di fibrinogeno (200 pl / pozzetto) evitando la formazione di bolle d'aria. Processo 6 pozzetti alla volta.
- Una volta che la soluzione di fibrinogeno copre completamente la superficie dei pozzetti, inclinare il piatto in un angolo di 45 ° e aggiungere 1,5 ml di soluzione di trombina al primo pozzo facendo cadere la trombina al centro del pozzo, e poi ruotare delicatamente la piastra orizzontale per 1-2 sec.
- Lasciare la piastra in posizione stabile sotto cappa a flusso laminare (5-10 min) fino a quando il processo di gelificazione / coagulazione ha completato (NB: il processo di polimerizzazione non deve essere disturbato, ad esempio, trasportando la piastra alla incubatore).
- Una volta che i primi sei pozzi sono polimerizzati, ripetere la stessa sequenza (cioè i 3 passaggi precedenti) per i prossimi sei pozzi fino a quando tutti i pozzetti sono stati elaborati.
3. secondo strato di fibrina gel e sandwich collagene Plug
- OpzioneA: (Utilizzo del plug collagene immediatamente).
- Assicurarsi che il primo strato di gel di fibrina è polimerizzato in tutti i pozzetti con delicatezza, inclinando la piastra. Posizionare la piastra a 96 pozzetti contenente lato tappi di gel di collagene fianco con piastra da 24 pozzetti (contenente gel di fibrina) per facilitare il trasferimento dei tappi di collagene.
- Aggiungere una goccia di HBSS in ciascun pozzetto della piastra contenente i tappi di collagene.
- Rimuovere ciascun tappo collagene dal pozzo con un ago sottile montato su una siringa (usato come una maniglia) o utilizzando un micro-cucchiaio (vedi video). Trasferire ogni spina collagene sul primo strato di gel di fibrina utilizzando uno o due micro-cucchiai, facendo in modo che il tappo di collagene sia ben centrato nel bene e che la sterilità è ben mantenuto.
- Sovrapporre il gel di fibrina precedentemente formato con il secondo strato di soluzione di fibrinogeno (300 ml / pozzetto) e introdurre la trombina come descritto in 2.3, mantenendo una minima 1:. Rapporto di 0,0075 e una sequenza di sei pozzetti alla volta
- Opzione B (rivestimento Plug collagene con un sottile strato di Growth Factor-ridotto membrana basale (GFRBM)).
- Raffreddare tutte le soluzioni preparate e gli strumenti in anticipo e tenerli a 4 ° C o su ghiaccio (ad esempio, pipette, consigli, provette) durante la movimentazione da aliquote congelate di GFRBM sono molto sensibili alla velocità di riscaldamento eccessivo durante lo scongelamento (seguire le istruzioni del produttore) .
- Dopo la rimozione dai pozzetti della piastra, immergere ogni spina collagene per 2 minuti in una provetta da centrifuga da 1,5 ml su ghiaccio contenente 100 ml di una soluzione GRFBM puro.
- Trasferire ciascun tappo rivestito sul primo strato di fibrina assicurando è ben centrata, come descritto in precedenza. Incubare le piastre a innesto contenente a 37 ° C per 5 minuti per consentire la GRFBM per formare un gel. Aggiungere il secondo strato di fibrina come al punto 3.1.4.
4. colture cellulari condizioni medie
- Riempire ogni pozzetto con terreno di coltura (400 ml). I terreni di coltura e supplementi saranno selezionati in base alla linea cellulare e condizioni sperimentali.
- Aggiungere aprotinina, un agente antifibrinolitico, al mezzo di coltura ad una concentrazione finale di 100 unità di inibitore callicreina (KIU) / ml.
NOTA: Conservare le piastre in un incubatore di coltura cellulare nelle condizioni utilizzate per la linea cellulare testato. - Rifornire culture con terreno fresco ogni altro giorno o in base alla pianificazione sperimentale, e aggiungere aprotinina. Prima di aggiungere mezzo fresco, inclinare leggermente la piastra (con un angolo di 30-35 °) e inclinare il pipetta contro il lato del bene mentre accuratamente aspirazione terreno condizionato sotto costante osservazione.
Risultati
Come precedentemente accennato, una caratteristica interessante di questo test coltura cellulare 3D è che le cellule tumorali possono non solo migrare dalla spina collagene al gel di fibrina adiacente, ma anche stabilire tumori secondari (strutture ad esempio, satellite tumore-like). Questo può essere direttamente osservata con un microscopio a contrasto di fase invertito a bassi e alti ingrandimenti attraverso lo spessore di gel, in particolare con una distanza di lavoro cond...
Discussione
Come importante nota tecnica, è essenziale che non gap è presente all'interfaccia tra la centrale ei gel periferici. Altrimenti, si potrebbe ridurre la capacità delle cellule di migrare / invadere il gel di fibrina. Uno spazio tra il collagene e gel di fibrina possono formarsi durante il primo 24 ore di coltura se trombina non è stato opportunamente diluito. È anche possibile che la linea cellulare testato potrebbe portare il gel di collagene per contrarre durante la coltura, causando così uno spazio relativam...
Divulgazioni
The authors have no disclosure.
Riconoscimenti
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Materiali
| Name | Company | Catalog Number | Comments |
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65 - 85% protein with ≥ 75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5 - 10T IU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
Riferimenti
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon