È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
La sintesi di RGD-funzionalizzati idrogeli come strumento per applicazioni terapeutiche
In questo articolo
Riepilogo
We present a protocol for the synthesis of RGD-functionalized hydrogels as devices for cell and drug delivery. The procedure involves copper catalyzed alkyne-azide cycloaddition (CuAAC) between alkyne-modified polyacrylic acid (PAA) and a RGD-azide derivative. The hydrogels are formed using microwave-assisted polycondensation and their physicochemical properties are investigated.
Abstract
The use of polymers as biomaterials has provided significant advantages in therapeutic applications. In particular, the possibility to modify and functionalize polymer chains with compounds that are able to improve biocompatibility, mechanical properties, or cell viability allows the design of novel materials to meet new challenges in the biomedical field. With the polymer functionalization strategies, click chemistry is a powerful tool to improve cell-compatibility and drug delivery properties of polymeric devices. Similarly, the fundamental need of biomedicine to use sterile tools to avoid potential adverse-side effects, such as toxicity or contamination of the biological environment, gives rise to increasing interest in the microwave-assisted strategy.
The combination of click chemistry and the microwave-assisted method is suitable to produce biocompatible hydrogels with desired functionalities and improved performances in biomedical applications. This work aims to synthesize RGD-functionalized hydrogels. RGD (arginylglycylaspartic acid) is a tripeptide that can mimic cell adhesion proteins and bind to cell-surface receptors, creating a hospitable microenvironment for cells within the 3D polymeric network of the hydrogels. RGD functionalization occurs through Huisgen 1,3-dipolar cycloaddition. Some PAA carboxyl groups are modified with an alkyne moiety, whereas RGD is functionalized with azido acid as the terminal residue of the peptide sequence. Finally, both products are used in a copper catalyzed click reaction to permanently link the peptide to PAA. This modified polymer is used with carbomer, agarose and polyethylene glycol (PEG) to synthesize a hydrogel matrix. The 3D structure is formed due to an esterification reaction involving carboxyl groups from PAA and carbomer and hydroxyl groups from agarose and PEG through microwave-assisted polycondensation. The efficiency of the gelation mechanism ensures a high degree of RGD functionalization. In addition, the procedure to load therapeutic compounds or biological tools within this functionalized network is very simple and reproducible.
Introduzione
Gli idrogel sono reti tridimensionali formate da polimeri reticolati idrofili, che sono naturali o sintetici, e caratterizzata da una struttura tridimensionale distintivo. Questi dispositivi sono sempre più interessante nel campo biomedico di drug delivery, l'ingegneria dei tessuti, portatori del gene e sensori intelligenti 1,2. Infatti, il loro elevato contenuto di acqua, come pure le proprietà reologiche e meccaniche li rendono idonei ad imitare microambienti tessuti molli e renderli strumenti efficaci per citochine idrosolubile o la crescita consegna fattore. Uno degli utilizzi più promettenti è come biomateriale iniettabile trasportano cellule e composti bioattivi. Gli idrogel possono migliorare la sopravvivenza delle cellule e il destino delle cellule staminali di controllo tenendo premuto e consegnando precisamente segnali regolatori di cellule staminali in modo rilevante fisiologico, come osservato in in vitro e in esperimenti in vivo 3,4. Il vantaggio principale di questo è la possibilitàmantenere cellule iniettate nella zona di inoculazione (in situ), minimizzando la quantità di cellule che lascia la zona e extravasates nel torrente circolatorio, migrando tutto il corpo e perdere l'obiettivo di destinazione 5. La stabilità delle reti idrogel tridimensionali è dovuto suoi siti di reticolazione, formate da legami covalenti o forze di coesione tra le catene polimeriche 6.
In questo quadro, ortogonale chimica selettiva applicata a catene polimeriche è uno strumento versatile in grado di migliorare le prestazioni di idrogel 7. Infatti, la modifica di polimeri con opportuni gruppi chimici potrebbe contribuire a fornire proprietà meccaniche chimiche appropriate, fisica e migliorare la vitalità cellulare e il loro uso nella formazione di tessuto. Allo stesso modo, tra le tecniche per caricare cellule o fattori di crescita nella matrice del gel, l'uso del peptide RGD permette miglioramenti nella adesione cellulare e la sopravvivenza. RGD è un tripeptide compostodi arginina, glicina e acido aspartico, che è di gran lunga il più efficace e spesso impiegato tripeptide grazie alla sua capacità di affrontare più di un recettore adesione cellulare e il suo impatto biologica sulla ancoraggio delle cellule, il comportamento e la sopravvivenza 8,9. In questo lavoro, la sintesi di idrogel RGD-funzionalizzato è studiato con l'obiettivo di progettare reti caratterizzate da sufficienti proprietà biochimiche per un microambiente delle cellule ospitale.
L'uso di radiazione a microonde nella sintesi idrogel offre una semplice procedura per minimizzare le reazioni collaterali e di ottenere velocità di reazione più elevate e rendimenti in un periodo di tempo più breve rispetto ai processi termici convenzionali 10. Questo metodo non richiede fasi di purificazione e rese idrogel sterili a causa delle interazioni dei polimeri e l'assenza di solvente organico nel sistema di reazione 11. Pertanto, si garantisce elevate percentuali di RGD collegati alla rete polimerica perché no modifications sono tenuti ai gruppi chimici dei polimeri coinvolti nella formazione di gel. gruppi carbossilici, da PAA e carbomer, e gruppi idrossilici, da PEG e agarosio, danno luogo alla struttura tridimensionale idrogel attraverso una reazione di policondensazione. I polimeri citati sono utilizzati per la sintesi degli idrogel nelle lesioni del midollo spinale trattamenti riparazione 12. Questi dispositivi, come riportato nel precedente opere 13,14, presentano un'elevata biocompatibilità e proprietà meccaniche e chimico-fisiche che assomigliano a quelli di molti tessuti viventi e in natura tissotropica. Inoltre, essi rimangano localizzati in situ, in corrispondenza della zona di iniezione.
In questo lavoro, PAA gruppi carbossilici vengono modificati con un residuo alchino (figura 1), e un composto RGD-azide viene sintetizzata sfruttando la reattività del gruppo terminale tripeptide -NH 2 con un composto chimico preparato con struttura (CH 2) n - N 3 ( Figura 2). Successivamente, il PAA modificato reagisce con il derivato RGD-azide attraverso CuAAC click reazione 15-17 (Figura 3). L'uso di rame (I) catalizzatore comporta notevoli miglioramenti sia la velocità di reazione e la regioselettività. La reazione CuAAC è ampiamente utilizzato nella sintesi organica e nella scienza dei polimeri. Esso combina alta efficienza e un'alta tolleranza ai gruppi funzionali, ed è influenzato dalla uso di solventi organici. Una alta selettività, un tempo di reazione veloce e semplice procedura di purificazione consentono l'ottenimento di polimeri stella, copolimeri a blocchi o catene innesto frazioni desiderate 18. Questa strategia scatto consente di modificare polimeri dopo la polimerizzazione per personalizzare le proprietà fisico-chimiche a seconda dell'applicazione finale biochimico. Le condizioni sperimentali CuAAC sono facilmente riproducibile (la reazione è insensibile all'acqua, mentre l'ossidazione del rame può verificarsi minimamente), e la natura ditriazolo formata assicura la stabilità del prodotto. L'uso di rame metallico può essere considerato un punto critico, per il suo potenziale effetto tossico sulle cellule e nel microambiente biologico, ma la dialisi è utilizzato come metodo di purificazione per consentire la completa rimozione dei residui catalitici. Infine, PAA modificato RGD è utilizzato nella sintesi idrogel (figura 4) e le proprietà fisico-chimiche delle reti risultanti sono indagati, al fine di verificare il potenziale funzionalità di questi sistemi come cellule o farmaci vettori.
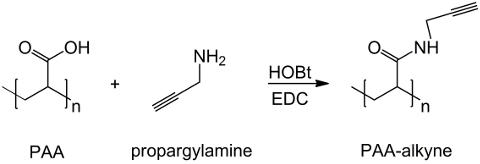
Figura 1: PAA modificato sintesi alkyne Uno schema di PAA funzionalizzazione con il gruppo alkyne;. "n" indica i monomeri con gruppo carbossilico reagendo con propargylamine. Clicca qui per vedereuna versione più grande di questa figura.

Figura 2:.. RGD-azide sintesi La sintesi di derivato RGD-azide Cliccate qui per vedere una versione più grande di questa figura.

Figura 3: Clicca reazione Schema di reazione click tra RGD-azide derivato e alchini-PAA.. Cliccate qui per vedere una versione più grande di questa figura.

Figura 4: Hydrogel SyntESI. RGD funzionalizzato procedura di sintesi idrogel. Cliccate qui per vedere una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Nota: Le sostanze chimiche sono utilizzate come ricevuto. Linear RGD è stato acquistato, ma può essere preparato in fase solida serie Fmoc peptide di sintesi 16,19. I solventi sono di grado analitico. La dialisi richiede l'uso di membrane con un M w pari a 3.500 Da cut-off. I composti sintetizzati sono caratterizzati da spettri 1 H NMR registrati su uno spettrometro 400 MHz usando cloroformio (CDCl 3) o ossido di deuterio (D 2 O) come solventi e spostamenti chimici sono riportati come valori δ in parti per milione. Inoltre, idrogel sono sottoposti ad analisi FT-IR con tecnica KBr pellet e la loro caratterizzazione fisica coinvolge studi gelificazione valutati utilizzando la provetta capovolta a 37 ° C.
1. Sintesi di 4-Azidobutanoyl Cloruro 1
- Sciogliere 500 mg di 4-azidobutanoic acido (3,90 mmol) in 10 ml di diclorometano e 0,5 ml di dimetilformamide.
- Raffreddare la soluzione a 0 ° C, Utilizzando un bagno di ghiaccio.
- Aggiungere 505 ml di cloruro di ossalile (5,85 mmol) a 5 ml di diclorometano e aggiungere lentamente goccia a goccia al sistema di reazione, sotto agitazione.
- Dopo 1 ora a 0 ° C utilizzando un bagno di ghiaccio, tornare a temperatura ambiente.
- Eliminare il solvente a pressione ridotta utilizzando un evaporatore rotante.
- Caratterizzare il prodotto ottenuto mediante spettroscopia 1 H-NMR, sciogliendo il campione in CDCl 3 16.
2. Sintesi di RGD-azide Derivata 2
- Sciogliere 50 mg di RGD (0,145 mmoli) in 1 ml di 1 M NaOH.
- Sciogliere 24 mg di 1 (0,16 mmol) in 2 ml di tetraidrofurano.
- Aggiungere tutta la soluzione RGD di soluzione 1 a gocce a 0 ° C utilizzando un bagno di ghiaccio.
- Ritorno a temperatura ambiente e mescolare durante la notte.
- Aggiungere 1 ml di 1 M HCl.
- Eliminare il solvente a pressione ridotta utilizzando un evaporatore rotante.
- Caratterizzare la OBTained prodotto 1 spettroscopia H-NMR, sciogliendo il campione in D 2 O 16.
3. PAA Acetilene Modifica 3
- Sciogliere 200 mg di 35% w / w soluzione PAA (2,8 mmol) in 15 ml di acqua distillata.
- Aggiungere 15.4 mg di propargylamine cloridrato (0.20 mmol).
- Disciogliere 42,8 mg di 1-idrossibenzotriazolo idrato (HOBt, 0,28 mmol) in 14 ml di una miscela 1: 1 v / v acetonitrile: soluzione acquosa, tramite riscaldamento a 50 ° C.
- Aggiungere tutta la soluzione HOBt alla soluzione di PAA a temperatura ambiente.
- Aggiungere 53,6 mg di ethyldimethylaminopropylcarbodiimide (EDC, 0,28 mmol) alla miscela di reazione.
- Utilizzare 1 M HCl per regolare il pH a 5,5 e agitare il sistema di reazione notte a temperatura ambiente.
- Dializzare la soluzione. Sciogliere 11.2 g di cloruro di sodio in 2 L di acqua distillata e aggiungere 0,2 ml di 37% w / w HCl. Dializzare la soluzione con una membrana con un M w cut-off di 3,5 kDa.
- Perfola dialisi rm per tre giorni. Cambiare la soluzione di dialisi quotidiana con 2 L di acqua distillata preparata di recente contenente 0,2 ml di 37% w / w HCl.
- Conservare la soluzione finale a -80 ° C. Lyophilize in un liofilizzatore secondo i protocolli del produttore.
- Caratterizzare il polimero funzionalizzato da 1 spettroscopia H-NMR, sciogliendo il campione in D 2 O 16.
4. Sintesi di PAA-RGD Polymer 4
- Sciogliere 78 mg di PAA modificato alkyne 3 (1.083 mmol) in 10 ml di acqua distillata.
- Disciogliere 25 mg del RGD azide 2 derivato (0,0722 mmoli) in 5 ml di tetraidrofurano.
- Aggiungere tutta la soluzione RGD alla soluzione polimerica.
- Aggiungere 2,2 mg di ioduro di rame (0,0116 mmoli) e 2,2 mg di ascorbato di sodio (0.0111 mmol).
- Riflusso la miscela risultante per una notte a 60 ° C, sotto agitazione.
- Raffreddare la miscela a 25 ° C.
- Dialyzvia e la soluzione. Sciogliere 11.2 g di cloruro di sodio in 2 L di acqua distillata e aggiungere 0,2 ml di 37% w / w HCl. Dializzare la soluzione con una membrana con un M w cut-off di 3,5 kDa.
- Eseguire dialisi per tre giorni. Cambiare la soluzione di dialisi quotidiana con 2 L di acqua distillata preparata di recente contenente 0,2 ml di 37% w / w HCl.
- Conservare la soluzione finale a -80 ° C. Lyophilize in un liofilizzatore secondo i protocolli del produttore.
- Caratterizzare il prodotto ottenuto mediante spettroscopia 1 H-NMR, sciogliendo il campione in D 2 O 16.
5. RGD-funzionalizzati idrogel Sintesi
- Preparare il PBS. Sciogliere 645 mg di sale PBS in 50 ml di acqua distillata.
- Miscela 40 mg di carbomer e 10 mg di PAA funzionalizzati 4 in 9 ml di PBS (passo 5.1), a temperatura ambiente, fino a dissoluzione completa (30 min).
- Aggiungere 400 mg di PEG alla soluzione e mantenere agitazione per 45 min.
- Fermare l'agitazione e consentire al sistema di accontentarsi di 30 min.
- Utilizzare 1 N NaOH per aggiustare il pH a 7,4.
- A 5 ml della miscela ottenuta, aggiungere 25 mg di polvere di agarosio.
- Irradiare il sistema con radiazione a microonde a 500 W fino a ebollizione, per un tempo generalmente compreso tra 30 secondi e 1 minuto ed elettromagneticamente riscaldare fino a 80 ° C.
- Lasciare la miscela esposto a temperatura ambiente fino alla temperatura scende a 50 ° C e aggiungere 5 ml di PBS (punto 5.1), in modo da ottenere una soluzione in un rapporto 1: 1 volumetrico.
- Preparare 12 piastra contenente cilindri di acciaio multipozzetto con un diametro di 1,1 cm.
- Prendere 500 microlitri aliquote dalla soluzione e metterle a ciascun cilindri in acciaio.
- Lasciare a riposo per 45 minuti fino a completa gelificazione del sistema.
- Rimuovere i cilindri con una pinza in acciaio inox per ottenere gli idrogel.
6. Caricamento di strumento terapeutico (Drug o cellule)
- ripetere steps 5,1-5,7.
- Quando il composto (già allo stato sol) raggiunge 37 ° C, aggiungere 5 ml della soluzione contenente la coltura soluzione medicinale o cella desiderato, al fine di ottenere un sistema finale in un rapporto 1: 1 volumetrico.
- Ripetere i passaggi 5,9-5,12 per ottenere reti polimerici con biocompounds intrappolate fisicamente all'interno del gel.
7. Hydrogel Caratterizzazione
- Analisi FT-IR
- Dopo formazione del gel, immergere uno degli idrogel sintetizzati in 2,5 ml di acqua distillata per 24 ore.
- Rimuovere i mezzi acquosi in cui è sommerso idrogel e congelare-secco con liquido N 2.
- Laminato campione idrogel secondo la tecnica pellet KBr.
- Aggiungere una spatola piena di KBr in un mortaio di agata. Prendere una piccola quantità di campione idrogel (circa 0,1-2% dell'importo KBr, o appena sufficiente a coprire la punta di spatola) e mescolare con la polvere KBr.
- Macinare il composto fino a quando la polvere è fine ed omogenea.
- Utilizzare il kit di pellet di KBr per formare il pellet IR. Pressare la polvere utilizzando una pressa da laboratorio manuale: per 3 min a capacità di pressione pari a 5 tonnellate e poi per 3 min a capacità di pressione di 10 tonnellate.
- Rilasciare la pressione per ottenere il pellet finale omogeneo e trasparente in apparenza. Inserire il pellet nel supporto del campione IR ed eseguire lo spettro 16.
- Studi gelificazione
- Riempire provetta 2 ml con 900 ml di PBS ed equilibrare a 37 ° C.
- Aggiungere 100 microlitri della soluzione polimerica preparata per formare l'idrogel e incubare a 37 ° C.
- Capovolgere la provetta e osservare se il gel fluisce a 1, 2, 5, 10 e 20 min. Registrare il momento in cui il gel non scorre come il tempo di gelificazione.
Access restricted. Please log in or start a trial to view this content.
Risultati
Il derivato PAA alchino viene efficacemente sintetizzato da acido poliacrilico e propargylamine, come mostrato in Figura 1 dove n etichette monomeri i cui gruppi carbossilici reagire con l'ammina. L'identità del prodotto è confermata mediante spettroscopia 1 H-NMR. La Figura 5 mostra la 1 H-NMR Spettro di PAA modificato con triplo legame.
Access restricted. Please log in or start a trial to view this content.
Discussione
The PAA post-polymerization modification with alkyne moieties and the RGD functionalization with the azide group guarantee the formation of a stable bond between the polymer and the peptide. Indeed, triazole serves as a rigid linking unit among the carbon atoms, attached to the 1,4 positions of the 1,2,3-triazole ring and it cannot be cleaved hydrolytically or otherwise. In addition, triazole is extremely difficult to oxidize and reduce, unlike other cyclic structures such as benzenoids and related aromatic heterocycles<...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
The authors state no conflict of interest and they have not received any payment in preparation of this manuscript.
Riconoscimenti
Gli autori desiderano ringraziare il Prof. Maurizio Masi per la discussione proficua e Miss Chiara Allegretti per la modifica della lingua. Autori 'è supportata dal Bando Giovani Ricercatori 2010 (Ministero della Salute GR-2010- 2.312.573).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Poly(acrylic acid) solution average Mw ~100,000, 35 wt% in H2O | Sigma Aldrich | 523925 | CAS 9003-01-4 |
| Poly(ethylene glycol) 2,000 | Sigma Aldrich | 84797 | CAS 25322-68-3 |
| Carbomeer 974P | Fagron | 1387083 | |
| Agarose | Invitrogen Corp. | 16500-500 | UltraPure Agarose |
| RGD peptide | abcam | ab142698 | |
| 4-azidobutanoic acid | Aurum Pharmatech | Z-2421 | CAS 54447-68-6 |
| Oxalyl chloride | Sigma Aldrich | O8801 | CAS 79-37-8 |
| Propargylamine hydrochloride 95% | Sigma Aldrich | P50919 | CAS 15430-52-1 |
| Copper(I) iodide | Sigma Aldrich | 3140 | CAS 7681-65-4 |
| Sodium ascorbate | Sigma Aldrich | Y0000039 | CAS 134-03-2 |
| Phosphate buffered saline | Sigma Aldrich | P4417 | |
| Dialysis Membrane | Spectrum Laboratories, Inc. | 132725 | Spectra/Por 3 Dialysis Membrane Standard RC Tubing MWCO: 3.5 kD |
Riferimenti
- Slaughter, B. V., Khurshid, S. S., Fisher, O. Z., Khademhosseini, A., Peppas, N. A. Hydrogels in Regenerative Medicine. Adv. Mater. 21 (32-33), 3307-3329 (2009).
- Rossi, F., Perale, G., Papa, S., Forloni, G., Veglianese, P. Current options for drug delivery to the spinal cord. Expert Opin. Drug Deliv. 10 (3), 385-396 (2013).
- Huebsch, N., et al. Harnessing traction-mediated manipulation of the cell/matrix interface to control stem-cell fate. Nat. Mater. 9 (6), 518-526 (2010).
- Mothe, A. J., Tam, R. Y., Zahir, T., Tator, C. H., Shoichet, M. S. Repair of the injured spinal cord by transplantation of neural stem cells in a hyaluronan-based hydrogel. Biomaterials. 34 (15), 3775-3783 (2013).
- Khetan, S., et al. Degradation-mediated cellular traction directs stem cell fate in covalently crosslinked three-dimensional hydrogels. Nat. Mater. 12 (5), 458-465 (2013).
- Ashley, G. W., Henise, J., Reid, R., Santi, D. V. Hydrogel drug delivery system with predictable and tunable drug release and degradation rates. Proc. Natl. Acad. Sci. U S A. 110 (6), 2318-2323 (2013).
- Rossi, F., van Griensven, M. Polymer Functionalization as a Powerful Tool to Improve Scaffold Performances. Tissue Eng. Part A. 20 (15-16), 2043-2051 (2014).
- Gould, S. T., Darling, N. J., Anseth, K. S. Small peptide functionalized thiol-ene hydrogels as culture substrates for understanding valvular interstitial cell activation and de novo tissue deposition. Acta Biomater. 8 (9), 3201-3209 (2012).
- Azagarsamy, M. A., Anseth, K. S. Wavelength-Controlled Photocleavage for the Orthogonal and Sequential Release of Multiple Proteins. Angew. Chem. Int. Edit. 52 (51), 13803-13807 (2013).
- Larrañeta, E., et al. Microwave-Assisted Preparation of Hydrogel-Forming Microneedle Arrays for Transdermal Drug Delivery Applications. Macromol. Mater. Eng. 300 (6), 586-595 (2015).
- Cook, J. P., Goodall, G. W., Khutoryanskaya, O. V., Khutoryanskiy, V. V. Microwave-Assisted Hydrogel Synthesis: A New Method for Crosslinking Polymers in Aqueous Solutions. Macromol. Rapid Comm. 33 (4), 332-336 (2012).
- Perale, G., et al. Multiple drug delivery hydrogel system for spinal cord injury repair strategies. J. Control. Release. 159 (2), 271-280 (2012).
- Rossi, F., Perale, G., Storti, G., Masi, M. A Library of Tunable Agarose Carbomer-Based Hydrogels for Tissue Engineering Applications: The Role of Cross-Linkers. J. Appl. Polym. Sci. 123 (4), 2211-2221 (2012).
- Frith, J. E., et al. An injectable hydrogel incorporating mesenchymal precursor cells and pentosan polysulphate for intervertebral disc regeneration. Biomaterials. 34 (37), 9430-9440 (2013).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click chemistry: Diverse chemical function from a few good reactions. Angew. Chem. Int. Edit. 40 (11), (2001).
- Sacchetti, A., Mauri, E., Sani, M., Masi, M., Rossi, F. Microwave-assisted synthesis and click chemistry as simple and efficient strategy for RGD functionalized hydrogels. Tetrahedron Lett. 55 (50), 6817-6820 (2014).
- Ossipov, D. A., Hilborn, J. Poly(vinyl alcohol)-based hydrogels formed by "click chemistry". Macromolecules. 39 (5), 1709-1718 (2006).
- Truong, V., Blakey, I., Whittaker, A. K. Hydrophilic and Amphiphilic Polyethylene Glycol-Based Hydrogels with Tunable Degradability Prepared by "Click" Chemistry. Biomacromolecules. 13 (12), 4012-4021 (2012).
- Hou, R. Z., et al. New synthetic route for RGD tripeptide. Prep. Biochem. Biotechnol. 36 (3), 243-252 (2006).
- Rossi, F., Chatzistavrou, X., Perale, G., Boccaccini, A. R. Synthesis and Degradation of Agar-Carbomer Based Hydrogels for Tissue Engineering Applications. J. Appl. Polym. Sci. 123 (1), 398-408 (2012).
- Mauri, E., Rossi, F., Sacchetti, A. Tunable drug delivery using chemoselective functionalization of hydrogels. Mater. Sci. Eng. C. 61, 851-857 (2016).
- Joaquin, A., Peppas, N. A., Zoldan, J. Hydrogel Polymer Library for Developing Induced Pluripotent Stem Cell Derived Cardiac Patches. Tissue Eng. Part A. 20, S55-S55 (2014).
- Rossi, F., et al. Tunable hydrogel-Nanoparticles release system for sustained combination therapies in the spinal cord. Colloids Surf. B Biointerfaces. 108, 169-177 (2013).
- Kolb, H. C., Sharpless, K. B. The growing impact of click chemistry on drug discovery. Drug Discov. Today. 8 (24), 1128-1137 (2003).
- Ossipov, D. A., Yang, X., Varghese, O., Kootala, S., Hilborn, J. Modular approach to functional hyaluronic acid hydrogels using orthogonal chemical reactions. Chem. Commun. 46 (44), 8368-8370 (2010).
- Anderson, S. B., Lin, C. C., Kuntzler, D. V., Anseth, K. S. The performance of human mesenchymal stem cells encapsulated in cell-degradable polymer-peptide hydrogels. Biomaterials. 32 (14), 3564-3574 (2011).
- Caron, I., et al. A new three dimensional biomimetic hydrogel to deliver factors secreted by human mesenchymal stem cells in spinal cord injury. Biomaterials. 75, 135-147 (2016).
- Lee, J. W., Kim, H., Lee, K. Y. Effect of spacer arm length between adhesion ligand and alginate hydrogel on stem cell differentiation. Carbohyd. Polym. 139, 82-89 (2016).
- Liu, Y., Fan, Z., Wang, Y., Yu, L. Controlled Release of Low Molecular Protein Insulin-like Growth Factor-1 through Self-Assembling Peptide Hydrogel with Biotin Sandwich Approach. J.Biomed. Eng. 32 (2), 387-392 (2015).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon