Method Article
Attivazione delle cellule Lo stress e la morte con i convenzionali UV laser Microscopia confocale
In questo articolo
Riepilogo
Targeted manipulations to cause directed stress or death in individual cells have been relatively difficult to accomplish. Here, a single-cell-resolution ablation approach to selectively stress and kill individual cells in cell culture and living animals is described based on a standard confocal UV laser.
Abstract
Using a standard confocal setup, a UV ablation method can be utilized to selectively induce cellular injury and to visualize single-cell responses and cell-cell interactions in the CNS in real-time. Previously, studying these cell-specific responses after injury often required complicated setups or the transfer of cells or animals into different, non-physiological environments, confounding immediate and short-term analysis. For example, drug-mediated ablation approaches often lack the specificity that is required to study single-cell responses and immediate cell-cell interactions. Similarly, while high-power pulsed laser ablation approaches provide very good control and tissue penetration, they require specialized equipment that can complicate real-time visualization of cellular responses. The refined UV laser ablation approach described here allows researchers to stress or kill an individual cell in a dose- and time-dependent manner using a conventional confocal microscope equipped with a 405-nm laser. The method was applied to selectively ablate a single neuron within a dense network of surrounding cells in the zebrafish spinal cord. This approach revealed a dose-dependent response of the ablated neurons, causing the fragmentation of cellular bodies and anterograde degeneration along the axon within minutes to hours. This method allows researchers to study the fate of an individual dying cell and, importantly, the instant response of cells-such as microglia and astrocytes-surrounding the ablation site.
Introduzione
Microscopia a fluorescenza è stato a lungo utilizzato per studiare gli effetti dei transgeni nel zebrafish sistema nervoso centrale, in particolare i loro effetti sullo sviluppo 1. -Microscopia ad alta risoluzione ha permesso una mappatura dettagliata dei processi cellulari coinvolti nello sviluppo del cervello, la generazione del muscolo, e molti altri eventi di sviluppo 2. Studiando la morte di una singola cella è stato più impegnativo, soprattutto a causa delle difficoltà tecniche di indurre la morte delle cellule selettivo durante le procedure di imaging standard. Tuttavia, la combinazione delle immagini risoluzione singola cellula e tecniche di ablazione altamente mirati permette la ricerca di risposte cellulari immediate allo stress e lesioni, nonché delle interazioni cellula-cellula conseguenti. La comprensione di questi processi è critica, soprattutto per le malattie neurodegenerative come il morbo motoneurone (MND), dove è stato dimostrato interazioni neuroni-glia di contribuire alla progressionedella malattia 3.
MND, o la sclerosi laterale amiotrofica (SLA), è una malattia neurodegenerativa devastante che colpisce i neuroni motori nel tronco encefalico, corteccia motoria, e nel midollo spinale. La perdita di questi neuroni porta alla perdita di massa muscolare, ed i pazienti muoiono entro 3 - 5 anni dalla diagnosi 4. motoneuroni del midollo spinale collegamento alle fibre muscolari e svolgono un ruolo essenziale nel facilitare la contrazione muscolare. La mancata comunicazione di questo o di morte di questi neuroni indebolisce progressivamente i muscoli e colpisce la capacità del paziente di deglutire, camminare, parlare e respirare. Visualizzare la morte di un neurone motore e le conseguenze a breve termine in un animale vivente offre un'eccellente opportunità per comprendere meglio i processi dinamici coinvolti nella normale omeostasi cellulare e la malattia.
Zebrafish sono emerse come un sistema modello interessante per studiare le malattie neurodegenerative 1. Questoè dovuto ai vantaggi offerti da questo organismo modello, come la fecondazione esterna, breve tempo di sviluppo, accesso ottico al sistema nervoso, e facilità di transgenesi. Inoltre, la capacità di generare facilmente composto zebrafish transgenico consente molteplici strategie di etichettatura di diversi tipi cellulari. Ablazione genetica si avvicina per uccidere specifici tipi cellulari permettono piuttosto ampia disturbo, ma non hanno la multa di controllo di colpire singole celle 5. tecniche laser assistita, invece, forniscono controllo fine temporale e spaziale e sono stati utilizzati per diversi modelli animali. Mentre la maggior parte approcci utilizzare attrezzature specializzate, come i laser 6, 7, 8, 9, 10, 11, 12 o due fotoni set-up 13 pulsata, altrogruppi di ricerca hanno recentemente approfittato di un laser UV nei microscopi confocale convenzionali 14.
La tecnica qui descritta combina alta risoluzione microscopia confocale con un approccio laser-mediata UV per provocare stress cellulare o morte in maniera dose-dipendente motoneuroni selezionati. Esso si basa sull'utilizzo del laser 405 nm comunemente installato, è stato testato con successo in coltura cellulare e in animali viventi, e permette la caratterizzazione dettagliata di interazioni cellulari, quali incidenza microglia dopo la morte neuronale.
Protocollo
NOTA: Design, condotta, e la segnalazione di esperimenti sugli animali devono tener conto degli orientamenti attuali 15. Tale lavoro deve essere preventivamente approvato dalle autorità locali il benessere degli animali (nel nostro caso, il comitato etico degli animali di Macquarie University).
1. Preparare il Zebrafish per il montaggio e UV cellulare ablazione
- Genera zebrafish (Danio rerio) che esprime proteine fluorescenti.
- Per esprimere proteine fluorescenti di interesse in zebrafish, eseguire le iniezioni plasmide nella fase una cella dell'uovo pesce zebra (come descritto altrove 16) o utilizzare linee transgeniche fluorescenti. Per etichettare più tipi di cellule, creare composti linee di zebrafish transgenico attraversando linee transgeniche stabiliti pertinenti alla questione di interesse. Inserire un maschio e una femmina zebrafish su ciascun lato di una coppia tank doppio fondo accoppiamento la sera e rimuovere il divisore con l'inizio della luceLa mattina successiva (come descritto altrove 17). Mantenere il pesce zebra a 28 ° C e gestirli secondo i protocolli stabiliti 17, 18.
- Raccogliere gli embrioni dopo la deposizione di successo da sforzare l'acqua della vasca contenente gli embrioni attraverso un colino da tè di plastica. Lavare le uova con l'acqua del sistema e trasferirli in acqua uovo in una capsula di Petri.
- li esaminare al microscopio ottico per determinare la fecondazione. Conservare uova fecondate in una capsula di Petri e metterli in un incubatore a 28 ° C 18.
- Opzionale: Eseguire un microiniezione per etichettare specifiche popolazioni cellulari.
NOTA: Questo è un metodo alternativo che permette l'espressione e la visualizzazione di proteine, senza la necessità di aumentare linee transgeniche stabili. Questo metodo è anche vantaggioso quando la proteina di interesse è tossico e vieta la generazione di un trans stabilelinee geniche.- Iniettare i costrutti plasmidici nella fase una cella di embrioni zebrafish, come descritto altrove 19, 20, 21.
NOTA: Questo metodo risulta nell'espressione mosaico della proteina di interesse. La proteina di interesse è guidata da un promotore di scelta (ad esempio, islet1 22, -3mnx1 23, 24, 25 incontrato o MPEG1 26) affiancato da Tol2 invertito ripetizioni 20.
- Iniettare i costrutti plasmidici nella fase una cella di embrioni zebrafish, come descritto altrove 19, 20, 21.
- Åge il pesce alla dimensione desiderata.
- Sollevare il pesce per 3-5 giorni dopo la fecondazione (DPF) e metterli sotto un microscopio composto fluorescente. Schermo gli animali di espressione fluoroforo appropriata e selezionare il pesce brillantemente etichettato. Separare le larve appropriata in un altro piatto con acqua uovo per l'incorporamento in ritardoR (conservare in 28 ° C incubatore).
Opzionali: embrioni possono essere inseriti in un 0,2 mM 1-fenil-2-thioures soluzione (PTU) Ringers a 24 ore dopo la fecondazione (HPF) per inibire la formazione di pigmentazione. La cura deve essere presa con PTU, in quanto è tossico e può avere fisiologici negativi, genetica, o gli effetti morfologici. - Per gli studi in una fase di sviluppo precoce (<2 DPF), dechorionate gli embrioni utilizzando manualmente pinze taglienti. Dechorionate gran numero di embrioni enzimaticamente aggiungendo pronase (2 mg / mL) all'acqua uovo e li incubando per 10 min a 28 ° C.
- Passare gli embrioni periodicamente attraverso una pipetta Pasteur di plastica per facilitare dechorionation. Terminare il processo quando la maggior parte degli embrioni sono emersi dai loro chorions lavando più volte con acqua uovo.
- Sollevare il pesce per 3-5 giorni dopo la fecondazione (DPF) e metterli sotto un microscopio composto fluorescente. Schermo gli animali di espressione fluoroforo appropriata e selezionare il pesce brillantemente etichettato. Separare le larve appropriata in un altro piatto con acqua uovo per l'incorporamento in ritardoR (conservare in 28 ° C incubatore).
- Preparare le soluzioni per l'incorporamento zebrafish in agarosio.
- Preparare una soluzione di anestesia con l'aggiunta di 4 g / L MS222 (soluzione tricaine, pH 7,0)goccia a goccia ad una piastra di Petri contenente acqua uovo. Una dose di 50 mg / L è un punto di partenza consigliato (Figura 1A).
- Preparare uno stock di basso punto di fusione agarosio (0,8-1,5%) in acqua uovo e aliquota in provette da microcentrifuga da 1,5 ml. Inserire una aliquota in un blocco di calore pre-riscaldato (38 - 40 ° C) e lasciare equilibrare alla temperatura impostata (~ 30 min; Figura 1B).
- Opzionale: Per l'imaging a lungo termine (> 4 h), preparare un piccolo cerchio agarosio all'interno della 35 mm piastra di Petri con fondo di vetro e permettono di impostare (Figura supplementare 1).
NOTA: Questo passo ulteriore è stato efficace nell'evitare qualsiasi movimento di tutta la goccia di agarosio con il pesce zebra un lasso di tempo più lunghi.- Per fare ciò, posto ~ 300 ml di agarosio lungo il cerchio interno del piatto fondo di vetro per preparare un cerchio a forma di ciambella con una piccola apertura al centro in cui collocare il pesce (fase 1.5.3; supplementare figura 1) .
- Montare il pesce zebra in agarosio per la microscopia.
- Selezionare 1 - 3 del pesce pre-screening per l'ablazione e anestetizzare le larve tramite trasferimento (utilizzando una pipetta di trasferimento) in un piatto con la soluzione anestesia (passo 1.4.1; la figura 1C, circa 5 min).
NOTA: I pesci sono anestetizzati quando mostrano un movimento opercolare superficiale e una diminuzione della frequenza cardiaca e visualizzare non più di una risposta di fuga touch-evocato (TEER, pena di nuotare via dopo delicatamente toccare la coda a pennello). Garantire l'anestesia appropriata per il trattamento etico dei pesci e per evitare spasmi al momento del trasferimento in agarosio o l'esposizione a luce fluorescente. - Dopo l'anestesia è confermato, succhiare una larva utilizzando una pipetta regolabile (con un cut-off di 200 microlitri punta impostato a ~ 30 mL) e lasciare che si depositano sul fondo della punta. Trasferire la larva in agarosio preriscaldato (fase 1.4.2) rilasciando una goccia del liquido con illarva in agarosio (cercare di minimizzare la quantità di acqua uovo entrare in agarosio; Figura 1D).
- Aspirare il pesce circondato da agarosio. Distribuire rapidamente nel piatto precedentemente preparato fondo di vetro da 35 mm.
- Utilizzare un microscopio dissezione e un pennello standard (di linea lunga, formato 1) per posizionare l'animale all'interno del agarosio sul lato (testa a sinistra) in modo che il corpo e la coda sono piatte (Figura 1E). Se si lavora con pesce multipla, allineare tutti i pesci nel piatto in modo che siano facilmente individuati dalla microscopio confocale seguito.
NOTA: eseguire rapidamente questa procedura di posizionamento e allineamento (si può richiedere una certa pratica, come l'agarosio inizia la presa immediatamente dopo l'esposizione a temperature più fredde). - Lasciare il pesce agarosio-embedded per 10 - 15 minuti fino a quando l'agarosio è impostato saldamente. Top con cautela il 35 mm piastra di Petri con ~ 2 ml di acqua contenente uova tricaine (Figura 1F).
- Selezionare 1 - 3 del pesce pre-screening per l'ablazione e anestetizzare le larve tramite trasferimento (utilizzando una pipetta di trasferimento) in un piatto con la soluzione anestesia (passo 1.4.1; la figura 1C, circa 5 min).
2. Impostare il microscopio confocale e imaging Parametri
- Porre la capsula di Petri con la larva incorporato sul palco microscopio confocale e concentrarsi sul lato dorsale del midollo spinale degli animali (con campo chiaro). Esaminare l'animale sotto l'ingrandimento appropriata (40X) e l'impostazione fluorescenti e visualizzare la struttura di interesse (ad esempio, intensità di fluorescenza dei neuroni marcati o movimenti della microglia) per confermare che tutti i parametri di imaging sono come necessario per la successiva ablazione (Figura 2). Noi abitualmente utilizziamo l'obiettivo 40X per eseguire i nostri studi lasso di tempo.
- Opzionale: Per eseguire uno studio time-lapse per diverse ore, si consiglia di registrare un singolo o pochi punti temporali prima di ablazione per stabilire la risposta fisiologica imperturbato della cellula e l'ambiente (ad esempio, il movimento della microglia stabilire velocità basale e la motilità).
- Determinare lo spessore della structure di interesse per l'ablazione laser UV.
- Utilizzando la z-drive, verificare la parte superiore e inferiore della struttura di interesse (ad esempio, il soma cella) concentrandosi manualmente su e giù. Si annota il piano z che saranno ablazione (ad esempio, il centro della cella).
NOTA: Per esperienza, questo metodo è più efficace di mira neuroni del midollo spinale che sono stati brillantemente etichettati (un alto rapporto segnale-rumore che permette una facile visualizzazione temporizzata dopo l'ablazione, ad esempio, figura 4) e ablazione mezzo della soma cellulare. Cellulare nucleo di fluorescenza può essere di vantaggio per assicurare una corretta targeting e ad alta efficienza l'ablazione.
- Utilizzando la z-drive, verificare la parte superiore e inferiore della struttura di interesse (ad esempio, il soma cella) concentrandosi manualmente su e giù. Si annota il piano z che saranno ablazione (ad esempio, il centro della cella).
3. Eseguire mirato Laser Ablation di celle singole nel midollo spinale Zebrafish
NOTA: per questo approccio di ablazione e visualizzazione, è stato usato un microscopio confocale (Leica SP5). La procedura di ablazione mediante un diodo 405 nm per dest cellule-specificheruction è dettagliato in base al software (Leica Application Suite, v2.7.3.9723). Tuttavia, qualsiasi microscopio confocale convenzionale che è dotato di un laser 405 nm e un FRAP (recupero di fluorescenza dopo photobleaching) o modulo candeggina consentire l'effettuazione delle stesse manipolazioni cellulari, ma potenzialmente con impostazioni leggermente diverse, i parametri e nomi.
- Avviare la procedura guidata FRAP facendo clic sul menu a discesa nella parte superiore del menu del software (Figura 3A, 1 e 2). Osservare una nuova finestra con diversi passaggi che permette la messa a punto dei parametri specifici per l'ablazione laser (Figura 3B, 3).
- Determinare i parametri dell'immagine per l'approccio di ablazione selezionando il formato, velocità di scansione (Figura 3B, 4), e media (Figura 3B, 5). Un formato immagine di 1.024 x 1.024 ad una velocità di scansione di 400 Hz e una lineamedia di 4 era più applicabile.
NOTA: Non vi è alcuna necessità di cambiare il rilevamento spettrale (ad esempio i parametri dell'eccitazione o emissione), così come sono stati determinati nel precedente acquisizione.- Se non è già stato selezionato il piano z per l'ablazione (come descritto nel passaggio 2.4.), Premere il tasto "Live" e mettere a fuoco attraverso il campione fino alla fluorescente struttura o piano z desiderato che sta per essere ablated è messo a fuoco.
- Una volta impostati i parametri dell'immagine generale, l'accesso alla fase "Bleach" (Figura 3C, 6) per controllare i componenti di ablazione specifici.
NOTA: Una combinazione di intensità del laser (Figura 3C, 8), la velocità di scansione, e la media che è stato impostato nel passo 3.2 (Figura 3B, 4 e 5), nonché il numero di ripetizioni che sarà fissato nelle passo 3.5 (Figura 3E,12), determina il tempo di permanenza complessivo della laser UV al ROI, e quindi, l'efficienza sbianca.- Inserire il laser 405 nm attivando per la procedura di sbianca (Figura 3C, 8).
NOTA: La maggior parte successo con le impostazioni di cui sopra è stato raggiunto con intensità laser 405 nm tra il 60 - 80% nel nostro apparato sperimentale. Essere consapevoli del fatto che questa potenza del laser è specifico strumento e sarà diverso per ogni configurazione confocale. - Utilizzare la "zoom in" opzione (Figura 3C, 7) per massimizzare l'intensità sbiancante al ROI selezionata riducendo il campo di scansione, quindi ottimizzando tempo di sosta. In alternativa, utilizzare l'opzione "punto Bleach" del software di scelta per questo processo.
- Inserire il laser 405 nm attivando per la procedura di sbianca (Figura 3C, 8).
- Selezionare una o più ROI (Figura 3D, 10) per l'ablazione utilizzando uno qualsiasi degli strumenti di disegno nel vento di acquisizione delle immaginiOW (Figura 3D, 9). Obiettivo poggio assone, per esempio, con lo strumento di disegno circolare di circa 4 - 8 micron.
NOTA: La zona di ablazione è regolabile da un singolo pixel in un'area più ampia, a seconda dell'applicazione. - Dopo aver stabilito il ROI, selezionare il pulsante "Time Course" (Figura 3E, 11) e confermare il numero di cicli del ROI sarà scansito / ablazione (Figura 3E, 12). Scegliere il "Pre-Bleach" e cornici "post-Bleach", se lo desideri per consentire una visione d'insieme dell'intera immagine appena prima e subito dopo il processo di sbiancamento.
- Dopo aver stabilito tutti i parametri di ablazione necessario, premere "Run Experiment" (Figura 3E, 13) e monitorare l'efficienza della ablazione.
NOTA: Nel nostro setup FRAP, una singola immagine verrà presa prima e dopo il ciclo FRAP con il laser appropriata excitation (ad esempio, 488 nm di eccitazione per le cellule EGFP che esprimono). Queste immagini pre e post-ablazione consentono un rapido giudizio di come soddisfacente ROI è stato sbiancato e l'efficacia dei parametri di ablazione scelti erano. - Ripetere la procedura regolando l'intensità del laser (Figura 3C, 8), velocità di scansione e media (Figura 3B, 4 e 5), e le ripetizioni (Figura 3E, 12) nel caso della ROI selezionata mostra ancora alta intensità di fluorescenza dopo il completamento della ciclo FRAP.
4. Eseguire la procedura di follow-up, tra cui pesce "Rescue" o lo smaltimento
- Se l'esperimento è il morsetto, eutanasia l'animale con una overdose di tricaine. Rimuovere l'acqua uovo e sostituirlo con soluzione di riserva anestesia per 10 min. Per garantire l'eutanasia, controllare sotto il microscopio per la cessazione del battito cardiaco.
- Opzionale:Se l'esperimento non è il morsetto, togliere il pesce con attenzione di agarosio con pinza sottile e un pennello. Mettere il pesce in acqua fresca all'uovo e permettono di recuperare sotto osservazione per 15 min. Se il normale comportamento di nuoto torna, restituire il pesce per l'incubatore.
- Smaltire animali transgenici in base al flusso di rifiuti OGM approvato dell'istituzione.
Risultati
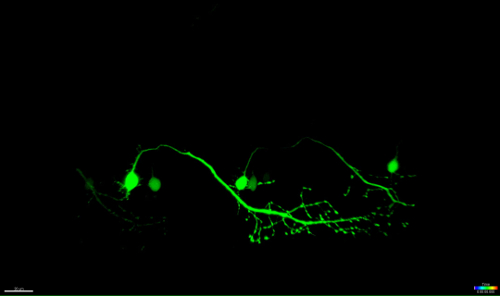
Il metodo qui descritto permette l'ablazione dei motoneuroni nel midollo spinale zebrafish utilizzando il modulo FRAP di un microscopio confocale commerciale. Linee di zebrafish transgenici che esprimono una proteina fluorescente verde nei neuroni sotto il controllo di promotori specifici, come - 3mnx1, islet1, o incontrato, sono stati utilizzati. L'espressione di GFP guidata dal promotore del motoneurone (come -3mnx1 o incontrato) permette la visualizzazione ad alta risoluzione dei corpi cellulari, le principali assoni e rami periferici estendono ai muscoli (Figura 4 e video 1).
I neuroni nel midollo spinale di 3 a 5 giorni di età pesci sono stati ablazione con successo, con un tempo di permanenza complessiva di 60 - 80 s ad una potenza laser di ~ 70% e le impostazioni generali descritto al punto 3. l'ablazione di successo è raggiunto quando la fluorescenza svanisce subito dopo l'ablazionee mai riprende (Figura 5, C e D). I tentativi di ablazione con altre linee laser (come ad esempio la linea laser 488 nm) non hanno comportato sbiadimento permanente, e la fluorescenza è stata ripristinata in tempi brevi. È importante sottolineare che questa tecnica ha dimostrato caratteristiche di apoptosi nei neuroni UV-ablazione, come ad esempio la presenza di annessina V, cambiamenti morfologici consistenti di Somal degenerazione e blebbing assonale del neurone ablato 27.
La specificità di questo approccio è confermato negli esperimenti utilizzando il fluoroforo fotoconvertibile Kaede (che passa la sua emissione da verde a rosso dopo l'esposizione ai raggi UV), dove è stato convertito un singolo neurone bersaglio (Figura 5, A e B) senza segni di cellulari distruzione per diverse ore. L'utilizzo di un laser di potenza superiore porta invece to estinzione del neurone bersaglio (senza fotoconversione o ricomparsa della fluorescenza) e fotoconversione (senza morte) delle cellule in prossimità (~ 20 micron) al sito di ablazione (Figura 5, C e D).
Un importante vantaggio di questa tecnica di ablazione laser-indotta è la dipendenza dose di approccio. Per indirizzare cellule con diverse intensità, strati multipli di messa a punto sono disponibili regolando la potenza del laser (Figura 3C, 8), la velocità di scansione e la linea media (Figura 3B, 4 e 5), la dimensione della ROI da ablazione (Figura 3D, 10), e le ripetizioni (Figura 3E, 12). In particolare, questo approccio può essere utilizzato anche per applicare stress cellulare celle individuali invece di indurre la morte cellulare. Ad esempio, la messa a punto è statamolto prezioso per valutare i processi cellulari durante la morte di un neurone. Motoneuroni con lunghe proiezioni assonale che sono stati ablated con intensità laser inferiori UV rivelato caratteristica "blebbing" (la formazione e la frammentazione delle vescicole cellulari), che ha avuto inizio alla soma mirato e continuato lungo l'assone nel corso del tempo (40 - 90 min; Figura 4 ; 3D rendering di film di questo ablazione in Video 1). Di conseguenza, modulando i diversi parametri di ablazione laser e quindi il livello di stress cellulare indotto sul decorso della morte permette ai ricercatori un elevato livello di flessibilità sperimentale.
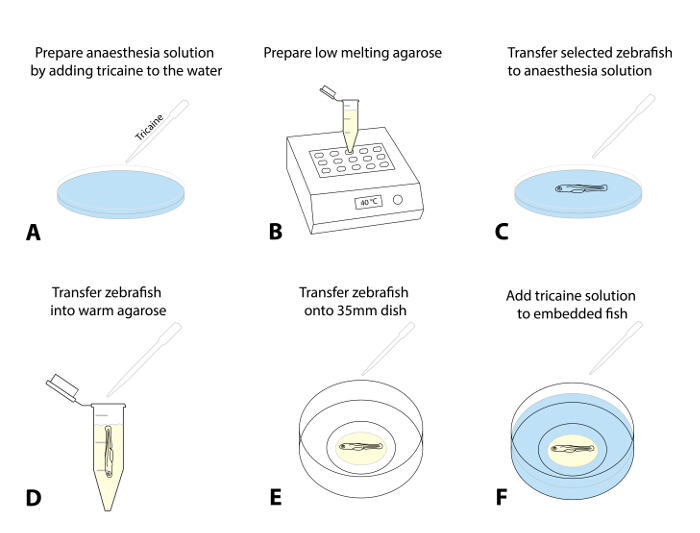
Figura 1: Embedding di zebrafish per l'imaging dal vivo. (AF) Incorporare procedura per l'imaging dal vivo: (A) Tricaine viene aggiunto all'acqua uovo per anestetizzare il pesce zebra un ta dose iniziale di 50 mg / L. (B) a bassa fusione agarosio (0,8 specificato - 1,5%) viene preparato e riscaldato a 38 - 40 ° C. (C) Usando una pipetta di trasferimento, il pesce zebra esaminati e selezionati vengono trasferiti in un piatto con la soluzione tricaine. Dopo la sedazione con successo (il movimento opercolare superficiale, diminuzione della frequenza cardiaca, la mancanza di una risposta al tocco evocata), un pesce viene trasferito nel agarosio preriscaldato (D). Minimizzare la quantità di acqua di uovo che è trasferito nel agarosio per impedire successiva diluizione. (E) trasferimento di una goccia di agarosio (~ 30 - 50 mL) contenente il pesce zebra su un piatto fondo di vetro da 35 mm. Eseguire questo sotto un microscopio dissezione e utilizzare un pennello per allineare delicatamente il zebrafish al suo orientamento preferenziale. Attendere 10 - 15 minuti, fino a quando l'agarosio è impostato, e aggiungere ~ 2 ml di soluzione tricaine al piatto (F).ank "> Clicca qui per vedere una versione più grande di questa figura.
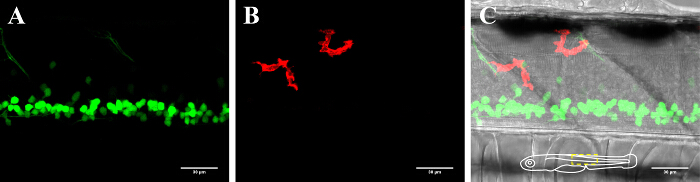
Figura 2: Visualizzazione dei neuroni e microglia nel midollo spinale di un zebrafish 3 dpf. Visualizzazione della microglia e neuroni nel midollo spinale di un 3-day-old zebrafish transgenico che esprime (A) neuroni GFP-positive (islet1: GFP) e (B) mCherry-positivo microglia (MPEG1: GAL4, UAS: mCherry). (C) Immagine composita di canale neurone e microglia l'immagine in campo chiaro insieme. L'inserto schema in (C) illustra l'orientamento del pesce e delinea l'area presentato. Barra di scala = 30 micron. Clicca qui per vedere una versione più grande di questa figura.

Figura 3: Passi nel processo di ablazione laser UV (come descritto nel protocollo, fase 3). Misure per controllare il modulo software FRAP nel software confocale (Leica Application Suite). (A) Avviare il modulo FRAP come strumento per eseguire l'ablazione laser UV. (B) Impostazione del piano z per le impostazioni di ablazione e altri FRAP come formato, la velocità e media, che determineranno il tempo di permanenza del laser. (C) Il controllo intensità del laser e la "zoom in" per massimizzare l'efficienza sbiancamento. (D) Selezione di una o più regioni di interesse (ROI) che verrà ablazione. (E) Impostazione il decorso temporale di sbiancamento determina i cicli di lavaggio e il tempo complessivo di sosta laser sul ROI. Si prega di cliccare il suo e per vedere una versione più grande di questa figura.
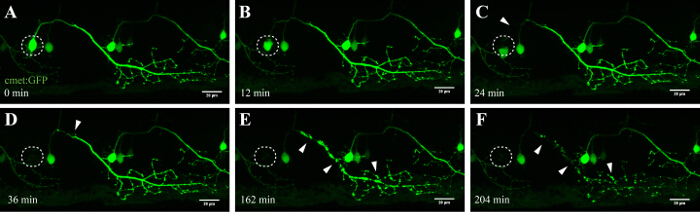
Figura 4: degenerazione Anterograde di un neurone UV-ablazione. time-lapse imaging della neurodegenerazione di un neurone spinale UV-ablazione. (AF) UV-irradiazione di un singolo neurone spinale (incontrato: GAL4, UAS: EGFP; A; cerchio) ha provocato la soma del neurone contrazione e arrotondamento nel tempo (AC), seguita da assonale frammentazione (CF; punte di freccia) . La degenerazione assonale iniziata alla soma (sito di ablazione) e progredito anterograda verso l'estremità distale del assone finché, la fluorescenza nel soma scomparve e l'intero assone mostrato "blebbing" (DF). Barre di scala = 20 micron. Il time-lapse film in 3D-rendering di questo ablazione è mostrato in Video 1.es / ftp_upload / 54983 / 54983fig4large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
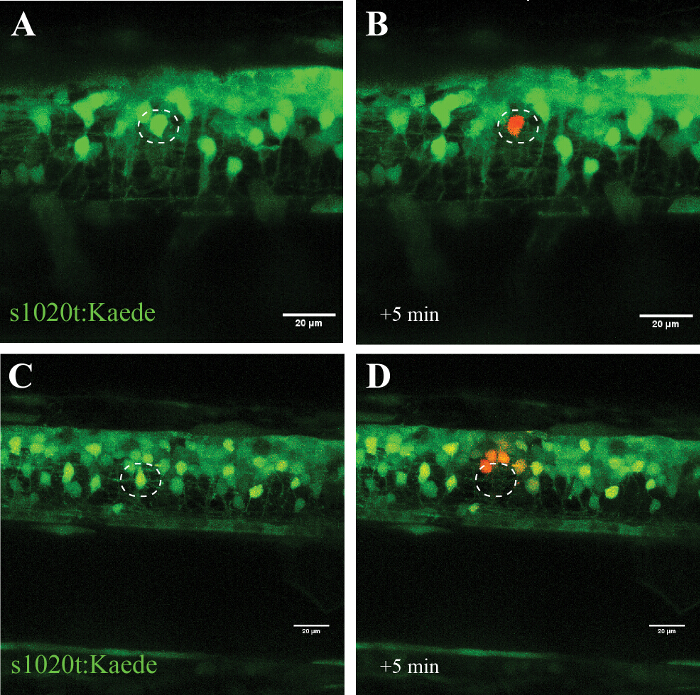
Figura 5: conferma dell'effetto di cella singola irradiazione UV utilizzando un fluoroforo fotoconvertibile (Kaede) in un motoneurone. Convalida di cella singola irradiazione UV attraverso l'attivazione del fotoconvertibile fluoroforo Kaede in un neurone. (AD) irradiazione UV di neuroni marcati con Kaede. (A) Fotoconversione di un singolo neurone (cerchio) con una potenza laser del 30% per 10 s portato alla fotoconversione di Kaede (da verde a rosso) solo neurone individuale mirata (B). Si noti che la cella convertito sopravvissuto per diverse ore e non ha mostrato segni visivi di deterioramento, come blebbing o arrotondamento in su. Ablazione di un singolo neurone (C ; cerchio) con una potenza laser maggiore (95% per 10 s) portato immediata scomparsa di quel neurone (D) e successiva fotoconversione di Kaede in un piccolo numero di neuroni circostanti entro un raggio di circa 20 micron. Barre di scala = 20 micron. Clicca qui per vedere una versione più grande di questa figura.
Video 1: Rappresentazione superficie 3D (Imaris) del UV ablated neurone illustrata in figura 4.
Il time-lapse video del neurone rappresentato in figura 4 è reso superficie utilizzando un software di visualizzazione (Imaris, Bitplane). Si evidenzia il processo di restringimento del soma ablato, seguita dalla frammentazione assonale anterogradely verso l'estremità distale della cella.euron_ablation-3D_rendered.mov "target =" _ blank "> Clicca qui per scaricare il file.
Figura supplementare 1: fusione agarosio opzionale per l'imaging di lunga data.
Per evitare spostamenti del pesce e l'agarosio durante l'acquisizione lungo termine preparare una ciambella a forma di cerchio di agarosio lungo i bordi al centro della piastra da 35 millimetri di vetro-inferiore (A). Lasciare il set di agarosio per ~ 10 min e trasferiti i pesci nel cerchio interno con una goccia di agarosio (B). Cercare di minimizzare la quantità di agarosio per l'incorporamento (pennello eccesso di agarosio all'esterno dopo orientando il pesce). Clicca qui per scaricare il file.
Discussione
Approcci ablazione laser
tecniche di ablazione laser assistita consentono di targeting preciso di individui o piccoli gruppi di cellule. La combinazione di questa tecnica con microscopia ad alta risoluzione e le manipolazioni genetiche in modelli animali, come zebrafish permette ai ricercatori di studiare in modo sistematico il destino di una singola cella e le interazioni dopo l'infortunio.
L'UV (405 nm) protocollo ablazione laser qui descritto delinea come le singole cellule possono essere stressati o uccisi in modo selettivo (in modo dose-dipendente), mentre la vicina neuroni, cellule gliali e gli assoni sono lasciati illesi. Abbiamo utilizzato con successo questo approccio in esperimenti di coltura cellulare e descrivere qui l'approccio dettagliato per il midollo spinale zebrafish. Mostriamo l'attuazione di questo approccio nel midollo spinale zebrafish, sottolineando in modo selettivo un singolo neurone all'interno di una rete di altre cellule (Figura 5, A e B), o uccidendo immediatamente e senza recupero di un singolo neurone (Figura 5, C e D).
In precedenza, sistemi laser specializzati, come ad esempio il laser pulsato-azoto o sistemi laser a due fotoni, sono stati necessari per indurre danni ai tessuti e transections 10, 11, 12, 13 nervo motore. Questi sistemi laser sono stati utilizzati con successo per causare danni alle cellule, come ad esempio la trombosi nelle arterie e vene 6, danno renale acuto 7, danno cardiaco 8, e di studiare le onde di calcio e la risposta della microglia dopo una lesione cerebrale 9. Inoltre, Soustelle e colleghi hanno utilizzato una configurazione confocale convenzionale (351 nm e 364 nm laser UV) per indurre danni alle epiteliali e cellule gliali in Drosophila 14 </ Sup>.
Importanza dei modelli Zebrafish per la comprensione ALS (e altre malattie umane)
Zebrafish sono un organismo modello ampiamente utilizzato, soprattutto per gli studi di sviluppo 28, 29, 30. Mentre hanno alcune limitazioni, il loro potenziale per modellare le malattie umane e dare una comprensione dei meccanismi molecolari patogenetici è enorme. Modelli zebrafish sono stati ben consolidata per lo studio della MND e hanno portato a importanti intuizioni molecolari 31, 32, 33, 34. linee di zebrafish transgeniche possono essere rapidamente generato (4 - 5 mesi) e consentono il tracciamento selettiva di un tipo di cellula specifica, caratteristiche che li rendono una preziosa aggiunta alla modelli animali di SLA correnti fanno. embrioni di zebrafish / larve sono otticamente trasparente e offrono esperimenti unicovantaggi mentali che permettono a lungo termine live-immagini a livello di singola cellula nel cervello o al midollo spinale, che non può essere facilmente ottenuto in modelli di roditori (o nell'uomo). Quando combinato con tecniche molecolari, come l'ablazione singola cellula, questo fornisce una piattaforma sperimentale unica per studiare i meccanismi molecolari precisi in vivo.
Motoneuroni possono essere selettivamente mirati Utilizzando UV Laser Ablation
Neuroni spinali in zebrafish iniziano a sviluppare entro 10 ore dopo la nascita e sono stabiliti dopo circa 48 ore 35, 36. Questo rapido sviluppo permette la visualizzazione di questi neuroni in tempi brevi e con un elevato throughput. I motoneuroni forniscono il legame essenziale tra cervello e muscoli e, nella SLA, sono colpiti nella corteccia motoria (neuroni motori superiori), il tronco cerebrale e il midollo spinale (motoneuroni). Perdita di questi neuroni determina inevitabilmente muatrofia SCLE e debolezza. Motoneuroni del midollo spinale di zebrafish possono essere identificati dal loro proiezioni distinte e dall'uso di promotori specifici del motore-neurone come -3MNX1. Targeting la soma delle cellule di tali neuroni proiettano rivelato la degenerazione anterograda lungo la proiezione assonale nel tempo (figura 4 e Video 1). L'imaging risoluzione di una singola cellula dei motoneuroni spinali inoltre confermato fosfatidilserina traslocazione e annessina conseguente V-etichettatura dopo ablazione laser (vedi figura 4 e supplementare Video 3 in riferimento 27). Anche se si segnala l'attivazione di annessina V morendo neuroni dopo il nostro approccio ablazione laser UV, non possiamo essere certi che la cascata di morte, che viene attivato durante questo processo accelerato corrisponde esattamente alla morte neuronale che si verifica durante la neurodegenerazione o normale omeostasi cellulare.
Sebbene questo approccio ablazione è altamente riproducibilee specifiche, diverse strategie all'incorporamento potrebbero anche influenzare l'efficienza dell'ablazione UV. Nella nostra esperienza, era più efficace per ridurre lo strato di agarosio si conficcarono nostro pesce. Spessori di mezzo di inclusione con uno strato addizionale di acqua uovo può ridurre la potenza UV infine ricevuta dalla cellula causa dell'attenuazione e effetti di dispersione che si verificano lungo il percorso del fascio.
In futuro, l'attraversamento di diverse linee di pesci transgenici permetterà la visualizzazione della immediato e di breve termine (fino a 12 h) le risposte delle altre cellule colpite, come la glia, alla distruzione delle cellule indotta da laser. Ad esempio, astrociti e la tossicità autonoma non-cellule in malattie neurodegenerative come la SLA sono stati sotto i riflettori della ricerca e sono fortemente implicati nella patogenicità di sporadica e SLA familiare 37, 38. Tuttavia, i meccanismi alla base della tossicità gliali e selettivitàverso il motore neuroni rimangono poco chiari. Noi e gli altri recentemente approfittato di questo approccio per studiare la engulfment di morire neuroni dalla microglia e visualizzati liquidazione dei residui neuronali 27, 39, 40.
Combinando la tecnica di ablazione ad alta risoluzione microscopia e marcatori per neuroinfiammazione permetterà ai ricercatori in futuro di ampliare la comprensione della funzione single-cell e sistemi cellulari interconnessi. La caratterizzazione di questi processi in un ambiente in vivo è fondamentale non solo in contesti di sviluppo, ma anche in modelli di malattie neurodegenerative, tra cui MND, in cui le interazioni cellulari può essere compromessa 3, 41.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
This work was supported by the MND Research Institute of Australia and the Cure for MND Foundation [GIA 1638], the Snow Foundation, and Macquarie University [MQRDG 9201401462]. Imaging was carried out at the Microscopy Facility in the Department of Biomedical Sciences, Macquarie University. Other members of the MND research center are thanked for their contributions to the development of these methods and fish lines.
Materiali
| Name | Company | Catalog Number | Comments |
| Agarose low melting | Fisher-Scientific | Dissolve in egg water with tricaine (0.02%) at 0.8 - 1.5% | |
| Tricaine | Argent Labs | MS-222 | 0.02% |
| Harvard standard wall Borosilicate with filament Capillary Glass | World Precision Instruments, Inc. | GC100F-10 (short) GC100F-15 (long) | Pull to a resistance of 2 - 7 MΩ |
| Egg water | 0.6 g Instant Ocean sea salt, 4 mL of 1 mg/mL methylene blue in 10 L deionized water | ||
| 1-phenyl-2-thiourea (PTU) | Sigma | P7629 | |
| Pronase | Sigma | 10165921001 | |
| Heat block | Select BioProducts | Digital block heater (SBD110_) | |
| Microinjection apparatus | World Precision Instruments, Inc. | Microinjection was performed by hand under a steromicroscope (Leica) with a loaded glass needle and a Picospritzer II (General Valve corporation) | |
| Stereoscope | Leica | Bright field illumination microscopy was performed on a Leica M165FC stereo dissection microscope (Leica) | |
| Microscope | Leica | SP5 | |
| 35 mm glass bottom dish | MatTek Corporation | P35G-0-20-C |
Riferimenti
- Becker, T. S., Rinkwitz, S. Zebrafish as a genomics model for human neurological and polygenic disorders. Dev Neurobiol. 72 (3), 415-428 (2012).
- Wilt, B. A., et al. Advances in light microscopy for neuroscience. Annu Rev Neurosci. 32, 435-506 (2009).
- Philips, T., Robberecht, W. Neuroinflammation in amyotrophic lateral sclerosis: role of glial activation in motor neuron disease. Lancet Neurol. 10 (3), 253-263 (2011).
- Robberecht, W., Philips, T. The changing scene of amyotrophic lateral sclerosis. Nat Rev Neurosci. 14 (4), 248-264 (2013).
- White, D. T., Mumm, J. S. The nitroreductase system of inducible targeted ablation facilitates cell-specific regenerative studies in zebrafish. Methods. 62 (3), 232-240 (2013).
- Jagadeeswaran, P., Paris, R., Rao, P. Laser-induced thrombosis in zebrafish larvae: a novel genetic screening method for thrombosis. Methods Mol Med. 129, 187-195 (2006).
- Johnson, C. S., Holzemer, N. F., Wingert, R. A. Laser ablation of the zebrafish pronephros to study renal epithelial regeneration. J Vis Exp. (54), e2845(2011).
- Matrone, G., et al. Laser-targeted ablation of the zebrafish embryonic ventricle: a novel model of cardiac injury and repair. Int J Cardiol. 168 (4), 3913-3919 (2013).
- Sieger, D., Moritz, C., Ziegenhals, T., Prykhozhij, S., Peri, F. Long-range Ca2+ waves transmit brain-damage signals to microglia. Dev Cell. 22 (6), 1138-1148 (2012).
- Lewis, G. M., Kucenas, S. Motor nerve transection and time-lapse imaging of glial cell behaviors in live zebrafish. J Vis Exp. (76), (2013).
- Rosenberg, A. F., Wolman, M. A., Franzini-Armstrong, C., Granato, M. In vivo nerve-macrophage interactions following peripheral nerve injury. J Neurosci. 32 (11), 3898-3909 (2012).
- Villegas, R., et al. Dynamics of degeneration and regeneration in developing zebrafish peripheral axons reveals a requirement for extrinsic cell types. Neural Dev. 7, 19(2012).
- O'Brien, G. S., et al. Two-photon axotomy and time-lapse confocal imaging in live zebrafish embryos. J Vis Exp. (24), (2009).
- Soustelle, L., Aigouy, B., Asensio, M. L., Giangrande, A. UV laser mediated cell selective destruction by confocal microscopy. Neural Dev. 3, 11(2008).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), 1000412(2010).
- Essentials of Biology 2. JoVE. , JoVE Science Education Database. Mouse, Zebrafish, and Chick. Zebrafish Microinjection Techniques (2016).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: an introduction. J Vis Exp. (69), e4196(2012).
- Westerfield, M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio).Vol.4th ed. , Univ. of Oregon Press. Eugene. (2000).
- Clark, K. J., Urban, M. D., Skuster, K. J., Ekker, S. C. Transgenic zebrafish using transposable elements. Methods Cell Biol. 104, 137-149 (2011).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Dev Dyn. 236 (11), 3088-3099 (2007).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. J Vis Exp. (25), (2009).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. J Neurosci. 20 (1), 206-218 (2000).
- Arkhipova, V., et al. Characterization and regulation of the hb9/mnx1 beta-cell progenitor specific enhancer in zebrafish. Dev Biol. 365 (1), 290-302 (2012).
- Flanagan-Steet, H., Fox, M. A., Meyer, D., Sanes, J. R. Neuromuscular synapses can form in vivo by incorporation of initially aneural postsynaptic specializations. Development. 132 (20), 4471-4481 (2005).
- Hall, T. E., et al. The zebrafish candyfloss mutant implicates extracellular matrix adhesion failure in laminin alpha2-deficient congenital muscular dystrophy. Proc Natl Acad Sci U S A. 104 (17), 7092-7097 (2007).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117 (4), 49-56 (2011).
- Morsch, M., et al. In vivo characterization of microglial engulfment of dying neurons in the zebrafish spinal cord. Front. Cell. Neurosci. , (2015).
- Grunwald, D. J., Eisen, J. S. Headwaters of the zebrafish -- emergence of a new model vertebrate. Nat Rev Genet. 3 (9), 717-724 (2002).
- Lele, Z., Krone, P. H. The zebrafish as a model system in developmental, toxicological and transgenic research. Biotechnol Adv. 14 (1), 57-72 (1996).
- Veldman, M. B., Lin, S. Zebrafish as a developmental model organism for pediatric research. Pediatr Res. 64 (5), 470-476 (2008).
- Kabashi, E., et al. Gain and loss of function of ALS-related mutations of TARDBP (TDP-43) cause motor deficits in vivo. Hum Mol Genet. 19 (4), 671-683 (2010).
- Laird, A. S., et al. Progranulin is neurotrophic in vivo and protects against a mutant TDP-43 induced axonopathy. PLoS One. 5 (10), 13368(2010).
- Lemmens, R., et al. Overexpression of mutant superoxide dismutase 1 causes a motor axonopathy in the zebrafish. Hum Mol Genet. 16 (19), 2359-2365 (2007).
- Ramesh, T., et al. A genetic model of amyotrophic lateral sclerosis in zebrafish displays phenotypic hallmarks of motoneuron disease. Dis Model Mech. 3 (9-10), 652-662 (2010).
- Hanneman, E., Trevarrow, B., Metcalfe, W. K., Kimmel, C. B., Westerfield, M. Segmental pattern of development of the hindbrain and spinal cord of the zebrafish embryo. Development. 103 (1), 49-58 (1988).
- Lewis, K. E., Eisen, J. S. From cells to circuits: development of the zebrafish spinal cord. Prog Neurobiol. 69 (6), 419-449 (2003).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. J Cell Biol. 187 (6), 761-772 (2009).
- Philips, T., Rothstein, J. D. Glial cells in amyotrophic lateral sclerosis. Exp Neurol. 262, Pt B 111-120 (2014).
- Mazaheri, F., et al. Distinct roles for BAI1 and TIM-4 in the engulfment of dying neurons by microglia. Nat Commun. 5, 4046(2014).
- van Ham, T. J., Kokel, D., Peterson, R. T. Apoptotic cells are cleared by directional migration and elmo1- dependent macrophage engulfment. Curr Biol. 22 (9), 830-836 (2012).
- Radford, R. A., et al. The established and emerging roles of astrocytes and microglia in amyotrophic lateral sclerosis and frontotemporal dementia. Front Cell Neurosci. 9, 414(2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon