È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione e valutazione di
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Here, we describe a protocol for radiolabeling and in vivo testing of tridentate 99mTc(I) chelate-tetrazine derivatives for pre-targeting and bioorthogonal chemistry.
Abstract
Pre-targeting combined with bioorthogonal chemistry is emerging as an effective way to create new radiopharmaceuticals. Of the methods available, the inverse electron demand Diels-Alder (IEDDA) cycloaddition between a radiolabeled tetrazines and trans-cyclooctene (TCO) linked to a biomolecule has proven to be a highly effective bioorthogonal approach to imaging specific biological targets. Despite the fact that technetium-99m remains the most widely used isotope in diagnostic nuclear medicine, there is a scarcity of methods for preparing 99mTc-labeled tetrazines. Herein we report the preparation of a family of tridentate-chelate-tetrazine derivatives and their Tc(I) complexes. These hitherto unknown compounds were radiolabeled with 99mTc using a microwave-assisted method in 31% to 83% radiochemical yield. The products are stable in saline and PBS and react rapidly with TCO derivatives in vitro. Their in vivo pre-targeting abilities were demonstrated using a TCO-bisphosphonate (TCO-BP) derivative that localizes to regions of active bone metabolism or injury. In murine studies, the 99mTc-tetrazines showed high activity concentrations in knees and shoulder joints, which was not observed when experiments were performed in the absence of TCO-BP. The overall uptake in non-target organs and pharmacokinetics varied greatly depending on the nature of the linker and polarity of the chelate.
Introduzione
99m Tc rimane il radioisotopo dominante utilizzato in medicina nucleare diagnostica, con oltre 50 milioni di procedure di imaging condotti ogni anno in tutto il mondo 1, 2, 3. La maggior parte degli agenti 99m Tc usati clinicamente sono di tipo perfusione radiofarmaci. Ci sono un numero limitato di composti mirati attivamente in cui 99m Tc è diretto ad associare un biomarker specifico mediante legatura ad un costrutto targeting. La creazione di 99m mirata Tc radiofarmaci è spesso ostacolato dalla influenza di 99m complessi Tc-ligando sulla capacità della molecola targeting impegnare la biomarker di interesse, o gli isotopi emivita non è sufficiente per l'utilizzo con elevate biomolecole peso molecolare come gli anticorpi. Quest'ultimo richiede tipicamente diversi giorni prima immagini sono acquisite in modo che la biomolecola cancellare da non bersaglio tiss UES. Pre-targeting offre un approccio alternativo per superare queste sfide.
Pre-targeting combinato con la chimica bioorthogonal ha dimostrato di essere un modo efficace per sviluppare nuove sonde imaging molecolare sia per fluorescenza e radio imaging 4, 5, 6, 7, 8. La domanda di elettroni inversa Diels-Alder (IEDDA) reazione tra 1,2,4,5-tetrazina (Tz) e derivati -cyclooctene trans (TCO), come mostrato nella Figura 1, ha dimostrato di essere particolarmente efficace 6. La reazione IEDDA con questi componenti può esibire una rapida cinetica in PBS (k 2 ≈ 6.000 M -1 s -1) e alta selettività, che lo rende ideale per in vivo pre-targeting applicazioni 9, 10.
e_content "> L'approccio più comune utilizzato implica la gestione di un vettore targeting TCO-derivati e dopo un periodo di ritardo sufficiente, un tetrazina radioattivo viene somministrato. tetrazines radioattivo sulla base di 11 C, 18 F, 64 Cu, 89 Zr, e 111 sono stati segnalato 11, 12, 13, 14, 15. al contrario, c'è solo un rapporto di un 99m Tc-etichettato Tz, che è stato preparato utilizzando un tipo ligando HYNIC richiedere l'uso di co-ligandi per prevenire legame proteico e la degradazione in vivo 16. in alternativa, riportiamo qui la sintesi di 99m Tc (I) etichettato tetrazines utilizzando una famiglia di leganti che formano complessi stabili con tridentati [99m Tc (CO) 3] + nucleo. 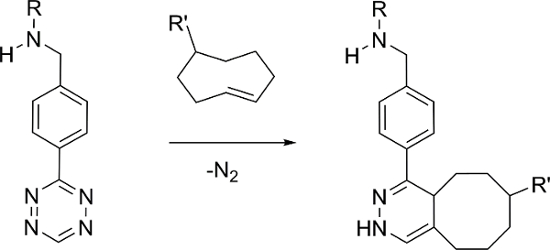
Figura 1: La reazione IEDDA bioorthogonal tra tetrazina e -cyclooctene trans. Clicca qui per vedere una versione più grande di questa figura.
La famiglia di leganti preparati contengono chelati tridentati che variano in polarità e la natura del gruppo linker tra la regione di legame del metallo e Tz (Figura 2). L'obiettivo era quello di individuare una 99m Tc-tetrazina costrutto che potrebbe efficacemente localizzare e reagire con i siti TCO-etichettati in vivo e rapidamente chiaro non collegate, al fine di produrre alta target-to-non-bersaglio rapporti. Per testare i ligandi, un TCO-derivato di un bisfosfonato (TCO-BP) è stato utilizzato 17. Abbiamo dimostrato in precedenza che il TCO-BP localizza alle aree di metabolismo osseo attivo e può reagire contetrazines radiomarcati in vivo 18. È un reagente conveniente per testare nuove tetrazines, perché può essere preparato in un'unica fase e gli esperimenti può essere eseguita in topi normali dove localizzazione luogo soprattutto nelle articolazioni (ginocchia e spalle).
Protocollo
Gli studi sugli animali sono stati approvati dal Consiglio di Ricerca Etica degli animali alla McMaster University in accordo con il Consiglio Canadese Animal Care (CCAC) le linee guida.
1. radiomarcatura di ligandi Tz-tridentati con 99m Tc
NOTA: Le seguenti procedure richiedono l'uso di composti radioattivi. Il lavoro dovrebbe essere fatto solo in un laboratorio autorizzato con aderenza alle norme di sicurezza e di smaltimento. reazioni microonde devono essere eseguiti in un forno a microonde specificamente progettato per sintesi chimica.
- Sintesi di [99m Tc (CO) 3 (H 2 O) 3] + 19, 20
- In una fiala forno a microonde, unire 8 mg K 2 [BH 3 CO 2], 15 mg di Na 2 CO 3, 20 mg di Na 2 B 4 O 7 · 10H 2 O, e 25 mg KOCO [CH (OH)]2 COONa · 4H 2 O. spurgo la fiala per 10 minuti con gas argon.
- Aggiungere 4 ml di 99m TcO 4 - (~ 1.100 MBq, ~ 30 MCI) in soluzione fisiologica 0,9% al flaconcino.
- Riscaldare la reazione in un forno a microonde per 3,5 min a 110 ° C dopo 10 s di agitazione per assicurare una completa miscelazione dei reagenti.
- Regolare il pH della soluzione a 3,5-4 utilizzando ~ 400 ml di 1 M HCl. Verificare utilizzando carta pH.
- Radiomarcatura di tetrazina ligandi 1-5
- Sciogliere 2 mg di ciascun ligando (composti 1-5) in 250 ml MeOH 21.
- Aggiungere 250 ml di [99m Tc (CO) 3 (H 2 O) 3] + (~ 74 MBq, ~ 2 MCI) a ogni soluzione.
- Riscaldare la miscela di reazione utilizzando un forno per 20 minuti a 60 ° C.
NOTA: Questo passaggio era identica per tutti i 5 tetrazines. - Per composti 2- 5, si evapora il solvente e re-dissolve i prodotti risultanti in 1 ml di 1: 1 v / v DCM: TFA.
- Riscaldare i prodotti di reazione disciolti (2-5) a 60 ° C in un forno a microonde per 6 minuti (2-4) o 10 min (5).
- Dopo raffreddamento a temperatura ambiente, si evapora il solvente usando un evaporatore (36 ° C, 8 mbar, 3 min, 6.000 rpm) e sciogliere il composto essiccato in 1: 1 ACN: H 2 O o 1: 1 MeOH: H 2 O, prima purificazione HPLC.
- Purificare i 99m Tc-marcato composti (1-5), tra cui la separazione del prodotto etichettato da senza etichetta ligando tetrazina, utilizzando HPLC (C 18 in fase inversa). Tipicamente, utilizzare un gradiente di eluizione di 30:70 ACN: H 2 O (entrambi con 0,1% TFA) a 40:60 ACN: H 2 O oltre 20 min (18 min) e una analitica colonna C 18 4,6 x 100 mm. Utilizzare sia UV (254 nm) e la rilevazione di gamma.
- Prendere un piccolo campione di ciascun prodotto etichettato e confrontare il suo tempo di ritenzione HPLC a quella di un co-injette, non radioattivo, standard di Re-marcato (0,125 mg nel 20% di metanolo-H 2 O). Lo standard Re-marcato è identificato nella traccia UV HPLC, e verrà eluire al tempo stesso come il 99m Tc composto marcato nella traccia γ-HPLC. Questa co-iniezione mostra picchi a tempi di ritenzione comparabili, confermando l'identità del 99m Tc-etichettato compound.
- Evaporare il solvente dalle frazioni HPLC utilizzando un evaporatore (36 ° C, 8 mbar, 3 min, 6,000 rpm).
- Formulare il composto purificato ad una concentrazione di 7,4 kBq / ml in PBS, contenente 0,5% di BSA e 0,01% Tween-80.
- Per garantire i composti marcati sono stabili, effettuare uno studio in vitro stabilità. Incubare il composto formulato a 37 ° C per 1, 4 e 6 h, iniettando una piccola quantità (3,7 MBq) della miscela sulla HPLC ad ogni tempo per valutare la stabilità.
2. Studi Bio-Pre-distribuzione mirati
- Preparazione degli animali
- Utilizzando 7-9 settimane di età, i topi femmina BALB / c (n = 3), amministrare TCO-BP formulato in soluzione salina (20 mg / kg) (5 mg / mL), mediante iniezione coda vena.
- Posizionare il mouse in un dispositivo di contenzione fisica, e identificare le vene situate sulle superfici laterali della coda e pulire con un tampone imbevuto di alcol. A circa 2 cm dall'estremità della coda, inserire un ago da 30 gauge con un angolo basso, parallelamente alla vena. Premere lentamente lo stantuffo per iniettare, rimuovere l'ago ed applicare pulita garza al sito di iniezione con una leggera pressione fino a quando si arresta l'emorragia.
- Al 1 ore dopo l'iniezione di TCO-BP, amministrare ~ 0,74 MBq (20 pCi) di 99m Tc-tetrazina formulati in 100 ml di 0,5% di BSA, 0,01% di Tween-80 in PBS, tramite iniezione coda vena.
- Studi Bio-distribuzione
- Al punto di tempo desiderato (t = 6 h), anestetizzare i topi utilizzando 3% isoflurano e miscela gassosa di ossigeno 2%. Dimostrare un ae un pizzico di ritiro sul mouse anestetizzato per assicurare che siano in aereo chirurgico di anestesia.
- Raccogliere il sangue (1 mL) mediante puntura cardiaca usando una siringa pre-trattati con eparina. Posizionare il mouse sul dorso con il naso nel cono di naso per continuare l'anestesia e individuare il processo xifoideo sull'animale.
- Inserire un ago G 25, leggermente a sinistra della linea mediana dell'animale sotto il processo xifoideo, ad un angolo di 20 °. Inserire completamente l'ago, e lentamente tirare indietro lo stantuffo per vedere il sangue nel mozzo ago se il cuore è stato perforato. Leggermente regolare nuovamente l'ago tenendo lo stantuffo se necessario, forare il cuore. Lentamente prelevare il sangue nella siringa.
- Eutanasia dell'animale mediante dislocazione cervicale, mentre sotto anestesia.
- Mettere ogni animale in un sacchetto di plastica e utilizzare un calibratore di dosi (99m impostazione Tc) per misurare tutto il livello di attività del corpo.
- Raccogliere i seguenti tessuti e fluidi in pre-pesareEd contando tubi: sangue, midollo (ginocchio e della spalla), cistifellea, reni, fegato, dello stomaco (con il contenuto), piccolo intestino (con il contenuto), intestino crasso e cieco (con il contenuto), tiroide e trachea, vescica urinaria con l'urina , e la coda.
- Risciacquare tessuti idonei (ad esclusione del sangue, della cistifellea e vescica urinaria) in PBS per rimuovere il sangue e asciugare prima di mettere i tessuti nelle provette di conteggio appropriati.
- Mettere carcassa animale in un sacchetto di plastica e misurare l'attività residua di tutto il corpo con un calibratore di dosi.
- Pesare ciascuna provetta contenente un campione di tessuto. Sottrarre peso iniziale del tubo per ottenere la massa del tessuto.
- Utilizzare un calibratore di dosi (99m Tc impostazione) per misurare la quantità di attività in un campione di prova (100 mL) al momento dell'iniezione per ogni mouse.
NOTA: Questo campione è uguale al volume di iniezione, dando così il conteggio attività al momento dell'iniezione. - Al momento della misurazione del tessuto, unliquot 5 ml di campione usato in precedenza. Utilizzare un contatore gamma multi-detector (99m impostazione Tc) e contare per ottenere il conteggio al minuto (CPM) per il campione 5 ml.
- Utilizzare i due valori ottenuti in 2.2.9 e 2.2.10 per calcolare l'attività e rapporto CPM con l'equazione 1 per ottenere un fattore di conversione (CPM pCi -1).
(1)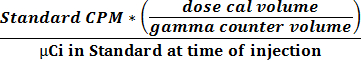
- Utilizzare il contatore gamma per misurare la quantità di radioattività in ogni tessuto o campione di fluido.
- Utilizzare equazione 1 per calcolare la quantità di attività in ciascun tessuto o fluido al momento della misura relativa alla dose totale iniettata. Questo valore viene quindi normalizzata per il peso degli organi e riportato come la dose percentuale iniettata per grammo (cioè,% ID / g) di tessuto.
- Seguire i passaggi 2.1.2 a 2.2.13 per condurre un esperimento di controllo negativo utilizzando i 99m Tc-marcato ligandi tetrazina nel Absence di TCO-BP. topi sacrificio (n = 3) a 0.5, 1, 4 e 6 ore dopo l'iniezione ed ottenere tessuti o fluidi come sopra descritto.
Risultati
I leganti sono stati sintetizzati utilizzando diversi linker e chelanti tramite una semplice strategia amminazione riduttiva (figura 2), seguita da accoppiamento del prodotto ad un tetrazina disponibile in commercio 22, 23. Radiomarcatura è stata effettuata utilizzando lo stesso metodo per tutti i composti ed era altamente riproducibile. Il processo è stato ottimizzato variando il pH, quantità di ligando, temp...
Discussione
Una collezione di tetrazina linked chelati tridentati di polarità variabile è stata preparata, e l'utilità dei loro complessi 99m Tc nella reazione IEDDA con un derivato TCO in vivo è stata valutata. Un metodo di etichettatura 99m Tc efficace e riproducibile stato sviluppato per cinque tetrazina chelati, dove la concentrazione del ligando era 10 -3 M. Il passo etichettatura è stata seguita da deprotezione del t-butil (per i composti 2-5). L'...
Divulgazioni
The authors declare they have no competing financial interests.
Riconoscimenti
This work supported by research grant funding from the Natural Sciences and Engineering Research Council (NSERC) of Canada, the Ontario Institute for Cancer Research (OICR, #P.SI.015.8), and the Canadian Cancer Society (CCS, #703857). The authors acknowledge the contributions of Dr. Denis Snider who provided assistance in preparing the manuscript.
Materiali
| Name | Company | Catalog Number | Comments |
| Argon gas | Alphagaz | --- | --- |
| Na2CO3 | EMD Millipore | 106395 | --- |
| Na2B4O7·10H2O | Anachemia | S9640 | --- |
| KNaC4H4O6·4H2O | Anachemia | 217255 | --- |
| Technelite 99mTc generator | Lantheus medical imaging | --- | Source of 99mTcO4- |
| 0.9% Saline | Lantheus medical imaging | --- | To elute generator |
| 1 M HCl | Lab Chem | --- | --- |
| MeOH | Caledon | --- | --- |
| ACN | Caledon | --- | HPLC grade |
| Millipore H2O | Thermo Fisher Scientific | Barnstead Nanopure | --- |
| DCM | Caledon | --- | --- |
| TFA | Caledon | --- | --- |
| PBS | Thermo Fisher Scientific | 10010023 | pH 7.4 1x |
| BSA | Sigma Aldrich | A7906 | --- |
| Tween80 | Sigma Aldrich | P8047 | --- |
| Isoflurane | CDMV | 108737 | Supplier: Fresenius Kabi Animal Health |
| HPLC | Waters | 1525 Binary Pump, 2998 Photodiodde Array Detector, E-SAT/IN, Bioscan Flowcount PMT detector (item # 15590) | --- |
| HPLC column for analysis and purification of compounds 2-4 | Phenomenex | 00G-4435-E0 | Gemini® 5 µm C18 110 Å, LC Column 250 x 4.6 mm |
| HPLC column for analysis and purification of compounds 1 and 5 | Waters | 186003115 | XBridge BEH C18 Column, 130 Å, 5 µm, 4.6 mm x 100 mm |
| Microwave Reactor | Biotage | Initiator 8 | --- |
| Biotage V10 Evaporator | Biotage | Serial # V1041 | --- |
| Dose calibrator | Capintec, Inc. | CRC-25R | --- |
| Gamma counter | Perkin Elmer | Wizard 1470 Automatic Gamma Counter | --- |
| Animal room scale | Mettler Toledo | XP105 Delta Range | --- |
| Microwave vials | Biotage | 355629 | 0.5-2 mL |
Riferimenti
- Jurisson, S. S., Lydon, J. D. Potential Technetium Small Molecule Radiopharmaceuticals. Chem. Rev. 99 (9), 2205-2218 (1999).
- Kluba, C. A., Mindt, T. L. Click-to-chelate: Development of Technetium and Rhenium-Tricarbonyl Labeled Radiopharmaceuticals. Molecules. 18, 3206-3226 (2013).
- Amato, I. Nuclear Medicines Conundrum. Chem. Eng. News. 87 (36), 58-70 (2009).
- Hnatowich, D. J., Virzi, F., Rusckowski, M. Investigations of Avidin and Biotin for Imaging Applications. J. Nucl. Med. 28 (8), 1294-1302 (1987).
- Blackman, M. L., Royzen, M., Fox, J. M. Tetrazine Ligation: Fast Bioconjugation Based on Inverse-Electron-Demand Diels-Alder Reactivity. J. Am. Chem. Soc. 130 (41), 13518-13519 (2008).
- Devaraj, N. K., Weissleder, R., Hilderbrand, S. A. Tetrazine-Based Cycloadditions: Application to Pretargeted Live Cell Imaging. Bioconjugate Chem. 19 (12), 2297-2299 (2008).
- Rossin, R., et al. In Vivo Chemistry for Pretargeted Tumor Imaging in Live Mice. Angew. Chem., Int. Ed. 49 (19), 3375-3378 (2010).
- Zeglis, B. M., et al. Optimization of a Pretargeted Strategy for the PET Imaging of Colorectal Carcinoma via the Modulation of Radioligand Pharmacokinetics. Mol. Pharmaceutics. 12 (10), 3575-3587 (2015).
- Rossin, R., et al. Highly Reactive trans-Cyclooctene Tags with Improved Stability for Diels-Alder Chemistry in Living Systems. Bioconjugate Chem. 24 (7), 1210-1217 (2013).
- Rossin, R., Robillard, M. S. Pretargeted Imaging Using Bioorthogonal Chemistry in Mice. Curr. Opin. Chem. Biol. 21, 161-169 (2014).
- Denk, C., et al. Development of a 18F-Labeled Tetrazine with Favorable Pharmacokinetics for Bioorthogonal PET Imaging. Angew. Chem., Int. Ed. 53 (36), 9655-9659 (2014).
- Herth, M. M., Andersen, V. L., Lehel, S., Madsen, J., Knudsen, G. M., Kristensen, J. L. Development of a 11C-labeled Tetrazine for Rapid Tetrazine-Trans-Cyclooctene Ligation. Chem. Commun. 49 (36), 3805-3807 (2013).
- Li, Z., et al. Tetrazine-Trans-Cyclooctene Ligation for the Rapid Construction of 18F Labeled Probes. Chem. Commun. 46 (42), 8043 (2010).
- Nichols, B., Qin, Z., Yang, J., Vera, D. R., Devaraj, N. K. 68Ga Chelating Bioorthogonal Tetrazine Polymers for the Multistep Labeling of Cancer Biomarkers. Chem. Commun. 50 (40), 5215-5217 (2014).
- Zeglis, B. M., et al. A Pretargeted PET Imaging Strategy Based on Bioorthogonal Diels-Alder Click Chemistry. J. Nucl. Med. 54 (8), 1389-1396 (2013).
- García, M. F., et al. 99mTc-Bioorthogonal Click Chemistry Reagent for In Vivo Pretargeted Imaging. Bioorg. Med. Chem. 24 (6), 1209-1215 (2016).
- Russell, R. G. G. Bisphosphonates: The First 40 Years. Bone. 49 (1), 2-19 (2011).
- Yazdani, A., et al. A Bone-Seeking Trans-Cyclooctene for Pretargeting and Bioorthogonal Chemistry: A Proof of Concept Study Using 99mTc and 177Lu-Labeled Tetrazines. J. Med. Chem. , (2016).
- Alberto, R., et al. A Novel Organometallic Aqua Complex of Technetium for the Labeling of Biomolecules: Synthesis of [99mTc(OH2)3(CO)3]+ from [99mTcO4]- in Aqueous Solution and its Reaction with a Bifunctional Ligand. J. Am. Chem. Soc. 120 (31), 7987-7988 (1998).
- Alberto, R., Ortner, K., Wheatley, N., Schibli, R., Schubiger, A. P. Synthesis and properties of boranocarbonate: A convenient in situ CO source for the aqueous preparation of [99mTc(OH2)3(CO)3. J. Am. Chem. Soc. 123 (13), 3135-3136 (2001).
- Lu, G., et al. Synthesis and SAR of 99mTc/Re-labeled Small Molecule Prostate Specific Membrane Antigen Inhibitors with Novel Polar Chelates. Bioorg. Med. Chem. Lett. 23 (5), 1557-1563 (2013).
- Maresca, K. P., et al. Small Molecule Inhibitors of PSMA Incorporating Technetium-99m for Imaging Prostate Cancer: Effects of Chelate Design on Pharmacokinetics. Inorg. Chim. Acta. 389, 168-175 (2012).
- Bartholomä, M. D., et al. Insight into the Mode of Action of Re(CO)3 Thymidine Complexes. ChemMedChem. 5 (9), 1513-1529 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon