Method Article
Misura della T cellulare alloreattività Utilizzando Imaging Citometria a Flusso
In questo articolo
Riepilogo
Questo documento descrive un metodo per misurare alloreattività in una popolazione mista di cellule T usando un flusso di imaging citometria.
Abstract
La misurazione della reattività immunologica agli antigeni del donatore in pazienti sottoposti a trapianto è probabile che sia di fondamentale importanza per la riduzione di successo o la revoca di immunosoppressione. La reazione mista leucociti (MLR), saggi di diluizione limite, e ipersensibilità test trans-vivo di tipo ritardato (DTH) sono stati tutti applicati a questa domanda, ma questi metodi hanno limitato la capacità predittiva e / o significative limitazioni pratiche che riducono la loro utilità. flusso Imaging citometria è una tecnica che combina i poteri quantitativi multiparametriche di citometria a flusso con le funzionalità di imaging di microscopia a fluorescenza. Recentemente abbiamo utilizzato un approccio citometria di flusso imaging per definire la proporzione di cellule T riceventi capaci di formare sinapsi immuni mature con cellule presentanti l'antigene (APC) donatore. Utilizzando un modello di trapianto di cuore del mouse ben caratterizzato, abbiamo dimostrato che la frequenza delle sinapsi del sistema immunitario in vitro tra T-APC Membreventi contatti ane predetti fortemente esito allotrapianto a rifiuto, la tolleranza, e una situazione in cui il trapianto sopravvivenza dipende cellule T regolatrici indotte. La frequenza dei contatti T-APC aumentato con le cellule T da topi durante rigetto acuto e diminuita con cellule T da topi resi insensibile alla alloantigene. L'aggiunta delle cellule T regolatorie al sistema in vitro ridotto prolungati contatti T-APC. Criticamente, questo effetto è stato osservato anche con policlonale umano espanso, naturalmente linfociti T regolatori, che sono noti per controllare il rigetto di tessuti umani in modelli di topo umanizzato. Ulteriore sviluppo di questo approccio può consentire una caratterizzazione più profonda del vano cellule T alloreattive nei pazienti trapiantati. In futuro, sviluppo e valutazione di questo metodo utilizzando cellule umane possono costituire la base per i saggi utilizzati per selezionare i pazienti per immunosoppressione minimizzazione, e può essere utilizzato per misurare l'impatto di tolerogenic terapie nella clinica.
Introduzione
trapianto di organo solido ha trasformato la cura di pazienti con malattie allo stadio terminale del rene, fegato, cuore e polmoni. A causa di disparità di maggiori e minori antigeni di istocompatibilità, tuttavia, trapianti vengono prontamente respinte da cellule riceventi T se non vengono utilizzati farmaci immunosoppressivi. Questi agenti hanno numerosi effetti collaterali, compresi i rischi per il cancro e la disfunzione d'organo. Un importante obiettivo clinico è quindi quello di ridurre la dose di immunosoppressione al livello minimo necessario per evitare rigetto. Questo livello può variare a seconda del grado di attivazione del sistema immunitario innato; il grado di donatore-ricevente alloantigene disadattamento; e le differenze tra pazienti in funzione immunitaria, farmacocinetica, farmacodinamica e.
Purtroppo, i medici trapianto non hanno alcuno strumento per valutare con precisione reattività donatore nei singoli pazienti 1. il mistoreazione leucocitaria (MLR) può rilevare reattività donatore, ma non riesce a prevedere in modo affidabile innesto esito 2, 3. Limitanti saggi di diluizione, ELISPOTs citochine, e il saggio trans-vivo sia misurare una gamma limitata di risposte o non sono pratici segnature 4, 5, 6, 7, 8 profili di espressione .Gene hanno rivelato relative alla tolleranza operativa 9, 10, 11, 12 e rifiuto 13, 14, 15, ma questi non sono sempre generalizzabile nelle popolazioni 16 e può quindi avere un'utilità limitata nei singoli pazienti. analy Sequence-basedses del recettore delle cellule T (TCR) di cellule T nel sangue periferico 17 o proliferando in MLR 18 sono stati anche sviluppati ma richiedono ulteriore convalida.
Concettualmente, sarebbe desiderabile avere un saggio che rileva i primi passi necessari a destinatario attivazione delle cellule T da un antigene donatore. Poiché la coltura di cellule più giorni (come nel MLR) può introdurre artefatti, tale test idealmente non richiedono la misurazione di eventi a valle, come proliferazione o funzione effettrice. Ugualmente, tuttavia, sarebbe anche desiderabile per la prova di dipendere qualche elemento della funzione delle cellule T, poiché valutazioni puramente descrittivo (Ad esempio, TCR sequenziamento) potrebbe non essere in grado di distinguere tra cellule T anergic e funzionali.
Numerosi studi hanno indicato che il contatto prolungato T-APC è necessaria per la formazione di una sinapsi immunitario, che è un primo fondamentalepasso nella risposta delle cellule T 19, 20, 21, 22. Recentemente abbiamo riportato che, durante dinamica nell'imaging time lapse vitro, circa 5 - 10% di topo cellule T CD4 + formano contatti duraturi con cellule ossee allogeniche derivate dal midollo dendritiche (BMDCs) 23. La frequenza di contatto prolungato è aumentata negli animali che hanno respinto un innesto, mentre in topi precedentemente reso tollerante agli stessi antigeni, rimanendo su livelli osservati nei topi untransplanted 23. Interazioni prolungate sono stati ridotti in presenza di destinatario Tregs e aumentato in loro assenza, e abbiamo osservato fenomeni simili utilizzando cellule umane T e cellule dendritiche derivate da monociti allogeniche (MoDCs) 23.
Tuttavia, l'enumerazione di contatti prolungati effettuate in un popolazio policlonale cellule Tn è in termini di tempo e ad alta intensità di manodopera. Abbiamo quindi fatto uso dell'imaging citometria a flusso per esaminare allogenico formazione di sinapsi immunitaria. flusso Imaging incorpora citometria le capacità multiparametriche di acquisizione e analisi dei dati di flusso convenzionale citometria con le capacità di imaging singola cella di microscopia a fluorescenza. Questa tecnica è stata utilizzata da altri ricercatori per studiare la formazione di sinapsi immune dalle cellule T monoclonali 24, 26, 27 o in presenza di superantigeni 28. In questi contesti, tuttavia, la frequenza di cellule T che rispondono varia dal 30-100%, mentre le cellule T alloreattive sono generalmente stimati per rappresentare 5-15% del repertorio totale delle cellule T 29, 30, 31, 32. È importante sottolineare che, abbiamo dimostrato che il flusso di immagini in grado di produrre citometria avery misura comparabile di alloreattive frequenza delle cellule T 23 e che i cambiamenti nella frequenza sinapsi all'interno di una popolazione di cellule T policlonale sono predittivi di innesto 23 risultati. Attualmente, questo approccio è stato ottimizzato per calcolare l'alloreattività diretto delle cellule T CD4 +, ma, in linea di principio, potrebbe anche essere sviluppato per esaminare le cellule T CD8 + e la via indiretta. Alloreattività indiretta si crede di diventare sempre più rilevante in tempi più lunghi post-trapianto 33. Stiamo sviluppando questo metodo per utilizzare cellule umane, che consentirà di testare in pazienti. Così, in futuro, l'approccio generale può essere utile per la valutazione funzionale delle risposte delle cellule T in pazienti trapiantati prima del trapianto; subito dopo il trapianto; e nel lungo termine, quando la droga minimizzazione diventa un obiettivo importante.
Protocollo
1. Preparare i reagenti e materiali necessari
- Preparare soluzione salina tamponata con fosfato (PBS) contenente siero bovino fetale 2% (FBS) ( "tampone di lavaggio"). Preparare PBS con 2% FCS contenente 0,1% di detergente non ionico ( "tampone perm-wash", vedere la tabella dei materiali). Preparare PBS con 1,5% di formaldeide.
NOTA: ATTENZIONE! La formaldeide è corrosivo e potenzialmente cancerogeni e deve essere maneggiato indossando opportuni dispositivi di protezione individuale. - Preparare PBS contenente 2% FBS e 0,5 mM di acido etilendiamminotetraacetico (EDTA) per la separazione cellulare magnetica ( "tampone MCS").
- Preparare 50 ug / mL falloidina-fluoresceina isotiocianato (FITC-falloidina) in dimetil solfossido (DMSO). Preparare un 1 mg / mL colorazione nucleare (es 1 mg / mL 7-aminoactinomycin D (7-AAD) in DMSO o bis-benzimide colorante, vedere la tabella dei materiali) in DMSO. Preparare anticorpi marcati con fluorocromi appropriata per le cellule di interesse eimaging citofluorimetro.
- Ottenere tessuti animali (ad esempio, linfonodi e milza) come fonte di cellule T e tessuti animali allogenico (ad esempio, milza e midollo osseo) come fonte di cellule presentanti l'antigene o progenitori.
- Preparare terreno di coltura cellulare (ad es, medio Roswell Park Memorial Institute (RPMI) 1640 o Dulbecco Modified Eagle Medium (DMEM) integrato con il 10% FBS), 50 micron 2-mercaptoetanolo, la penicillina e la streptomicina e di ottenere a 24 e / o 96- pozzetti di coltura cellulare.
2. Preparare cellule presentanti l'antigene
NOTA: In teoria, ogni popolazione APC potrebbe essere esaminata con questo metodo. osseo di topo cellule immature derivate dal midollo dendritiche (DC) come APC stati citati in giudizio in questo caso. Esistono molti protocolli per la generazione di queste cellule (ad esempio, i riferimenti 34 e 35). In breve, è stato utilizzato il seguente protocollo.
- midollo filo da femori e tibie in RPMI 1640 o DMEM.
- Passare le cellule sospese attraverso un colino cella 70 micron per rimuovere piccoli pezzi di osso e detriti.
- Agglomerare le cellule mediante centrifugazione e poi lisare i globuli rossi utilizzando un tampone di cloruro di ammonio per 5 min a temperatura ambiente.
- Agglomerare le cellule mediante centrifugazione (400 xg, 5 min) e risospendere il pellet cellulare.
- Lavare le cellule in 5 - 10 ml di tampone di lavaggio, pellet per centrifugazione (400 xg, 5 min), e risospendere il pellet cellulare.
- Arricchire precursori emopoietici sopra una colonna di separazione cellulare marcando le cellule con biotinilato anti-CD3 (5 ug / mL), anti-B220 (5 ug / mL), anti-MHC di classe II (1 ug / mL), e anti-CD11b (/ mL 5 ug) anticorpi.
- Agglomerare le cellule per centrifugazione (400 xg, 5 min) e risospendere il pellet cellulare.
- Incubare le cellule con microsfere magnetiche anti-biotina (vedere la tabella dei materiali) a 4 ° C per 10 min.
- Lavare e agglomerare le cellule (400 xg, 5 min) e ri-suspenli d in 1 ml di tampone MCS prima di rimuovere le cellule marcate utilizzando una vasta selezione positiva colonna di separazione cellulare (LS) magnetico innescato con 3 mL di tampone MCS e collocato nella sua magnete. Lavare la colonna 3 volte con 3 ml di tampone MCS; il flusso continuo conterrà cellule desiderate.
- Coltura le cellule che passano attraverso la colonna per 6 giorni in RPMI 1640 o DMEM integrato con 2 ng / mL ricombinante topo granulociti e macrofagi fattore stimolante le colonie (GM-CSF) e 2 ng / ml di ricombinante β1 fattore di crescita trasformante umani (TGFβ1) . Sostituire la metà della media ogni 2 giorni con terreno completo fresco contenente 2 ng / mL GM-CSF e TGFβ1.
NOTA: TGFβ1 umana ha l'attività in cellule di topo. I dati sono stati generati utilizzando queste DC immature. Altre cellule (ad esempio, cellule B e DC mature) possono essere adatti come APC, ma non sono stati testati in questo saggio. - Cryopreserve DC nel 90% siero / 10% DMSO e conservare in azoto liquido; recuperare suil giorno di utilizzo. Prima dell'uso, contare il numero di cellule dendritiche vitali in un emocitometro utilizzando trypan blu. Risospendere il pellet cellulare in terreno di coltura ad una densità appropriata (vedere fase 4.1) prima dell'uso nella sezione 4.
3. Preparare cellule T
- Utilizzare metodi di selezione negativa per evitare inavvertitamente trasmettere segnali di attivazione o inibitori alle cellule.
NOTA: In questo esempio, le cellule T CD4 + sono preparati per l'analisi.- Per preparare le cellule T CD4 + dalla milza topo, schiacciare la milza attraverso un colino cella di 70 micron con lo stantuffo di una siringa. Lavare il filtro cella con tampone di lavaggio.
- Agglomerare le cellule sospese mediante centrifugazione (400 xg, 5 min) e poi lisare i globuli rossi da ri-sospendendo il pellet in un buffer di cloruro di ammonio per 5 min a temperatura ambiente.
- Agglomerare le cellule per centrifugazione (400 xg, 5 min) e risospendere il pellet.
- Lavare la cellas in 5 - 10 mL di tampone di lavaggio e pellet per centrifugazione (400 xg, 5 min). Risospendere il pellet.
- Macchiare le cellule con anticorpi biotinilati a CD8, complesso maggiore di istocompatibilità di classe II (MHC II, 1 ug / mL), e CD19 (5 ug / mL). Incubare per 10 minuti a 4 ° C.
- Lavare le cellule in 10 ml di tampone di lavaggio e pellet per centrifugazione (400 xg, 5 min). Risospendere il pellet.
- Incubare le cellule con microsfere magnetiche anti-biotina (vedere la tabella dei materiali) secondo le istruzioni del produttore.
- Lavare le cellule in 10 ml di tampone di lavaggio e pellet per centrifugazione (400 xg, 5 min); risospendere il pellet.
- Risospendere le cellule in 1 ml di tampone di MCS e arricchire le cellule T CD4 + su colonna di separazione cellulare magnetica innescato con 3 ml di tampone MCS su un magnete. Lavare la colonna 3 volte con 3 ml di tampone MCS. Colonna flow-through conterrà le cellule T arricchite.
- Con cytome flusso standardprovare, valutare la purezza delle cellule T con un'aliquota di cellule negativamente selezionati. Macchiare le cellule utilizzando un coniugato con fluorocromo streptavidina (per individuare eventuali cellule biotina che avrebbero dovuto essere rimosse in colonna) e un anticorpo o anticorpi per identificare la popolazione di cellule T di interesse (CD4 in questo caso); purezza ≥85% è accettabile 23.
- Contare le cellule T in un emocitometro per esclusione trypan blu (≥90% redditività è accettabile).
NOTA: tampone MCS contiene EDTA, che deve essere rimosso prima del test. Per eseguire ciò, agglomerare le cellule mediante centrifugazione (400 xg, 5 min) e lavare in 1 ml di tampone di lavaggio. Agglomerare le cellule di nuovo (400 xg, 5 min) e risospendere in terreno di coltura alla densità adeguata (vedi punto 4.1).
- Contare le cellule T in un emocitometro per esclusione trypan blu (≥90% redditività è accettabile).
4. Co-incubare cellule T e cellule dendritiche
- cellule T semi e DC a 2: 1 T: rapporto DC in una piastra di coltura cellulare a 24 pozzetti o 96 pozzetti. Assicurarsi che il volume di coltura finale è ≤500 ml per piastre da 24 pozzetti o ≤50 ml per piastre da 96 pozzetti.
NOTA: minori volumi incoraggiano interazioni cellula-cellula e consentire lo spazio per la successiva di buffer fissazione.- Regolare il numero di cellule precisi empiricamente, ma come una guida generale, utilizzare 1 x 10 6 cellule T e 0,5 x 10 6 cellule dendritiche per pozzetto (piastra a 96 pozzetti). Questi dovrebbero essere considerati il numero minimo di cellule, perché l'utilizzo di un minor numero di cellule rende l'enumerazione delle sinapsi immuni difficili.
- Per aumentare il numero di cellule, istituito pozzi replicare e piscina dopo il punto 5 (fissazione).
NOTA: Quando si impostano i pozzi repliche, si consiglia di seminare DC in tutti i pozzi prima e poi le cellule T di semi in tutti i pozzi; questo riduce al minimo le discrepanze in tempo di incubazione tra i pozzetti.
- Per aumentare il numero di cellule, istituito pozzi replicare e piscina dopo il punto 5 (fissazione).
- Regolare il numero di cellule precisi empiricamente, ma come una guida generale, utilizzare 1 x 10 6 cellule T e 0,5 x 10 6 cellule dendritiche per pozzetto (piastra a 96 pozzetti). Questi dovrebbero essere considerati il numero minimo di cellule, perché l'utilizzo di un minor numero di cellule rende l'enumerazione delle sinapsi immuni difficili.
- Incubare la piastra per 4 ore a 37 ° C in atmosfera di CO 2 5%.
- Aggiungere 3 volte il volume di coltura del 1,5% formaldeide in PBS ad ogni pozzetto ed incubare a temperatura ambiente per 30 min; TT è importante fissare le cellule prima di rimuoverli dalla piastra per ridurre al minimo l'interruzione delle interazioni cellula-cellula.
- Trasferire le cellule nella piastra in provette per successivo lavaggio e colorazione. In questa fase, accantonato celle aggiuntive per i controlli singola macchia. Oltre a questi controlli, l'intera coltura deve essere trattata con il cocktail di anticorpi (vedere fase 4.1.1).
6. Le cellule Stain
- cellule macchia in 100 microlitri di tampone di lavaggio contenente un cocktail di anticorpi coniugati a fluorocromi desiderati per 30 min a temperatura ambiente, protetto dalla luce.
NOTA: Il cocktail comprende anticorpi specifici cellule e APC-specifici T. Fluorocromi dovrebbero essere scelti in modo che essi possono essere distinti utilizzando la configurazione dell'imaging citometro di flusso. in tsperimenta qui illustrati, blu fluoroforo-coniugato CD11b (5 ug / mL, consulta la tabella dei materiali) e CD90.2 APC-coniugato (5 ug / mL) sono stati utilizzati. - Lavare le cellule in 1 ml di tampone di lavaggio e centrifugare per 5 min a 400 x g. Decantare il surnatante. Risospendere le cellule in tampone perm-lavaggio contenente falloidina FITC a 0,05-0,5 mg / ml e incubare per 30 minuti a temperatura ambiente al riparo dalla luce.
NOTA: concentrazioni falloidina FITC di circa 0,1 ug / mL funzionano bene per le cellule di topo, ma la concentrazione appropriata dovrebbe variare da fornitore, tipo di cellula, e l'imaging citofluorimetro. - Lavare le cellule in 1 ml di perm / tampone di lavaggio e centrifugare per 5 min a 400 x g. Decantare il surnatante. Risospendere le cellule in tampone di perm / lavaggio contenenti colorante nucleare alla concentrazione appropriata (ad esempio, circa 25 ug / mL 7-AAD) e incubare per 30 minuti a temperatura ambiente al riparo dalla luce.
- Lavare la cellas in 1 mL di perm / tampone di lavaggio e centrifugare per 5 min a 400 x g. Decantare il surnatante. Lavare le cellule una volta in tampone di lavaggio, pellet e risospendere in 50 - 100 microlitri di tampone di lavaggio, trasferire le cellule a piccole provette da microcentrifuga capped.
- Procedere alla acquisizione dati immediatamente o conservare le cellule a 4 ° C al riparo dalla luce per fino a diversi giorni prima dell'acquisizione sull'imaging citofluorimetro.
NOTA: Le cellule sono stati memorizzati con successo in questo modo per un massimo di 7 giorni. una conservazione più lunga può essere possibile, ma non è stato testato.
7. acquisire dati
- Inizializzare e configurare il flusso di imaging citometro secondo le istruzioni del produttore. Garantire la stabilità del nucleo flusso prima di raccogliere i dati.
- Prenota un canale per l'acquisizione delle immagini in campo chiaro. Acquisire dati di controllo singola macchia con il canale in campo chiaro spento.
- Fare clic sul pulsante "Load" e insert una provetta contenente un campione completamente macchiato (un campione che è stato macchiato con tutti fluorocromi richiesti) nel supporto.
- Nella finestra "di lavoro", selezionare e creare una nuova dispersione con le proporzioni sopra dell'area e porta singoletti cui le proporzioni è vicino a 1. Creare un nuovo dispersione per ciascun canale utilizzato (intensità del canale sull'asse orizzontale) .
- Per ogni fluorocromo, controllare la popolazione positiva e, se necessario, regolare la tensione del laser nella casella "Illuminazione".
- Scaricare il tubo e caricare il primo tubo singolo macchiate.
- Nella casella "Impostazioni di acquisizione", digitare il nome del campione e impostare il numero di eventi che dovrebbero essere raccolti; se si tratta di una sola macchia (per i controlli di compensazione), 1.000 - 2.000 eventi sono sufficienti.
- Nella casella "Canali", selezionare i canali che ogni campione è stato macchiato con. Per i controlli singola macchia, tutti i canali dovrebbero essere selezionati con brightfield e laterale scatter off. Fare clic sul pulsante "Registra" sotto la casella "Acquisizione"; quando il numero di eventi raggiunge la soglia specificata, acquisizione si arresta automaticamente.
- Fare clic sul pulsante "Return" per scaricare il tubo. Ripetere i punti 7.2.4 - 7.2.6 per ogni controllo single-macchia. A seconda del citometro e software, potrebbe non essere possibile impostare tutte le porte indicate nella figura 1 durante l'acquisizione (più precisa gating viene eseguita durante l'analisi; vedere Sezione 8).
- Acquisire campioni per campioni singoli macchiate (in fase 7.2), ma nella casella "canali", selezionare tutti i canali che sono necessari, compreso il canale in campo chiaro.
- Prima di registrare dati, controllo per confermare che l'intensità canale appropriato per individuare le popolazioni cellulari desiderati. Altrimenti, regolare le impostazioni laser e registrare di controlli singola macchia utilizzando le nuove impostazioni, come descritto al punto 7.2.
- Per ciascunocampione, acquisiscono diverse decine di migliaia di eventi.
NOTA: In condizioni, eventi contatto cellula-cellula sono una piccola minoranza del numero totale di cellule (la maggior parte sono singole cellule). In generale, è desiderabile avere almeno 100 eventi nel cancello contatto membrana finale.
8. Analizzare i dati
- Analizzare i dati acquisiti sul flusso di imaging citometro utilizzando il software di analisi a disposizione gratuitamente dal sito del produttore (è necessario creare un account utente, vedere la tabella dei materiali).
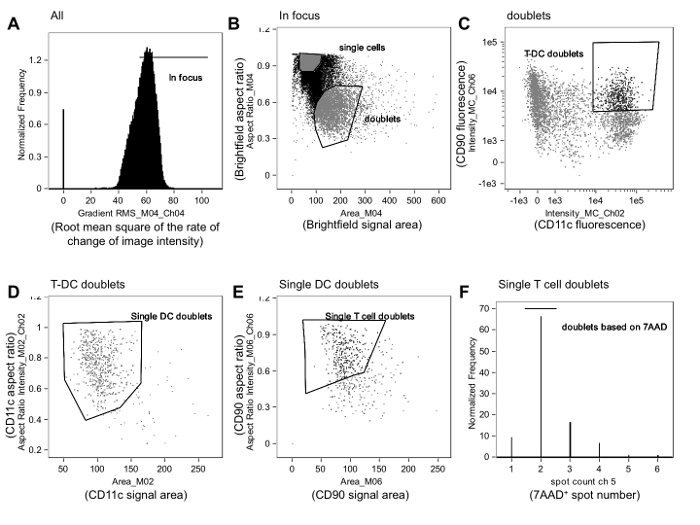
Figura 1. strategia di gating utilizzato per identificare alloreattive immunitario sinapsi. A. A fuoco eventi sono gated da tutti gli eventi rivedendo immagini cellulari basate sul valore quadratico medio della velocità di variazione del profilo di intensità dell'immagine (gradiente RMS) utilizzando il campo chiaro channel (Channel 4, Ch04), come descritto nel testo. B. Tra gli eventi in-fuoco, doppietti si distinguono dalle singole cellule tracciando le proporzioni rispetto zona per il canale in campo chiaro. Singole cellule sono raggruppate vicino al formato 1 e avere un'area più piccola, mentre doppietti sono vicini a 0.5 e avere una superficie maggiore. C. intensità di fluorescenza della APC (in questo caso, un marker delle cellule dendritiche [DC], CD11c) viene tracciata rispetto intensità di fluorescenza del marcatore cellule T (in questo caso, CD90.2), e gli eventi doppio positivi sono gated. Confini del cancello può essere raffinato, rivedendo le immagini di eventi vicino al confine. Doppietti D. T-APC vengono poi rifiniti in modo che contengono solo un APC tracciando le proporzioni contro l'area del marcatore di APC (CD11c, Ch02). Doppietti E. Questi single-APC sono poi rifiniti in modo che essi contengono una sola cellula T tracciando le proporzioni contro la zonadel marker delle cellule T (CD90.2, CH06). F. Infine, gli eventi che contengono solo due nuclei vengono selezionati tracciando un istogramma del numero di spot sul canale colorazione nucleare (7-AAD, CH05) e gating eventi che contengono solo i punti 2 7-AAD-positivi (cioè nuclei). Gli eventi in questa porta vengono analizzati per contatto membrana e formazione di sinapsi, come descritto nella Figura 2. I dati sono stati analizzati in cieco rispetto al trattamento assegnato e sono da un esperimento pubblicato in precedenza 23. Si prega di cliccare qui per vedere una versione più grande di questa figura.
NOTA: La strategia di gating è descritto in questa sezione ed è raffigurato in Figura 1. Analisi del flusso di imaging citometria di dati deve essere eseguita in cieco rispetto al trattamento assegnato. Anche se crediamo che le sinapsi immunitarie e non synaptic contatti sono generalmente facilmente distinguibili (vedi sotto e Figure 2 e 3), accecamento dovrebbero minimizzare le distorsioni derivanti dalla soggettività intrinseca di analisi dell'immagine.
- Generare una matrice di compensazione caricando i file di dati di controllo singola macchia nella procedura guidata compensazione. Dopo aver caricato i file singoli macchiati, selezionare i canali fluorescenti utilizzate nell'esperimento.
NOTA: Il software genera automaticamente una matrice di compensazione, ma questo dovrebbe essere convalidato manualmente per garantire che le popolazioni positivi corretti sono stati selezionati.- Doppio clic su un valore nella matrice e aggiungere i dati per l'area di analisi. Creare una nuova porta, se necessario, per escludere eventuali morti cellule / doppietti / falsi positivi; questa nuova popolazione positiva raffinato può essere selezionato nella casella matrice nel menu per ciascun canale giù.
- Ripetere questa operazione per ogni canale. Clicca su "Fine" per salvare il compensatiomatrice n (file .ctm).
- Ottenere un file di analisi dei dati (.daf) dal file raw (.RIF) caricando il file .RIF in software di analisi e applicando la matrice di compensazione.
- Una volta che i dati vengono caricati, eseguire gating per identificare gli eventi di contatto T-cellule APC.
NOTA: Una tipica strategia di gating consiste nell'individuare eventi a fuoco, selezionando doppietti basato su criteri dimensionali (zona contro proporzioni dell'evento), e selezionando T doppietti cellule APC come eventi che sono doppio positive per il T-cellulare e marcatori APC (Figura 1A-C).
NOTA: Il rapporto di aspetto è il rapporto tra la larghezza di un evento alla sua altezza, che consente la discriminazione di singole cellule (rapporto vicino a 1) da doppietti (rapporto vicino a 0,5). - Identificare gli eventi in-fuoco tracciando il valore quadratico medio della velocità di variazione del profilo di intensità di imaging (RMS gradiente) nel canale in campo chiaro (Figura 1A). Clicca su °e gradiente RMS istogramma da visualizzare eventi cellulari in singoli contenitori e quindi inserire un cancello escluse eventi out-of-focus.
- Tracciare la zona contro le proporzioni del canale in campo chiaro e disegnare una porta che identifica doppietti basata sulla forma e dimensione evento (Figura 1B). Rassegna di immagini di eventi appena dentro e fuori il confine di questa porta può aiutare l'analista per raffinare dimensione e la posizione del cancello. Poi, costruzione di un tracciato di questi eventi doppietto in cui compare l'intensità del marcatore di cellule T su un asse e appare l'intensità del marcatore APC dall'altro. Disegnare un cancello doppietto T-APC contenente eventi positivi per entrambi i marcatori.
- Tra gli eventi doppietto cellule T-APC, selezionare gli eventi che contengono solo una cellula T e uno APC.
- Fare questo tracciando le proporzioni rispetto area per il marcatore APC e gating su doppiette contenenti un singolo APC (Figura 1D). Tracciare le proporzioni rispetto zona per il marchio T-celluleer e la porta su doppiette contenenti una singola cellula T (Figura 1E).
NOTA: Ulteriore affinamento può essere ottenuta tracciando un istogramma della funzione numero di spot applicata a fluorescenza nucleare macchia e gating su eventi con solo due punti (Figura 1F).
- Fare questo tracciando le proporzioni rispetto area per il marcatore APC e gating su doppiette contenenti un singolo APC (Figura 1D). Tracciare le proporzioni rispetto zona per il marchio T-celluleer e la porta su doppiette contenenti una singola cellula T (Figura 1E).
- In alcuni casi, le due celle in un doppietto non sarà in contatto; per identificare le cellule in contatto tra loro, definiscono maschere oggetto per APC e cellule T.
- Utilizzare l'opzione "Maschere" nel menu Analysis per aprire il manager Maschere e definire una nuova maschera. Digitare un nome, come "maschera oggetto cellule T". Fare clic sul pulsante "Function", e nella finestra di dialogo, scegliere "Oggetto".
- Selezionare il canale in cui viene rilevato il marcatore T-cellulare (per esempio, CH06). Fai clic su "OK".
NOTA: "Object (M06, CH06, Stretto)" viene visualizzato nella casella funzione. Questa maschera oggetto predefinito di solito works bene, ma può richiedere l'ottimizzazione. - Ripetere questa procedura per creare una maschera oggetto APC nel canale appropriato.
- Dopo aver identificato le maschere APC e cellule T, determinare il contatto membrana tracciando marcatore intensità di fluorescenza delle cellule T nella maschera oggetto APC contro intensità di fluorescenza APC nella maschera oggetto T-cellule. Su questo terreno, disegnare un cancello che comprende solo le cellule in contatto tra loro.
NOTA: Tipicamente, ci sono abbastanza chiari popolazioni doppio-positivi e doppio negativo (Figura 2A). Il confine tra le popolazioni doppio-positivi e negativi doppio può essere impostato rivedendo immagini brightfield di celle nella regione di confine per assicurare che le cellule a contatto sono all'interno della porta e che le cellule non a contatto sono esclusi. - In questa fase, rivedere manualmente le immagini falloidina FITC di eventi all'interno di questa porta per distinguere sinapsi immuni mature dal semplice contatto cellula-cellula. USE la funzione "immagini di tag" per contrassegnare queste immagini.
NOTA: La percentuale di eventi categoria (sinapsi immuni) all'interno di questa porta può essere utilizzata come indice di alloreattività diretta nella popolazione delle cellule T in fase di studio.
Risultati
Questo metodo è stato utilizzato per studiare CD4 + alloreattività cellule T nei topi resi tolleranti a alloantigeni donatori prima eterotopico trapianto allogenico cardiaco. Topi CBA (H-2 k) hanno avuto un protocollo tolerizing costituito da un donatore-specifica (B6, H-2 b) trasfusione di sangue in combinazione con un anticorpo CD4 uno mese non riducono prima di ricevere un trapianto cardiaco B6. Questo protocollo risultati nella sopravvivenza del trapianto a lungo termine che dipende da linfociti T regolatori Foxp3 + 36, 37. Sette giorni dopo il trapianto, splenici cellule T CD4 + sono stati ottenuti da tolleranti e quelli riceventi non controllo tolleranti di allotrapianti cardiaci B6 e sono stati co-incubate con B6 osso DC derivate dal midollo secondo questo protocollo. La figura 2 mostra i dati rappresentativi di questo esperimento. Il cancello contatto membrana è mostrato in figura 2A, con mirino verdi disposti su un evento sinaptica (pannello di sinistra, 1) e su un evento non-sinaptica (pannello di destra). La Figura 2B mostra i canali campo chiaro e fluorescenza di questo evento. Per ridurre i pregiudizi, i dati sono stati analizzati con un osservatore cieco al trattamento assegnato 23. Come mostrato in diversi esempi in figura 3, sia dal non controllo tolleranti (Figura 3A-B) e controllo tolleranti (Figura 3C-D) CBA destinatari dei cuori B6, sinapsi sono facilmente distinguibili dai contatti non-sinaptici dalla presenza di una cresta FITC-positivo denso all'interfaccia T-APC. Questi risultati mostrano che rilevazione visiva delle sinapsi immuni fatte da cellule riceventi T tracce con il grado di alloreattività nel ricevente.
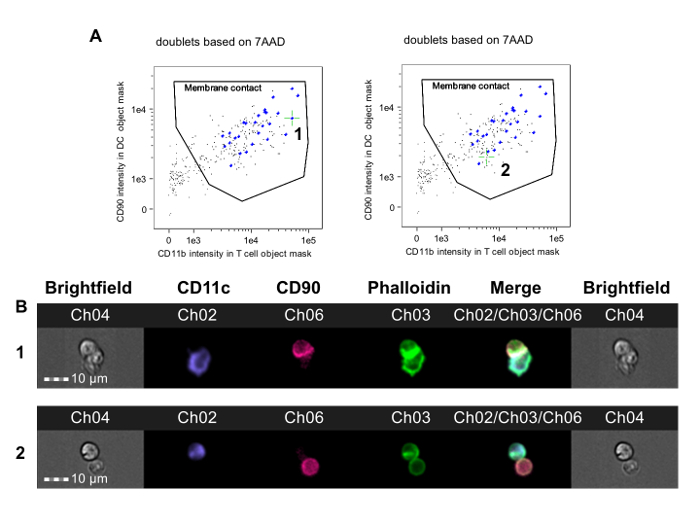
Figura 2. Identificazione di T-APC Doublets con membranaContatto e Formazione Synapse immunitario. Eventi nel cancello doppietto finale (figura 1F) vengono analizzati. A. marcatore delle cellule T di fluorescenza nella maschera oggetto APC è tracciata contro APC marcatore fluorescente nella maschera oggetto DC. Alcuni eventi hanno un doppietto APC e una cellula T senza contatto cellula-cellula e appaiono nell'angolo in basso a sinistra del grafico (immagini non mostrato). Un cancello contatto membrana è pertanto possibile stabilire che include solo doppietti in cui le cellule T e APC sono in contatto. Immagini di ogni evento in questa porta sono rivisti per la prova di actina citoscheletro riarrangiamento nel canale falloidina-FITC e possono essere etichettati utilizzando il software di analisi. Il pannello di sinistra indica un evento sinapsi immune (contrassegnata con 1 e indicato con mirino verdi), mentre il pannello di destra indica un evento contatto membrana senza formazione di sinapsi immune (etichettati 2 ed indicato con reticolo verde). La determinazione della formazione di sinapsi richiede revisione manuale di questiimmagini, mostrato in B. B. La riga superiore mostra campo chiaro e canali di fluorescenza immagini per un doppietto con una sinapsi immune (corrisponde all'evento 1 in A); la fila inferiore mostra un doppietto con contatto membrana ma manca formazione sinapsi (corrisponde all'evento 2 in A). I dati sono stati analizzati in cieco rispetto al trattamento assegnato e sono da un esperimento pubblicato in precedenza 23. Si prega di cliccare qui per vedere una versione più grande di questa figura.
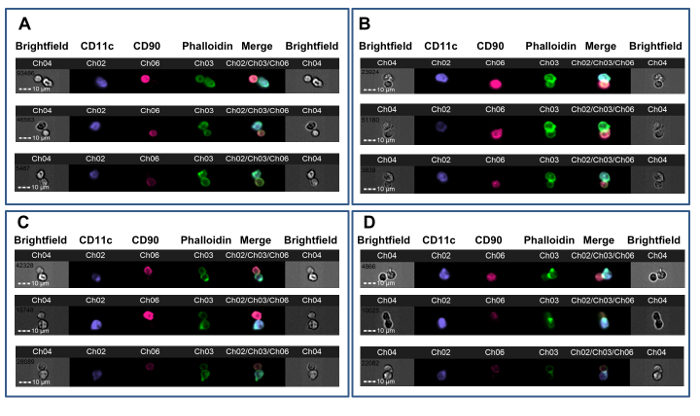
Figura 3. Esempi di T-APC Synapse Formation. Topi CBA ricevuti allotrapianti cardiaci da donatori B6 dopo o senza pre-trattamento (AB) o dopo l'induzione della tolleranza con sangue intero B6 sotto la copertura di un anticorpo anti-CD4 non-ozono ( rong> CD). Dopo 7 giorni, splenici cellule T CD4 + sono stati testati per la formazione di sinapsi con DC B6. A. Tre esempi di doppietti non-sinaptici con contatto a membrana da un animale non controllo tolleranti. B. Tre esempi di sinapsi immuni da un animale non controllo tolleranti. C. Tre esempi di doppietti non-sinaptici con contatto a membrana da un animale controllo tolleranti. D. Tre esempi di sinapsi immuni da un animale controllo tolleranti. formazione delle sinapsi è indicato dalla presenza di un brillante, cresta FITC-positivo all'interfaccia T-APC (Ch03). I dati sono stati analizzati in cieco rispetto al trattamento assegnato e sono da un esperimento pubblicato in precedenza 23. Si prega di cliccare qui per vedere una versione più grande di questa figura.
Tabella 1. Gli anticorpi e coloranti utilizzati in questo studio. anticorpi fluorocromo-coniugati, coloranti, fornitori, e le concentrazioni raccomandate sono presentati nella tabella. Il flusso di imaging citometro canale che è stato utilizzato per rilevare ogni fluorocromo è anche mostrato nella tabella.
Discussione
Imaging flusso citometria è stato usato per dimostrare la formazione di sinapsi immune tra cellule T e APC monoclonali o in presenza di superantigeni 24, 25, 26, 27, 28. Questo metodo sfrutta il fatto che dopo un cellule T-APC contatto produttivo, la cellula T cambia la sua citoscheletro actina, polarizzando verso il sito di contatto 21. Questo riarrangiamento non avviene senza segnalazione TCR, ed è quindi un correlato precoce di attivazione delle cellule T 19, 20, 21. Il metodo qui presentato si adatta questo approccio alla misurazione della frequenza alloreattive cellule T in policlonali popolazioni di cellule T. Come tale, essa può in futuro servire come base per lo sviluppo di test per reactivi donatore ty nel trapianto clinica.
Anche se i confronti diretti non sono ancora stati fatti, l'individuazione di alloreattive sinapsi immuni sembra avere potere predittivo superiore rispetto alla tradizionale MLR. Ad esempio, lavori precedenti hanno dimostrato che, nel protocollo tolerizing sopra descritto, i risultati di una MLR riescono a correlare in modo affidabile con innesto risultato 2.
Un certo numero di saggi sono stati sviluppati per lo stato operativo tolleranza nell'uomo 9, 10, 11, anche se questi non misurano la funzione delle cellule effettrici in risposta a alloantigene. Al contrario, IFNy ELISPOT Saggi funzione 8 misura effettore cellule T ma non può catturare l'intero spettro di secrezione di citochine che possono essere relativo al rigetto del trapianto acuto e cronico, quali IL-17 38,> 39. Il saggio diluizione limitante 4, che è laborioso, e il saggio trans-vivo 6, che richiede i topi, hanno importanti limitazioni pratiche che impedirebbero la loro applicazione in ambito clinico. Recenti miglioramenti sull'analisi di cellule proliferanti utilizzando TCR analisi della sequenza di cellule T che rispondono in MLR possono essere di valore, ma come il saggio qui presentato, richiedono ulteriore validazione in studi clinici 18, 40.
Ulteriore sviluppo del test di rilevamento sinapsi immunitaria richiederà che un certo numero di questioni importanti rispondere. In primo luogo, il saggio come sviluppato misura solo alloreattività diretta. La via diretta prevede la presentazione di allogenici complessi MHC / peptide su APC donatore-derivati. Queste ultime sono in genere eliminati rapidamente dopo il trapianto, e l'ulteriore presentazione alloantigene è carricato da APC beneficiari presentano intatta donatore MHC (via semi-diretto) o antigeni donatore trasformati in sé MHC (via indiretta). Il percorso indiretto è un importante fattore di rigetto cronico 33, 41.
In linea di principio, dovrebbe essere possibile individuare le sinapsi immuni indiretti da questo test, ma indirettamente alloreattive cellule T hanno una frequenza molto più bassa di quelli diretti 42, 43, il che significa che sarà necessaria l'analisi di un maggior numero di eventi. Una seconda considerazione è che abbiamo testato soltanto questo saggio utilizza cellule T CD4 +, mentre le cellule T CD8 + sono anche una componente importante della risposta anti-donatore. Ancora una volta, dovrebbe essere possibile rilevare sinapsi T CD8 + cellule APC utilizzando questo metodo. Un'altra limitazione è che il metodo richiede l'esame manuale e l'analisi delle immagini cellulari in memb finalecancello contatto rane e stiamo lavorando l'automazione di questa fase.
Infine, il metodo richiede sperimentazione e sviluppo in soggetti umani, e sono attualmente in corso studi preliminari con campioni umani. Ulteriori fenotipica sottoinsieme di analisi delle cellule T (vale a dire, effettrici, la memoria, normativo, ecc) in combinazione con il rilevamento di sinapsi del sistema immunitario nei pazienti trapiantati rappresenterebbe un approccio potente per la caratterizzazione del repertorio delle cellule T alloreattive e sarà un focus importante per lavoro futuro.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
SCJ è stato sostenuto da un'International Society for Heart Lung Transplantation Research Fellowship e un Royal College of Physicians e chirurghi del Canada Detweiler Viaggiare Fellowship.SM stato sostenuto in parte da un'International Society for Heart Lung Transplantation Career Development Award (a SCJ). SS è stato sostenuto dal National Institutes of Health Research Oxford Biomedical Research Centre.JH è il destinatario di un rene Research Fellowship UK anziano non clinici. Questo lavoro è stato finanziato dalle seguenti sovvenzioni per AB e KW: un Wellcome Trust Grant Program (082519Z07Z), un British Heart Foundation Grant Program (PG / 10 / 62,28,504 mila), e il programma dell'Unione europea quadro 7 (uno studio; BioDRIM). Gli autori desiderano ringraziare Michael Parsons e il meccanismo di citometria a flusso Nucleo presso l'Istituto di Ricerca Lunenfeld-Tanenbaum, Sinai Health System, Toronto per la fornitura di accesso e il supporto con lo strumento ImageStream Mark X.
Materiali
| Name | Company | Catalog Number | Comments |
| Phosphate-buffered saline | Various | Varies | |
| Ethylenediamenetetraacetic acid, 0.5 M solution | Thermo Fisher Scientific | AM9260G | |
| Triton X-100 nonionic detergent | Sigma-Aldrich | X100 | |
| Beta-mercaptoethanol | Sigma-Aldrich | M3148 | |
| Dimethyl sulfoxide | Sigma-Aldrich | D8418 | |
| Formaldehyde | Sigma-Aldrich | F1635 | Solution is 37% formaldehyde and so must be diluted 25 times for 1.5% solution |
| Cell strainers, 70 μm pore size | Fisher Scientific | 08-771-2 | |
| Phalloidin-fluorescein isothiocyanate | Sigma-Aldrich | P5282 | |
| 7-aminoactinomycin D | Thermo Fisher Scientific | A1310 | Reconstitute in DMSO |
| Allophycocyanin-conjugated anti-mouse CD90.2 | eBioscience | 17-0902 | |
| Pacific blue-conjugated anti-mouse CD11b | eBioscience | 48-0112 | Pacific blue has been replaced by eFluor 450 |
| Biotinylated anti-mouse CD3 | eBioscience | 13-0032 | |
| Biotinylated anti-mouse MHC class II | eBioscience | 13-5321 | |
| Biotinylated anti-mouse B220 | eBioscience | 13-0452 | |
| Biotinylated anti-mouse CD8 | eBioscience | 13-0081 | |
| Biotinylated anti-mouse CD19 | eBioscience | 13-0193 | |
| Anti-biotin microbeads | Miltenyi Biotec | 130-090-485 | |
| LS columns | Miltenyi Biotec | 130-042-401 | |
| MidiMACS magnetic cell separator | MIltenyi Biotec | 130-042-302 | |
| recombinant mouse GM-CSF | Peprotech | 315-03 | |
| recombinant human TGFβ1 | Peprotech | 100-21 | Human TGFβ1 has activity on mouse cells |
| Amnis ImageStream X Mark II | Amnis/EMD Millipore | N/A | Imaging flow cytometer; details available at http://www.emdmillipore.com/ |
| IDEAS Software | Amnis/EMD Millipore | N/A | Free download (registration required): https://www.amnis.com/index.php/page/Display/login%20%20 |
| Cell culture medium | Various | Varies | |
| Fetal bovine serum | Various | Varies | |
| Cell culture plates | Various | Varies |
Riferimenti
- Cravedi, P., Heeger, P. S. Immunologic monitoring in transplantation revisited. Curr Opin Organ Transplant. 17 (1), 26-32 (2012).
- Pearson, T. C., et al. The assessment of transplantation tolerance induced by anti-CD4 monoclonal antibody in the murine model. Transplantation. 55 (2), 361-367 (1993).
- Strober, S., Benike, C., Krishnaswamy, S., Engleman, E. G., Grumet, F. C. Clinical transplantation tolerance twelve years after prospective withdrawal of immunosuppressive drugs: studies of chimerism and anti-donor reactivity. Transplantation. 69 (8), 1549-1554 (2000).
- Fussell, S. T., Donnellan, M., Cooley, M. A., Farrell, C. Cytotoxic T lymphocyte precursor frequency does not correlate with either the incidence or severity of graft-versus-host disease after matched unrelated donor bone marrow transplantation. Transplantation. 57 (5), 673-676 (1994).
- Roelen, D. L., et al. Relevance of cytotoxic alloreactivity under different immunosuppressive regimens in clinical islet cell transplantation. Clin Exp Immunol. 156 (1), 141-148 (2009).
- VanBuskirk, A. M., et al. Human allograft acceptance is associated with immune regulation. J Clin Invest. 106 (1), 145-155 (2000).
- Poggio, E. D., Clemente, M., Hricik, D. E., Heeger, P. S. Panel of reactive T cells as a measurement of primed cellular alloimmunity in kidney transplant candidates. J Am Soc Nephrol. 17 (2), 564-572 (2006).
- Zitzner, J. R., Tambur, A. R. Role of ELISPOT Assays in Risk Assessment Pre- and Post-Kidney Transplantation. Cells. 1 (2), 100-110 (2012).
- Newell, K. A., et al. Identification of a B cell signature associated with renal transplant tolerance in humans. J Clin Invest. 120 (6), 1836-1847 (2010).
- Brouard, S., et al. Identification of a peripheral blood transcriptional biomarker panel associated with operational renal allograft tolerance. Proc Natl Acad Sci U S A. 104 (39), 15448-15453 (2007).
- Sagoo, P., et al. Development of a cross-platform biomarker signature to detect renal transplant tolerance in humans. J Clin Invest. 120 (6), 1848-1861 (2010).
- Halloran, P. F., Famulski, K. S., Reeve, J. Molecular assessment of disease states in kidney transplant biopsy samples. Nat Rev Nephrol. 12 (9), 534-548 (2016).
- Li, L., et al. Identification of common blood gene signatures for the diagnosis of renal and cardiac acute allograft rejection. PLoS One. 8 (12), e82153(2013).
- Khatri, P., et al. A common rejection module (CRM) for acute rejection across multiple organs identifies novel therapeutics for organ transplantation. J Exp Med. 210 (11), 2205-2221 (2013).
- Halloran, P. F., et al. Microarray diagnosis of antibody-mediated rejection in kidney transplant biopsies: an international prospective study (INTERCOM). Am J Transplant. 13 (11), 2865-2874 (2013).
- Mastoridis, S., Issa, F., Wood, K. J. Novel biomarkers and functional assays to monitor cell-therapy-induced tolerance in organ transplantation. Curr Opin Organ Transplant. 20 (1), 64-71 (2015).
- Miqueu, P., et al. Analysis of the peripheral T-cell repertoire in kidney transplant patients. Eur J Immunol. 40 (11), 3280-3290 (2010).
- Morris, H., et al. Tracking donor-reactive T cells: Evidence for clonal deletion in tolerant kidney transplant patients. Sci Transl Med. 7 (272), 272ra210(2015).
- Dustin, M. L., Bromley, S. K., Kan, Z., Peterson, D. A., Unanue, E. R. Antigen receptor engagement delivers a stop signal to migrating T lymphocytes. Proc Natl Acad Sci U S A. 94 (8), 3909-3913 (1997).
- Goldsmith, M. A., Weiss, A. Early signal transduction by the antigen receptor without commitment to T cell activation. Science. 240 (4855), 1029-1031 (1988).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Stoll, S., Delon, J., Brotz, T. M., Germain, R. N. Dynamic imaging of T cell-dendritic cell interactions in lymph nodes. Science. 296 (5574), 1873-1876 (2002).
- Juvet, S. C., Sanderson, S., Hester, J., Wood, K. J., Bushell, A. Quantification of CD4(+) T Cell Alloreactivity and Its Control by Regulatory T Cells Using Time-Lapse Microscopy and Immune Synapse Detection. Am J Transplant. 16 (5), 1394-1407 (2016).
- Ahmed, F., Friend, S., George, T. C., Barteneva, N., Lieberman, J. Numbers matter: quantitative and dynamic analysis of the formation of an immunological synapse using imaging flow cytometry. J Immunol Methods. 347 (1-2), 79-86 (2009).
- Burbach, B. J., et al. Distinct regulation of integrin-dependent T cell conjugate formation and NF-kappa B activation by the adapter protein ADAP. J Immunol. 181 (7), 4840-4851 (2008).
- Markey, K. A., et al. Cross-dressing by donor dendritic cells after allogeneic bone marrow transplantation contributes to formation of the immunological synapse and maximizes responses to indirectly presented antigen. J Immunol. 192 (11), 5426-5433 (2014).
- Moreau, H. D., et al. Dynamic in situ cytometry uncovers T cell receptor signaling during immunological synapses and kinapses in vivo. Immunity. 37 (2), 351-363 (2012).
- Wabnitz, G. H., Nessmann, A., Kirchgessner, H., Samstag, Y. InFlow microscopy of human leukocytes: A tool for quantitative analysis of actin rearrangements in the immune synapse. J Immunol Methods. , (2015).
- Ford, W. L., Simmonds, S. J., Atkins, R. C. Early cellular events in a systemic graft-vs.-host reaction. II. Autoradiographic estimates of the frequency of donor lymphocytes which respond to each Ag-B-determined antigenic complex. J Exp Med. 141 (3), 681-696 (1975).
- Macedo, C., et al. Contribution of naive and memory T-cell populations to the human alloimmune response. Am J Transplant. 9 (9), 2057-2066 (2009).
- Noorchashm, H., et al. A direct method for the calculation of alloreactive CD4+ T cell precursor frequency. Transplantation. 67 (9), 1281-1284 (1999).
- Suchin, E. J., et al. Quantifying the frequency of alloreactive T cells in vivo: new answers to an old question. J Immunol. 166 (2), 973-981 (2001).
- Lee, R. S., et al. Indirect recognition of allopeptides promotes the development of cardiac allograft vasculopathy. Proc Natl Acad Sci U S A. 98 (6), 3276-3281 (2001).
- Pickl, W. F., et al. Molecular and functional characteristics of dendritic cells generated from highly purified CD14+ peripheral blood monocytes. J Immunol. 157 (9), 3850-3859 (1996).
- Inaba, K., et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. J Exp Med. 176 (6), 1693-1702 (1992).
- Francis, R. S., et al. Induction of transplantation tolerance converts potential effector T cells into graft-protective regulatory T cells. Eur J Immunol. 41 (3), 726-738 (2011).
- Saitovitch, D., Bushell, A., Mabbs, D. W., Morris, P. J., Wood, K. J. Kinetics of induction of transplantation tolerance with a nondepleting anti-Cd4 monoclonal antibody and donor-specific transfusion before transplantation. A critical period of time is required for development of immunological unresponsiveness. Transplantation. 61 (11), 1642-1647 (1996).
- Faust, S. M., et al. Role of T cell TGFbeta signaling and IL-17 in allograft acceptance and fibrosis associated with chronic rejection. J Immunol. 183 (11), 7297-7306 (2009).
- Yuan, X., et al. A novel role of CD4 Th17 cells in mediating cardiac allograft rejection and vasculopathy. J Exp Med. 205 (13), 3133-3144 (2008).
- Emerson, R. O., Mathew, J. M., Konieczna, I. M., Robins, H. S., Leventhal, J. R. Defining the alloreactive T cell repertoire using high-throughput sequencing of mixed lymphocyte reaction culture. PLoS One. 9 (11), e111943(2014).
- Stanford, R. E., Ahmed, S., Hodson, M., Banner, N. R., Rose, M. L. A role for indirect allorecognition in lung transplant recipients with obliterative bronchiolitis. Am J Transplant. 3 (6), 736-742 (2003).
- Benichou, G., Valujskikh, A., Heeger, P. S. Contributions of direct and indirect T cell alloreactivity during allograft rejection in mice. J Immunol. 162 (1), 352-358 (1999).
- Liu, Z., et al. Contribution of direct and indirect recognition pathways to T cell alloreactivity. J Exp Med. 177 (6), 1643-1650 (1993).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon