Method Article
Selezione ambientale di hydrophila dell'aeromonas, Mycobacterium spp. e Pseudocapillaria tomentosa in Zebrafish sistemi
In questo articolo
Riepilogo
Questo protocollo descrive l'uso di tamponi di pozzetto e analisi dei fanghi, dei sistemi di zebrafish, che conduce alla rilevazione aumentata rispetto all'utilizzo esclusivo di sentinelle per rilevare gli agenti patogeni quali Aeromonas hydrophila, Mycobacterium spp. e Tomentosa di Pseudocapillaria. Viene proposto anche un sistema per monitorare le uova p. tomentosa in quarantena.
Abstract
Sistemi di monitoraggio di salute vengano sviluppati e utilizzati in strutture di ricerca di zebrafish, perché gli agenti patogeni di Danio rerio quali Aeromonas hydrophila, Mycobacterium spp. e Pseudocapillaria tomentosa hanno il potenziale di compromettere la ricerca e benessere degli animali. I pesci sono in genere analizzati post-mortem per rilevare i microbi. L'uso di sentinelle è un modo suggerito per migliorare la sensibilità della sorveglianza e per ridurre il numero di animali per assaggiare. L'impostazione di un serbatoio di pre-filtrazione sentinella fuori di un sistema di ricircolo è descritto. La tecnica è sviluppata per prevenire l'inquinamento delle acque e di rappresentare la popolazione di pesci da un'attenta selezione di età, sesso e ceppi. Per poter utilizzare il minimo numero di animali, tecniche di schermare l'ambiente sono anche dettagliate. Polymerase Chain Reaction (PCR) su tamponi di superficie pozzetto viene utilizzato per migliorare significativamente la rilevazione di alcune specie micobatterica prevalente e patogeni quali Mycobacterium fortuitum, Mycobacterium haemophilume I chelonae del micobatterio. Un altro metodo ambientale consiste nell'elaborazione i fanghi nella parte inferiore di un serbatoio o il pozzetto per cercare le uova p. tomentosa . Si tratta di una tecnica a buon mercato e veloce che può essere applicata in quarantena dove un dispositivo di allevamento è sommersa nel serbatoio di ritenzione degli animali importati. Infine, PCR è applicato al campione dei fanghi e a. hydrophila è rilevato al basso e la superficie del pozzetto. Generalmente, queste tecniche di screening ambientale applicate a questi patogeni specifici hanno portato ad una maggiore sensibilità rispetto ai test di pre-filtrazione sentinelle.
Introduzione
Al fine di proteggere la ricerca e benessere degli animali1,2, la presenza di agenti patogeni viene monitorata all'interno di strutture per animali. Nel caso di zebrafish,3,4,5,6,7,8,9,10,11 di monitoraggio dello stato spesso si basa su animali analizzati post-mortem di istopatologia, cultura di batteriologia o metodi molecolari. Test solo animali di Colonia non è il metodo consigliato a causa del numero di pesci e relative spese che sarebbero necessari per rilevare gli agenti patogeni di bassa prevalenza. Di conseguenza, il metodo preferito consiste nell'esporre un piccolo gruppo di animali a un più alto carico di contaminanti. Questi pesci sono chiamati pre-filtrazione sentinelle. Questa esposizione dura per mesi e comporta un aumento del carico di lavoro di cura degli animali e/o qualche soluzione di ingegneria costruito appositamente. Un'altra sfida è la proiezione di linee importate in quarantena dove gli animali fertili sono debba essere mantenuto in vita e questo non è compatibile con le analisi di routine sulle carcasse.
Qui descriviamo alcuni metodi per rilevare determinati patogeni di zebrafish (a. hydrophila, Mycobacterium spp. e p. tomentosa) di ambiente di sistema acquatico di screening. L'obiettivo è di ridurre il numero dei pesci utilizzati per il monitoraggio sanitario e per ottimizzare il fatturato, costo e la sensibilità della rilevazione. Tali metodi sono un'alternativa all'uso di animali e alcune tecniche possono essere applicate alle importazioni di screening in quarantena. Ad esempio, Mocho9 era in grado di identificare altre specie micobatteriche patogene eseguendo PCR su tamponi di pozzetto anziché su zebrafish (tra cui sentinelle), e questo è stato ottenuto con un minor numero di campioni. In quanto stesso studio, p. tomentosa uova sono state rilevate con più sensibilità schermando i fanghi di serbatoio mediante flottazione e microscopia elettronica piuttosto che test pesce mediante PCR e l'istopatologia.
La tabella 1 riassume le varie caratteristiche di sentinella programmi3,4,5,6,7,8,9,10 utilizzato da un numero di strutture di zebrafish. Post-filtrazione sentinelle ricevono acqua nello stesso modo come qualsiasi pesce di Colonia, mentre pre-filtrazione sentinelle ricevono l'acqua una volta che ha fatto circolare attraverso vasche di pesci di Colonia in primo luogo. Ad esempio, sentinelle di pre-filtrazione possono essere impostare il sistema di ricircolo continuamente ricevendo acqua del pozzetto. Questo non può essere un'opzione quando ci sono molti sistemi indipendenti in una stanza. In questo caso, un carro armato di pre-filtrazione sentinelle consente di schermare l'intera stanza. Le sentinelle sono in un serbatoio statico, il sistema di ricircolo, e l'acqua viene cambiata regolarmente, usando solo pre-filtrazione acqua cioè, acqua del pozzetto da tutti i sistemi in camera. Questa tecnica è descritta qui di seguito come base per il confronto con l'efficacia dello screening ambientale. L'allestimento proposto è progettato per controllare i problemi di qualità di acqua come una diminuzione del pH o un inquinamento di azoto.
Il concetto dello screening ambientale batterico si basa sull'ipotesi che i batteri sono rilevabili nel biofilm come quello trovato sul muro pozzetto alla superficie dell'acqua o nel fango nella parte inferiore di un carro armato. Il pozzetto sembra un punto di campionamento ideale in un sistema di ricircolo acquacoltura poiché raccoglie rifiuti (acqua, feci, mangimi e altro materiale organico) da tutti i serbatoi pre-filtrazione. La superficie del pozzetto è spesso facilmente raggiungibile, la scovolatura è veloce e può essere eseguita in modo asettico per evitare la contaminazione del campione (da guanti per esempio). Il concetto viene utilizzato per identificare spp Mycobacterium patogeno prevalente in zebrafish sistemi9,12. La tecnica è descritta di seguito e anche stiamo segnalando rilevazione di a. hydrophila in zebrafish pozzetto tamponi superficiali e fanghi.
Lo screening ambientale per uova di parassiti è basato sulla rilevazione di Murray et al. 13 e la tecnica di galleggiamento è usato ordinariamente per Parassitologia e screening microscopico di uova di parassiti nelle feci14. Mocho9 proposto un'alternativa al processo di campionamento e ha mostrato che la tecnica potrebbe essere usata per rilevare altre specie del biotopo pesce. Infetti d. rerio passare p. tomentosa uova con le feci e le uova del parassita rimangono nella parte inferiore del serbatoio, nel fango. Ci possono essere raccolti a causa della loro densità maggiore di acqua. La densità delle uova viene utilizzata per elaborare il campione ambientale troppo. Un primo flottazione con centrifugazione separa acqua e detriti leggeri dalla materia più pesante. Una seconda centrifugazione si basa sulla soluzione di zucchero saturo (con una densità maggiore densità delle uova di p. tomentosa ) per consentire le uova del parassita ad emergere sulla superficie del tubo.
Lo screening per i batteri nel biofilm e per p. tomentosa dalla parte inferiore del serbatoio possa essere combinato mediante l'esecuzione di PCR per tutti questi agenti patogeni sul sedimento del campione dei fanghi ottenuti dopo la centrifugazione prima. Ciò consente di ottimizzare il tempo di campionamento. Il metodo è descritto di seguito. Proponiamo inoltre di utilizzare queste tecniche in un contesto di quarantena. Per schermare importati zebrafish adulto che hanno bisogno di essere mantenuto in vita, viene inserito un dispositivo di allevamento alla vasca di quarantena. Dopo una settimana, le feci e altri materiali di scarto nel dispositivo allevamento vengono raccolti e schermati da microscopia o PCR. La tecnica è descritta di seguito e alcune uova di p. tomentosa sono stati rilevati da microscopia in questo contesto.
Protocollo
1. esposizione di pre-filtrazione sentinelle fuori di un sistema di ricircolo
-
Impostare un pulito serbatoio 8 L fuori di un sistema di ricircolo. Riempire con acqua proveniente da pozzetti. Aggiungere 2 perle in ceramica o una spugna di cubi di bio-media dai sistemi a schermo (Figura 1). Aggiungere 1-2 d. rerio/L (cioè, 12 pesci). Utilizzare il tipo selvaggio pesce del background genetico dominante nella struttura, ad esempio AB.
- Selezionare almeno 6 pesci come segue: almeno una femmina e un maschio di età inferiore a 6 mesi di età, una femmina e un maschio tra 6 e 18 mesi e una femmina e un maschio sopra 18 mesi di età.
-
Mangiare una volta al giorno. Variare le diete (ad es., dieta asciutta, gambero di salamoia) per assicurarsi che le sentinelle sono esposti a tutte le diete utilizzate nella struttura zebrafish. Cambiare l'acqua il lunedì, mercoledì e venerdì, cioè, tre volte a settimana per 4 mesi.
- Effettuare il cambio dell'acqua, trasferimento sentinelle e bio-media in un serbatoio temporaneo. Svuotare completamente il serbatoio di sentinella e pulirlo. Riempire il serbatoio di sentinella con solo acqua del pozzetto. Rimettere le sentinelle e i bio-media.
- Esporre le sentinelle per 4 mesi di acqua del pozzetto. Eutanasia il pesce da un metodo approvato come l'immersione in una soluzione di sovradosaggio del 2-fenossietanolo (3 mL/L).
-
Per confermare la morte, attendere 10 min dopo cessazione del movimento opercoli.
- Afferrare il cadavere con il forcipe e congelarlo a-80 ° C in un contenitore identificato. Verrà utilizzato per PCR12,15.
- In alternativa, tagliare il tailat il peduncolo caudale, nick la parete addominale e impostare in formalina 4%.
Attenzione: Utilizzare guanti e armadietto per l'istopatologia di fumi. Etichettare il contenitore del campione.
2. pozzetto tamponi
- Utilizzare un tampone sterile asciutto con un albero di plastica. Indossare i guanti. Individuare la superficie a tampone (parete del pozzetto alla superficie dell'acqua) e rimuovere qualsiasi elemento impedendo l'accesso facile alla superficie. Scegliere una superficie pozzetto con basso flusso.
-
Sguainare il tampone rimuovendo l'imballaggio esterno ed esporre la punta di cotone sterile all'aria. Evitare la contaminazione incrociata del tampone di avendo cura di non toccare le superfici non testate.
- La parete del pozzetto oltre il 5-10 cm per assorbire l'acqua e biofilm a livello superficiale di pozzetto acqua del tampone.
- Il tampone posteriore del fodero o rompere la punta in una provetta sterile. Etichettare il campione e inviare per il test di PCR o congelare a-80 ° C.
3. rilevamento di p. tomentosa uova nella parte inferiore di un carro armato
-
Analisi dei fanghi da microscopia
- Utilizzare una siringa di 60 mL9 per aspirare i fanghi nella parte inferiore di un pozzetto o qualsiasi serbatoio di pesce tra cui sentinelle della tenuta. Dividere il campione in provette da 15 mL. Chiudere le provette con i tappi a vite ed etichettare le provette.
- Preparare la soluzione di zucchero saturata (peso specifico = 1.27) mescolando 227 g di zucchero semolato in 177 mL di acqua calda con un agitatore magnetico14.
- Centrifugare le provette da 15 mL a 175-250 x g per 10 min in una centrifuga con secchi di oscillazione. Decantare le provette e mantenere il sedimento in loro tubo.
- Riempire i tubi a metà strada con la soluzione saturata di zucchero. Chiudere le provette con il loro tappo a vite e mescolare bene il sedimento con la soluzione.
- Posizionare i tubi nei secchi dell'oscillazione centrifuga e riempirli con soluzione saturato di zucchero verso l'alto. Impostare una copertura in vetro delicatamente sulla cima di ogni tubo e a contatto con la soluzione saturata di zucchero.
- Centrifuga a 175-250 x g per 10 min. nota che qualche vetro di copertura possono cadere e rompersi durante la centrifugazione da qui ci sono 4 tubi per ciascun campione di 60 mL. Sollevare la copertura in vetro e metterlo su un vetrino. Etichettare la diapositiva con una penna, matita o pennarello.
- Nel caso in cui si verificano troppe rotture di vetro di copertura, riempire la maggior parte del tubo con la soluzione di zucchero saturata, centrifugare a 175-250 x g per 10 min, riempire fino alla parte superiore con la soluzione di zucchero saturata, quindi impostare delicatamente il vetro di copertura. Attendere 30 min.
- Cercare le uova di p. tomentosa con il microscopio13 (Figura 2 e Video 1). Identificare le spine bipolari a ingrandimento 400 X6.
Nota: La dimensione delle uova è 57-78 µm di lunghezza e 27-39 µm diametro16,17. Notare che una diapositiva positiva è sufficiente per il campione di 60 mL essere dichiarato positivo.
-
Lo screening importato animali in quarantena per uova di p. tomentosa
- Impostare maschio e femmina d. rerio in un serbatoio. Aggiungere al serbatoio un dispositivo normalmente utilizzato per raccogliere e conservare le uova generate ma usarlo qui per raccogliere le feci (Figura 3).
Nota: ad esempio, un serbatoio pieno di allevamento 1 L (serbatoio esterno e interno del carro armato con fondo grattugiato) è completamente sommerso in un serbatoio 13 L, consentendo il libero accesso per i pesci di muoversi dentro e fuori il dispositivo di riproduzione. - Rimuovere il dispositivo di riproduzione dopo una settimana e raccolto i fanghi raccolti nel dispositivo di riproduzione, come descritto nel passo 3.1 "analisi dei fanghi da microscopia."
- Impostare maschio e femmina d. rerio in un serbatoio. Aggiungere al serbatoio un dispositivo normalmente utilizzato per raccogliere e conservare le uova generate ma usarlo qui per raccogliere le feci (Figura 3).
4. PCR su sedimenti di fango
- Aspirare i fanghi nella parte inferiore di un carro armato o il pozzetto con una siringa di 60 mL9 e trasferire il campione in una provetta di 60 mL. Tappare la provetta con il tappo a vite ed etichettare la provetta. Smaltire la siringa.
- Agitare il tubo da 60 mL e trasferire 15 mL in una provetta da 15 mL. Tappare la provetta con il tappo a vite ed etichettare la provetta.
- Centrifugare la provetta da 15 mL a 175-250 x g per 10 min in una centrifuga con secchi di oscillazione. Decantare le provette e mantenere il sedimento nel tubo.
-
Sfoderare un tampone rimuovendo l'imballaggio esterno ed esporre la punta di cotone sterile all'aria. Evitare la contaminazione incrociata del tampone di avendo cura di non toccare le superfici non testate.
- Il sedimento del tampone nel tubo per 15 s.
- Il tampone posteriore del fodero o rompere la punta in una provetta sterile. Etichettare il campione, congelare a-80 ° C e inviare per il test PCR.
Nota: 45 mL rimangono nel tubo 60 mL. Questo può essere tenuto per il rilevamento di p. tomentosa uova con analisi dei fanghi da microscopia come descritto al punto 3.1, ad esempio, per confermare il risultato PCR. La PCR nel fango può essere provata per gli animali importati seguendo passo 3.2 di screening.
Risultati
I vantaggi dei tamponi di pozzetto per identificare prevalente Mycobacterium spp, rispetto ai campioni di pesce sono supportati dai risultati nella Figura 4. Di 115 pesce testati, M. chelonae e haemophilum del m. sono stati rilevati in 5% e il 3% dei campioni, rispettivamente. Nessuna altra specie di micobatteri patogena è stata identificata. Dagli stessi sistemi, 49 tamponi di pozzetto ha rivelato la presenza di specie micobatteriche 5. Rapporto di probabilità sono calcolati con l'ipotesi che M. chelonae e M. fortuitum sono rilevati più frequentemente dalla PCR nei tamponi di superficie pozzetto più del campione di pesce. Questo è statisticamente significativo con rispettivi odds ratio di 11 (95% IC: 4 a 29; p < 0,0001) e 306 (95% CI: 18 a 5208; p = 0,0001). I risultati mostrano che la tecnica del tampone di superficie pozzetto è una valida alternativa per l'uso esclusivo di sentinelle a schermo l'impianto di zebrafish per Mycobacterium spp. I campioni ambientali sono stati utilizzati anche per schermo per a. hydrophila. Questi batteri sono stati rilevati in pesce, fanghi e campioni di superficie (Figura 4). Questo supporta anche la capacità delle tecniche proposte di schermare il biotopo di pesce.
Per quanto riguarda l'analisi dei fanghi per rilevare le uova p. tomentosa , Mocho9 rilevato il parassita nel 27% dei campioni di pesce mediante PCR e l'istopatologia, considerando che le uova sono state rilevate nel 93% dei fanghi analizzati dallo stesso sistema. Qui, la tecnica è stata sfidata a riprodurre lo screening di quarantena. In questo contesto, non è possibile campionare gli animali importati, e valutare il loro stato di salute in maniera tempestiva aiuta con la gestione di biosicurezza. Pesce dello stato di salute sconosciuti da un impianto di positivo p. tomentosa sono stati fissati in 8 serbatoi con fertilizzante: massimo di 16 pesci/13 L serbatoio, 7 transgenici e linea 1 wild-type, genere, misto di età compresa tra 4-24 mesi. Il fango è stato raccolto dai dispositivi dopo una settimana e analizzato da microscopia. P. tomentosa uova sono state vedute in 7 campioni (88%). Infine, la rilevazione di PCR del parassita è stata sperimentata su tamponi di pozzetto e sedimenti di fango. 4 su 6 campioni di fango erano PCR positivo e tutti i risultati erano negativi per i tamponi superficiali. Questo non è sorprendente dal momento che lo screening dei fanghi si basa sulla capacità delle uova di cadere sul fondo del serbatoio. Questo dimostra che le tecniche di analisi dei fanghi possono essere utilizzate per schermo d. rerio acquari per infestazione di p. tomentosa e che i metodi possono essere adattati per lo screening degli animali importati.

Figura 1: serbatoio pre-filtrazione sentinella fuori dal sistema a ricircolo. Un serbatoio 8L è riempito con acqua e bio-media dai pozzetti dei sistemi a schermo. Le due perle di ceramica bianco bio-media sedersi nella parte inferiore del serbatoio (al centro della foto). 12 pesci sono selezionati secondo la loro età, ceppo e sesso, e vengono aggiunti al serbatoio della sentinella. Clicca qui per visualizzare una versione più grande di questa figura.
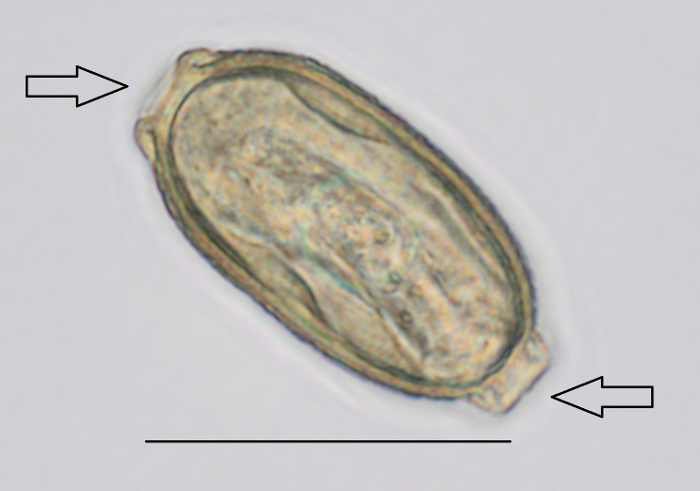
Figura 2: p. tomentosa uovo rilevato durante l'analisi dei fanghi da microscopia. Ingrandimento utilizzato era di 400 X. Le frecce indicano le spine bipolari. Barra della scala = 50 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: dispositivo di allevamento immerso in un serbatoio di pesce per raccogliere fango per analisi. Questo serbatoio è impostato su una panchina ai fini della foto; si trova in caso contrario, nel sistema di ricircolo. Clicca qui per visualizzare una versione più grande di questa figura.
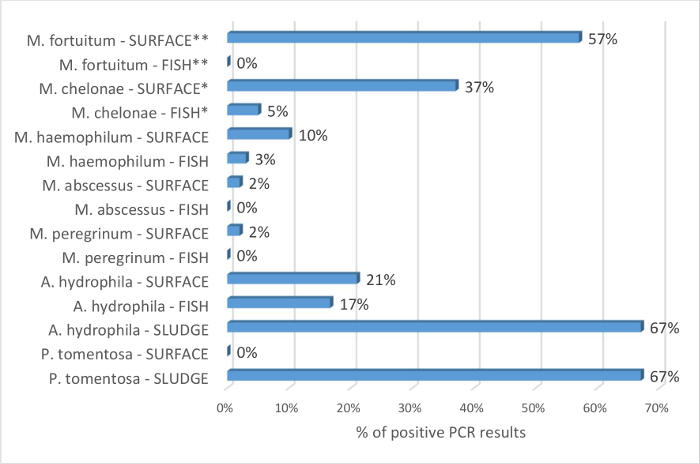
Figura 4: Percentuale di identificazione del Mycobacterium spp., a. hydrophilae p. tomentosa mediante PCR sul pesce, Superficie pozzetto tamponi e fanghi pozzetto. Percentuale è ottenuta dividendo il numero di risultati positivi per ogni specie di agente patogeno per il numero di campioni testati. La percentuale di risultati positivi è data dal tipo di campione come pesce, superficie o fanghi e indicata dopo il nome dei batteri. 115 pesce e 49 tamponi di superficie pozzetto sono stati testati mediante PCR per l'identificazione di Mycobacterium spp. I dati vengono compilati con risultati9 di Mocho dal momento che è un'estensione di questo studio. I pesci sono principalmente pre-filtrazione sentinelle secondo il protocollo sezione 1. Raramente, quando le sentinelle non erano disponibili, fuggitivi e vecchia Colonia pesce (> 18 mesi) sono stati provati. Tutti i sistemi testati per Mycobacterium spp., sono stati testati su tamponi pesce e pozzetto. Rapporto di probabilità sono calcolati con l'ipotesi che M. chelonae e M. fortuitum sono rilevati più frequentemente dalla PCR nei tamponi di superficie pozzetto più del campione di pesce. Questo è statisticamente significativo con rispettivi odds ratio di 11 (95% IC: 4 a 29; p < 0,0001) e 306 (95% CI: 18 a 5208; p = 0,0001). Mycobacterium marinum La PCR era negativa per tutti i campioni ed è pertanto considerata assente da queste strutture e non inclusi nell'analisi. 12 pesce, 14 tamponi di superficie pozzetto e pozzetto 6 fanghi sono stati testati mediante PCR per la presenza di a. hydrophila. 6 pozzetti sono stati testati per la presenza di p. tomentosa sulla superficie e nel fango. PCR = reazione a catena della polimerasi. CI = intervallo di confidenza. * e * * indicare la significatività statistica; altri confronti non erano statisticamente significativi. Clicca qui per visualizzare una versione più grande di questa figura.
Video 1: scansione per un uovo di Tomentosa di p. con il microscopio. La diapositiva è ottenuta da analisi dei fanghi come descritto al punto 3.1. Il campo viene analizzato per rilevare un uovo di p. tomentosa. Una volta che una struttura è riconosciuta, si è ingrandito per confermare l'identificazione a risoluzione superiore. Per favore clicca qui per vedere questo video. (Tasto destro per scaricare.)
| Autori | Età all'inizio dell'esposizione | Lunghezza di esposizione | Età di campionamento | Pre o Post filtrazione | Genere | Ceppo |
| Barton et al. 3 | 4 mesi | 6 mesi | 10 mesi | Pre-filtrazione | N/A | N/A |
| Borges et al. 4 | 6 mesi | 6 mesi | 12 mesi | Pre-filtrazione | N/A | AB wild-type |
| Collymore et al. 5 | Giovane come possibile | 3 mesi | < 6 mesi | Pre-filtrazione | N/A | N/A |
| Geisler et al. 6 | 4 mesi | 4 mesi | 8 mesi | Pre e post filtrazione | N/A | AB wild-type |
| Liu et al. 7 | 3 mesi | 1-6 mesi | 4-9 mesi | Pre e post filtrazione | N/A | Wild-type |
| Martins et al. 8 | 3 mesi | 3 mesi | 6 mesi | Pre-filtrazione | N/A | Wild-type |
| Mocho9 | < 6 mesi, 6 - 12 mesi, > 18 mesi | 4 mesi | 7 - 24 mesi | Pre-filtrazione | 1 femmina e 1 maschio di ogni gruppo di età | AB wild-type |
| Murray et al. 10 | 3-4 mesi | 3 mesi, 6 mesi, 1 anno | 7, 10 e 16 mesi | Pre e post filtrazione | N/A | AB wild-type |
Tabella 1: confronto delle impostazioni di sentinella nelle strutture di zebrafish. Il pesce di sentinella possono essere selezionato secondo la loro età, il sesso o il ceppo. Sono esposti per un periodo definito e ricevono acqua sistema pre- o post-filtrazione. I dati vengono compilati da 2016 numero speciale sulla salute di Zebrafish journal3,4,5,6,7,8,9, 10.
Discussione
Limitazioni delle tecniche, passaggi critici e risoluzione dei problemi:
L'età, genere, deformazione e lunghezza di esposizione delle sentinelle non sono standardizzati. Questo è mostrato nella tabella 1. C'è molto poco screening di pesce inferiore a 6 mesi di età, o di pesce invecchiato. Ci possono essere alcuni agenti patogeni che colpiscono i pesci giovani, come ci sono alcuni agenti patogeni che sono più prevalenti nei più anziani della popolazione10,18,19,20. Allo stesso modo, il sesso non è considerato nella selezione di alcuni gruppi di sentinella nonostante qualche relazione che c'è un pregiudizio di genere per alcuni agenti patogeni21. La tecnica proposta cerca di affrontare questi problemi, anche se la scelta del ceppo ha potuto essere fatto secondo un patogeno specifico per monitorare. Ad esempio, TU potrebbe aiutare con il rilevamento di Mycobacterium spp.12,22, ma c'è il rischio che le sentinelle fungerebbe quindi da un serbatoio o display segni clinici. Per quanto riguarda la durata dell'esposizione, l'approccio di Zebrafish International Resource Center10 aumenta le possibilità di rilevare gli agenti patogeni che potrebbero sfuggire con un periodo di contaminazione inadeguata. La necessità di un'esposizione prolungata implica che le sentinelle non sono prontamente disponibili. L'aggiunta dei campioni ambientali permette una certa flessibilità e la moltiplicazione degli eventi lo screening. Per esempio, campionamento può avvenire ogni mese con un intervallo di 4 mesi tra ogni metodo di screening. Questo può ridurre il lasso di tempo prima che un agente patogeno recentemente introdotto viene rilevato.
Le tecniche di selezione ambientale si basano sulla rilevazione degli agenti patogeni nell'ambiente. Gli agenti patogeni sono versati dai pesci e quindi diluiti in acqua dell'impianto. Non è stata esplorata la possibilità di catturare gli agenti patogeni da acqua filtrazione23 . I metodi che descriviamo sono efficaci solo se gli agenti patogeni sono dato abbastanza tempo di moltiplicarsi in pesce e biofilm per raggiungere una soglia di contaminazione che permettono la rilevazione. Questa limitazione delle tecniche è ridotta a icona di una selezione critica dei siti di campionamento: il fango nel serbatoio viene campionato piuttosto che i fanghi di pozzetto, e l'acqua e il biofilm sono campionati alla superficie del pozzetto, piuttosto che in un serbatoio o una post-filtrazione. Tuttavia, non tutti i campioni dallo stesso sistema rischiano di dare gli stessi risultati. Risultati positivi per p. tomentosa possono essere confermati mediante un altro test (istopatologia, PCR o analisi dei fanghi). Micobatterici risultati positivi di PCR possono essere confermati da coltura o da un altro laboratorio diagnostico. Tuttavia, quando si stabilisce uno stato di salute, ulteriori campioni sono raccomandati per confermare i risultati negativi da qualsiasi tecnica di screening ambientale.
Significato della tecnica rispetto ai metodi esistenti/Alternative:
Mycobacterium spp sono comuni nell'ambiente e la loro presenza nel pozzetto non predice la loro patogenicità12. Mocho9 hanno mostrato che i tassi di mortalità di monitoraggio è la chiave per sorvegliare gli sviluppi di problemi di salute. L'uso di campioni animali rimane essenziale per qualsiasi indagine veterinaria. Monitoraggio dello stato implica il rilevamento di tutti gli agenti patogeni prevalenti in una struttura e questo non può essere realizzato con l'uso esclusivo di tecniche di screening ambientale. Tuttavia, una mancanza di sensibilità degli strumenti di diagnosi può ritardare o impedire un'accurata descrizione dello stato di salute. Mentre l'uso di sentinelle riduce il numero di pesci richiesto per rilevare un microbo prevalente nella popolazione, la mancanza di sensibilità aggiunge peso alla utilizzando una combinazione di metodi, tra cui selezione ambientale5,23. Infatti allo status specifico patogeno libero è solitamente definito come l'assenza di una specie nella struttura tale che campioni ambientali e animali devono prova negativa24,25.
I risultati del tampone di pozzetto per identificare Mycobacterium spp. dimostrano che affidarsi a pesce campioni possono condurre ad uno stato di falsi negativi per la salute. 6 specie micobatteriche testate sono descritti come patogeni o potenziale patogeno in zebrafish15 e alcuni non avrebbe eliminato di disinfezione delle superfici uovo con cloro26 effettuati come ordinariamente in quarantena. Di conseguenza, il falso negativo può avere alcune conseguenze per collaboratori che linee di importazione. Ad esempio, M. fortuitum è stato perso dalla PCR sul campione di pesce, ma più della metà del tampone pozzetto PCR ha rilevato. Considerando che questi micobatteri sono più resistenti al cloro rispetto ad altri e la loro capacità di crescere nell' acqua sistemi27, è un rischio per l'impianto di importazione non contaminati. Per consentire l'importazione di linee, i gestori devono fidarsi e confrontare i rapporti di salute della struttura esportatore con loro. Il programma di valutazione delle prestazioni ICLAS28 è la chiave per quel processo in roditori. La rete RESAMA segnala l'individuazione di gordonae del M. e M. mucogenicum in francese d. rerio11. Questi micobatteri non sono proposte nei pannelli dei laboratori commerciali che utilizziamo. Sarebbe utile per estendere il programma ICLAS e ad armonizzare i saggi diagnostici, nonché l'elenco delle specie patogene29.
A. hydrophila è anche un agente patogeno che ha il potenziale per essere introdotti durante l'importazione di animali, anche se la sua suscettibilità a cloro30 rende più probabile la sua eliminazione durante la disinfezione delle superfici uovo routine. Il pozzetto, tampone e fanghi risultati mostrano che lo screening ambientale può essere usato per rilevare questo agente patogeno. Altri batteri come Mycobacterium spp sono stati rilevati in fanghi da PCR23. Questo tipo di campione è particolarmente rilevante poiché consente il rilevamento degli agenti patogeni capannone. Ad esempio, un'altra nuova applicazione è l'analisi dei fanghi allo schermo pesce importato in quarantena per p. tomentosa. Il parassita è una minaccia per la salute13 e neoplasia modelli16 dell'animale. Inoltre, le concentrazioni di cloro utilizzate nella disinfezione delle superfici di routine zebrafish uovo non sono efficienti31. Di conseguenza, la possibilità di schermare gli animali importati con un fatturato di una settimana e senza qualsiasi eutanasia di pesce sembra molto attraente. Questa tecnica può influenzare le regole di quarantena e biosicurezza consentendo un triage delle importazioni. Un processo decisionale è quindi progettato secondo i patogeni prevalenti nella struttura esportatore, i patogeni rilevati nei campioni dal pesce importato e il rischio di compromettere lo stato di salute dell'importazione struttura10.
Applicazioni future o indicazioni dopo la padronanza di queste tecniche:
Anche se il trattamento di routine quarantena è l'opzione scelta, l'efficacia di tale farmaco32,33,34,35,36 può essere valutata con l'analisi di fanghi dispositivo di allevamento. Più in generale, lo screening ambientale poteva essere utilizzato per testare composti contro batteri e parassiti eradicazione, tra cui il biotopo di pesce. Un'altra applicazione di nicchia dello screening ambientale è quello di monitorare la popolazione dell'agente patogeno nel live feed37,38. Se l'applicazione principale di queste tecniche è come una preziosa aggiunta alla casella degli strumenti di diagnosi per il monitoraggio in zebrafish strutture dello stato. Grazie ad una più accurata, costo e tempo efficiente definizione dello stato di salute, tamponi di pozzetto e analisi dei fanghi sono complementari per la sorveglianza sentinella e la pratica di routine quarantena. Infatti, il futuro di queste tecniche è quello di essere una parte sistematica di qualsiasi rapporto di salute del laboratorio acquatico.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori vorrei ringraziare il team di BRF Aquatics del Francis Crick Institute per l'aiuto tecnico e il contributo critico. Questo lavoro è stato supportato dall'Istituto Francis Crick che riceve il finanziamento di base da Cancer Research UK (FC001999), UK Medical Research Council (FC001999) e il Wellcome Trust (FC001999).
Materiali
| Name | Company | Catalog Number | Comments |
| Aqua-Sed 250 mL | Vetark | 2-phenoxyethanol | |
| Tubed Sterile Dryswab Tip | mwe | MW100 | Sump surface |
| BD Plastipak Disposable Syringe 50mL Eccentric | Becton Dickinson | 300866 | They are actually graduated to 60 ml |
| Centrifuge tube 15 mL Corning | Corning | 430766 | |
| Centaur 2 benchtop centrifuge with 4 x 200 mL Swing–Out Rotor (unsealed) | Sanyo | MSB020.CX1.5 | |
| Cover Glass 22 mm x22 mm | Menzel-Glaser | MNJ-350-020H | |
| Plain Swab Sterile Plastic Applicator Rayon Tipped White Cap | Sterilin Ltd Thermo Fisher Scientific | F155CA | Swab sediment from sludge |
| 50 mL Self-Standing Centrifuge Tube CentriStar Cap | Corning | 430921 | |
| In-Tank Spawning Tray Set | MBK Installations Ltd |
Riferimenti
- Schroeder, P., Mocho, J. P. A veterinary perspective on laboratory zebrafish welfare. Fish Veterinary Journal. 14, 37-46 (2014).
- Mason, T., et al. Strategies to Mitigate a Mycobacterium marinum Outbreak in a Zebrafish Research Facility. Zebrafish. 13, 77-87 (2016).
- Barton, C. L., Johnson, E. W., Tanguay, R. L. Facility Design and Health Management Program at the Sinnhuber Aquatic Research Laboratory. Zebrafish. 13, 39-43 (2016).
- Borges, A. C., et al. Implementation of a Zebrafish Health Program in a Research Facility: A 4-Year Retrospective Study. Zebrafish. 13, 115-126 (2016).
- Collymore, C., Crim, M. J., Lieggi, C. Recommendations for Health Monitoring and Reporting for Zebrafish Research Facilities. Zebrafish. 13, 138-148 (2016).
- Geisler, R., Borel, N., Ferg, M., Maier, J. V., Strähle, U. Maintenance of Zebrafish Lines at the European Zebrafish Resource Center. Zebrafish. 13, 19-23 (2016).
- Liu, L., Pan, L., Li, K., Zhang, Y., Zhu, Z., Sun, Y. Zebrafish Health Conditions in the China Zebrafish Resource Center and 20 Major Chinese Zebrafish Laboratories. Zebrafish. 13, 8-18 (2016).
- Martins, S., Monteiro, J. F., Vito, M., Weintraub, D., Almeida, J., Certal, A. C. Toward an Integrated Zebrafish Health Management Program Supporting Cancer and Neuroscience Research. Zebrafish. 13, 47-55 (2016).
- Mocho, J. -. P. Three-Dimensional Screen: A Comprehensive Approach to the Health Monitoring of Zebrafish. Zebrafish. 13, 132-137 (2016).
- Murray, K. N., Varga, Z. M., Kent, M. L. Biosecurity and Health Monitoring at the Zebrafish International Resource Center. Zebrafish. 13, 30-38 (2016).
- Legendre, L., et al. RESAMA: A Network for Monitoring Health and Husbandry Practices in Aquatic Research Facilities. Zebrafish. 13, 56-65 (2016).
- Whipps, C. M., Matthews, J. L., Kent, M. L. Distribution and genetic characterization of Mycobacterium chelonae in laboratory zebrafish Danio rerio. Dis Aquat Organ. 82 (1), 45-54 (2008).
- Murray, K. N., Peterson, T. S. Pathology in practice. P. tomentosa infection in zebrafish. J Am Vet Med Assoc. 246 (2), 201-203 (2015).
- Foreyt, W. J. . Veterinary Parasitology Reference Manual. , (2001).
- Whipps, C. M., Lieggi, C., Wagner, R. Mycobacteriosis in zebrafish colonies. ILAR J. 53 (2), 95-105 (2012).
- Kent, M. L., Bishop-Stewart, J. K., Matthews, J. L., Spitsbergen, J. M. Pseudocapillaria tomentosa, a nematode pathogen, and associated neoplasms of zebrafish (Danio rerio) kept in research colonies. Comp Med. 52 (4), 354-358 (2002).
- Moravec, F. Observations on the bionomy of the nematode Pseudocapillaria brevispicula (Linstow, 1873). Folia Parasitol. 30, 229-241 (1983).
- Ramsay, J. M., Watral, V., Schreck, C. B., Kent, M. L. Pseudoloma neurophilia infections in zebrafish Danio rerio: effects of stress on survival, growth, and reproduction. Dis Aquat Organ. 88 (1), 69-84 (2009).
- Watral, V., Kent, M. L. Pathogenesis of Mycobacterium spp. in zebrafish (Danio rerio) from research facilities. Comp Biochem Physiol C Toxicol Pharmacol. 145, 55-60 (2007).
- Whipps, C. M., Dougan, S. T., Kent, M. L. Mycobacterium haemophilum infections of zebrafish (Danio rerio) in research facilities. FEMS Microbiol Lett. 270, 21-26 (2007).
- Chow, F. W., Xue, L., Kent, M. L. Retrospective study of the prevalence of Pseudoloma neurophilia shows male sex bias in zebrafish Danio rerio (Hamilton-Buchanan). J Fish Dis. 39 (3), 367-370 (2016).
- Murray, K. N., Bauer, J., Tallen, A., Matthews, J. L., Westerfield, M., Varga, Z. M. Characterization and management of asymptomatic Mycobacterium infections at the Zebrafish International Resource Center. J Am Assoc Lab Anim Sci. 50 (5), 675-679 (2011).
- Crim, M. J., Lawrence, C., Livingston, R. S., Rakitin, A., Hurley, S. J., Riley, L. K. Comparison of Antemortem and Environmental Samples for Zebrafish Health Monitoring and Quarantine. J Am Assoc Lab Anim Sci. , (2017).
- Jensen, E. S., Allen, K. P., Henderson, K. S., Szabo, A., Thulin, J. D. PCR testing of a ventilated caging system to detect murine fur mites. J Am Assoc Lab Anim Sci. 52 (1), 28-33 (2013).
- . Commission Regulation (EC) No 1168/2006 of 31 July 2006 implementing Regulation (EC) No 2160/2003 as regards a Community target for the reduction of the prevalence of certain salmonella serotypes in laying hens of Gallus gallus and amending Regulation (EC) No 1003/2005 (Text with EEA relevance). OJ. L. 211, 4-8 (2006).
- Chang, C. T., Colicino, E. G., DiPaola, E. J., Al-Hasnawi, H. J., Whipps, C. M. Evaluating the effectiveness of common disinfectants at preventing the propagation of Mycobacterium spp. isolated from zebrafish. Comp Biochem Physiol C Toxicol Pharmacol. 178, 45-50 (2015).
- Le Dantec, C., Duguet, J. P., Montiel, A., Dumoutier, N., Dubrou, S., Vincent, V. Chlorine disinfection of atypical mycobacteria isolated from a water distribution system. Appl Environ Microbiol. 68 (3), 1025-1032 (2002).
- Goto, K., Hayashimoto, N., Ishida, T., Takakura, A., Kagiyama, N. First trial in the developmental phase of the "performance evaluation program" based on the ICLAS animal quality network program: self-assessment of microbiological monitoring methods using test samples supplied by ICLAS. Exp Anim. 58 (1), 47-52 (2009).
- Nogueira, C. L., et al. Mycobacterium saopaulense sp. nov., a rapidly growing mycobacterium closely related to members of the Mycobacterium chelonae--Mycobacterium abscessus group. Int J Syst Evol Microbiol. 65 (12), 4403-4409 (2015).
- Massa, S., Armuzzi, R., Tosques, M., Canganella, F., Trovatelli, L. D. Note: susceptibility to chlorine of Aeromonas hydrophila strains. J Appl Microbiol. 86 (1), 168-173 (1999).
- Martins, M. L., Watral, V., Rodrigues-Soares, J. P., Kent, M. L. A method for collecting eggs of Pseudocapillaria tomentosa (Nematoda: Capillariidae) from zebrafish Danio rerio and efficacy of heat and chlorine for killing the nematode's eggs. J Fish Dis. 40 (2), 169-182 (2017).
- Maley, D., Laird, A. S., Rinkwitz, S., Becker, T. S. A simple and efficient protocol for the treatment of zebrafish colonies infected with parasitic nematodes. Zebrafish. 10 (3), 447-450 (2013).
- Samaee, S. M. Experimental Assessment of the Efficacy of Five Veterinary Broad-Spectrum Anthelmintics to Control the Intestinal Capillariasis in Zebrafish (Danio rerio). Zebrafish. 12 (3), 255-267 (2015).
- Collymore, C., et al. Tolerance and Efficacy of Emamectin Benzoate and Ivermectin for the Treatment of Pseudocapillaria tomentosa in Laboratory Zebrafish (Danio rerio). Zebrafish. 11 (5), 490-497 (2014).
- Chang, C. T., Whipps, C. M. Activity of Antibiotics against Mycobacterium Species Commonly Found in Laboratory Zebrafish. Journal of Aquatic Animal Health. 27 (2), 88-95 (2015).
- Chang, C. T., Doerr, K. M., Whipps, C. M. Antibiotic treatment of zebrafish mycobacteriosis: tolerance and efficacy of treatments with tigecycline and clarithromycin. J Fish Dis. , (2017).
- Peterson, T. S., Ferguson, J. A., Watral, V. G., Mutoji, K. N., Ennis, D. G., Kent, M. L. Paramecium caudatum enhances transmission and infectivity of Mycobacterium marinum and M. chelonae in zebrafish Danio rerio. Dis Aquat Organ. 106 (3), 229-239 (2013).
- Watts, S. A., Lawrence, C., Powell, M., D'Abramo, L. R. The Vital Relationship Between Nutrition and Health in Zebrafish. Zebrafish. 13, 72-76 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon