È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un
In questo articolo
Riepilogo
Qui si descrive un metodo rapido equilibrio di dialisi (RED) per misurare farmaco legame caseum da lesioni tubercolosi polmonare e cavità. Il protocollo viene utilizzato anche con una matrice macrofagi derivato schiumosa che è un surrogato efficace caseum.
Abstract
L'eradicazione della malattia di tubercolosi richiede regimi farmacologici che possono penetrare negli strati multipli di lesioni polmonari complesse. La distribuzione dei farmaci nei corpi caseosi delle cavità e delle lesioni è particolarmente cruciale perché ospitano sottopopolazioni di batteri tolleranti ai farmaci comunemente indicati come persistenti. I metodi esistenti per la misura della penetrazione di farmaci nelle lesioni della tubercolosi comportano costi costosi e che richiedono molto tempo gli studi farmacocinetici in vivo accoppiati a tecniche bioanalitiche o di imaging. La misura in vitro della legame di farmaci a macromolecole di caso è stata proposta come un'alternativa a tali tecniche in quanto tale legame ostacola la diffusione passiva delle molecole di farmaco attraverso il caso. La dialisi di equilibrio rapido è un sistema veloce e affidabile per eseguire studi di legame tra proteine plasmatiche e tessuti. In questo protocollo abbiamo usato un dispositivo rapido di dialisi di equilibrio (RED) per misurare il legame dei farmaci a homogenati del casoDalle lesioni e dalle cavità dei conigli infetti da tubercolosi. Il protocollo descrive anche come generare una matrice surrogata da macrofagi THP-1 caricati da lipidi da utilizzare in sostituzione del caso. Questo test di associazione di caso / surrogato è uno strumento importante nella scoperta di droga della tubercolosi e può essere adattato per aiutare a studiare la distribuzione dei farmaci nelle lesioni o negli ascessi causati da altre malattie.
Introduzione
Il trattamento della malattia della tubercolosi polmonare richiede una distribuzione efficace di farmaci in diversi tipi di lesioni. Le lesioni e le cavità nocrotiche contengono centri caseosi che ospitano sottopopolazioni di batteri tolleranti o "persistenti". 1 , 2 La malattia cavitaria è associata a tassi di cura inferiori e prognosi scarsa. 3 , 4 Precedenti studi hanno mostrato, utilizzando tecniche quantitative e di imaging, che la capacità di penetrare nel caso è significativamente diversa da una classe di medicinali all'altra. 5 , 6 Questi metodi richiedono tuttavia l'uso di modelli di infezione animale che sono lenti e noiosi. È stato progettato un dosaggio in vitro che misura il legame di farmaci al caso caso ex vivo . Questo legame è stato trovato a correlare inversamente con la penetrazione di farmaci nei granulomi casiosi e, di conseguenza, èUtilizzato come strumento predittivo. 7
La dialisi di equilibrio è considerata come l'approccio standard gold standard per studi di legame proteico plasmatico. Il dispositivo rapido di dialisi di equilibrio (RED) fornisce un sistema veloce, facile da usare e affidabile per eseguire tali analisi. 8 Il dispositivo è costituito da due componenti: inserti monouso, monouso composti da due camere separate da un cilindro verticale di membrana semipermeabile; E piastre base riutilizzabili che possono contenere fino a 48 inserti alla volta. La membrana di dialisi ha un cut-off di peso molecolare di 8 kDa (MWCO) che è l'ideale per studi di legame con farmaci e macromolecole. L'elevato rapporto superficie / volume del compartimento della membrana consente una rapida dialisi e un equilibratura. Sia gli inserti che la piastra di base sono stati convalidati per un minimo legame non specifico. La combinazione del dispositivo RED con tecniche bioanalitiche fornisce accurate stime delle frazioni non legate di farmaci in pLasma. 8, 9
Sebbene originariamente progettato per misurare proteine plasmatiche, il dispositivo RED è stato utilizzato in vari tessuti studi di binding utilizzando omogenati. 10, 11 In questo protocollo, si misurano farmaco legame caseum, i detriti necrotici asportato dalle lesioni necrotiche e cavità di conigli tubercolosi infettati. La natura acellulare e non vascolare di materiale caseoso è facilissimo omogeneizzare in una sospensione omogenea che è compatibile con il saggio.
Dato che caseum è noioso da produrre e difficili da trovare, il protocollo è anche stato convalidato per l'uso con una matrice surrogata che viene preparato da macrofagi schiumosi. THP-1 derivate da monociti macrofagi vengono indotte con acido oleico di accumulare più corpi lipidiche che conferiscono loro aspetto 'schiumosa'. Queste cellule lipidiche-caricati vengono raccolte eelaborati per produrre una matrice che usiamo come surrogato caseum. Questo studio ha dimostrato che farmaci legame a questa matrice surrogata correla bene con legame caseum, mimando efficacemente il processo in vivo che ostacola la penetrazione farmaco nel nucleo caseosa di granulomi e cavità.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutti gli studi sugli animali sono stati eseguiti in conformità alla Guida per la cura e l'uso degli animali da laboratorio degli Istituti Nazionali di Salute con l'approvazione del Comitato istituzionale per la cura e l'uso degli animali della NIAID (NIH) di Bethesda, MD. Tutti gli studi riguardanti la M. tuberculosis sono stati eseguiti in un laboratorio con livello di contenimento della biosicurezza 3 (BSL-3).
1. Modello di infezione del coniglio e collezione di Caseum
- Infettare conigli bianchi della Nuova Zelanda con M. tuberculosis utilizzando un sistema di esposizione agli aerosol solo a naso come descritto in precedenza. 12 , 13 Lasciare che l'infezione progredisca per 12-16 settimane. Sedate i conigli con 35 mg / kg di ketamina e 5 mg / kg di xilazina intramuscolare, eutanalizzare i conigli con 0,22 mL / kg di pentobarbital sodico e fenytoina sodico per via endovenosa e procedere con le necropsie.
- Usando le pinzette e un bisturi, rimuovi i polmoni dalla cassa caVITY. Da ogni lobo del polmone, disseccare singole cavità e grandi granulomi necrotici utilizzando un bisturi. Raschiare correttamente il caseum dalla parete di cavità e granuloma. Pesare, registrare e conservare campioni in 2 mL tubi a vite a -20 ° C fino all'uso pronto.
- Gamma-irradia i campioni infetti di caso in 3 MegaRad su ghiaccio secco per renderli ininfluenti e sicuri per l'uso in un laboratorio BSL-2.
2. In vitro generazione di Caseum Surrogate da cellule THP-1
- Crescono monociti THP-1 nel mezzo RPMI 1640 (2 mM L-glutamina e 10% siero fetale bovino) in tazze di coltura T175 (80 mL / pallone). Incubare le fiasche in un'atmosfera al 5% di CO 2 a 37 ° C per 3-4 giorni.
- Centrifugare la coltura da una fiala T175 in due tubi conici da 50 mL a 150 xg per 5 min. Scartare il surnatante e sospendere il pellet in 10 ml di supporti RPMI 1640.
- Pipettare 5 μL di questa coltura in un tubo da 1,5 mL contenente 45 μL di tblu rypan. Mescolare accuratamente pipettando. Trasferimento 10 microlitri ad un emocitometro e contare il numero di vitali THP-1 monociti (non colorati) utilizzando un microscopio ottico (ingrandimento 10X). Calcolare il numero di cellule vitali per ml della cultura. Diluire con mezzi RPMI alla densità finale di 1,25 x 10 6 cellule / ml.
- Carico 40 mL di coltura su una grande piastra di coltura cellulare (50 x 10 6 cellule / piastra). Aggiungere 40 ml di 100 mM PMA (forbolo 12-myristate13-acetato preparata in etanolo) e consentono alle cellule di aderire durante la notte in incubatrice.
NOTA: concentrazione finale di PMA è 100 nm. - Diluire acido oleico puro (OA) (0,89 g / ml) in etanolo alla concentrazione di 0,1 M (cioè 31,7 microlitri OA a 968,3 ml di etanolo). Diluire questa soluzione in acqua dolce dei media RMPI pre-riscaldato a una concentrazione di 10 mm. Diluire questa sospensione OA di 0,4 mM (concentrazione finale di lavoro) in terreno RPMI pre-riscaldato a 37 ° C.
- Rimuovere i media e non esistenticellule -adhered dalle piastre di coltura cellulare e delicatamente aggiungono 40 mL di 0,4 mM OA ai macrofagi THP-1 (THP-M). Incubare a 37 ° C in incubatore notte.
- Utilizzare un microscopio ottico a 40 ingrandimenti per confermare visivamente la presenza di numerose inclusioni lipidiche corpo in ogni THP-M. Rimuovere tutti mezzo RPMI dalle piastre di coltura cellulare e lavare delicatamente le cellule aderenti due volte con tampone fosfato isotonico (PBS) usando una pipetta sierologica 50 mL.
NOTA: corpi lipidici appaiono come piccole, chiare, strutture sferiche nel citoplasma della THP-M. - Aggiungere 40 ml di 5 mM acido etilendiamminotetraacetico (EDTA) in PBS per ciascuna piastra. Incubare per 15 minuti a 37 ° C.
- Staccare i macrofagi schiumosi (FM) ripetutamente pipettando su e giù sulla superficie di tutta la piastra usando una pipetta sierologica 10 mL. Trasferire la sospensione cellulare in una provetta conica da 50 ml e centrifugare a 150 xg per 5 min.
- Risospendere il pellet cellulare in 10 ml di PBS (terzo lavaggio PBS) unIl trasferimento in un tubo conico pre-pesato da 15 ml. Spin giù di nuovo a 150 xg per 5 minuti. Aspira attentamente il surnatante usando una pipetta sierologica e scartare.
- Sostituire i pellet FM a 3 cicli di congelamento-scongelamento per liscivare le cellule e incubarle a 75 ° C per 20-30 min per denaturare proteine nella matrice. Conservare i pellet a -20 ° C fino a quando non sarà pronto per l'uso.
3. Analisi della dialisi rapida di equilibrazione (RED)
- Preparare soluzioni di 10 mM di tutti i composti di prova in dimetilsolfossido (DMSO). Diluire fino a 500 μM soluzioni di lavoro in DMSO prima di ogni dosaggio.
- Pesare il tubo contenente il pellet surrogato di caso. Sottrai il peso del tubo vuoto per ottenere il peso del pellet da sola. Aggiungere 2-3 branelli metallici per tubo e, utilizzando un omogeneizzatore a 1,200 colpi / min per 1 min, interrompere il caso o la matrice surrogata in PBS (1: 9 w / v) per ottenere una sospensione diluita di 10 volte di ciascuna matrice.
- Spike 6.5 μL del 500ΜM del composto in esame in 643,5 μL dell'omogenato per ottenere la concentrazione finale di 5 μM (≤1% DMSO) e vortex.
- Posizionare gli inserti ROSSI nella piastra di base. Aggiungere in una camera di ricevente 200 μL della matrice a spruzzo a farmaci nella camera donatrice (anello rosso) di ciascun inserto RED e 350 μL di PBS. Preparare 3 inserti per ciascun composto di prova (campioni triplicati). Piastra di tenuta con una guarnizione di piastra adesiva e incubare a 37 ° C sul termomexer a 200 giri / min (1 g) per 4 h.
- Dopo l'incubazione, mescolare delicatamente il contenuto della camera donatore e ricevente pipettando su e giù 2-3 volte. Pipettare 20 μL aliquote di omogeneate dalle camere donatrici e aggiungere 20 μl di PBS pulito in un tubo da 1,5 ml (1: 1). Allo stesso modo, pipettare 20 μL aliquote di campioni PBS dalle camere ricevitore e aggiungere 20 μL di homogenate pulito (corrispondenza matrice). 8
NOTA: la corrispondenza matrice elimina il nePer 2 curve separate di calibrazione (in omogeneo e PBS) da effettuare per l'analisi quantitativa. Il contenuto della camera donatrice può sedimentarsi nel tempo. Mescolare delicatamente il contenuto pipettando prima di rimuovere le aliquote.
4. Quantificazione LC-MS e analisi dei dati
- Aggiungere 160 μl di metanolo 1: 1: acetonitrile contenente 500 ng / ml diclofenac o 10 ng / mL verapamil (standard interno) ad ogni tubo e vortex per precipitare le proteine. Centrifugare a 10.000 xg per 5 minuti per sedimentare il precipitato e trasferire i supernatanti in piatti a pozzetto a 96 pozzetti per l'analisi di spettrometria di massa cromatografica-massa (LCMS). 7
- Creare curve di calibrazione da 1-1.000 nM per ogni composto di prova mantenendo la stessa composizione della matrice come i campioni di cui sopra. Quantificare la concentrazione del composto di prova nei campioni provenienti dalle camere donatori e riceventi utilizzando un metodo LC-MS.
- Calcola la frazione non legata ( f u ) of farmaco nella matrice diluito utilizzando l'equazione 1. Calcolare il f u in matrice diluito con l'equazione 2 (D = fattore di diluizione di 10). 14
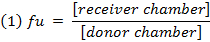
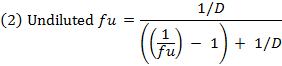
- Controllare il recupero (bilancio di massa) di ciascun composto usando l'equazione 3 per identificare i composti con la stabilità / metabolismo / non specifici problemi vincolanti.
NOTA: Il recupero di solito cade tra il 70% e il 130%. 15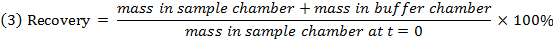
Access restricted. Please log in or start a trial to view this content.
Risultati
Usando questo protocollo, abbiamo testato centinaia di composti di sviluppo della droga della tubercolosi per la loro efficacia prevista a penetrare nel caso. La figura 1 mostra i concetti base del test RED. La membrana di dialisi degli inserti RED permette alle piccole molecole non legate di diffondere dal pozzo del donatore al pozzo del ricevitore, raggiungendo infine un equilibrio tra i due compartimenti. Piccole molecole che sono legate a macromolecole come proteine ...
Access restricted. Please log in or start a trial to view this content.
Discussione
lesioni necrotiche polmonari e cavità in pazienti infettati tuberculosis contengono sottopopolazioni di batteri che sono recalcitranti al trattamento farmacologico. I nuclei caseosi di queste strutture sono particolarmente responsabili per ospitare queste persistenti in un ambiente extracellulare. 16 la distribuzione favorevole di agenti anti-batterici in questi luoghi remoti si crede di essere un importante determinante di efficacia della tubercolosi farmaco. Prima della convalida di questo pro...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Non ci sono interessi finanziari concorrenti.
Riconoscimenti
Desideriamo ringraziare Johnson & Johnson, la TB Alliance, Astra Zeneca, Rib-X e Trius Therapeutics per la fornitura di bedaquiline, PA-824 (pretomanid), AZD5847, radezolid e tedizolid, rispettivamente. Brendan Prideaux, Matthew Zimmerman, Stephen Juzwin, Emma Rey-Jurado, Nancy Ruel, Leyan Li e Danielle Weiner fornito supporto con analisi MALDI, metodi bioanalitici, preparazione del surrogato caseum, sintesi chimica, e l'isolamento di coniglio caseum. Questo lavoro è stato condotto con il finanziamento del Fondazione Bill e Melinda, premio # OPP1044966 e OPP1024050 a V. Dartois, NIH Shared Strumentazione di Grant S10OD018072, così come il finanziamento congiunto da parte della Fondazione Bill e Melinda Gates e Wellcome Trust per un centro di eccellenza per l'ottimizzazione di piombo per malattie del mondo in via di sviluppo di P. Wyatt.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| New Zealand White Rabbits | Covance | - | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| THP-1 monocytic cell line | ATCC | ATCC TIB-202 | |
| 175 cm² TC-Treated Flask (T175) | Fisher Scientific | T-3400-175 | |
| RPMI 1640 media w/o glutamine | Fisher Scientific | MT-15-040-CV | |
| Hyclone Fetal Bovine Serum, Gamma irradiated | Fisher Scientific | SH3091003IR | |
| Hyclone L-glutamine, 200 mM | Fisher Scientific | SH3003401 | |
| Cellstar TC dish, 145 mm x 20 mm, vented | Fisher Scientific | T-2881-1 | |
| Phorbol 12-myristate 13-acetate (PMA) | Fisher Scientific | BP685-1 | |
| Ethylenediaminetetraacetic acid | Sigma | E6758 | |
| Oleic acid | Fisher Scientific | ICN15178101 | |
| Pierce RED Device Reusable Base Plate | Fisher Scientific | PI-89811 | |
| Pierce RED Device Inserts, 50/box | Fisher Scientific | PI-89809 | |
| Pierce RED insert removal tool | Fisher Scientific | 89812 | |
| Adhesive plate seal | Fisher Scientific | 08-408-240 | |
| PBS, pH 7.4, 10x 500 mL (Gibco) | Life Technologies | 10010-049 | |
| DMSO | Sigma | 472301 | |
| Acetonitrile | Sigma | 34998 | |
| Methanol | Sigma | 34860 | |
| Verapamil hydrochloride | Sigma | V4629 | |
| Diclofenac sodium salt | Sigma | 93484 | |
| Trypan Blue Solution, 0.4% | Fisher Scientific | 15-250-061 | |
| Ethanol, 200 proof | Fisher Scientific | 04-355-451 | |
| 2010 Geno/Grinder | SPEX SamplePrep | 2010 | |
| Bead Mill Homogenizer Accessory, Metal Bulk Beads | Fisher Scientific | 15-340-158 | |
| 484R Cobalt 60 Irradiator | JL Shepard | 7810-484-1 | |
| INCYTO C-Chip Disposable Hemacytometers | Fisher Scientific | 22-600-100 | |
| Upright Light Microscope | Leica | DM1000 | |
| Binary Liquid Chromatography system | Agilent | 1260 | Multi-compenent |
| Mass spectrometer | AB Sciex | 4000 |
Riferimenti
- Sacchettini, J. C., Rubin, E. J., Freundlich, J. S. Drugs versus bugs: in pursuit of the persistent predator Mycobacterium tuberculosis. Nat Rev Microbiol. 6 (1), 41-52 (2008).
- Zhang, Y. Persistent and dormant tubercle bacilli and latent tuberculosis. Front Biosci. 1 (9), 1136-1156 (2004).
- Aber, V. R., Nunn, A. J. Short term chemotherapy of tuberculosis. Factors affecting relapse following short term chemotherapy. Bull Int Union Tuberc. 53 (4), 276-280 (1978).
- Chang, K. C., Leung, C. C., Yew, W. W., Ho, S. C., Tam, C. M. A nested case-control study on treatment-related risk factors for early relapse of tuberculosis. Am J Respir Crit Care Med. 170 (10), 1124-1130 (2004).
- Dartois, V. The path of anti-tuberculosis drugs: from blood to lesions to mycobacterial cells. Nature Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Sarathy, J. P., et al. Prediction of Drug Penetration in Tuberculosis Lesions. ACS Infect Dis. 2 (8), 552-563 (2016).
- Waters, N. J., Jones, R., Williams, G., Sohal, B. Validation of a rapid equilibrium dialysis approach for the measurement of plasma protein binding. J Pharm Sci. 97 (10), 4586-4595 (2008).
- Singh, J. K., Solanki, A., Maniyar, R. C., Banerjee, D., Shirsath, V. S. Rapid Equilibrium Dialysis (RED): an In-vitro High-Throughput Screening Technique for Plasma Protein Binding using Human and Rat Plasma. J Bioequiv Availab. 14, 1-4 (2012).
- Liu, X., et al. Unbound drug concentration in brain homogenate and cerebral spinal fluid at steady state as a surrogate for unbound concentration in brain interstitial fluid. Drug Metab Dispos. 37 (4), 787-793 (2009).
- Able, S. L., et al. Receptor localization, native tissue binding and ex vivo occupancy for centrally penetrant P2X7 antagonists in the rat. Br J Pharmacol. 162 (2), 405-414 (2011).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: a failed host immune response. Open Biol. 1 (4), 1-14 (2011).
- Via, L. E., et al. Tuberculous Granulomas are Hypoxic in Guinea pigs, Rabbits, and Non-Human Primates. Infect Immun. 76 (6), 2333-2340 (2008).
- Kalvass, J. C., Maurer, T. S. Influence of nonspecific brain and plasma binding on CNS exposure: implications for rational drug discovery. Biopharm Drug Dispos. 23 (8), 327-338 (2002).
- Di, L., Umland, J. P., Trapa, P. E., Maurer, T. S. Impact of recovery on fraction unbound using equilibrium dialysis. J Pharm Sci. 101 (3), 1327-1335 (2012).
- Lenaerts, A. J., et al. Location of persisting mycobacteria in a Guinea pig model of tuberculosis revealed by r207910. Antimicrob Agents Chemother. 51 (9), 3338-3345 (2007).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon