Method Article
Corticale multistrato Ca
In questo articolo
Riepilogo
Qui esempiamo una procedura per l'esecuzione di immagini su larga scala Ca 2+ con risoluzione cellulare su più strati corticali in topi liberamente spostati. Centinaia di cellule attive possono essere osservate simultaneamente utilizzando un microscopio a testa in miniatura accoppiato con una sonda a prisma implantato.
Abstract
L' imaging funzionale a livello di circuito e di livello cellulare in vivo è uno strumento cruciale per capire il cervello in azione. L'imaging ad alta risoluzione dei neuroni corticali di topi con la microscopia a due fotoni ha fornito una visione unica sulle strutture corticali, sulla funzionalità e sulla plasticità. Tuttavia, questi studi sono limitati agli animali fisso testa, riducendo notevolmente la complessità comportamentale disponibile per lo studio. In questo articolo descriviamo una procedura per eseguire la microscopia cronica di fluorescenza con risoluzione cellulare su più strati corticali in topi comportamentali liberamente. Abbiamo utilizzato un microscopio integrato miniaturizzato a fluorescenza accoppiato con una sonda prismata impiantata per visualizzare e registrare simultaneamente le dinamiche di calcio di centinaia di neuroni attraverso diversi strati della corteccia somatosensoriale come il mouse si è impegnato in un nuovo esplorazione di oggetti oggetto, per diversi giorni. Questa tecnica può essere adattata ad altre regioni del cervello in diverse specie animali per altri comportamentaliaradigms.
Introduzione
La corteccia è un giocatore essenziale in molte complesse funzioni mentali e comportamentali, dall'attenzione, dalla percezione sensoriale e dai controlli cognitivi dall'alto 1 , 2 , 3 alle motivazioni, ricompense e dipendenze 4 , 5 . Comprendere i processi computazionali che sono alla base della sua funzione è un obiettivo importante per guidare una migliore comprensione clinica di molti disturbi mentali e comportamentali.
Molte teorie attuali della malattia psichiatrica si concentrano attorno all'idea che la disfunzione del circuito neuronale corticale o la disordinazione del disco possono essere alla base di anomalie cognitive e comportamentali che sono le caratteristiche di condizioni come la schizofrenia 6 , l'autismo 7 o il disturbo ossessivo-compulsivo 8 . Così, ottenendo dati di attività neurale di popolazione da coI circuiti rtical all'interno del corretto contesto di informazioni comportamentali simultanee sono di grande importanza e idealmente possono essere mirate a specifici tipi di cellule per la disezione del circuito neurale più fine.
I microscopi miniaturizzati in combinazione con i microlenti dell'indice di rifrazione del gradiente (GRIN) impiantabili permettono l'accesso ottico a gruppi neuronali in condizioni di libera circolazione da una diversità di possibili regioni del cervello 9 , 10 , 11 , 12 , 13 , incluse le corteccia 14 , 15 , 16 . L'utilizzo di un sistema di microscopia mobile accoppiato con indicatori di calcio geneticamente codificato consente di ottenere immagini coerenti della stessa popolazione cellulare che comprende centinaia di neuroni tra giorni e settimane in molte regioni del cervello 9 e può essereGeneticamente mirati a specifici tipi di cellule utilizzando vettori virali o tecniche transgeniche.
Poiché la corteccia è conosciuta per supportare funzioni diverse e connettersi a diverse regioni del cervello a seconda della posizione delle celle all'interno della lamina corticale 17 , 18 , 19 , siamo interessati ad ottenere un'attività neurale contemporanea multi-strato in soggetti comportamentali svegli. Qui dimostriamo come immagini centinaia di neuroni etichettati a fluorescenza nei topi liberi di comportamento per giorni, utilizzando il microscopio miniaturizzato a fluorescenza 20 accoppiato con una sonda prismata impiantata, che offre una visione multipla della corteccia ( Figura 1 ).
La sonda a prisma utilizzata qui è composta da due lenti separate GRIN: un prisma e una lente cilindrica del relè ( figura 1 ). La luce del microscopio eccita il fluorescenti etichettatoCellule situate lungo la faccia di imaging della sonda a prisma, dopo essere riflesse dall'ipotena della porzione di prisma della sonda. La luce emessa dalle cellule riflette anche l'ipotenusa del prisma, viene raccolta attraverso l'obiettivo del microscopio e raggiunge il sensore nel microscopio. La sonda a prisma utilizzata in questa procedura è adattata per un facile utilizzo con apparecchiature standard stereotassiali.
Il microscopio miniaturizzato di fluorescenza 20 rileva i transienti Ca 2+ evocati dal potenziale d'azione nelle popolazioni neuronali con risoluzione di una singola cellula, dopo che queste cellule sono state specificamente etichettate con indicatori fluorescenti geneticamente codificati Ca 2+ . In questo protocollo, abbiamo iniettato l'indicatore Ca 2+ codificato in un vettore virale (AAV1.CaMKII.GCaMP6f.WPRE.SV40), implantato una sonda a prisma, installato il microscopio, quindi ottenuto più giorni di dati di attività neurale somatosensoriale (S1 posteriori) Da un animale esponeD alle nuove superfici dell'oggetto durante l'esplorazione gratuita ( Figura 2 ).
Protocollo
Le procedure che coinvolgono soggetti animali sono stati approvati dal Comitato istituzionale per la cura degli animali (IACUC) presso LifeSource Biomedical Services, NASA Ames Research Center, California.
1. Preparazione preoperatoria
- Sterilizzare gli strumenti da utilizzare nelle procedure chirurgiche in un sterilizzatore a caldo e strofinare l'area chirurgica con il 70% di etanolo. Accendere il riscaldatore posizionato sopra lo stadio stereotassiale e mantenerlo a 37 ° C.
- Anestetizzare l'animale usando isoflurano (5% per l'induzione e 1-2% per la manutenzione, 0.6-0.8 L / min O 2 ). Verificare che l'assenza di un riflesso a punta-pinch per valutare la profondità dell'anestesia.
- Montare l'animale in un telaio stereotaxicato dotato di barre d'orecchio e denti.
- Applicare unguento oculare sugli occhi dell'animale e coprirli con un pezzo di carta scura per proteggerli dall'essiccazione e da intense luci chirurgiche.
- Iniettare sottocutanea l'animale con ketoprofene (2.5Mg / kg) o carprofene (2,5 mg / kg)
2. Chirurgia dell'iniezione di virus
- Tagliare e barattare il cuoio capelluto tra gli occhi e le orecchie e disinfettare la pelle con 3 tamponi alternati di etanolo al 70% e betadina.
- Esponete il cranio facendo un'incisione nel cuoio capelluto, cominciando tra gli occhi e estendendo 1,5 cm rostrocaudal con una lama chirurgica sterile. Aprire la pelle per esporre il cranio e rimuovere il periostato attorno al sito di iniezione desiderato utilizzando tamponi di cotone e bisturi. Sciacquare il cranio con PBS sterile. Pulire e lucidare il cranio con tamponi di cotone.
- Livello del cranio, e con un marcatore, contrassegnare le coordinate stereotassiali per l'iniezione di virus. Utilizzando una bava di 0,5 mm su un microdrillo ad alta velocità (impostato a circa 7.000-10.000 giri / min), creare un piccolo foro nel cranio. Applicare una leggera pressione durante la foratura e pulire intermittentemente la polvere ossea e inumidire l'area con PBS sterile per prevenire il surriscaldamento del tessuto cerebrale, finché la superficie del cervello non viene redoleva. Mantenere il cervello umido in cui è forato il foro.
- Utilizzare un ago da 26 G per prelevare virus ( ad es. AAV1.CaMKII.GCaMP6f.WPRE.SV40) nella microsiringa e sostituirlo con un ago da 35 G per l'iniezione. Fissare il microspirone caricato con virus al braccio manipolatore dell'apparecchio stereotaxic.
- Portare la siringa vicino al foro del foro e regolare l'angolo dell'ago in modo che entri ad un angolo di 90 ° rispetto alla superficie del cervello. Abbassare l'ago fino a toccare il mater pia e perforare attraverso la dura. Iniziare a abbassare l'ago in incrementi di 10 μm / s fino a raggiungere la profondità desiderata (z). Fissare la posizione dell'ago usando il braccio stereotaxic.
- Impostare la pompa microspirante per iniettare 250 nl di virus a 25 nL / min.
- Passo critico: poiché il volume del virus da iniettare dipende dal titolo e dalla diluizione, eseguire in precedenza esperimenti di diluizione per stabilire i criteri ottimali di volume e di concentrazione per le cellule di imagingNell'esperimento.
- Se un virus viene visto fuoriuscendo dal sito di iniezione, interrompere l'iniezione e attendere che il tessuto cerebrale assorbe la caduta del virus. Attendere 5-7 min dopo che il volume totale è stato iniettato prima di ritirare l'ago. Anche i coloranti come il verde veloce possono essere aggiunti alla soluzione del virus per aiutare a controllare il tasso di iniezione nel caso in cui il virus si sia visto esulando dalla superficie del cervello.
- Per l'etichettatura di più strati in corteccia, se necessario, utilizzare più iniezioni. Inizialmente, in primo luogo, in attesa del 5-7 min dopo l'iniezione e tirando l'ago al prossimo punto dorsale più iniettabile ( ad esempio inietta a -1,0 mm AP, 1,5 mm ± ML e 400 e 600 μm DV). Attendere 10 minuti dopo l'iniezione finale prima di estrarre l'ago e rimuoverlo dalla configurazione stereotaxicica.
- Mescolare una piccola quantità di adesivo elastomero trasparente biocompatibile in vivo dalla siringa a doppia barra (Ad esempio Kwik-Sil) e coprire il buco nel cranio con esso. Applicare l'adesivo cianoacrilato sulla parte superiore dello strato di adesivo elastomero e lasciarlo curare.
- Suturare il cuoio capelluto e permettere all'animale di recuperare da un'anestesia in una calda gabbia di recupero fino a quando non è ambulatorio. Amministrare sottocutanea ketoprofene (2,5 mg / kg) o carprofene (2,5 mg / kg) prima di riportare l'animale alla sua gabbia. Parte singola di post-chirurgia soggetti per proteggere il sito chirurgico e ripetere la dose 24 h più tardi.
- Dopo aver rimosso la microspirella, sciacquare entrambi gli aghi da 26 G e 35 G con acqua distillata 7-10 volte per pulire prima di essere conservati.
3. Chirurgia dell'impianto della prismatina
- 1-2 settimane dopo l'iniezione del virus, preparare la chirurgia dell'impianto di pressa pressa. Disinfettare la sonda a prisma in etanolo al 70% e pulirla con la carta dell'obiettivo. Inserire la sonda a prisma nell'alloggiamento dell'obiettivo e serrare la vite esagonale con il cacciavite. Posizionare il microscopio nel supporto base (ilI magneti lo tengono in posizione).
- Preparare l'animale come descritto sotto la sezione Preparazione pre-operativa.
- Tagliare e rasare la testa dell'animale tra gli occhi e le orecchie e disinfettare la pelle con tamponi alternativi di etanolo al 70% e betadina.
- Esponete il cranio incidendo la pelle con un paio di forbici sterili e rimuovete il lembo della pelle e il periostato sottostante. Asciugare e lucidare il cranio con tamponi di cotone. Assicurare un'adeguata rimozione del tessuto muscolare circostante per creare una fondazione ossea pulita, asciutta e larga in preparazione per le seguenti fasi.
- Viti del cranio dell'impianto nell'emisfero contralaterale per rendere l'impianto stabile e sicuro. Questi possono anche essere utili se si sceglie di implantare una barra di testa per fissare la testa sveglia per preparare l'animale per le sessioni sperimentali di imaging nella Sezione 5.
- Livellare il cranio e con un segno di marcatura le coordinate AP e ML per l'inserimento dell'obiettivo. Utilizzando una bava di 0,5 mm su un microdrillo aprire una craniotomia rotonda, assicurando thIl diametro craniotomico è appena più grande del diametro della prisma, vale a dire 1,0 mm in questo caso. Far scivolare con delicatezza il cranio con PBS sterile e aspirarlo via con tamponi di cotone. Rimuovere la polvere ossea che viene generata.
- Passo critico: Posizionare la craniotomia in modo tale che quando il prisma viene inserito nella corteccia, il suo bordo piatto (superficie di imaging) si trova di fronte al sito di iniezione del virus e si trova entro un raggio di 150-200 μm.
- Fermare la perforazione prima che il cranio sia completamente sfinito. I vasi sanguigni devono essere visibili attraverso l'osso sottile. Rimuovere delicatamente la spina ossea con una pinza fine 45 °.
- Rimuovere la dura con la pinza # 5.
- Passo critico: Una volta che il tessuto cerebrale è esposto, tenere sempre il tessuto umido. Posizionare un tampone di cotone immerso in salina sterile sopra la craniotomia. Ciò manterrà anche la pressione sul tessuto.
- Per alleviare la pressione nel tessuto cerebrale duInserimento dell'anello della sonda a prisma, creare un tracciato di inserzione prima del tempo. Fissare un coltello di dissezione diritto al braccio dell'elettrodo dell'apparato stereotossico e montarlo sull'apparato stereotossico ad un angolo tale che la lama del coltello sia perpendicolare alla curvatura del cranio (10 ° in questo caso) e in un Piano parallelo alla colonna di iniezione del virus.
- Posizionare con attenzione il coltello sopra la craniotomia lungo il suo bordo mediale anteriore in questo caso e ~ 200 μm lateralmente al sito di iniezione del virus con il bordo di taglio rivolto posteriormente ( Figura 1 ). Svitare l'asse Z quando la punta del coltello tocca il piatto e abbassa gradualmente (con incrementi di 10 μm / s) ad una profondità in cui verrà inserita la sonda a prisma. Quindi spostare il coltello 1 mm posteriormente per creare un percorso per il bordo superiore del prisma. Sospendi e controlli per eventuali sanguinamenti che possono verificarsi durante l'incisione con un pre-sterile salino impregnato di gelfoam.
- Una volta che il coltello si trova in questa posizione, sciacquare il sito con una soluzione salina sterile e attendere che sanguinamenti svaniscano. Quindi ritirare lentamente il coltello usando il micromanipolatore a braccio stereotossico in incrementi di 10 μm / s e mettere un pezzo di spugna gelfocco imbevuto in salina sterile sopra l'incisione.
- Fissare il supporto dell'obiettivo (con la sonda a prisma e il microscopio) al braccio manipolatore stereotassiale allo stesso angolo del coltello nella fase precedente. Allineare il prisma in modo che il lato piatto del prisma sia sopra l'incisione e parallelo alla colonna di iniezione del virus. Questo passaggio potrebbe richiedere una buona correzione della posizione del braccio stereotossico. Regolare l'allineamento rimanendo vicino al cranio per ottenere risultati più veloci.
- Una volta che il prisma è all'angolo corretto, gradualmente abbassarlo nel cervello in incrementi di 10 μm fino ad una z finale di 1,1 mm per questa sonda, partendo dalla superficie del cervello. Il tessuto cerebrale si espanderà attorno al prisma e ogni pressione che si crea è dietro i visualizatiSul piano e non influenzerà il campo visivo. Inserire il microscopio in un computer con software di acquisizione installato tramite una porta USB3 e visualizzare la fluorescenza del campo accendendo il LED.
- Coprire qualsiasi tessuto esposto attorno al prisma nella craniotomia in uno strato protettivo molto sottile di adesivo elastomero usando un ago da 25G.
- Dopo che l'adesivo elastomero è curato (di solito per 3-5 minuti) utilizzare un ago da 25G per applicare un adesivo cianoacrilato per fissare il bicchiere dell'obiettivo a prisma al cranio adiacente sullo strato di adesivo elastomero, per evitare che l'obiettivo si muova all'interno La craniotomia. Includere i bordi del bracciale della sonda della prism per una migliore adesione. Non ottenere alcun adesivo sulla superficie superiore della sonda a prisma impiantato. Una volta che l'adesivo cianoacrilato viene guarito svitate il supporto dell'obiettivo e rimuovete accuratamente il microscopio. Quindi ritirare lentamente il braccio manipolatore stereotatico per lasciare la sonda a prisma implantata in modo sicuro.
- Applicare uno strato di acrilico dentale oCianoacrilato intorno all'impianto per coprire tutta la superficie del cranio esposto, fino a non toccare il tessuto muscolare retrattato circostante. La copertura di una grande area del cranio con questo tappo cranico in seguito aiuterà nell'accoppiamento del basamento. La pelle intorno al sito dell'impianto dovrebbe guarire da solo intorno al cappuccio cranico.
- Passo critico: Non lasciare che l'adesivo tocchi alcun tessuto circostante o tessuto muscolare e non inghiotti la pelle nel cappuccio cranico. In tal modo si irritano la pelle e possono causare gravi e gravi danni all'impianto.
- Facoltativo: Se si desidera utilizzare una configurazione fissa testata per fissare e staccare il microscopio in una piattaforma di base per l'animale in sessioni di immagini sperimentali piuttosto che brevemente anestetizzare o schiacciare l'animale, impianta una barra di testa nel tappo cranico compatibile con una testa- Impostazione fissa di scelta (non dimostrata in questo protocollo).
- Mescolare il catalizzatore e la base da un silicioE mettere una goccia dell'elastomero all'interno del bracciale della sonda della prism per coprire la parte superiore dell'obiettivo della sonda per evitare danni e polvere da risolvere.
- Rimuovere l'animale dal telaio stereotaxic e consentire il recupero da anestesia in una camera calda. Amministrare sottocutanea ketoprofene (2,5 mg / kg) o carprofene (2,5 mg / kg) e riportare l'animale in una gabbia di casa pulita quando è ambulatorio. Singolarmente ospita tutti i soggetti per proteggere l'impianto e ripetere la dose 24 h più tardi.
4. Attacco base per installazione microscopio miniatura
- Una settimana dopo 10 giorni dopo l'impianto della sonda a prisma, controllare l'espressione del virus nel tessuto attraverso la sonda prismata impiantata e collegare una piastra di base sul cranio se la preparazione mostra l'attività cellulare. Il microscopio aggancerà sulla piastra base durante l'imaging in diretta.
- Seguire i passaggi descritti nella procedura pre-operativa per la preparazione dell'animale per l'attaccatura del basamento.
- Rimuovere il tappo adesivo in silicone sulla superficie della testa dell'obiettivo della sonda a prisma impiantato. Esaminare la superficie della sonda dell'obiettivo e pulire delicatamente tutti i detriti con la carta dell'obiettivo e il 70% di etanolo per assicurare che la superficie di imaging sia pulita.
- Inserire il microscopio nella sua scatola DAQ e collegarlo tramite la porta USB3 al PC.
- Aprire il software di acquisizione sul computer e collegare il microscopio tramite la porta USB3. Utilizzare il software di acquisizione per controllare l'attività neurale e per misurare e documentare le impostazioni di visualizzazione di campo per le registrazioni future in questo argomento.
- Fissare una piastra base al microscopio e fissare la vite di fissaggio della piastra base per tenere in posizione la piastra di base e fissare il microscopio nella presa del microscopio sul braccio micromanipolatore stereotaxicamente dal corpo del microscopio. Fissare la pinza ad una barra Newport, che può essere montata sul braccio di micromanipolatore stereotaxic.
- Posizionare il microscopio sopra la lente della sonda a prisma usando la sBraccio micromanipuator tereotaxic. Ispezionare visivamente l'orientamento osservando l'obiettivo prisma dal lato e dalla parte posteriore della fase animale. Gli assi ottici sia dell'obiettivo del microscopio che della lente della pressa devono essere allineati.
- Accendere il microscopio tramite il software. Valutare la qualità dell'allineamento del microscopio concentrandosi sulla superficie superiore della lente della sonda prismata impiantata nel software di acquisizione. Quando allineato correttamente, i bordi della faccia superiore dell'obiettivo della sonda prismata devono essere nitidi.
- Regolare la distanza fisica del microscopio sopra la sonda prismata impiegata usando il braccio manipolatore stereotassi per ottenere il piano focale desiderato all'interno del tessuto. La distanza ottimizzata ottimizzata tra l'obiettivo del microscopio e l'obiettivo GRIN impiantato è di ~ 500 μm.
- Salvare un'immagine di fluorescenza di riferimento una volta acquisito il piano di imaging desiderato.
Punto critico: Da questo punto in poi, non regolare la posizione del microscopio, in quanto ciò cambierà i locatiSul piano di imaging nel tessuto.
NOTA: Applicare l'adesivo nel passo successivo per fissare in modo permanente la posizione della piastra di base rispetto al tappo cranio. L'adesivo può verificarsi qualche restringimento del volume nel giorno successivo o due, che può cambiare il piano focale nel tessuto. Preventivamente tenere conto di ciò misurando la quantità di restringimento per la miscela adesiva e la distanza ex vivo , quindi sostenendo la posizione finale Z del microscopio + base di base per quella quantità prima di procedere all'apertura dell'adesivo. - Utilizzare l'acrilico o il cianoacrilato dentale per fissare in modo permanente la piastra base al cappello acrilico che copre il cranio dell'animale, colmando il divario con l'acrilico o l'adesivo. Applicare gradualmente e acrilico / cianoacrilato dentale in più fasi può minimizzare l'effetto del ritiro precedentemente menzionato sulla posizione finale del piano di immagine del microscopio.
- Fase critica: Prestare attenzione durante l'applicazione di odontoiatriaAcrilico / cianoacrilato per evitare che qualsiasi materiale entri in contatto con l'obiettivo obiettivo del microscopio, la vite di fissaggio o il corpo del microscopio, che impedirà il corretto funzionamento della strumentazione in seguito.
- Passo critico: durante l'applicazione dell'adesivo, non spingere il microscopio. La pressione sul microscopio o sulla base può causare il movimento dell'obiettivo del microscopio rispetto alla lente della sonda a prisma, il che potrebbe provocare un disallineamento o una modifica del piano focale nel tessuto che richiederebbe una rapida rettifica.
- Verificare che l'acrilico / cianoacrilato dentale sia indurito e indurito toccando l'acrilico con una coppia di punte o punta della siringa. Acquisire un'immagine di fluorescenza finale di riferimento con il software di acquisizione.
- Rilasciare il microscopio dalla pinza e ritirare la pinza dal microscopio. Se si utilizza cianoacrilato o un altro adesivo trasparente, coprirlo con smalto nero o uno strato di cemento dentale nero per evitareLa perdita di luce prolungata nel tappo di testa, che può contaminare le immagini future acquisite durante gli esperimenti.
- A questo punto rimuovere il microscopio, se necessario. Per la separazione del microscopio dalla piastra base, rilasciare la vite di fissaggio della piastra di base ruotando la vite a circa ½ di rotazione in senso antiorario. Pinch il corpo del microscopio mentre sostenete la piastra di base e il tappo acrilico con l'altra mano e tirare il microscopio in su. Sostituirlo nel contenitore di stoccaggio.
- Proteggere la sonda a prisma impiantata con un coperchio della piastra base. Ciò impedirà che le particelle di polvere si stabiliscano sulla superficie dell'obiettivo, che può essere difficile da pulire dopo che la piastra di base è stata installata.
- Fissare il coperchio della piastra di supporto sulla piastra di base e far avanzare la vite di regolazione per circa ½ di rotazione in senso orario o fino a che la vite di regolazione è in scala con il coperchio della piastra base. Non sovraccaricare.
- Rimuovere l'animale da anestesia e monitorare in una calda camera di recupero fino all'ambulanza. Restituisce il thL'animale alla sua gabbia. Singolarmente ospita tutti gli animali con basi piantate per proteggere l'impianto.
5. Imaging di più corticali in un mouse in movimento
- Preparare l'apparato comportamentale ( es. Phenotyper, Noldus), pulendolo e disinfettando e pulendo con una soluzione di candeggina del 10%.
- Inserire il microscopio nella relativa scatola DAQ e collegarla al computer e avviare il software di acquisizione.
- Controllare lo spazio di archiviazione di grandi dimensioni nel computer di acquisizione e fare spazio ai film di imaging di calcio. Salva direttamente dal software al disco rigido locale, piuttosto che scrivere su un disco rigido esterno, per accogliere l'elevata velocità di trasferimento dati tra il microscopio e il computer e impedire la perdita di dati durante le registrazioni.
- Anestetizzare l'animale con isoflurano (5% in ossigeno) in una camera di induzione per fissare il microscopio. In alternativa, strofinare delicatamente l'animale o utilizzare una configurazione testata svegliaCon una testina se è noto che l'anestesia interferisce con il paradigma comportamentale della scelta.
- Rimuovere il coperchio della piastra di supporto ruotando la vite di supporto in senso antiorario e sollevando il coperchio della piastra base.
- Posizionare il microscopio sulla piastra base sull'animale. Il microscopio deve scattare in posizione con l'ausilio dei magneti sulla piastra di base. Avanzate la vite di fissaggio della piastra base fino a che non si senta una leggera resistenza.
- Punto critico: Non stringere la vite di fissaggio della piastra base per evitare danni all'alloggiamento del microscopio.
- Controllare il piano di imaging nel tessuto acquistando un'istantanea di fluorescenza nel software e, se necessario, regolare il piano focale nel tessuto allentando la vite a vite di microscopio, ruotando la torretta del microscopio per regolare la messa a fuoco precisa, quindi stringendo nuovamente la torretta Vite di fissaggio alloggiamento.
- Punto critico: Non forzare mai la torretta per girare senza prima allentare la vite di regolazione eNon stringere più la vite della torretta.
- Se si conduce uno studio longitudinale, tornare alla posizione della torretta fisica per catturare lo stesso campo di vista. Nell'hardware, notare il numero di giri della torretta, o la posizione fisica della torretta, per ogni animale imaged con lo stesso microscopio per un rapido ritorno allo stesso campo visivo.
- Rilasciare l'animale che trasporta il microscopio nella propria gabbia o nella camera di comportamento per l'acclimatazione e aspettare l'usura dell'anestesia se del caso.
- Fase critico: allenare gli animali per portare il peso del microscopio usando un microscopio fittizio per diverse sessioni fino a garantire che il microscopio non interferisca con il loro comportamento normale, prima di iniziare le sessioni sperimentali. La movimentazione regolare e la formazione per una sorveglianza sveglia impediranno agli animali un indebito sforzo.
- Selezionare le impostazioni di acquisizione da utilizzare per raccogliere i dati. Questo include il fraMe per catturare dati ( ad esempio 20 fps, guadagno di 1 e potenza LED del 50%). Controllare l'istogramma dell'immagine quando seleziona le impostazioni per assicurare una buona SNR.
NOTA: L'apertura numerica per la raccolta di fluorescenza è di 0,35 per la sonda a prisma da 1 mm rispetto a 0,5 per la sonda retta da 1 mm. - Avviare il software comportamentale e programmarlo per attivare il microscopio al ciclo di registrazione imaging desiderato ( ad es. Un 4X 5 min ON 2 min OFF). Collegare la porta TTL sulla casella NODUS IO alla porta TRIG sulla casella DAQ tramite un cavo RJ45 a BNC.
- Posizionare l'animale nell'arena comportamentale se non già presente, e avviare l'esperimento.
- Dopo aver acquisito i dati desiderati, riconestetizzare l'animale con isoflurano (5% in ossigeno) in una camera di induzione o svegliare delicatamente l'animale.
- Allentare la vite di fissaggio della piastra base e staccare il microscopio dalla piastra base tirando delicatamente il microscopio. Sostituire il coperchio della piastra base e stringere delicatamente la baseImpostare la vite.
- Rimettere l'animale alla gabbia di casa fino alla successiva sessione di registrazione. Utilizza le immagini di fluorescenza di riferimento come guida per le sessioni di imaging successive per tornare allo stesso campo visivo.
6. Valutazione dei dati di imaging di Ca 2+ di grandi dimensioni
- Per estrarre la posizione delle cellule e la dinamica Ca 2+ nel campo visivo dai dati, possono essere utilizzate diverse piattaforme di analisi dei dati. Per questo studio è stato utilizzato Mosaic, una piattaforma di analisi dei dati progettata appositamente per elaborare filmati di grande formato Ca 2+ .
- Rilevare i pixel difettosi e interpolare i singoli frame eliminati nei film grezzi nella fase di precaricamento. Staccare le immagini nello spazio dal pieno campo visivo di 1,440 x 1,080 pixel a 720 x 540 pixel per ridurre l'impronta dei dati.
- Per correggere gli artefatti del movimento nel cervello rispetto al sensore di immagine del microscopio, registrare i filmati usando una rigorosa immagine immagine basata su ImageJAlgoritmo di registrazione (TurboReg).
- Per identificare singoli neuroni, esprimere nuovamente le immagini come cambiamenti relativi alla fluorescenza ΔF / F 0 = FF 0 / F 0 dove F 0 è l'immagine media ottenuta mediando l'intero filmato.
- Identificare i filtri spaziali corrispondenti a singole celle utilizzando un algoritmo di selezione delle cellule stabilito. Qui abbiamo usato l'analisi principale e individuale dei componenti 21 per individuare i singoli neuroni.
NOTA: Un evento è stato specificato quando l'ampiezza di picco di un evento in una traccia era più di 8 deviazioni standard dalla base di riferimento del tracciato nel nostro set di dati e la posizione della cella e i dati della dinamica di Ca 2+ sono stati esportati per ulteriori analisi.
Risultati
Il protocollo descritto qui descrive un modo efficace ed efficace per eseguire l'imaging Ca 2+ multi-layer longitudinale da centinaia di neuroni corticali in topi comportamentali che usano sonde prismatiche ( Figura 1 ). Gli approcci precedenti verso l'imaging corticale multistrato sono stati principalmente limitati agli animali fisso testa 22 , 23 , 24 , 25 , 26 , 27 . Per acquisire questo livello di dati in un contesto comportamentale liberamente, è stata utilizzata una piattaforma miniaturizzata di microscopi per la flessibilità comportamentale; Un indicatore di calcio geneticamente codificato (GCaMP6f) è stato utilizzato per individuare una popolazione cellulare specifica (cellule CAMKII + nella corteccia); E una sonda a prisma è stata scelta per fornire un campo visivo cronico e multistrato.
Abbiamo dimostrato il flusso di lavoro per la preparazione dell'animale per l'imaging. Un vettore virale che codifica un indicatore di calcio appropriato è stato iniettato nella corteccia ( figura 2 , passaggio 1), prima di impianto cronometrico di una sonda a prisma per consentire l'accesso ottico alle celle etichettate ( figura 2 , passaggio 2). Una piastra base che funge da banchina sicura e temporanea per il posizionamento del microscopio durante le sessioni di imaging è stata poi installata sulla testa dell'animale ( figura 2 , passaggio 3), consentendo la visualizzazione dell'attività corticale su più strati di cellule in un esperimento sveglio di comportamento Setup ( Figura 2 , passaggio 4).
Per assicurare che la popolazione cellulare desiderata sia stata selezionata, nella figura 3 è mostrata una sezione cerebrale coronale post-mortem da un topo rappresentativo con il tratto di sonda prismastico e il campo di vista contrassegnato rispetto al laboratorio GCaMP6fNeuroni eled nei livelli 2/3 e 5 della corteccia somatosensoriale.
Durante il comportamento sveglio con il sistema, l'attività dei neuroni corticali somatosensori è stata registrata quando il mouse è stato esposto a tre diversi ambienti: Open Field (Day 1), Object Familiarization (Day 2-4) e Object Novel (Day 5) ( Figura 4 ). Il giorno 1 il mouse è stato collocato in un arena comportamentale privo di qualsiasi oggetto. Il giorno 2-4 il mouse è stato messo nell'arena con gli stessi due oggetti strutturalmente diversi (un gel pad e un blocco di legno). Il giorno 5, uno degli oggetti è stato sostituito da un nuovo oggetto. L'animale è stato imaging per 5 giorni per 20 minuti ogni giorno.
Dopo l'estrazione delle cellule usando il software di analisi dei dati di immagine Ca 2+ , i filtri spaziali corrispondenti alle posizioni delle cellule sono state sovrapposte alla proiezione di intensità fluorescente media dei dati di registrazione del microscopio( Figura 5) . Una linea tratteggiata bianca separa gli strati di 2/3 e 5 cellule. Le corrispondenti Ca 2+ tracce da 5 celle di ognuno dei livelli mostrano lo schema di cottura delle celle in due contesti comportamentali diversi: Object Familiarization e Novel Object Exposure. Le cellule Layer 2/3 erano più attive rispetto alle cellule del livello 5 il giorno in cui il mouse è stato esposto ad un oggetto nuovo. Ciò è anche evidente dalle trame raster che mostrano l'attività di cottura soggetta a tutte le cellule imaged nei giorni 1, 4 e 5.
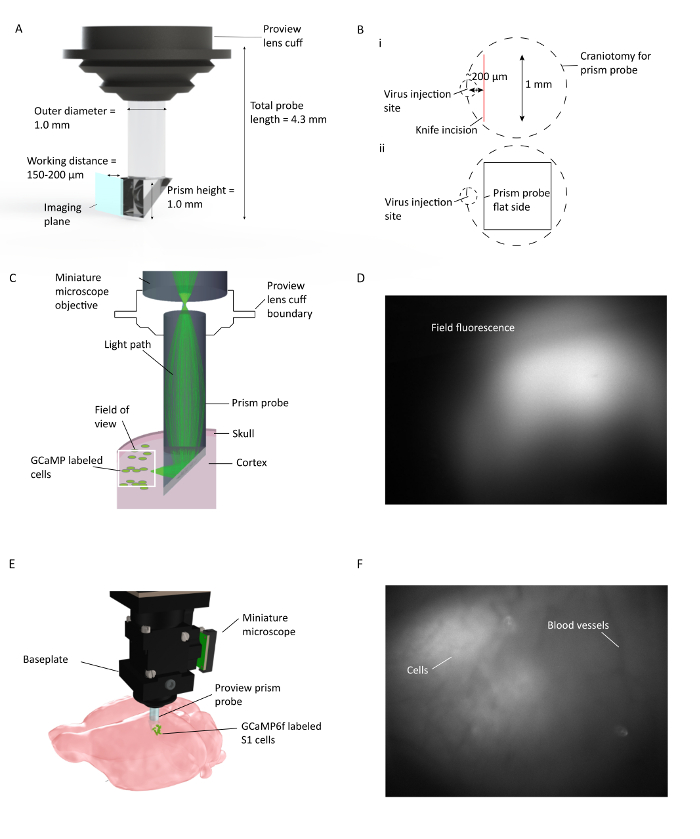
Figura 1: In Vivo Ca 2+ Imaging su più livelli corticali in Mouse in movimento. ( A ) Specifiche della sonda prismata e rappresentazione del piano di imaging. Il rivestimento riflettente all'interno dell'ipotenusa consente di imaging 90 ° dal piano di inserimento della sonda a prisma. La lente cuFf si integra con il supporto dell'obiettivo, che semplifica la procedura di impianto e consente la visualizzazione potenziale della fluorescenza del tessuto ambientale durante l'impianto ( B ) (i). Illustrazione del posizionamento della craniotomia e del coltello della pressa prismatica rispetto al sito di iniezione del virus, e (ii) l'illustrazione della posizione della sonda di prisma della superficie piana rispetto all'incisione del coltello e al sito di iniezione del virus. ( C ) Illustrazione di setup in-vivo di Ca 2+ che mostra il percorso della luce per una piccola area all'interno del campo visivo attraverso la sonda a prisma impiantata nella corteccia del mouse. ( D ) Campo di vista di esempio durante l'installazione della sonda a prisma. Il microscopio miniaturizzato è collegato al supporto dell'obiettivo, che contiene la sonda a prisma che consente di controllare l'espressione del virus durante l'installazione della sonda a prisma. ( E ) Integrazione del microscopio con sonda a prisma per l'imaging corticale multistrato di celle S1 etichettate con GCaMP6f. F Campo di visualizzazione di esempioDurante l'installazione del basamento. Il modello di vaso sanguigno chiaro è visibile al momento dell'installazione del basamento con alcune celle nell'immagine grezze. Altre celle sono chiaramente visibili quando DF / F è acceso nella finestra del software di acquisizione. Clicca qui per visualizzare una versione più grande di questa figura.
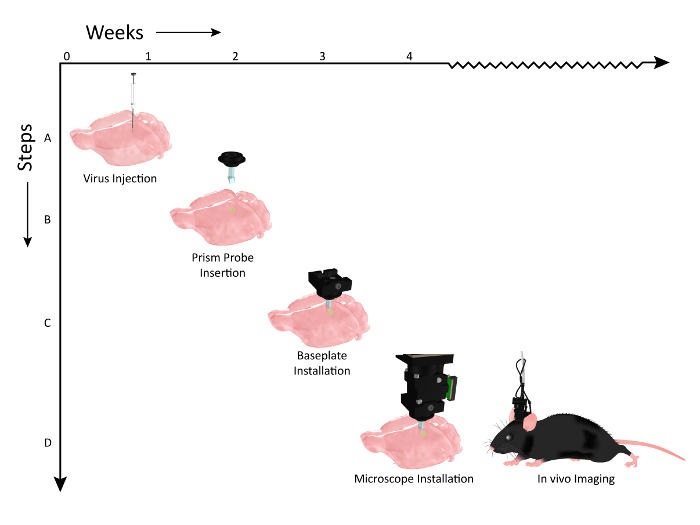
Figura 2: Diagramma che mostra la sequenza temporale degli eventi del flusso di lavoro per l'impianto di impianto e l'installazione del microscopio. Numero di settimane è rappresentato sull'asse X e le fasi del flusso di lavoro delle procedure lungo l'asse Y. ( A ) Grafico che illustra l'iniezione virale (AAV1.CaMKII.GCaMP6f.WPRE.SV40) lungo lo stesso asse dorso-ventrale, per etichettare più strati della corteccia somatosensoria del topo. ( B ) 2 settimane dopo le iniezioni di virus, un prisma probE viene impiantato ad un asse parallelo ai siti di iniezione del virus. ( C ) Circa una settimana dopo l'impianto di pressa pressa, l'animale viene controllato per l'espressione con il microscopio e una piastra di base è montata sulla testa se una popolazione di cellule è visibile. ( D ) L'animale è quindi pronto per l'imaging cronico durante compiti comportamentali pertinenti (Clip art del mouse modificato dopo il permesso di UW-Madison Biochemistry MediaLab). Clicca qui per visualizzare una versione più grande di questa figura.
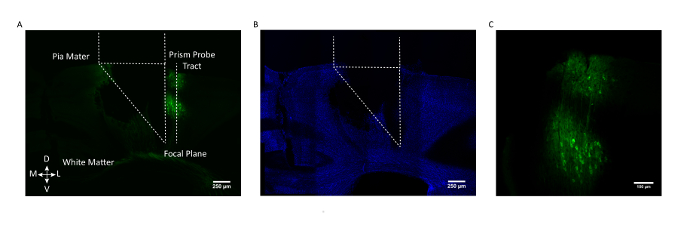
Figura 3: Validazione istologica postmortem della posizione della sonda prismata e dell'espressione GCaMP. ( A ) sezione coronale da un cervello del topo rappresentativo che mostra il tratto della sonda della prism e con il suo lato di imaging rivoltoLe cellule espresse GCaMP6f (AAV1.CaMKII.GCaMP6f espresse nei neuroni negli strati 2/3 e 5). ( B ) Same sezione del cervello coronale dopo la colorazione per DAPI. Barra di scala = 250 μm ( C ) Zoomato in vista delle cellule GCaMP6f espresse in corteccia somatosensoriale. Barra di scala = 100 μm. Clicca qui per visualizzare una versione più grande di questa figura.
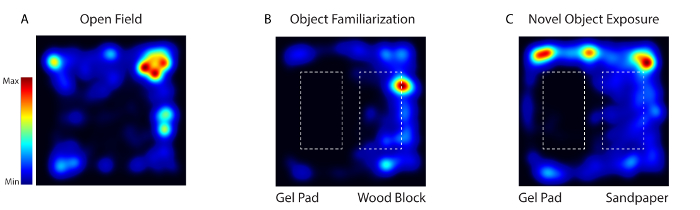
Figura 4: L'attività del mouse durante l'abitudine, la familiarizzazione e il nuovo esame di esposizione degli oggetti sono stati monitorati tramite video utilizzando il software video. ( A ) Il primo giorno, l'animale è stato messo in un arena comportamentale privo di qualsiasi oggetto (Open Field). ( B ) Nei giorni 2-4, gli stessi due oggetti strutturalmente diversi (gel pad e blocco di legno) sono stati posti nell'arena (Object Familiarization). ( C ) Il giorno 5, uno degli oggetti è stato sostituito da un oggetto nuovo (blocco di legno con carta sabbia) (Novel Object Exposure). Clicca qui per visualizzare una versione più grande di questa figura.
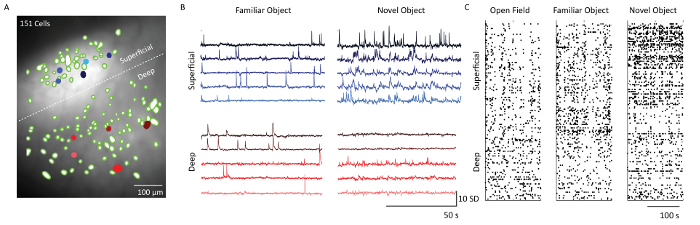
Figura 5: Dinamica del calcio da superficiali e profondi livelli di corteccia somatosensoriale di un topo rappresentativo con il microscopio. ( A ) Immagine unita di filtri spaziali neuronali (blobs verdi) e proiezione media di intensità di fluorescenza della registrazione del microscopio attraverso il campo visivo della sonda a prisma. Il confine tra gli strati supragranulari e infragranulari indicati da una linea bianca tratteggiata. Barra di scala = 100 μm. ( B ) Tracce di calcio da cinque esempi di cellule strati superficiali e profonde (riempito blu e rosso cElls nel pannello A), indicando unità di deviazione standard della fluorescenza seguendo l'analisi principale e indipendente dei componenti. Barra di scala orizzontale 50 s e barra di scala verticale 10 SD ( C ) Trama raster di celle superficiali (strati 2/3) e strati profondi (livello 5) mostrati sul campo aperto, Object Familiarization e Novel object exploration. Barra di scala = 100 s. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Capire l'attività del circuito neurale durante il comportamento sveglio è un livello vitale di indagini neuroscientificali necessarie per disciparle efficacemente la funzione del cervello in salute e malattie. La corteccia è una regione particolarmente importante da studiare nel contesto del comportamento sveglio, in quanto svolge un ruolo importante in molte funzioni vitali, cognitive ed esecutive 28 , 29 .
La colonna corticale è considerata l'unità funzionale base nella corteccia e l'attività delle cellule corticali a livello di popolazione è noto per essere diversa in base alla loro posizione fisica all'interno della colonna. Ad esempio, i neuroni eccitatori negli strati 2/3 nella corteccia somatosensoria proiettano principalmente altre regioni neocorticali e modulano altre reti corticali 30 , mentre le cellule in strati più profondi proiettano principalmente nelle regioni subcorticali come il thalamus 31 . Registrazione dell'attività di centoS di celle corticali pre-specificate simultaneamente e affidabile nel tempo attraverso diverse lamelle in soggetti liberamente comportanti, avrebbe notevolmente migliorato la nostra comprensione del flusso informativo corticale, consentendo una più funzionale dissezione funzionale di colonne corticali informate da informazioni comportamentali in tempo reale e da tempo- bilancia.
La raccolta di questo livello di dati dei circuiti neurali è resa possibile grazie all'impiego di una piattaforma miniaturizzata microscopica efficiente e semplificata per condurre un'imaging su larga scala Ca 2+ in soggetti con comportamenti liberi (o soggetti fisso a piacere). Utilizzato con indicatori di calcio geneticamente codificati per consentire il targeting specifico di tipo cellulare e l'immagine di un campo di visione multistrato fornito da una sonda a prisma cronica impiantato, questo protocollo ha esplorato un caso tra molte applicazioni possibili: osservare le differenze laminari nell'elaborazione corticale somatosensoria quando i topi Fisicamente impegnati con un oggetto nuovo ( Figura 5 ).Questa è la prima illustrazione procedurale di questo tipo di approccio specifico e in vivo di cellule specifiche per studiare più strati corticali in animali svegli e liberamente comportamentali e amplifica lo spettro dei metodi sperimentali disponibili per comprendere le strutture laminari nel cervello attivo.
Il campo visivo periscopico permesso dalla sonda a prisma in questa tecnica può essere applicato in modo efficace ad altre strutture del cervello quando si desidera la conservazione del tessuto direttamente dorsale verso una regione di interesse; Per esempio, l'imaging CA3 potrebbe essere raggiunto senza interruzione della funzione ippocampale.
L'approccio basato sulla sonda prismatica per l'attività di imaging Ca 2+ richiede l'inserimento fisico e l'impianto permanente di un microprismo nella corteccia, che equivale alla creazione di una lesione corticale in cui viene inserita la sonda dell'obiettivo. Ciò può causare interruzioni alla circuiteria neurale locale, compreso il taglio di dendriti e processi apici. TLa sua procedura provocherà anche un'attivazione iniziale di cellule gliali nella regione, anche se questo si prevede di essere localizzato al tessuto circa 150 μm dalla faccia di prisma e di diminuire dopo che il cervello è guarito 22 . È molto importante considerare se questa tecnica influenzerà la normale anatomia e / o il comportamento del circuito quando pianifica esperimenti. I gruppi di controllo comportamentali dovrebbero sempre essere condotti per garantire che non ci siano alterazioni significative nei comportamenti di base che potrebbero produrre risultati confondenti sperimentali.
Utilizzando questa miniatura, la tecnica mobile Ca 2+ di imaging con manipolazione neurofarmacologica, i diversi paradigmi cognitivi, sociali, motori o intrinseci comportamentali e combinandola con altre metriche fisiologiche possono approfondire e arricchire gli studi mirati alla comprensione dei ruoli funzionali dei circuiti neurali nel comportamento e nel segnale Elaborazione 32 . Soppressione o attivazioneLa determinazione di alcuni percorsi modulati da farmaci può influenzare comportamenti associati, che possono essere facilmente studiati usando questa tecnologia 33 . Il raggruppamento in diversi tipi di cellule modificando il targeting dell'indicatore di calcio è un'altra applicazione potente e utile e consente molte combinazioni creative di strumenti sperimentali per affrontare diverse domande sul circuito neurale.
Divulgazioni
Gli autori hanno letto la politica del diario e hanno i seguenti interessi concorrenti: SG, SO e VC sono dipendenti pagati a Inscopix.
Riconoscimenti
Gli autori vorrebbero ringraziare V. Jayaraman, DS Kim, LL Looger e K. Svoboda dell'Espressione Neuronale Codificata Genetica ed Effector (GENIE) presso il Campus di Ricerca Janelia presso l'Istituto Medico Hughes Howard per la loro generosa donazione di AAV1-GCaMP6f All'Università di Pennsylvania Vector Core. Vorrebbero inoltre ringraziare l'A. Olson e la Neuroscience Microscopic Core presso l'Università Stanford sostenuta dalla NIH NS069375 per i loro servizi di microscopia confocale.
Materiali
| Name | Company | Catalog Number | Comments |
| Neurostar Motorized Ultra Precise Small Animal Stereotaxic Instrument | Kopf | Model 963SD | Surgery |
| Stereoscope | Labomed | Prima DNT | Surgery and Imaging |
| Mini Rectal Thermistor Probe (.062"/1.6 mm diameter) - 1/4" Jack | FHC | 40-90-5D-02 | Surgery |
| Heating Pad 5 X 12.5 cm | FHC | 40-90-2-07 | Surgery |
| DC Temperature Controller | FHC | 40-90-8D | Surgery |
| Microsyringe Pump | World Precision Instruments | UMP3 model; serial 155788 F110 | Surgery |
| NanoFil 10 μL Syringe | World Precision Instruments | NANOFIL | Surgery |
| 35 G Beveled Tip Nanofil NDL 2PK | World Precision Instruments | NF35BV-2 | Surgery |
| Omnidrill35, 115 - 230 V | World Precision Instruments | 503598 | Surgery |
| Burrs for Micro Drill | Fine Science Tools | 19007-05 | Surgery |
| nVista | Inscopix | 100-001048 | Imaging |
| AAV1.CaMKII.GCaMP6f.WPRE.SV40 | Penn Vector Core | AV-1-PV3435 | Surgery |
| Ketoprofen | Victor Medical | 5487 | Surgery |
| Carprofen | Victor Medical | 1699008 | Surgery |
| Isoflurane | Victor Medical | 1001054 | Surgery |
| Gelfoam (Patterson Veterinary Supply Inc Gelfoam Sponge 12 cm x 7 mm) | Pfizer (Fisher Scientific) | NC9841478 | Surgery |
| Dumont #5/45 forceps | Fine Science Tools | 11251-35 | Surgery |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | Surgery |
| Dissecting knives | Fine Science Tools | 10055-12 | Surgery |
| ProView Implant Kit | Inscopix | 100-000756 | Surgery and Imaging |
| ProView Prism Probe 1.0 mm-Dia. ~4.3 mm Length | Inscopix | 100-000592 | Surgery and Imaging |
| Kwik-Sil adhesive pack of 2 | World Precision Instruments | KWIK-SIL | Surgery |
| Kwik-Cast Sealant | World Precision Instruments | KWIK-CAST | Surgery and Imaging |
| Miniature Optical Mounting Post | Newport | M-TSP-3 | Imaging |
| Microscope Baseplate | Inscopix | BPL-2 | Imaging |
| Microscope Baseplate Cover | Inscopix | BPC-2 | Imaging |
Riferimenti
- McConnell, S. K. Development and decision-making in the mammalian cerebral cortex. Brain Res. 472 (1), 1-23 (1988).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decision-related activity propagate in a cortical feedback loop during touch perception. Nat. Neurosci. 19 (9), 1243-1249 (2016).
- Miller, E. K., Cohen, J. D. An integrative theory of prefrontal cortex function. Annu. Rev. Neurosci. 24, 167-202 (2001).
- Bailey, M. R., Simpson, E. H., Balsam, P. D. Neural substrates underlying effort, time, and risk-based decision making in motivated behavior. Neurobiol. Learn. Mem. 133, 233-256 (2016).
- Dehaene, S., Changeux, J. P. Reward-dependent learning in neuronal networks for planning and decision making. Prog. Brain Res. 126, 217-229 (2000).
- Ferenczi, E. A., et al. Prefrontal cortical regulation of brainwide circuit dynamics and reward-related behavior. Science. 351 (6268), aac9698 (2016).
- Anomal, R. F., et al. Impaired Processing in the Primary Auditory Cortex of an Animal Model of Autism. Front. Sys. Neurosci. 9, 158 (2015).
- Pauls, D. L., Abramovitch, A., Rauch, S. L., Geller, D. A. Obsessive-compulsive disorder: an integrative genetic and neurobiological perspective. Nat. Rev. Neurosci. 15 (6), 410-424 (2014).
- Ziv, Y., et al. Long-term dynamics of CA1 hippocampal place codes. Nat. Neurosci. 16 (3), 264-266 (2013).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Sun, C., et al. Distinct speed dependence of entorhinal island and ocean cells, including respective grid cells. Proc. Natl. Acad. Sci. 112 (30), 9466-9471 (2015).
- Kitamura, T., et al. Entorhinal Cortical Ocean Cells Encode Specific Contexts and Drive Context-Specific Fear Memory. Neuron. 87 (6), 1317-1331 (2015).
- Pinto, L., Dan, Y. Cell-Type-Specific Activity in Prefrontal Cortex during Goal-Directed Behavior. Neuron. 87 (2), 437-450 (2015).
- Cox, J., Pinto, L., Dan, Y. Calcium imaging of sleep-wake related neuronal activity in the dorsal pons. Nat. Comm. 7, 10763 (2016).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat. Protoc. 11 (3), 566-597 (2016).
- Hooks, B. M., et al. Organization of cortical and thalamic input to pyramidal neurons in mouse motor cortex. The J. Neurosci. 33 (2), 748-760 (2013).
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nat. Neurosci. 17 (7), 987-994 (2014).
- Rowland, D. C., Moser, M. -. B. From cortical modules to memories. Curr. Opin. Neurobiol. 24 (1), 22-27 (2014).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nat. Methods. 8 (10), 871-878 (2011).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nat. Protoc. 9 (11), 2515-2538 (2014).
- Chia, T. H., Levene, M. J. In vivo imaging of deep cortical layers using a microprism. J. Vis. Exp. (30), (2009).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J. Neurophysiol. 102 (2), 1310-1314 (2009).
- Chia, T. H., Levene, M. J. Multi-layer in vivo imaging of neocortex using a microprism. Cold Spring Harb. Protoc. 2010 (8), (2010).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc. Natl. Acad. Sci. 111 (52), 18739-18744 (2014).
- Zeisel, A., et al. Brain structure. Cell types in the mouse cortex and hippocampus revealed by single-cell RNA-seq. Science. 347 (6226), 1138-1142 (2015).
- Hawrylycz, M., et al. Inferring cortical function in the mouse visual system through large-scale systems neuroscience. Proc. Natl. Acad. Sci. 113 (27), 7337-7344 (2016).
- Petrof, I., Viaene, A. N., Sherman, S. M. Properties of the primary somatosensory cortex projection to the primary motor cortex in the mouse. J. Neurophysiol. 113 (7), 2400-2407 (2015).
- Aronoff, R., et al. Long-range connectivity of mouse primary somatosensory barrel cortex. Euro. J. Neurosci. 31 (12), 2221-2233 (2010).
- Rogan, S. C., Roth, B. L. Remote control of neuronal signaling. Pharma. Rev. 63 (2), 291-315 (2011).
- Berdyyeva, T., et al. Zolpidem reduces hippocampal neuronal activity in freely behaving mice: a large scale calcium imaging study with miniaturized fluorescence microscope. PloS One. 9 (11), e112068 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon