È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurazione e risposta alla somministrazione di glucosio alla stimolazione dell'insulina in
In questo articolo
Riepilogo
In questo metodo, le cellule muscolari primarie umane vengono coltivate in vitro per ottenere miotubi differenziati e misurati i tassi di assorbimento del glucosio. Forniamo un protocollo dettagliato per quantificare i tassi negli stati basali e stimolati da insulina utilizzando il [ 3 H] 2-deoxy-D-Glucose radiomarcato.
Abstract
Il muscolo scheletrico è il più grande deposito di glucosio nei mammiferi e contribuisce in gran parte all'omeostasi del glucosio. La valutazione della sensibilità all'insulina delle cellule muscolari è di grande rilevanza per tutti gli studi dedicati all'esplorazione del metabolismo muscolare del glucosio e alla caratterizzazione delle alterazioni metaboliche. Nelle cellule muscolari, le proteine di glucosio trasportatore di tipo 4 (GLUT4) si traslocano alla membrana plasmatica in risposta all'insulina, consentendo così l'immissione massiccia di glucosio nella cellula. La capacità delle cellule muscolari di rispondere all'insulina aumentando il tasso di assorbimento di glucosio è una delle letture standard per quantificare la sensibilità delle cellule muscolari all'insulina. I miotubi primari umani sono un modello in vitro adatto, in quanto le cellule mantengono molte caratteristiche del fenotipo del donatore, compresa la sensibilità all'insulina. Questo modello in vitro è anche adatto per la prova di tutti i composti che potrebbero influenzare la reattività dell'insulina. Riflettere le misurazioni della portata di glucosio in miotubi differenziatiSensibilità all'insulina.
In questo metodo, le cellule muscolari primarie umane vengono coltivate in vitro per ottenere miotubi differenziati e misurati i tassi di assorbimento di glucosio con e senza stimolazione dell'insulina. Forniamo un protocollo dettagliato per quantificare i tassi di trasporto passivi e attivi di glucosio usando [ 3 H] 2-deoxy-D-Glucose ([ 3 H] 2dG radiolabeled). I metodi di calcolo sono forniti per quantificare i tassi attivi basali e insulino-stimolati, nonché la piega di stimolazione.
Introduzione
Il muscolo scheletrico è il più grande deposito di glucosio nei mammiferi e contribuisce in gran parte all'omeostasi del glucosio. Questo tessuto sensibile all'insulina è il sito primario dell'assorbimento di glucosio che è innescato dalla stimolazione insulinica 1 .
Nel diabete di tipo 2, la resistenza all'insulina è osservata in diversi tessuti, inclusi i muscoli scheletrici, e conduce alla normale concentrazione di glucosio nel sangue. Pertanto, è di grande importanza determinare il livello di sensibilità all'insulina di questo tessuto e delle sue cellule, se si vuole caratterizzare un difetto di un soggetto o per valutare l'efficacia di un trattamento che intende migliorare. Nei soggetti umani o animali, la tecnica del gold standard per valutare la sensibilità all'insulina è il morsetto iperinsulinemico euglicemico. Introdotto da DeFronzo nel 1979 2 e modificato dal 3 , 4 poi, il metodo permette di quantificare il corpo intero aNd la reattività dell'insulina misurata come il tasso di glucosio da perfezionare sotto la stimolazione dell'insulina per mantenere la concentrazione normale di glucosio nel sangue.
L'esplorazione di sensibilità all'insulina può essere eseguita anche a livello cellulare utilizzando modelli muscolari in vitro e la misurazione dei tassi di assorbimento di glucosio rimane uno strumento efficace e affidabile per quantificare la risposta biologica della cellula alla stimolazione insulinica 5 , 6 , 7 . Infatti, la misurazione dell'assorbimento di glucosio quantifica la risposta biologica cellulare alla stimolazione dell'insulina, dal legame dell'insulina al suo recettore alla traslocazione delle vescicole arricchite GLUT4, e che comprende le cascate intracellulari di segnalazione e di fosforilazione 8 .
Questo è di grande interesse per i campioni umani, in quanto i miotubi differenziati mantengono molte caratteristiche del fenotipo del donatore, incluso il metabolismoI disturbi osservati nel paziente 9 , 10 , 11 , 12 . I myotubes mostrano somiglianze strutturali, metaboliche e fenotipiche al muscolo scheletrico 13 , 14 , compresa l'espressione dei trasportatori di glucosio 15 e delle macchine di segnalazione di insulina cellulare 16 . Pertanto, la misurazione dell'assorbimento di glucosio nei miotubi primari è rilevante per caratterizzare il fenotipo muscolare di un donatore, o per indagare l'effetto di un intervento (farmaco, nutrizione o attività fisica) sulla sensibilità dell'insulina nella cellula muscolare.
La misurazione dell'assorbimento di glucosio sui miotubi coltivati è anche uno strumento affidabile quando si eseguono esperimenti che modificano la sensibilità all'insulina 17 , 18 . L' in vitro è adatto per la prova di tutti i composti che potrebbero migliorare la reattività all'insulina o potrebbero impedire o invertire la resistenza all'insulina acquisita o indotta dalla 19 , 20 , 21 , 22 , 23 .
Qui descriviamo un protocollo dettagliato per coltivare e differenziare i miotubi umani e per misurare i tassi di assorbimento di glucosio cellulare. Il metodo è applicabile a qualsiasi sorgente di cellule umane di precursori muscolari, siano essi provenienti da preparazioni in laboratorio, collaborazioni o fornitori disponibili in commercio. Le linee di cellule muscolari immortalizzate, come C2C12 e L6, rispettivamente dall'origine del topo e del ratto, possono anche essere utilizzate per la misurazione dell'assorbimento di glucosio con questo protocollo 7 .
Forniamo un protocollo dettagliato per quantificare i tassi in stati basali e stimolati da insulina usando radiodiffatti [ 3 H] 2dG. TL'uso di un analogo glucosio etichettato consente una accurata determinazione dell'ingresso di glucosio con un materiale di partenza ridotto, una condizione comune quando si lavora con le cellule primarie. La molecola di glucosio modificata non è in grado di entrare nei percorsi metabolici e quindi si accumula all'interno della cellula, consentendo una quantificazione affidabile tramite la radioattività totale della cellula. Le condizioni sperimentali includono l'uso di un inibitore del trasporto di glucosio (citocalasin B) e le misurazioni vengono eseguite con e senza insulina. Questa combinazione permette di determinare le percentuali di ingresso attive del glucosio, nonché il calcolo del cambiamento di piega per l'indice di risposta dell'insulina. Il metodo viene presentato con una dose di insulina durante un solo periodo di incubazione, ma il protocollo può essere facilmente modificato per la risposta alla dose o per gli esperimenti del corso di tempo 12 .
Protocollo
1. Preparazione dei mezzi di coltura cellulare e delle soluzioni
- Preparazione di supporti di coltura
- Preparare il medium di proliferazione (PM) completando il mezzo F-10 di Ham con glutamina (2 mM), penicillina / streptomicina (5 μg / mL finale), 2% fetale calf serum (FCS) e 2% siero sostituto.
- Preparare il mezzo di differenziazione (DM) integrando Dulbecco's Modified Eagle Medium (DMEM) con glutamina (2 mM), penicillina / streptomicina (5 μg / mL finale) e 2% FCS.
- Preparazione di soluzioni di assorbimento di glucosio
Attenzione: La manipolazione del materiale radioattivo è consentita solo da un personale autorizzato in una zona limitata e controllata. Il materiale e gli sprechi devono essere trattati secondo procedure, linee guida e legislazioni locali appropriate.- Per preparare la soluzione salina fosforata (X-DPBS) di X-Dulbecco, preparare una soluzione di DPBS contenente 0,2% (w / v) (concentrazione finale)Umina (BSA). Filtrare la soluzione con un filtro da 0,2 μm. Conservare a 4 ° C.
- Per preparare una soluzione fredda di 2-deossi-D-glucosio (2dG), pesare 16,4 mg di 2dG e solubilizzare in 10 mL di acqua distillata per ottenere una soluzione di 10 mM. Conservare a 4 ° C.
- Aggiungere 600 μl di freddo 2dG e 6 μL di radiolabeled [3H] 2dG a 5400 μL di X-DPBS per ottenere la soluzione radiomarcata 2dG (2dG *).
NOTA: La concentrazione finale è di 1 mM 2dG e l'etichettatura è 1 μCi / mL.- Impostare una aliquota di 20 μl (TC20) di soluzione 2dG * radiomarcato.
- Preparazione delle miscele di incubazione
- Per la miscela di citocalasin B aggiungere 2 μL di 20 mM di citocalasin B a 2 ml di soluzione 2dG * radiolabeled.
NOTA: La soluzione di base del citocalasin B è a 10 mg / mL in dimetilsolfossido (DMSO). - Per la miscela DMSO aggiungere 4 μL di DMSO alle restanti 4 mL di soluzione 2dG * radiolabeled.
- Per la miscela di citocalasin B aggiungere 2 μL di 20 mM di citocalasin B a 2 ml di soluzione 2dG * radiolabeled.
2. Cultura di cellule muscolari primarie umane
- Seminazione di piatti a 6 pozzetti con cellule umane del muscolo cellulare
NOTA: utilizzare in-house (vedere il riferimento 24 per i dettagli) o le cellule umane del muscolo umano commercialmente disponibili da una fiala congelata (contenente 250.000 celle). La seguente procedura è fornita per 250.000 celle per ottenere una piastra a 6 pozzetti necessaria per la misurazione dell'assorbimento di glucosio in una sola condizione.- Rapidamente scongelare flaconi congelati di preparazioni in-house 24 o preparazioni commerciali di cellule umane del muscolo cellulare in acqua pre-riscaldata (37 ° C) fino a quando rimane solo un piccolo blocco di ghiaccio nella fiala.
- Versare direttamente in un tubo di plastica da 50 ml contenente 10 ml di PM pre-riscaldato (37 ° C).
- Centrifugare per 5 minuti a 500 xg e scartare il surnatante.
- Riposare delicatamente il pellet cellulare con 18 ml di PM pre-riscaldato (per ottenere 42.000 cellule per3 ml di media). Distribuire 3 mL in ogni pozzetto di una piastra a 6 pozzetti (9,6 cm2).
NOTA: i sei singoli pozzetti di una piastra sono necessari per eseguire una misura duplicata di assorbimento di glucosio per le seguenti condizioni: inibizione del trasporto passivo (pozzetti 1 e 2), tasso basale (pozzetti 3 e 4) e tasso stimolato da insulina (pozzetti 5 e 6). Ripetere quanti piatti a sei pozzetti, come sono necessari trattamenti distinti. - Incubare in condizioni di coltura standard (37 ° C, 5% CO 2 ) fino a quando le cellule raggiungono la confluenza del 90%.
NOTA: Questo passaggio richiede tra 48 e 72 h a seconda del batch della cella. Non cambia mezzo durante questo passaggio.
- Differenziazione delle cellule muscolari
- Rimuovere PM (dopo 48-72 h) e sostituire con DM pre-riscaldato (3 mL per pozzetto). Incubare a 37 ° C, 5% CO 2 .
NOTA: La differenziazione richiede cinque giorni per raggiungere uno stato stabile dove le celle sono allineate e polinucleate. Tipicamente, il primarioI miotubi vengono coltivati in un mezzo di glucosio da 1 g / l. Pertanto, per evitare l'esaurimento del glucosio durante la coltura, riempire la piastra con mezzo di 3 ml per assicurare che in qualsiasi momento sia disponibile il substrato di glucosio sufficiente per le cellule. - Sostituire il mezzo DM ogni due giorni.
NOTA: Da questo punto, i myotubes sono stabili per un massimo di 7 giorni senza alcuna modifica significativa e la misurazione dell'assorbimento di glucosio può essere eseguita in qualsiasi momento.
- Rimuovere PM (dopo 48-72 h) e sostituire con DM pre-riscaldato (3 mL per pozzetto). Incubare a 37 ° C, 5% CO 2 .
- Trattamento delle cellule muscolari (opzionale)
NOTA: i miotubi primari possono essere trattati per diversi giorni per indurre la modifica (test di farmaco, inibitori / attivatori del percorso di segnalazione, ecc. ) Prima della stimolazione dell'insulina e delle misure di assorbimento del glucosio. Le cellule muscolari possono essere sottoposte a qualsiasi trattamento che possa avere un impatto sulla sensibilità all'insulina e la misurazione dell'assorbimento di glucosio quantificerà tale impatto. Ad esempio, l'incubazione delle cellule muscolari con il palmitato acido grasso saturo promuove la resistenza all'insulina e le cellule presentano ridottiNsulin stimolava l'assorbimento di glucosio.- Preparare 12 ml di DM completato con 10% BSA (senza acidi grassi) e 0,5 ml di palmitato (PALM). Preparare solo 12 ml di DM completato con 10% BSA (solo acido grasso).
- Preparare due piastre a 6 pozzetti con miotubi primari umani e coltivarli come descritto nelle sezioni 2.1 e 2.2 (con 5 giorni di differenziazione).
- Il giorno 5, lavare ogni pozzetto con 2 ml di PBS. Ad una piastra aggiungere 2 mL di DM contenente PALM. All'altra piastra aggiungere 2 mL di BSA contenente solo DM.
- Incubare per 48 h a 37 ° C, 5% CO 2 .
3. Stimolazione dell'insulina
- Lavare le cellule muscolari differenziate due volte con 2 mL di PBS.
- Rimuovere attentamente PBS e incubare con 3 ml di DM senza FCS per 3 h (37 ° C, 5% CO 2 ) per l'esaurimento del siero.
- Sostituire i supporti in tutti i pozzetti con 3 mL di DM senza FCS. Aggiungere 100 nM insulina ai pozzetti 5 e 6.
- Incubare la cultura umana di myotubes per1 h (37 ° C, 5% CO 2 ).
4. Assorbimento di glucosio
- Dopo 1 ora di stimolazione dell'insulina, lavare i pozzetti due volte con X-DPBS (1 mL per lavaggio).
- Aggiungere 1 mL di miscela di citocalasin B ai pozzi 1 e 2 e 1 mL di miscela DMSO ai pozzetti 3 - 6. Incubare per 15 minuti (37 ° C, 5% CO 2 ). Al termine dell'incubazione, posizionare immediatamente la lastra sul ghiaccio.
5. Lysis cellulare
- Lavare le cellule due volte con 1 ml di PBS a ghiaccio freddo.
- Lyse le cellule in ciascun pozzetto con 600 μL di 50 mM NaOH. Incubare su ghiaccio per 5 minuti e mescolare delicatamente con rotazione orbitale lenta.
NOTA: Se il lisato è troppo viscoso, diluire fino a 1,5 mL di NaOH. - Usando una pipetta, risospendere e raccogliere il lisato cellulare.
6. Determinazione del glucosio radioattivato
- Mettere 400 μl di ciascuna cellula lisata in una fiala di conteggio liquido di scintillazione. Preparare una fiala di controllo negativa con 400ΜL di 50 mM NaOH e un flaconcino di controllo positivo con 20 μL di TC20 (dal punto 1.2.3.1).
- Aggiungere 4 ml di soluzione di scintillazione liquida a ciascuna fiala. Chiudere il tappo e mescolare bene ogni fiala (1-2 s).
- Inserire ciascuna fiala in un contatore di scintillazione liquida e misurare la radioattività secondo le istruzioni del produttore. Conteggio record per min (CPM) per ogni fiala di scintillazione per 10 min.
NOTA: CPM = "disintegrazioni al minuto" x "efficienza di conteggio".
7. Tasso di assorbimento di glucosio
- Utilizzare il restante lisato (200 μL dalla fase 5.2) per misurare la concentrazione proteica. Determinare la concentrazione proteica di ogni lisi cellulare utilizzando Bradford 25 o un metodo equivalente. Calcolare la quantità totale di proteine (Q) in mg per ogni pozzetto.
- Per ottenere TC1 (il valore per 1 μL di radiodiffusione 2dG *), dividere il valore CPM di TC20 per 20.
- Per ogni fiala, calcolare tTasso di assorbimento di glucosio come segue:
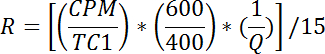
NOTA: R è misurato in pmol / mg / min. Il mezzo di R per i pozzi 1 - 2 fornisce un tasso di trasporto passivo, R p . Il mezzo di R per i pozzi 3-4 fornisce il tasso di trasporto totale basale, R bt . Il mezzo di R per i pozzi 5-6 fornisce il tasso di trasporto totale stimolato dall'insulina, R it .- Calcolare il tasso di trasporto attivo basale (R ba ) come segue:
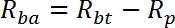
- Calcolare il tasso di trasporto attivo stimolato dall'insulina (R ia ) come segue:
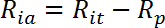
NOTA: nelle cellule reattive dell'insulina come i myotubes, i tassi di assorbimento del glucosio sono di solito rappresentati da tre valori: R ba , R ia , e la stimolazione di insulina piega come R ia / R ba .
- Calcolare il tasso di trasporto attivo basale (R ba ) come segue:
Risultati
Il giorno 3, i mioblasti arrivano a confluenza ( Figura 1A ). I myoblasti in questa fase sono tipicamente mononucleati. La media è stata modificata e il giorno 8, la differenziazione è stata completata ( figura 1B ) (protocollo sezione 2). Dopo 5 giorni di differenziazione, i myotubi sono allineati e tipicamente polinucleati. I miotubi primari umani sono stati sottoposti a un trattamento con palmitato o un solo BSA prima della...
Discussione
L'assorbimento di glucosio è una misura biologica chiave per l'attivazione di attivatori o inibitori sulla coltura cellulare e su come influenzano l'uso del glucosio e la capacità della cellula di rispondere all'insulina. Il metodo descritto qui è stato dimostrato rapido e affidabile ed è stato ampiamente utilizzato in molti studi utilizzando miotubi primari da soggetti sani e / o pazienti affetti da metabolismo 6 , 7 ,
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori riconoscono Anne Charrié presso il servizio Radiobiology (ospedale Lyon-Sud) e il Fond National Suisse (FNS) per il loro sostegno finanziario.
Materiali
| Name | Company | Catalog Number | Comments |
| Human primary muscle cell | In house preparation from human skeletal muscle biopsies | In house preparation from human skeletal muscle biopsies | If not available, use commercial source |
| Human primary muscle cell | Promocell | C-12530 | Should be cultured with associated media C23060 and C23061 |
| 6-well plate | Corning | 356400 | BioCoat Collagen I Multiwell Plates |
| Ham's F10 | Dutscher | L0145-500 | 1 g/L glucose |
| Glutamine | Dutscher | X0551-100 | |
| penicilin/streptomycin 100x | Thermo fisher scientific | 15140122 | |
| Serum substitute UltroserG | Pall France | 15950.017 | serum substitute in text |
| DMEM low glucose | Dutscher | L0064-500 | 1 g/L glucose |
| Fetal Calf Serum | Eurobio | CVFSVF00-01 | |
| Dulbecco's Phosphate-Buffered Saline | Dutscher | L0625-500 | Contains Mg2+ (0.5 mM) and Ca2+ (0.9 mM) |
| Insulin solution human | Sigma-Aldrich | I9278 | |
| 2-deoxy-D-glucose | Sigma-Aldrich | D6134 | |
| Albumin bovine | euromedex | 04-100-812-E | |
| fatty acid-free BSA | Roche | 10,775,835,001 | |
| palmitate | Sigma-Aldrich | P0500 | |
| Deoxy-D-glucose, 2-[1,2-3H (N)] | PerkinElmer | NET328A001MC | Specific Activity: 5 - 10 Ci (185-370GBq)/mmol, 1 mCi (37MBq |
| Cytochalasin B | Sigma-Aldrich | c2743 | |
| PICO PRIAS VIAL 6 mL | PerkinElmer | 6000192 | |
| ultima gold MW CA | PerkinElmer | 6013159 | scintillation liquid |
| bêta counter | PerkinElmer | 2900TR |
Riferimenti
- Stump, C. S., Henriksen, E. J., Wei, Y., Sowers, J. R. The metabolic syndrome: role of skeletal muscle metabolism. Ann Med. 38 (6), 389-402 (2006).
- DeFronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Fossum, E., Hoieggen, A., Moan, A., Nordby, G., Kjeldsen, S. E. Insulin sensitivity relates to other cardiovascular risk factors in young men: validation of some modifications of the hyperinsulinaemic, isoglycaemic glucose clamp technique. Blood Press Suppl. 2, 113-119 (1997).
- Heise, T., et al. Euglycaemic glucose clamp: what it can and cannot do, and how to do it. Diabetes Obes Metab. 18 (10), 962-972 (2016).
- Sell, H., Jensen, J., Eckel, J. Measurement of insulin sensitivity in skeletal muscle in vitro. Methods Mol Biol. 933, 255-263 (2012).
- Sarabia, V., Lam, L., Burdett, E., Leiter, L. A., Klip, A. Glucose transport in human skeletal muscle cells in culture. Stimulation by insulin and metformin. J Clin Invest. 90 (4), 1386-1395 (1992).
- Sarabia, V., Ramlal, T., Klip, A. Glucose uptake in human and animal muscle cells in culture. Biochem Cell Biol. 68 (2), 536-542 (1990).
- Richter, E. A., Hargreaves, M. Exercise, GLUT4, and skeletal muscle glucose uptake. Physiol Rev. 93 (3), 993-1017 (2013).
- Gaster, M., Kristensen, S. R., Beck-Nielsen, H., Schroder, H. D. A cellular model system of differentiated human myotubes. Apmis. 109 (11), 735-744 (2001).
- Bouzakri, K., et al. Reduced activation of phosphatidylinositol-3 kinase and increased serine 636 phosphorylation of insulin receptor substrate-1 in primary culture of skeletal muscle cells from patients with type 2 diabetes. Diabetes. 52 (6), 1319-1325 (2003).
- Scheele, C., et al. Satellite cells derived from obese humans with type 2 diabetes and differentiated into myocytes in vitro exhibit abnormal response to IL-6. PLoS One. 7 (6), e39657 (2012).
- Jackson, S., et al. Decreased insulin responsiveness of glucose uptake in cultured human skeletal muscle cells from insulin-resistant nondiabetic relatives of type 2 diabetic families. Diabetes. 49 (7), 1169-1177 (2000).
- Aas, V., et al. Are cultured human myotubes far from home?. Cell Tissue Res. 354 (3), 671-682 (2013).
- Bakke, S. S., et al. Myotubes from severely obese type 2 diabetic subjects accumulate less lipids and show higher lipolytic rate than myotubes from severely obese non-diabetic subjects. PLoS One. 10 (3), e0119556 (2015).
- Stuart, C. A., et al. Hexose transporter mRNAs for GLUT4, GLUT5, and GLUT12 predominate in human muscle. Am J Physiol Endocrinol Metab. 291 (5), E1067-E1073 (2006).
- Al-Khalili, L., et al. Insulin action in cultured human skeletal muscle cells during differentiation: assessment of cell surface GLUT4 and GLUT1 content. Cell Mol Life Sci. 60 (5), 991-998 (2003).
- Tsuka, S., et al. Promotion of insulin-induced glucose uptake in C2C12 myotubes by osteocalcin. Biochem Biophys Res Commun. 459 (3), 437-442 (2015).
- Gorbunov, E. A., Nicoll, J., Myslivets, A. A., Kachaeva, E. V., Tarasov, S. A. Subetta Enhances Sensitivity of Human Muscle Cells to Insulin. Bull Exp Biol Med. 159 (4), 463-465 (2015).
- Breen, D. M., Sanli, T., Giacca, A., Tsiani, E. Stimulation of muscle cell glucose uptake by resveratrol through sirtuins and AMPK. Biochem Biophys Res Commun. 374 (1), 117-122 (2008).
- Pinnamaneni, S. K., Southgate, R. J., Febbraio, M. A., Watt, M. J. Stearoyl CoA desaturase 1 is elevated in obesity but protects against fatty acid-induced skeletal muscle insulin resistance in vitro. Diabetologia. 49 (12), 3027-3037 (2006).
- Gastebois, C., et al. Transition from physical activity to inactivity increases skeletal muscle miR-148b content and triggers insulin resistance. Physiol Rep. 4 (17), (2016).
- Naimi, M., Tsakiridis, T., Stamatatos, T. C., Alexandropoulos, D. I., Tsiani, E. Increased skeletal muscle glucose uptake by rosemary extract through AMPK activation. Appl Physiol Nutr Metab. 40 (4), 407-413 (2015).
- Feng, Y. Z., et al. PPARdelta activation in human myotubes increases mitochondrial fatty acid oxidative capacity and reduces glucose utilization by a switch in substrate preference. Arch Physiol Biochem. 120 (1), 12-21 (2014).
- Perrin, L., et al. Human skeletal myotubes display a cell-autonomous circadian clock implicated in basal myokine secretion. Mol Metab. 4 (11), 834-845 (2015).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Bouzakri, K., et al. Malonyl CoenzymeA decarboxylase regulates lipid and glucose metabolism in human skeletal muscle. Diabetes. 57 (6), 1508-1516 (2008).
- Shemyakin, A., et al. Endothelin-1 reduces glucose uptake in human skeletal muscle in vivo and in vitro. Diabetes. 60 (8), 2061-2067 (2011).
- Alkhateeb, H., Chabowski, A., Glatz, J. F., Luiken, J. F., Bonen, A. Two phases of palmitate-induced insulin resistance in skeletal muscle: impaired GLUT4 translocation is followed by a reduced GLUT4 intrinsic activity. Am J Physiol Endocrinol Metab. 293 (3), E783-E793 (2007).
- Coll, T., et al. Oleate reverses palmitate-induced insulin resistance and inflammation in skeletal muscle cells. J Biol Chem. 283 (17), 11107-11116 (2008).
- Gaster, M., Rustan, A. C., Beck-Nielsen, H. Differential utilization of saturated palmitate and unsaturated oleate: evidence from cultured myotubes. Diabetes. 54 (3), 648-656 (2005).
- Hage Hassan, R., et al. Endoplasmic reticulum stress does not mediate palmitate-induced insulin resistance in mouse and human muscle cells. Diabetologia. 55 (1), 204-214 (2012).
- Haghani, K., Pashaei, S., Vakili, S., Taheripak, G., Bakhtiyari, S. TNF-alpha knockdown alleviates palmitate-induced insulin resistance in C2C12 skeletal muscle cells. Biochem Biophys Res Commun. 460 (4), 977-982 (2015).
- Hommelberg, P. P., et al. Palmitate-induced skeletal muscle insulin resistance does not require NF-kappaB activation. Cell Mol Life Sci. 68 (7), 1215-1225 (2011).
- Yang, M., et al. Saturated fatty acid palmitate-induced insulin resistance is accompanied with myotube loss and the impaired expression of health benefit myokine genes in C2C12 myotubes. Lipids Health Dis. 12, 104 (2013).
- Peng, G., et al. Oleate blocks palmitate-induced abnormal lipid distribution, endoplasmic reticulum expansion and stress, and insulin resistance in skeletal muscle. Endocrinology. 152 (6), 2206-2218 (2011).
- Lambernd, S., et al. Contractile activity of human skeletal muscle cells prevents insulin resistance by inhibiting pro-inflammatory signalling pathways. Diabetologia. 55 (4), 1128-1139 (2012).
- Nikolic, N., et al. Electrical pulse stimulation of cultured human skeletal muscle cells as an in vitro model of exercise. PLoS One. 7 (3), e33203 (2012).
- Hsu, F. L., et al. Antidiabetic effects of pterosin A, a small-molecular-weight natural product, on diabetic mouse models. Diabetes. 62 (2), 628-638 (2013).
- Zou, C., Wang, Y., Shen, Z. 2-NBDG as a fluorescent indicator for direct glucose uptake measurement. J Biochem Biophys Methods. 64 (3), 207-215 (2005).
- Catalano, K. J., et al. Insulin resistance induced by hyperinsulinemia coincides with a persistent alteration at the insulin receptor tyrosine kinase domain. PLoS One. 9 (9), e108693 (2014).
- Liu, H. Y., et al. Insulin is a stronger inducer of insulin resistance than hyperglycemia in mice with type 1 diabetes mellitus (T1DM). J Biol Chem. 284 (40), 27090-27100 (2009).
- Renstrom, F., Buren, J., Svensson, M., Eriksson, J. W. Insulin resistance induced by high glucose and high insulin precedes insulin receptor substrate 1 protein depletion in human adipocytes. Metabolism. 56 (2), 190-198 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon