Method Article
Procedure e strategie di ottimizzazione chiave per un metodo automatizzato Immunoassay basati su elettroforetica capillare
In questo articolo
Riepilogo
È dimostrato un immunodosaggio basato su capillare utilizzando una piattaforma commerciale per misurare proteine bersaglio dalle preparazioni di proteine totali. Inoltre, i parametri di analisi del tempo di esposizione, concentrazione nella proteina e diluizione dell'anticorpo sono ottimizzati per un sistema di modello di coltura cellulare.
Abstract
Nuove tecnologie che utilizzano test immunologici basati su capillare promettono valutazione più veloce e più quantitativa della proteina rispetto ai tradizionali test immunologici. Tuttavia, simile ad altri dosaggi di proteina anticorpo-basato, ottimizzazione dei parametri di base capillare immunoassay, quali concentrazione proteica, diluizione dell'anticorpo e tempo di esposizione è un presupposto importante per la generazione di significativo e affidabile dati. Misure devono rientrare all'interno della gamma lineare del dosaggio dove sono direttamente proporzionali ai cambiamenti nella concentrazione di lisato cambiamenti nel segnale. Il processo di scelta di concentrazioni adeguate di lisato, diluizioni di anticorpo e tempi di esposizione in linea di cellule epiteliali bronchiali umane, BEAS-2B, è dimostrato qui. Linearità di dosaggio è indicato sopra una gamma di concentrazioni di proteina intera cellula Estratto con gli anticorpi p53 e α-tubulina. Un esempio del burnout segnale è visibile alle più alte concentrazioni con tempi di esposizione lunghi, e una curva di diluizione dell'anticorpo di α-tubulina è mostrata dimostrando la saturazione. Inoltre, risultati sperimentali di esempio sono riportati per cellule trattate con doxorubicina utilizzando parametri ottimizzati.
Introduzione
Test immunologici mediante elettroforesi capillari misurano l'espressione della proteina in lisati cellulari utilizzando sistemi di separazione di dimensione o carica e offrono numerosi vantaggi rispetto i tradizionali test immunologici. Ad esempio, rispetto alla macchia occidentale, la procedura automatizzata basata su capillare elimina la necessità di gel, dispositivi di trasferimento, e manuale di lava. Inoltre, la quantità assoluta di proteine necessaria è circa 10 volte meno, rendendo i sistemi basati su capillare ideale per l'utilizzo con i tipi di cellule rare o campione limitato1,2. Risultati sono ottenuti in meno di 3 h utilizzando sistemi automatizzati e precedentemente sono stati dimostrati più quantitativa e riproducibile di convenzionale western blot procedure3,4,5. Il processo per saggi basati su dimensioni consiste di caricamento campioni contenenti sodio dodecil solfato (SDS), ditiotreitolo (DTT) e fluorescente etichettati marcatori di peso molecolare in colonne capillari contenenti matrici di accatastamento e separazione. Tensione applicata ai capillari separa le proteine in campioni in base alla dimensione, e luce UV immobilizza le proteine separate per la parete capillare. Il capillare è quindi immuno-sondato con specifica della destinazione primario dell'anticorpo e rafano perossidasi (HRP)-anticorpo secondario coniugato. Luminol e perossido di catalizzare chemiluminescente generazione di luce che è misurata da una telecamera di charge coupled device (CCD) ed analizzati per quantificare le proteine.
Nonostante la relativa facilità e la velocità di una piattaforma di dosagggio immunologico automatizzato basato su capillare elettroforetica, ottimizzazione di metodiche quali concentrazione proteica, diluizione dell'anticorpo e tempo di esposizione è importante per ottenere accurate, riproducibili risultati. In generale, è necessario eseguire le procedure seguenti per ottimizzare un dosaggio per questi sistemi:
1) uno schermo deve essere eseguito per valutare e scegliere gli anticorpi per segnale e specificità per il proteina bersaglio. Se disponibile, la proteina purificata o epitopo target può essere utilizzato per valutare la specificità; Tuttavia, è ancora importante valutare potenziali segnale aspecifico in proteine totali proveniente dal sistema di modello.
2) successivamente, la gamma dinamica del dosaggio deve essere determinato. In una situazione ideale, segnale raddoppio (misurato utilizzando area di picco) è osservato come la concentrazione del campione è raddoppiata; Tuttavia, in pratica, un cambiamento proporzionale a segnale di input in modo prevedibile (ad es., lineare adatta) è sufficiente per la quantificazione della proteina. Inoltre, questa ottimizzazione definirà la concentrazione di proteine con segnale alto ma ancora all'interno della gamma lineare per il modello sperimentale.
3) determinare la concentrazione di anticorpi ottimale utilizzando la concentrazione nella proteina fisso selezionata in fase di ottimizzazione 2. Come la concentrazione di anticorpi, il segnale aumenta fino a quando esso altipiani a saturazione. Una concentrazione di anticorpi vicino a questo livello di saturazione è necessaria per la misura accurata di concentrazione nella proteina.
Il processo utilizzato per ottimizzare le concentrazioni della proteina, diluizioni di anticorpo e tempi di esposizione per un di dosaggio automatizzato basato su capillare dimensione6 è dimostrato usando gli estratti di cellule intere isolati da BEAS-2B, un essere umano SV-40 trasformato bronchiale linea cellulare epiteliale. Isolamento della proteina dagli estratti delle cellule o del tessuto può essere eseguita utilizzando un numero di protocolli pubblicati7,8,9 e non sarà coperti qui. Risultati di un esperimento di prova utilizzando le condizioni ottimizzate sono inoltre segnalati per totale e fosforilate (serina 15, Serina 20) p53 nelle culture esposte a doxorubicina (un agente chemioterapeutico comune che induce l'apoptosi di cellule10) a 1.2, 1.8, e 2,4 media µ g/mL per 4 h prima del raccolto. Le aree di picco di p53 sono normalizzate a ɑ-tubulina, che è usato come un controllo di carico.
Protocollo
Nota: accertarsi che tutti i reagenti ed i campioni sono preparati secondo il produttore ' protocollo s, descritta di seguito. Si prega di indossare dispositivi di protezione individuale adeguata durante questa procedura, che include guanti in nitrile, camice, scarpe a punta chiusa e occhiali di sicurezza. Una tabella di materiali specifici, reagenti e attrezzatura necessaria è fornita separatamente. Proteina totale concentrazione dei campioni deve essere determinata in anticipo utilizzando metodologie consolidate che sono compatibili con il lisato buffer utilizzato, come analisi di Bradford 11.
1. preparazione dei campioni e reagenti del pacchetto standard come fornito dal produttore di
- per preparare la soluzione di lavoro di 400 mM di ditiotreitolo (DTT), aggiungere 40 µ l deionizzata acqua al tubo trasparente contenente il stock fornito dal produttore. È importante evitare di introdurre bolle alla soluzione mescolando la soluzione con lenta e delicata pipettaggio. Tampone del campione
- aggiungere 20 µ l 10 X e 20 µ l della soluzione preparata 400 mM DTT nella rosa provetta contenente 5 fluorescente X master mix (Vedi la Tabella materiali).
Nota: Il Master Mix (MM) è sigillato dal costruttore con una pellicola di copertura e deve essere trafitto da un puntale. Mix dolcemente pipettando lento per evitare spruzzi DTT in pipetta. - Successivamente, aggiungere 16 µ l deionizzata acqua, 2 µ l di fornito 10X tampone del campione e 2 µ l della soluzione preparata 400 mM DTT al bianco biotinilati scaletta tubo fornito dal produttore. Mescolare delicatamente e trasferire in una provetta di 0,6 mL di denaturazione.
- Preparare 0,1 x tampone diluendo la dotazione 10 X soluzione 1: 100 con acqua. Preparare abbastanza 0,1 x tampone per diluire i campioni tutti.
- Calcolare la quantità di 0,1 x sample buffer che viene aggiunto a un campione, che dipenderà la concentrazione finale desiderata delle proteine totali. Mescolare 1 parte 5 x fluorescente MM con 4 parti campione per ottenere la concentrazione finale desiderata di proteine diluito.
Volumi
- calcola come segue: (i) Volume 5 x fluorescente MM = (concentrazione nella proteina finale desiderata) / 5; (ii) volume di stock di proteine = (concentrazione di proteina finale desiderata x volume totale richiesto) / proteina stock concentrazione; (iii) volume di 0,1 x tampone del campione = volume totale - 5 x MM volume - proteina stock volume.
2. Denaturazione di campioni e scaletta
- luogo preparato campioni e biotinilati scaletta in un blocco di calore di 95 ° C per 5 min. tubi di vortice immediatamente dopo l'incubazione, eseguire uno spin per ~ 5 s in una centrifuga da tavolo e posto su Ice.
Nota: Alcune proteine possono richiedere condizioni denaturanti più delicate (ad es., 70 o C per 10 min) per impedire l'aggregazione proteica e migliorare la migrazione nella matrice capillare. Considerate questa opzione se c'è pesante sbavature presso i più alti pesi molecolari (Vedi ad esempio video).
3. Preparazione di anticorpi
- come determinato da ottimizzazione (Vedi Rappresentante risultati e video), l'anticorpo fornito da soli il desiderato diluizioni di anticorpo primario (ad esempio, 01:50, 1: 100) Diluente 2.
Nota: Gli anticorpi sono generalmente utilizzati a concentrazioni più elevate per immunodosaggio basato su capillare rispetto per macchiarsi occidentale tradizionale. L'anticorpo secondario fornito è pronto all'uso senza diluizione.
4. Preparazione di perossido e Luminol-S
- preparare una miscela 1:1 di perossido e luminol-S.
- Vortex per mescolare e conservare il ghiaccio
Nota: È importante che questa miscela è preparata fresco per ogni dosaggio sperimentale. 250ul mix totale è necessario per eseguire un piatto completo.
5. Preparazione del piatto dosaggio
- come illustrato nella Figura 1, caricare i campioni e reagenti preparati sopra nella piastra del dosaggio. Consulta le istruzioni dettagliate qui di seguito per ogni riga. Per minimizzare evaporazione dai pozzi, assicurarsi che il coperchio della piastra viene sostituito tra aggiunte di reagente.
- Nella riga A, pipettare 5 µ l di Biotinylated Ladder in pozzetto A1. Per l'altra fila, dispensare preparati campioni (5 µ l) nei pozzetti A2-A25.
Nota: È fondamentale che la A1 contiene bene sempre scaletta, come il primo capillare nella cartuccia è ottimizzato per l'esecuzione di questo standard. - In fila B, dispensare 10 µ l di diluente 2 anticorpo in ogni pozzetto (B1-B25).
- Nella riga C, dispensare 10 µ l di diluente 2 anticorpo in C1 bene. Nella riga resto pozzetti C, dispensare 10 µ l di anticorpo primario (pozzetti C2-C25).
- In fila D, dispensare 10 µ l di streptavidina-HRP in ben D1. Nella riga resto pozzetti D, dispensare 10 µ l di anticorpo secondario (pozzi D2-D25).
- In fila E, dispensare 10 µ l della miscela preparata luminol-perossido in ogni pozzetto (E1-E25).
- Infine, aggiungere 500 µ l di tampone di lavaggio per vano a ciascuno le prime 3 righe di pozzi buffer.
Nota: È importante ridurre al minimo la formazione di bolle di pipettaggio delicatamente e non espellere il volume finale dalla punta come bolle possono interferire con il capillare di carico ed eseguire. - Una volta caricati tutti i pozzetti, centrifugare la piastra a ~ 1000 x g per 5 min a temperatura ambiente per rimuovere le bolle e assicurarsi che il liquido sia il fondo dei pozzetti. Pop tutte le bolle visibili con un puntale piccolo o un ago pulito (ad es., calibro 25 sterile " alto rappresentante " needle).

Figura 1 . Modello di pipettaggio per piastra test. Codifica a colori rappresenta corretta reagenti e campioni (fino a 24 in totale) sulla piastra di dosaggio. Aggiungere biotinilati scaletta al pozzetto A1 (arancione), preparati campioni da pozzetti A2 fino A25 (blu chiaro), anticorpo 2 diluente nei pozzetti B1-B25 e C1 (verde chiaro), anticorpo primario per pozzetti C2 fino a C25 (blu), streptavidina-HRP ben D1 (rosa scuro), anticorpo secondario per pozzi D2 fino a D25 (verde scuro) e il mix di luminol-perossido nei pozzetti E1 fino a E25 (viola). Tampone di lavaggio viene aggiunto per le prime tre righe della piastra metà più grande pozzi (blu scuro). Clicca qui per visualizzare una versione più grande di questa figura.
6. a partire lo strumento capillare immunoassay
- assicurarsi che lo strumento e il computer di accompagnamento siano accesi. Nessun tempo di preriscaldamento è necessario.
- Aprire il software di strumentazione sul computer. In primo luogo, selezionare il " test " scheda sulla destra della finestra e " nuovo dosaggio " sotto il " Menu File " sulla sinistra. Selezionare il formato, la gamma di dimensioni (ad es., 12-230 kDa) e la cartuccia tipo (ad esempio, 25 capillare) che è stato utilizzato per il dosaggio particolare.
Nota: Un maggio anche input analisi parametri, incluso la concentrazione nella proteina, tipo di anticorpo e diluizione, se lo si desidera, ma questi non sono necessari per avviare il test. - Aprire la porta sullo strumento premendo il pulsante sulla parte superiore del pannello arancio.
- Rimuovere delicatamente la cartuccia capillare dalla confezione. Senza toccare i capillari di vetro se stessi, è necessario inserire la cartuccia nell'apposito supporto. Verificare i posti a sedere cartuccia osservando la luce interiore cambia da arancione a blu.
- Tenere saldamente la piastra sul banco e rimuovere con cautela il sigillo di evaporazione dalla parte inferiore della piastra. Pop tutte le bolle vista in questi pozzi di matrice di separazione con un smtutti puntale o aghi puliti (ad esempio, calibro 25 sterile " alto rappresentante " needle).
- Posizionare la piastra di saggio sul porta targa, assicurando che sia completamente inserita e chiudere la porta strumenti.
- Clic la " Start " pulsante nel software.
Nota: Se viene visualizzata la finestra di nessun pulsante di avvio, il collegamento con lo strumento è stato perso. Scegliere strumenti dal menu in alto a sinistro, quindi collegare. Un pop-up dovrebbe essere visualizzato con il numero di matricola; Selezionare questa opzione, quindi fare clic su Connetti. Pulsante Start dovrebbe ora apparire. - Quando viene completata, l'esecuzione scartare la piastra. Rimuovere la cartuccia e posto in un apposito contenitore per lo smaltimento, insieme a qualsiasi aghi che potrebbe essere stato utilizzato per bolle scoppiano. Lasciare acceso per evitare problemi di connessione se lo strumento viene utilizzato regolarmente (ad es., almeno settimanalmente).
7. Esperimento di analisi
- prima dell'analisi, garantire vengono eseguiti i seguenti controlli di qualità.
- Verifica fluorescente standard selezionando la " standard Visualizza " icona. Verificare che gli standard sono identificati correttamente nella " visualizzazione grafico " scheda. Se non sono corretti, andare alla " singola visualizzazione " icona, fare clic con il pulsante destro sul picco di corretto e selezionare " forza Standard ", o fare clic con il pulsante destro sul picco errato e selezionare " non Standard ". Eseguire questo controllo per ogni nuovo capillare.
- Verifica biotinilati scaletta cliccando sul " campioni " e " singola visualizzazione " icone. Selezionare la scala nella scheda esperimento. Se un picco è identificato in modo non corretto, fare clic destro su di esso in " visualizzazione grafico " e selezionare " Rimuovi Peak ".
Nota: ad esempio, la scala di biotinylated utilizzata per il 12-230 kDa kit dovrebbe mostrare 12, 40, 66, 116, 180 e 230 kDa picchi di ridimensionamento. Se questo passaggio non viene eseguito, il dimensionamento dei picchi del campione sarà calcolato in modo errato, producendo risultati spuri. - Vista e analizzare i picchi del campione. Derivano i dati dalla tabella di vette, tra cui peso molecolare, area di picco, picco alto e segnale-rumore (S/N), come necessario per calcoli sperimentali.
Risultati
Tempo di esposizione - Burnout di segnale di determinazione
Burnout di segnale può verificarsi quando il substrato di luminol e perossido si esaurisce troppo rapidamente. Questo può essere determinato esaminando i dati in tempi di esposizione differenti chemiluminescenza. Nel software di analisi, vai a "Modifica – > analisi – > immagini". Le esposizioni vanno da 5 a 480 s. L'asse y in un elettroferogramma rapporti segnale/tempo, quindi i dati da ogni esposizione dovrebbero avere un simile coefficiente di segnale/tempo. Questo coefficiente diminuisce con esposizioni in sequenza più lunghe se luminol si esaurisce, come si è visto con l'anticorpo di DO-1 di p53 (Figura 2). A causa di svuotamento del substrato, questo test può essere considerato misurabile fino alla concentrazione di 0,2 µ g / µ l solo presso le esposizioni di s di 5-30. Pertanto, in questo esempio, 15 s è stato determinato per essere il tempo di esposizione ottimale dei dati analisi per p53.
Titolazione lysate - Determinazione del range dinamico lineare
È importante che misure all'interno della gamma dinamica lineare di ogni dosaggio, dove cambiamenti nel segnale come misurato dall'area del picco sono proporzionali ai cambiamenti nella quantità di proteine nel campione. Utilizzando il tempo di esposizione ottimale di 15 scelti di s nella sezione precedente, dosaggio linearità è dimostrata per p53 sia ɑ-tubulina sopra maggiore di un intervallo di 15 volte della concentrazione (Figura 3). Nella nostra esperienza, un valore di2 R di > 0,9 di una regressione lineare adatta è considerato accettabile per un intervallo di diluizione della proteina purificata di quantità nota (se il test è una misura quantitativa assoluta) o campione lisato di proteina bersaglio sconosciuto (se dosaggio è una misura quantitativa relativa).
Ottimizzazione della diluizione di anticorpo
Usando gli anticorpi a saturare le concentrazioni aiuta a garantire che eventuali cambiamenti del segnale misurati sono dovuti solo a cambiamenti nella quantità di proteine. Come dimostrazione, due varietà di cellula BEAS-2B intera cellula estrae (0,2 µ g / µ l proteine totali caricati nel dosaggio) erano sondato con concentrazioni di anticorpo diluito serialmente ɑ-tubulina che vanno da 01:25 - 1: 800 (Figura 4). Segnale a chemiluminescenza (qui, misurata come area di picco) è stata tracciata contro la diluizione dell'anticorpo. Saturazione è stata osservata vicino il 01:50 diluizione dove la curva inizia un altopiano evidente.
Prova sperimentale - trattamento di doxorubicina in cellule BEAS-2B
Utilizzando condizioni di dosaggio ottimizzato, coltura cellulare BEAS-2B è stato trattato con tre differenti concentrazioni di doxorubicina (1.2, 1,8 e 2,4 µ g/mL) per 4 h (Figura 5, tabella 1). Attivazione di p53 attraverso modifiche post-traduzionali media diverse risposte cellulari, tra cui l'arresto del ciclo cellulare, senescenza e apoptosi12. In particolare, la fosforilazione della serina 15 è stata attribuita all'attivazione trascrizionale di p53, con conseguente apoptosi dopo doxorubicina trattamento13. In questa dimostrazione, ɑ-tubulina normalizzati picco aree vengono presentati come piega del controllo. È interessante notare che, 3.5 a 4 falde aumenti in p53 fosforilazione in serina sono stati osservati aumenti 15 e 2 volte nel livello di p53 fosforilata in serina 20 dopo l'esposizione di 4 h a doxorubicina. Questi risultati indicano l'attivazione di p53; Tuttavia, nessuna dose-risposta è visto per le concentrazioni scelte (al contrario, la dose più bassa testata ha suscitato la risposta più alta). Totale p53 non hanno dimostrato una risposta al trattamento chiaro in questo modello. In precedenza abbiamo osservato l'attivazione di p53 fosforilazione in assenza di aumento dei livelli di p53 totale in condizioni simili in zinco-trattati BEAS-2B cellule14.

Figura 2 . Confronto di immagini di esposizione per rilevare segnale burnout. Lane viste Visualizza diminuire le concentrazioni di proteina per BEAS-2B lisati sondato con p53 DO-1 anticorpo ad una diluizione di 1: 500. Coefficienti di segnale di chemiluminescenza, segnalati come altezze dei picchi nel software dello strumento, si sovrappongono. A differenza delle altezze dei picchi, le intensità di visual band sono generate automaticamente e regolate dallo strumento per facilitare la visualizzazione delle bande e sono quindi non confrontabili da un pannello a altro. Nota: la diminuzione del segnale di chemiluminescenza come aumento del tempo di esposizione, con il segnale di inizio a scomparire (picco di Spalato) presso le due esposizioni più lunghe, che indica lo svuotamento del substrato. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3 . Titolazione lysate Mostra le visualizzazioni di corsia. Lisato titolazione mostrando la corsia viste (A) di BEAS-2B lisato quando sondato con 1: 500 p53 DO-1 o 01:50 ɑ-tubulina. A differenza di valori di zona di picco, le intensità di visual band sono generate automaticamente e regolate dallo strumento per facilitare la visualizzazione delle bande e sono quindi non confrontabili da un pannello a altro. Analisi di regressione lineare (B) conferma che i dosaggi sono lineari su tutta la gamma testata, da 0,01 a 0,20 µ g / µ l e 0.025 a 0,40 µ g / µ l, con valori di R2 di 0,999 e 0.985, rispettivamente. Le concentrazioni di proteine totali nel mezzo della gamma lineare sono stati scelti per ospitare la potenziale variazione di proteina bersaglio in entrambe le direzioni (per esempio, 0,2 µ g / µ l per α-tubulina). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 . Diluizione di anticorpo α-tubulina curve per due lysates di proteina BEAS-2B separato con e senza normalizzazione della linea di base. Una partenza definitivature da linearità è visto presso il 01:50 (0,02) diluizione, che indica la saturazione. 01:50 quindi è stato scelto come la diluizione ottima per questo anticorpo. Clicca qui per visualizzare una versione più grande di questa figura.
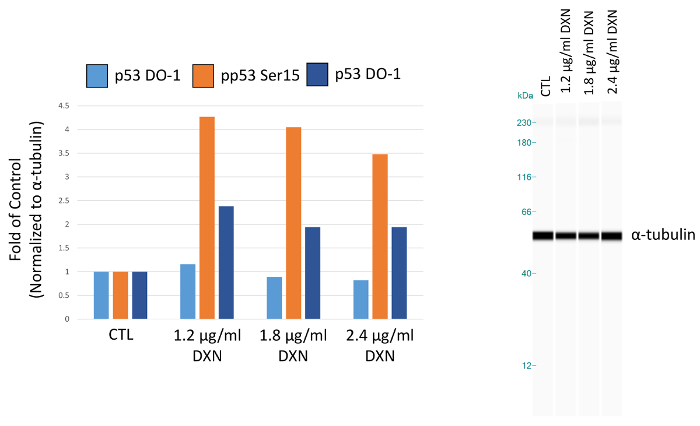
Nella figura 5. Effetto del trattamento di doxorubicina (DXN) 4 h su totale e serina fosforilata espressione della proteina p53 delle cellule BEAS-2B. Le aree dei picchi sono normalizzate a α-tubulina e tracciate come piega del controllo (CTL). Clicca qui per visualizzare una versione più grande di questa figura.
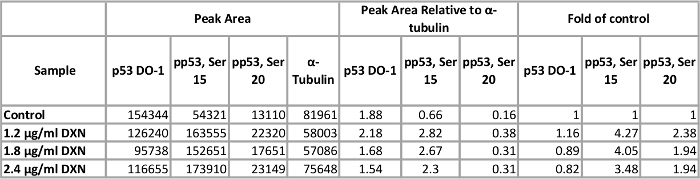
Tabella 1. Effetto del trattamento di doxorubicina (DXN) 4 h su totale e serina fosforilata espressione della proteina p53 delle cellule BEAS-2B. Clicca qui per visualizzare una versione più grande di questa tabella.
Discussione
Per decenni, c'è stato interesse costante nello sviluppo di metodi di immunoassay basati su elettroforetico capillare a causa basso dispendio campioni e reagenti, è diminuito di elaborazione tempo rispetto ai metodi tradizionali e ad alta compatibilità per automatizzare la procedura4,15. Ci sono un certo numero di diversi protocolli per la separazione delle proteine che hanno utilizzato i capillari, tra cui polimero elettroforetico, elettrocinetico, setacciatura e metodi isoelettrici, che isolare proteine dalle proprietà differenti (rispettivamente, carica elettrostatica, equilibrio di partizione, setacciatura proprietà della matrice separazione e pH)16. Qui, descriviamo un anticorpo-basato (o immunologico) metodo di elettroforesi capillare, utilizzando un polimero vagliatura separazione, che è stato automatizzato e commercialmente adottati3. Vantaggi di questo sistema sono la facilità di utilizzo e funzionamento, standardizzati e commercialmente disponibili reagenti e misurazioni affidabili, sensibili che richiedono meno reagenti e campioni rispetto all'analisi tradizionale proteina come macchia occidentale, immunoassay enzima-collegato e altri formati3,4,5. È stato osservato nelle precedenti valutazioni di questa tecnologia che l'intervallo di grandezza di proteina che può essere valutata è stato limitato dalla separazione disponibili matrice4, tuttavia recenti offerte hanno ampliato la gamma misurabile da 2 a 440 kDa17 . Inoltre, alcuni buffer di lisato sono noti per essere incompatibile con il saggio18, quindi selezione dei reagenti sperimentali utilizzato deve essere considerata in anticipo.
Un vantaggio principale di una procedura automatizzata con componenti disponibili in commercio è la coerenza dei risultati attraverso metodi standardizzati e reagenti. Questo riduce al minimo le probabilità di errore di dosaggio automatizzando i passaggi critici all'interno della routine. Tuttavia, è importante notare che certe pratiche devono essere rispettati durante il protocollo per ridurre al minimo i problemi con l'immunodosaggio basato su elettroforetica capillare. In primo luogo, è fondamentale che la miscela di luminol-S/perossido è preparata fresco e immediatamente prima di carico su piastra. Temporizzazione coerente si tradurrà in luminescenza coerenza dopo aver aggiunto l'agente ossidante, che si tradurrà in misure coerenti per un dosaggio anticorpo particolare termine dosaggio. Inoltre, è importante che vengano utilizzati i reagenti non scaduto, che colpisce principalmente la potenza dell'agente ossidante. Inoltre, è importante che l'ordine di caricamento dei campioni, anticorpi e altri reagenti essere rigorosamente rispettata (Vedi Figura 1). Qualsiasi reagente pipettato fuori luogo si tradurrà in errore di dosaggio e una corsa sprecata.
Oltre a questi passaggi critici, principali problemi sperimentati con la tecnica generalmente possono essere superati attraverso l'ottimizzazione. Infatti, queste condizioni sono specifiche per ogni combinazione di sistema/anticorpo modello e pertanto dovrebbero essere determinate empiricamente per ogni nuovo dosaggio. In questo articolo, ci concentriamo su tre comuni procedure di ottimizzazione: tempo di esposizione, la titolazione lisato e la diluizione di anticorpo primario. La capacità di generare risultati misurabili dipende dalle analisi di un tempo di esposizione quando il substrato di luminol non è stanno rapidamente esaurendo, come risultati di svuotamento di substrato in perdita di segnale. Lisato titolazione determina l'intervallo dinamico lineare di ogni dosaggio, che può differire da con sistemi di modello diverso, così come gli anticorpi differenti, anche per lo stessa proteina bersaglio. Diluizioni di anticorpo scelti a o vicino a saturare le concentrazioni garantiscono cambiamenti nel segnale non ne risentiranno di una carenza di anticorpi liberi, ma solo da diverse quantità di proteina disponibile destinazione epitopo. Altre considerazioni durante il processo di ottimizzazione possono includere il tempo di incubazione dell'anticorpo e accatastamento/campione tempo di caricamento. Nella maggior parte dei casi le impostazioni predefinite per lo strumento offrono il miglior equilibrio tra risoluzione e sensibilità. Tuttavia, in alcuni casi, scarsa risoluzione o sensibilità può essere migliorata mediante la regolazione di questi parametri.
Metodi di immunoassay basati su elettroforetico capillare forniscono misurazioni proteina veloce, efficace e riproducibile. Mentre questi metodi sono stati utilizzati principalmente nelle impostazioni di ricerca e sviluppo, la coerenza di queste tecnologie ha potenziale utilità nelle applicazioni cliniche e regolamentazione. Ad esempio, l'identificazione di sottopopolazioni suscettibili di tossici ambientali o pazienti con progressione della malattia può essere basato su proteine biomarcatori misurati in matrici accessibile come sangue, urine e saliva. Come reagente e goccia di costi di operazione e il numero di campioni e gli obiettivi che possono essere valutati contemporaneamente aumenta, probabilmente vedremo metodi di immunoassay di basati su elettroforetico capillare utilizzati per questi tipi di applicazioni.
Divulgazioni
Gli autori dichiarano di non avere nessun concorrenti interessi finanziari. Questo manoscritto è stato recensito dal National Health and Environmental Effects Research Laboratory e approvato per la pubblicazione. Il contenuto non riflette necessariamente le opinioni di EPA né menzione di marchi o prodotti commerciali costituisce approvazione o raccomandazione per l'uso.
Riconoscimenti
Gli autori vorrei ringraziare Keith Tarpley di l'US EPA Office del team ricerca e sviluppo-Research Triangle Park (RTP-ORD) grafica e Media per lo sviluppo, taping e di editing del video didattico. Vorremmo anche ringraziare Deborah Pritchett da ProteinSimple per le conversazioni utili per quanto riguarda l'ottimizzazione dei nostri dati. JM Guynn è stata sostenuta dall'Istituto Oak Ridge per scienza e formazione ricerca/Participation Program presso la US Environmental Protection Agency.
Materiali
| Name | Company | Catalog Number | Comments |
| Wes instrument | ProteinSimple (Santa Clara, CA) | 004-600 | |
| P53 DO-1 primary antibody | Santa Cruz Biotechnology, Inc. | sc-126 | |
| phosphorylated p53 (ser 15) primary antibody | Cell Signaling Technology | 9286 | |
| phosphorylated p53 (ser 20) primary antibody | Cell Signaling Technology | 9287 | |
| alpha-tubulin primary antibody | Cell Signaling Technology | 3873 | used as a loading control |
| Compass Software | ProteinSimple (Santa Clara, CA) | provided with the Wes | |
| 12-230 kDa Master kit | ProteinSimple (Santa Clara, CA) | PS MK02 (since replaced by a new kit #) | |
| www.proteinsimple.com/consumables_sw_wes.html | INCLUDES PART NO: Wash Buffer (60 mL) 042-202 10X Sample Buffer (440 μL) 042-195 Pre-Filled Microplates (8) PS-PP01 Capillary Cartridges (8) PS-CC01 Antibody Diluent II (20 mL) 042-203 Luminol-S (1.5 mL) 042-233 Peroxide (1.5 mL) 042-234 Streptavidin-HRP (132 μL) 042-414 Standard Pack (8): Biotinylated ladder, fluorescent 5X master mix, DTT, and empty 0.6 mL tube PS-ST01 Anti-Rabbit Secondary Antibody 042-206 or Anti-Mouse Secondary Antibody 042-205 | ||
| Name | Company | Catalog Number | Comments |
| Cell culture, treatment, and harvest (using vendor recommended protocols; protocols not included in manuscript) | |||
| BEAS-2B cells | American Type Culture Collection (ATCC, Manassas, VA) | CRL-9609 | |
| keratinocyte growth medium, KGM Gold | Lonza Ltd (Basel, Switzerland) | 192152 | for cell culture |
| keratinocyte basal medium, KBM Gold | Lonza Ltd (Basel, Switzerland) | 192151 | serum free medium for chemical dosing |
| doxorubicin | Sigma-Aldrich (St. Louis, MO) | D1515 | |
| Coomassie Blue Bradford Assays | ThermoFisher Scientific (Waltham, MA) | 23200 | for protein quantification |
| Nuclear Extract kit | Active Motif (Carlsbad, CA) | D1515 | used to prepare whole cell lysates |
| INCLUDES: | |||
| Lysis Buffer AM1 | |||
| 1M dithiothreitol (DTT) | |||
| Protease Inhibitor Cocktail | |||
| 10X PBS | |||
| Phosphatase Inhibitors |
Riferimenti
- Bradley, H. L., Sabnis, H., Pritchett, D., Bunting, K. D. . Hematopoietic stem cell protocols. 1185, (2014).
- Guo, L., Eldridge, S., Furniss, M., Mussio, J., Davis, M. Use of Human Induced Pluripotent Stem Cell-Derived Cardiomyocytes (hiPSC-CMs) to Monitor Compound Effects on Cardiac Myocyte Signaling Pathways. Curr Protoc Chem Biol. 7 (3), 141-185 (2015).
- Chen, J. Q., et al. Absolute quantitation of endogenous proteins with precision and accuracy using a capillary Western system. Anal Biochem. 442 (1), 97-103 (2013).
- Chen, J. Q., Wakefield, L. M., Goldstein, D. J. Capillary nano-immunoassays: advancing quantitative proteomics analysis, biomarker assessment, and molecular diagnostics. J Transl Med. 13, 182 (2015).
- Liu, S., et al. The Application of a Novel Nanovolume Capillary Electrophoresis- Based Protein Analysis System in Personalized & Translational Medicine Research. J Bioanal Biomed. S3 (004), (2013).
- ProteinSimple Western. . Size Assay Development Guide, Revision 1. , (2014).
- Eaton, S. L., et al. A guide to modern quantitative fluorescent western blotting with troubleshooting strategies. J Vis Exp. (93), (2014).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Silva, J. M., McMahon, M. The fastest Western in town: a contemporary twist on the classic Western blot analysis. J Vis Exp. (84), e51149 (2014).
- Thorn, C. F., et al. Doxorubicin pathways: pharmacodynamics and adverse effects. Pharmacogenet Genomics. 21 (7), 440-446 (2011).
- Ernst, O., Zor, T. Linearization of the bradford protein assay. J Vis Exp. (38), (2010).
- Taira, N., Yoshida, K. Post-translational modifications of p53 tumor suppressor: determinants of its functional targets. Histol Histopathol. 27 (4), 437-443 (2012).
- Thompson, T., et al. Phosphorylation of p53 on key serines is dispensable for transcriptional activation and apoptosis. J Biol Chem. 279 (51), 53015-53022 (2004).
- Currier, J. M., Cheng, W. Y., Menendez, D., Conolly, R., Chorley, B. N. Developing a Gene Biomarker at the Tipping Point of Adaptive and Adverse Responses in Human Bronchial Epithelial Cells. PLoS One. 11 (5), e0155875 (2016).
- Moser, A. C., Hage, D. S. Capillary electrophoresis-based immunoassays: principles and quantitative applications. Electrophoresis. 29 (16), 3279-3295 (2008).
- Shintani, H. . Handbook of Capillary Electrophoresis Applications. , (1997).
- . Wes reagents and consumables :: ProteinSimple Available from: https://www.proteinsimple.com/consumables_sw_wes.html (2017)
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon