È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un metodo di analisi cellulare per condilo mandibolare murino e morfometrica
In questo articolo
Riepilogo
Questo manoscritto presenta metodi per l'analisi morfometrica e cambiamenti cellulari all'interno del condilo mandibolare di roditori.
Abstract
Il giunto temporomandibular (TMJ) ha la capacità di adattarsi agli stimoli esterni, e cambiamenti di carico possa influenzare la posizione dei condili, così come i componenti strutturali e cellulari della cartilagine del condilo mandibola (MCC). Questo manoscritto descrive metodi per l'analisi di questi cambiamenti e un metodo per alterare il caricamento dell'ATM in topi (cioè, alla compressione statica TMJ caricamento). La valutazione strutturale qui illustrata è un approccio semplice morfometriche che utilizza il software Digimizer e viene eseguito nelle radiografie di piccole ossa. Inoltre, l'analisi del cellulare cambia leader alle alterazioni nell'espressione del collagene, rimodellamento osseo, divisione cellulare, e distribuzione di proteoglycan in MCC è descritto. La quantificazione di questi cambiamenti nelle sezioni istologiche - contando i pixel fluorescenti positivi utilizzando software e il mapping di distanza di misurazione di immagine e zona macchiata con Digimizer - è dimostrato anche. I metodi qui illustrati non sono limitati a TMJ murino, ma ha potuto essere usati su altre ossa di piccoli animali da esperimento e in altre regioni di ossificazione endochondral.
Introduzione
TMJ è un unico giunto portante che si trova nella regione craniofacial ed è costituito di fibrocartilagine. Il MCC del TMJ è essenziale per la funzione articolare, compreso movimento della mascella senza ostacoli mentre parlando e masticare, ma esso è influenzato dalle malattie degeneranti, compreso l'osteoartrite1. L'ATM ha la capacità di adattarsi a stimoli esterni e le alterazioni di carico, portando a cambiamenti strutturali e cellulari ai componenti del MCC2,3,4,5. Le proprietà portanti di MCC possono essere spiegate dalle interazioni tra i suoi costituenti, compresa l'acqua, la rete di collagene e densamente proteoglicani. Il MCC ha quattro distinte zone cellulari che esprimono diversi tipi di proteine di collagene e non-collagene: 1) l'area superficiale o articolare; 2) la zona proliferativa, composta di cellule mesenchimali indifferenziate e che risponde al carico di richieste; 3) la zona di prehypertrophic, composto da condrociti maturi esprimendo il collagene di tipo 2; e 4) l'ipertrofica di zona, la regione dove i condrociti ipertrofici esprimendo collagene tipo 10 die e sottoposti a calcificazione. La regione non mineralizzato è ricca di proteoglicani che offrono resistenza alle forze di compressione6.
C'è la mineralizzazione continua alla zona ipertrofica del MCC, dove si verifica la transizione da Condrogenesi ad osteogenesi, garantendo la robusta struttura minerale dell'osso subcondrale del condilo mandibolare7. Cambiamenti cellulari nelle regioni unmineralized e mineralizzate in ultima analisi, portano a cambiamenti morfologici e strutturali nel condilo mandibolare e mandibola. Mantenimento dell'omeostasi cellulare tutte le regioni di MCC e la mineralizzazione della porzione subchondral sono essenziali per la salute, capacità di carico e l'integrità dell'ATM.
Il modello di topo transgenico collagene multipli (come descritto da Utreja et al.) 8 è un ottimo strumento da utilizzare per comprendere i cambiamenti nell'espressione di collagene poiché tutti i transgeni sono espressi in MCC. Per un'approfondita valutazione istologica, macchie istologiche sono utilizzate per studiare la deposizione di matrice, mineralizzazione, proliferazione delle cellule e apoptosi, come pure l'espressione della proteina presso gli strati differenti delle cellule del MCC.
In questo manoscritto, istologico e le analisi morfometriche vengono utilizzate per valutare i cambiamenti strutturali e cellulari nell'osso MCC e subcondrale del condilo mandibola di topi. Inoltre, un metodo di quantificazione delle cellule, per analizzare le immagini istologiche fluorescente e per il mapping di vetrini da microscopio chiaro, è descritto. Compressione statica TMJ caricamento metodo che causa cambiamenti cellulari e morfologiche al MCC e subchondral dell'osso9, è illustrata anche per convalidare i nostri metodi.
I metodi descritti qui possono essere utilizzati per determinare morfometriche e cambiamenti istologici nel condilo mandibolare e mandibola di roditori o di analizzare altre regioni di ossificazione endochondral e la morfologia dei tessuti mineralizzati aggiuntive.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Il Comitato istituzionale cura degli animali del University of Connecticut Health Center ha approvato tutte le procedure di animale.
1. carico compressione statica TMJ: Bocca forzata
Nota: A topi transgenici che harboring reporter fluorescenti per il collagene (Col2a1XCol10a1), gentilmente fornito da Dr. David Rowe (Università del Connecticut), quattro-settimana-vecchi sono stati utilizzati per gli esperimenti descritti in questo manoscritto (n = 8; 4 maschi e 4 femmine). Transgene Col2a1 ciano (blu) è espresso in cellule nella zona prehypertrophic di MCC, mentre il Col10a1 ciliegie (rosse) cellule sono presenti nella regione ipertrofica8 (Figura 1). Topi sono stati divisi ugualmente in due gruppi: 1) il gruppo caricato, dove i topi sono stati sottoposti a compressione statica TMJ caricamento (descritta nel passaggio 2) e 2) il gruppo di controllo, dove i topi hanno ricevuto alcun intervento.
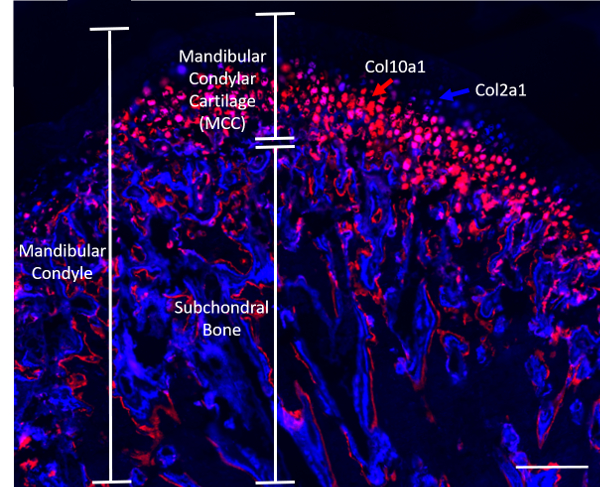
Figura 1. Rappresentante sagittale del condilo di un topo reporter fluorescenti doppio-collagene (Col2a1XCol10a1). Barra della scala = 200 µm. Clicca qui per visualizzare una versione più grande di questa figura.
- Fabbricare molle usingbeta archi in lega di titanio (0,017 x 0.025 in) (Figura 2A).
- Anestetizzare gli animali sperimentali tramite un'iniezione intraperitoneale di una miscela di ketamina (90 mg/kg di peso corporeo) e xilazina (13 mg/kg di peso corporeo).
- Aprire la bocca dei topi delicatamente e inserire le molle, coinvolgente i loop negli incisivi maxillary e mandibular (Figura 2B e C).
- Indurre il carico statico di TMJ compressione mantenendo le molle negli incisivi dei topi anestetizzati per 1 h. Ripetere questa procedura per 5 giorni.
- Iniettare intraperitonealmente ai topi con 5-ethnyl-2'-deoxyuridine (EdU; 30 mg/kg di peso corporeo) per analisi di proliferazione delle cellule 2 giorni e 1 giorno prima dell'eutanasia.
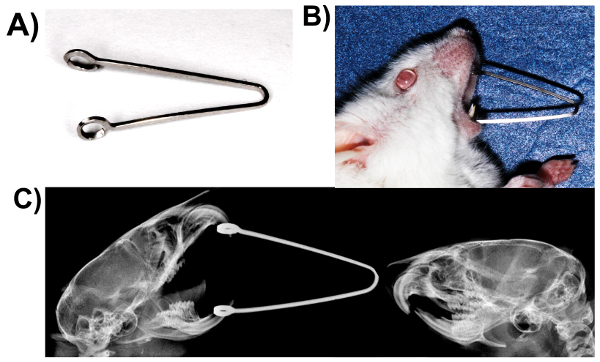
Nella figura 2. Carico di TMJ compressione statica: bocca costretto modello aperto. (A) primavera fabbricato di 0,017 x 0,025 beta titanio lega archwire. (B) il mouse caricato con molla. (C) radiografia di caricato e topi di controllo che mostrano differenze nel posizionamento della mandibola. Clicca qui per visualizzare una versione più grande di questa figura.
2. fissazione e sezionamento mandibola
- Presso l'endpoint delle procedure costretto aprire bocca, eutanasia degli animali sperimentali da un metodo approvato.
- Sezionare le mandibole tagliando l'allegato muscolare senza raschiare la cartilagine del condilo.
- Posizionare le mandibole pulite in formalina al 10% per 24 h per la fissazione.
Attenzione: La formalina è un irritante; indossare adeguati dispositivi di protezione personale.
3. x-ray Imaging e le misure morfometriche
- Posizionare le mandibole in un contenitore piano (ad es., una capsula di Petri 55 x 16 mm) e prendere le radiografie dei campioni utilizzando un sistema radiografico mobile un 26 kV per 5 s.
Nota: Inserire una barra di scala prima di salvare le immagini. - Eseguire le misure morfometriche delle mandibole utilizzando un software di analisi di immagine (Vedi la Tabella materiali).
Nota: Prima di eseguire qualsiasi misurazione, utilizzare la barra della scala presso la radiografia per determinare l'unità. Questo passaggio è importante misurare correttamente le strutture anatomiche. Fare clic sul pulsante "Unit" (Figura 3A). - Selezionare i punti anatomici utilizzando lo "stile del marcatore 2" nel software di imaging (Figura 3B). Per seguire il metodo descritto in questo documento, selezionare i seguenti punti (Figura 3B):
- Selezionare condylion (punto 1), il punto più posteriore del condilo mandibola;
- Selezionare il processo incisivo (punto 2);
- Selezionare il punto più profondo alla tacca sigmoidea (punto 3);
- Selezionare il punto più profondo nella concavità del ramus mandibular (punto 4);
- Selezionare il punto più anteriore della superficie articolare condylar (punto 5); e
- Selezionare il punto più posteriore della superficie articolare condylar (punto 6).
- Dopo aver selezionato i punti anatomici, eseguire le misure morfometriche utilizzando lo strumento "lunghezza", ma per la lunghezza della testa del condilo, utilizzare lo strumento "linea perpendicolare" da punti (3) e (4) (Figura 3C).
- Misurare la lunghezza mandibola, da condylion (1) al processo incisivo (2).
- Misurare la lunghezza della testa del condilo - la distanza perpendicolare da condylion (1) di una linea tracciata dal punto più profondo alla tacca sigmoidea (3) per il punto più profondo nella concavità del ramus mandibular (4).
- Misurare la larghezza della testa del condilo - la distanza dalla maggior parte anteriore al punto più posteriore della superficie articolare condylar (5-6).
- Copiare le misurazioni dalla "lista di misura" sul lato destro dello schermo (Figura 3C).
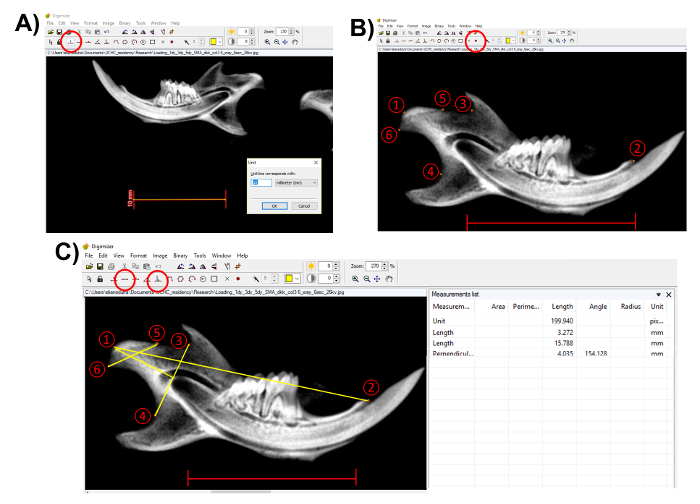
Figura 3 . Rappresentazione di misure morfometriche della mandibola. (A) utilizzare la barra della scala della radiografia per determinare l'unità (cerchiato in rosso, barra della scala: 10 mm). (B) selezionare i punti anatomici utilizzando lo "stile indicatore 2" (cerchiato in rosso). 1) Condylion; 2) processo incisivo; 3) punto più profondo alla tacca sigmoidea; 4) punto più profondo nella concavità del ramus mandibular; 5) punto più anteriore della superficie articolare condylar; 6) la maggior parte punto posteriore della superficie articolare condylar. Barra della scala: 10mm(C) eseguire misurazioni con la "lunghezza" e "perpendicolare" strumenti (cerchiati in rosso). Misure dal punto 1 al 2: lunghezza mandibola; dal punto 5 e 6: condylar larghezza; perpendicolare dal punto 1 al 4 - 3: lunghezza della testa condylar. Salva misure dalla "lista di misura". Barra della scala = 10 mm. per favore clicca qui per visualizzare una versione più grande di questa figura.
4. condilo incorporamento
Nota: Dopo aver preso le immagini radiografiche, le mandibole possono essere incorporate e sezionate per l'analisi istologica.
- Posto undecalcified mandibole (che sono stati corretti nel passaggio 2.3) in 30% di saccarosio in PBS durante la notte prima di incorporare.
- Sezionare i tessuti molli in eccesso e tagliare con cura il condilo mandibolare.
- Versare alcuni resina incorporamento (sufficiente a coprire il campione) in stampi di plastica usa e gettare e superficie mediale del condilo contro la base dello stampo, il campione di posizionamento parallelo alla parte inferiore dello stampo.
- Fissare il campione nella posizione corretta con un pezzo di ghiaccio secco.
- Riempire lo stampo con l'incorporamento di resina e posizionare lo stampo con campione fisso a freddo 2-metil-butano, che può essere pre-refrigerati in un congelatore a-20 ° C o da-80 ° C o in ghiaccio secco.
- Conservare i campioni a-20 ° C o a-80 ° C fino al sezionamento.
5. condilo sagittale sezionamento e preparazione del vetrino
- Creare sezioni congelate sagittale dei condili (5-7 µm) e trasferire i campioni alla diapositiva utilizzando il nastro trasferimento metodo10,11.
- Rispettare le sezioni istologiche trasferite al nastro utilizzando il metodo UV-curable10.
6. istologico macchiatura e formazione immagine microscopica
Nota: la maggior parte della colorazione istologica viene eseguita come descritto nella sezione istologica della carta da Dyment et al10.
- Per la scansione della linea di base, il primo passo è quello di immagine per il Col2a1 e Col10a1 transgeni, come descritto da Dyment et al10 .
- Posto coprioggetti sopra le diapositive in 30% glicerolo e PBS. Eseguire imaging microscopio a fluorescenza ofthesectionswitha basale e filtri appropriati.
- Eseguire la colorazione fluorescente fosfatasi acida tartrato-resistente (TRAP).
Nota: Trappola è espressa dalle cellule ematopoietiche, compreso l'osso resorbing cellule, gli osteoclasti12. Lo scopo di questa macchia è di analizzare MCC e il rimodellamento osseo subcondrale.- Rimuovere il vetrino coprioggetto delle diapositive da li ammollo in PBS. Lavare i vetrini in PBS tre volte per 5 minuti ciascuno.
- Preparare il tampone di trappola 1 sciogliendo acetato di sodio anidro (9,2 g) e L-tartrato di sodio bibasico diidrato (11,4 g) in 1 L di acqua distillata. Regolare il pH a 4.2 con acido acetico e memorizzare il buffer trappola 1 a 4 ° C.
- Preparare il tampone di trappola 2 sciogliendo appena nitrito di sodio (40 mg) in 1 mL di acqua distillata.
- Preparare il tampone substrato TRAP (appena prima della colorazione) con 7,5 mL di tampone 1 e 150 µ l di tampone 2. Applicare questa soluzione (200 µ l) per ogni diapositiva per 10 min a temperatura ambiente.
- Preparare il tampone di reazione trappola con 1,840 mL di tampone substrato e 23 µ l di substrato fluorescente (Vedi la Tabella materiali).
Nota: Il substrategeneratesayellowfluorescentsignal fluorescente per attività di trappola. - Rimuovere il tampone in eccesso di substrato trappola pipettando delicatamente la soluzione.
- Incubare i vetrini con 200 µ l di tampone di reazione di trappola per 5 min sotto una fonte di UV lampadina luce nera.
- Lavare i vetrini in PBS tre volte per 5 minuti ciascuno.
- Posizionare il coprioggetti sugli scivoli in 30% glicerolo in PBS ed effettuare formazione immagine microscopica10.
- Eseguire la macchiatura di proliferazione delle cellule.
Nota: In questa analisi, la timidina modificate analogico 5-Etinil-2'-deoxyuridine (EdU) è incorporato nel DNA recentemente sintetizzato: divisione delle cellule sono marcati con un colorante fluorescente.- Dopo imaging per trappola, rimuovere i coprioggetti e lavare i vetrini in PBS tre volte per 5 minuti ciascuno. Seguire i passaggi dal kit di proliferazione delle cellule 5-Etinil-2'-deoxyuridine a macchiare le sezioni istologiche.
- Preparare una reazione cocktail aggiungendo 430 µ l di tampone di reazione, 20 µ l di CuSO4, 1,2 µ l di colorante fluorescente e 50 µ l di 1 X: 1x tampone additivo (un volume totale di 500 µ l è sufficiente per una diapositiva).
Nota: Il produttore consiglia di aggiungere gli ingredienti nell'ordine descritto qui. - Incubare i vetrini con i cocktail preparati per 30 min a temperatura ambiente, al riparo dalla luce.
- Lavare i vetrini in PBS tre volte per 5 minuti ciascuno.
- Posto coprioggetti sopra le diapositive in 30% glicerolo in PBS con 1:1,000 DAPI.
Nota: DAPI (4', 6-diamidino-2-phenylindole) è una macchia nucleare fluorescente blu che si lega alle regioni ricche in AT nel DNA.
- Eseguire la macchiatura blu della toluidina (TB).
Nota: Colorazione TB rivela la distribuzione di proteoglycan presso MCC.- Sciacquare il indistilledwater di diapositive per rimuovere i coprioggetti.
- Dopo aver rimosso i coprioggetti, lavare i vetrini in acqua distillata tre volte per 5 minuti ciascuno per rimuovere completamente i sali da PBS.
- Preparare il buffer di lavoro TB facendo soluzione una (dissolvenza 28,4 g di fosfato di sodio bibasico in 1 L di acqua distillata) e soluzione B (sciogliere 27,6 g di fosfato di sodio monobasico in 1 L di acqua distillata). 94.7 mix mL di soluzione A con 5,3 mL di soluzione B. Diluire la soluzione 1:1 in acqua distillata per fare 200 mL di 0.1 M tampone di lavoro. Correggere il pH a 8.0 con l'aggiunta di idrossido di sodio fino a quando il pH è stato risolto.
- Preparare il brodo di 1% TB: mescolare 1 g di TB in 100 mL di acqua distillata.
- Preparare soluzione di lavoro di TB con 40 mL di buffer di lavoro 0.1 M in 3 mL di 1% delle scorte TB.
- Incubare i vetrini nella soluzione di lavoro di TB per 14-17 s.
Nota: Questa macchia è tempo molto sensibile; il tempo di incubazione potrebbe essere necessario essere regolata per evitare che overstaining. - Lavare i vetrini in acqua distillata tre volte per 5 minuti ciascuno.
- Posizionare i vetrini coprioggetto sopra le diapositive in 30% glicerolo in acqua distillata. Eseguire il microscopio chiaro10di imaging.
Nota: Non non vetrino coprioggetti i vetrini colorati per TB in glicerolo + PBS. PBS lava fuori questo tipo di macchia.
7. fluorescente quantificazione istologica
- Eseguire istologico quantificazione delle immagini fluorescenti utilizzando un software di analisi di immagine (Vedi la Tabella materiali).
Nota: Il principio di base di quantificazione istologica in questo metodo consiste nel dividere il numero di pixel fluorescente di interesse per il numero totale di pixel dell'area di interesse e moltiplicare il numero ottenuto per 100, risultante in una percentuale di positivi pixel all'interno di quella regione. - Eseguire la quantificazione dell'espressione di Col10a1 in MCC di sezioni sagittali dei condili.
- Nel quantificare tutti i tipi di cellule e macchie utilizzando questo metodo, è necessario selezionare l'area da quantificare. Aprire le immagini istologiche in un software di analisi di immagine e selezionare l'area utilizzando la "Lasso Tool (L)" (Figura 4A). Per l'analisi descritta qui, seleziona la regione MCC solo; Dopo aver selezionato l'area, il numero totale di pixel appare nella casella "Istogramma" sulla schermata del software (Figura 4A). Salvare il numero di pixel nell'area di interesse.
- Selezionare i pixel Col10a1 rosso utilizzando lo strumento di campionamento. Fare clic su "Select" sul pannello superiore e poi "Gamma di colore". Fare clic su "strumento contagocce," selezionare il campione di colore per il pixel di interesse nell'immagine e fare clic su "OK". Tutte le zone di positive per il colore del pixel scelto sarà selezionato (Figura 4B). Copiare il numero di pixel fluorescente (mostrato nella finestra di "Istogramma" dello schermo) e incollarli in un foglio di calcolo o software statistico per l'analisi.
- Dividere il numero di pixel fluorescente sopra il numero di pixel dell'area di interesse e moltiplicare questo numero per 100: fluorescente pixel / pixel nell'area di interesse * 100.
Nota: Altri tipi di cellule, quali blu Col2a1, possono essere quantificato con questo stesso metodo, ma i pixel blu dovrebbero essere selezionati invece i pixel Col10a1 rosso.
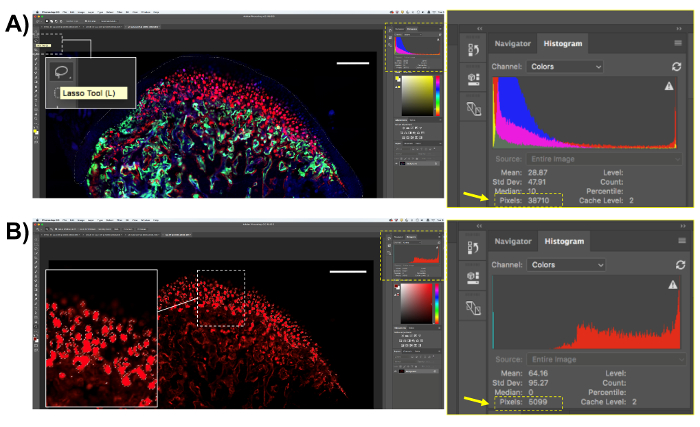
Figura 4 . Rappresentazione del transgene Col10a1 quantificazione. (A) selezionare l'area di interesse con lo strumento"lazo" (L). Per cellule Col10a1-positive, selezionare la cartilagine intero mandibular. Salvare il numero di pixel dalla casella "istogramma". (B) selezionare il pixel di interesse, in questo caso, il rosso fluorescente Col10a1 pixel. Si noti che verranno selezionati solo i pixel rossi all'interno dell'area di interesse. Salvare il numero di pixel rossi dalla casella "istogramma". Barra della scala = 200 µm. Clicca qui per visualizzare una versione più grande di questa figura.
- Eseguire la quantificazione dell'attività di trappola nell'osso MCC e subchondral.
- Seguire la procedura descritta al punto 8.2, ma invece di selezionare solo l'area MCC, selezionare le regioni di osso subcondrale e della cartilagine (Figura 5A).
- Per l'analisi di attività TRAP, selezionare i pixel gialli generati dal substrato ELF97, come descritto al punto 8.2.2 (Figura 5B); copia il numero di pixel positivo; e incollarli in un foglio di calcolo o software statistico per l'analisi.
- Ottenere la percentuale di pixel TRAP-positivi dividendo il numero di pixel giallo per il numero totale di pixel nell'area dell'osso subcondrale e moltiplicando per 100.
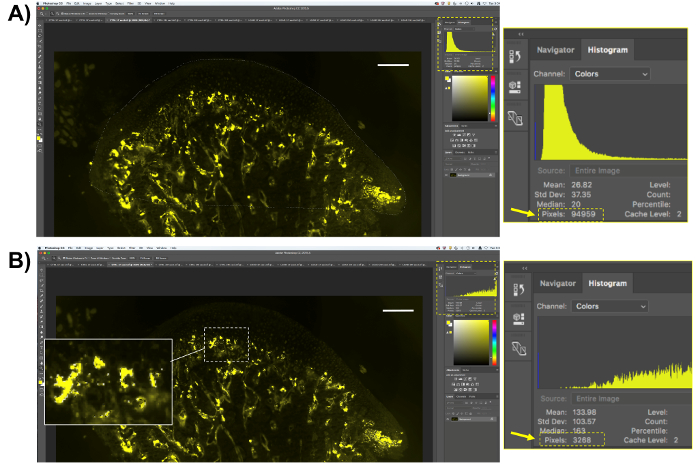
Figura 5 . Rappresentazione di quantificazione trappola fluorescente. (A) selezionare l'area di interesse (mandibular dell'osso subcondrale e della cartilagine) e salvare il numero di pixel di questa regione. (B) selezionare i pixel gialli fluorescenti, che rappresenta attività di trappola. Si noti che solo i pixel del TRAP-positivo sarà selezionare. Salvare il numero di pixel selezionati. Barra della scala = 200 µm. Clicca qui per visualizzare una versione più grande di questa figura.
- Eseguire la quantificazione delle cellule EdU-positive.
- Vetrini colorati EdU sono controcolorati con DAPI, così invece di contare il numero totale di pixel nell'area di interesse, selezionare i pixel DAPI-positivi per calcolare la percentuale di pixel EdU-positivi. Selezionare l'area di interesse come descritto al punto 8.2, ma non salvare il numero totale di pixel. Selezionare il pixel DAPI blu come il colore campionato, come descritto al punto 8.2.2; Copiare il numero di pixel di DAPI-positivi (Figura 6A); e incollarli in un foglio di calcolo o software statistico per l'analisi.
- Successivamente, selezionare i pixel di EdU-positiva (giallo fluorescente pixel) e salvare il numero di pixel nella casella «istogramma» (Figura 6B).
- Calcolare la percentuale di pixel EdU dividendo il numero di pixel di EdU-positivo per il numero di pixel di DAPI-positivo e moltiplicando il numero ottenuto per 100.
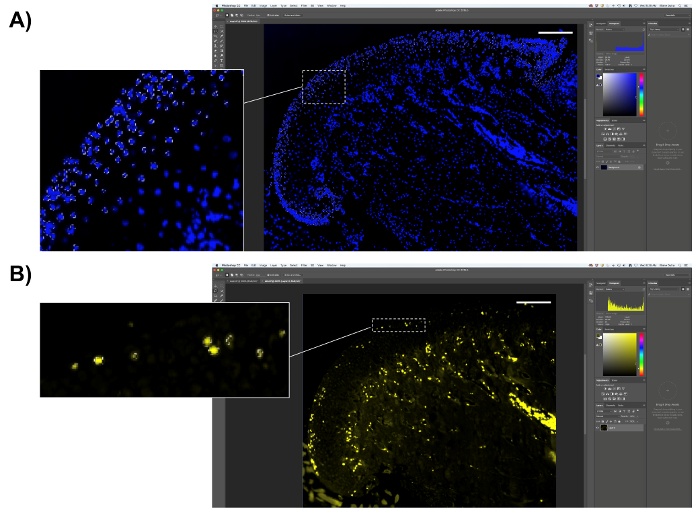
Figura 6 . Rappresentazione di quantificazione di EdU. (A) selezionare la regione proliferativa di MCC (lo strato esterno della cartilagine). Selezionare pixel DAPI-positivo e salvare il numero di pixel. (B) selezionare pixel EdU-positiva (giallo fluorescente) e salvare il numero di pixel. Barra della scala = 200 µm. Clicca qui per visualizzare una versione più grande di questa figura.
8. quantificazione dello spessore della cartilagine e Proteoglycan distribuzione
- Analizzare lo spessore della cartilagine (mapping di distanza) e la zona blu-macchiato toluidina utilizzando il software Digimizer immagine.
Nota: Utilizzare la barra della scala nell'immagine istologica per determinare l'unità (Figura 7A). - Eseguire una misurazione di mappatura di distanza.
Nota: La misurazione della distanza mappatura fornirà lo spessore della cartilagine al condilo mandibolare. Nel metodo descritto qui, cinque regioni del MCC sono selezionate, dando una media dello spessore complessivo del MCC. Il ricercatore può scegliere di misurare tre regioni differenti, o persino una regione unica al centro di MCC.- Utilizzando lo strumento "lunghezza", misurare la lunghezza della cartilagine dalla superficie esterna alla fine della toluidina blu-macchiato zona (Figura 7B) in cinque regioni, o in tutti i percorsi come preferito.
- Copiare le misurazioni di lunghezza dalla "lista di misura".
Nota: Il software fornisce anche una media delle misurazioni (Figura 7B).
- Misurare l'area di tinto blu di toluidina.
Nota: Nella misurazione della zona macchiata di blu di toluidina, l'area di proteoglycan in MCC si otterranno.- Selezionare lo strumento "area" e contorno della zona di tinto blu di toluidina (Figura 7C).
- Copiare le misurazioni di zona dalla "lista di misura".
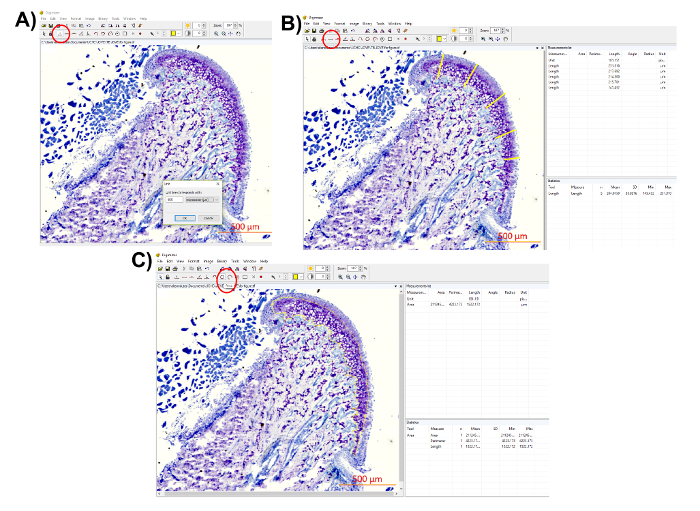
Figura 7 : Rappresentazione del proteoglicano quantificazione di distribuzione. (A) utilizzare la barra della scala dell'immagine istologica per determinare l'unità facendo clic sul pulsante "unità" (cerchiato in rosso, unità di misura selezionata: 500 µm). (B) misurare lo spessore della cartilagine in posizioni diverse utilizzando lo strumento di "lunghezza" (cerchiato in rosso). Salvare le misurazioni dalla "lista di misura" nel riquadro in alto a destra. Il software fornisce anche "statistiche" nel pannello destro inferiore, quindi la media e la deviazione standard delle misurazioni possono essere ottenuti direttamente. (C) misurare l'area di tinto blu di toluidina utilizzando lo strumento di "area" (cerchiato in rosso). L'area di interesse del cerchio e salvare la misurazione dalla "lista di misura". Clicca qui per visualizzare una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
Statistiche descrittive sono state effettuate per esaminare la distribuzione delle misure morfometriche (lunghezza mandibular, condylar lunghezza, larghezza condylar) e le analisi istologiche. I risultati sono stati confrontati fra il gruppo caricato (cioè, i topi sottoposti a carico di compressione con la molla in titanio beta) e il gruppo di controllo (cioè, i topi di controllo che non hanno ricevuto alcuna procedura di corrispondenza). Differenze statisticamente sig...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo manoscritto descritto metodi per la misurazione di morfometrica e analisi cellulare del murini condili mandibolari e mandibole. Le misure morfometriche radiografica è utilizzabile anche per analizzare altre ossa da piccoli animali da esperimento. Inoltre, l'analisi cellulare (cellule quantificazione e mappatura di distanza di cartilagine) non sono limitati al condilo mandibola roditore, ma può essere utilizzato per quantificare le sezioni istologiche di numerosi tessuti.
Modelli di to...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nessun concorrenti interessi finanziari.
Riconoscimenti
Gli autori vorrei ringraziare il Dr. David Rowe per gentilmente fornire i topi transgenici e Li Chen per l'assistenza istologico.
La ricerca riportata in questa pubblicazione è stata sostenuta dal National Institute of Dental & Craniofacial Research del National Institutes of Health, sotto Premio numero K08DE025914 e dalla associazione americana di Fondazione ortodontico per Sumit Yadav.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| MX20 Radiography System | Faxitron X-Ray LLC | ||
| Digimizer Image software | MedCalc Software | ||
| Shandon Cryomatrix embedding resin | Thermo Scientific | 6769006 | |
| Manual microscope Axio Imager Z1 | Carl Zeiss | 208562 | |
| yellow fluorescent protein filter - EYFP | Chroma Technology Corp | 49003 | |
| cyan fluorescent protein filter - ECFP | Chroma Technology Corp | 49001 | |
| red fluoresecent protein filter - Cy5 | Chroma Technology Corp | 49009 | |
| sodium acetate anhydrous | Sigma-Aldrich | S2889 | |
| sodium L-tartrate dibasic dihydrate | Sigma-Aldrich | 228729 | |
| sodium nitrite | Sigma-Aldrich | 237213 | |
| ELF97 substrate | Thermo Fisher Scientific | E6600 | |
| ClickiT EdU Alexa Fluor 594 HCS kit | Life Technologies | C10339 | includes EdU (5-ethynyl-2'-deoxyuridine) |
| DAPI (4',6-Diamidino-2-Phenylindole, Dihydrochloride) | Thermo Scientific | D1306 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S3264 | |
| Sodium phosphate monobasic | Sigma-Aldrich | 71505 | |
| Toluidine Blue O | Sigma-Aldrich | T3260 | |
| Adobe Photoshop | Adobe Systems Incorporated | ||
| Phosphate buffered saline tablets (PBS) | Research Products International | P32080-100T | |
| CNA Beta III Nickel-Free Archwire | Ortho Organizers, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. |
Riferimenti
- LeResche, L. Epidemiology of Temporomandibular Disorders: Implications for the Investigation of Etiologic Factors. Crit Rev Oral Biol Med. 8 (3), 291-305 (1997).
- Chen, J., et al. Altered functional loading causes differential effects in the subchondral bone and condylar cartilage in the temporomandibular joint from young mice. Osteoarthr Cartil. 17 (3), 354-361 (2009).
- Pirttiniemi, P., Kantomaa, T., Sorsa, T. Effect of decreased loading on the metabolic activity of the mandibular condylar cartilage in the rat. Eur J Orthod. 26 (1), 1-5 (2004).
- Chavan, S. J., Bhad, W. A., Doshi, U. H. Comparison of temporomandibular joint changes in Twin Block and Bionator appliance therapy: a magnetic resonance imaging study. Prog Orthod. 15 (57), (2014).
- Dutra, E. H., et al. Cellular and Matrix Response of the Mandibular Condylar Cartilage to Botulinum Toxin. PLoS ONE. 11 (10), 0164599(2016).
- Benjamin, M., Ralphs, J. R. Biology of fibrocartilage cells. Int Rev Cytol. 233, 1-45 (2004).
- Shen, G., Darendeliler, M. A. The Adaptive Remodeling of Condylar Cartilage- A Transition from Chondrogenesis to Osteogenesis. J Dent Res. 84 (8), 691-699 (2005).
- Utreja, A., et al. Cell and matrix response of temporomandibular cartilage to mechanical loading. Osteoarthr Cartil. 24 (2), 335-344 (2016).
- Kaul, R., et al. The Effect of Altered Loading on Mandibular Condylar Cartilage. PLoS ONE. 11 (7), 0160121(2016).
- Dyment, N. A., et al. High-Throughput, Multi-Image Cryohistology of Mineralized Tissues. J Vis Exp. , e54468(2016).
- Kawamoto, T. Use of a new adhesive film for the preparation of multi-purpose fresh-frozen sections from hard tissues, whole-animals, insects and plants. Arch Histol Cytol. 66 (2), 123-143 (2003).
- Hayman, A. R. Tartrate-resistant acid phosphatase (TRAP) and the osteoclast/immune cell dichotomy. Autoimmunity. 41 (3), 218-223 (2008).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon