È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Valutazione in vivo delle proprietà meccaniche e viscoelastiche del linguaggio del ratto
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Descriviamo una procedura chirurgica in un modello di ratto anestetizzato per determinare il tono muscolare e le proprietà viscoelastiche della lingua. La procedura prevede una stimolazione specifica dei nervi ipoglossi e l'applicazione di curve passive di forza / deformazione Lissajous al muscolo.
Abstract
La lingua è un idrostatico muscolare altamente innervato e vascolarizzato sul pavimento della bocca della maggior parte dei vertebrati. Le sue funzioni primarie includono il sostegno della masticazione e della deglutizione, così come il sensore di gusto e la fonetica. Di conseguenza, la forza e il volume della lingua possono influenzare la capacità dei vertebrati di compiere attività di base come l'alimentazione, la comunicazione e la respirazione. I pazienti umani con apnea del sonno hanno lingue allargate, caratterizzate da toni muscolari ridotti e un aumento del grasso intramuscolare che possono essere visualizzati e quantificati mediante la risonanza magnetica (MRI). Le capacità di misurare la forza e le proprietà viscoelastiche della lingua costituiscono importanti strumenti per ottenere informazioni funzionali correlate ai dati di imaging. Qui presentiamo tecniche per misurare la produzione di forza della lingua nei ratti Zucker anestetizzati tramite stimolazione elettrica dei nervi ipoglossi e per determinare le proprietà viscoelasticheF la lingua applicando le curve passive di forza / deformazione Lissajous.
Introduzione
La lingua fornisce sostegno essenziale per la masticazione, la deglutizione, la sensazione del gusto e il parlare. La presenza di muscolatura estrinseca e intrinseca, con innervazione e anatomia / funzione distinte, rappresenta l'unicità di questo idrostatico muscolare. I recenti progressi nelle tecniche di imaging hanno fornito una visione più dettagliata della sua complessa anatomia 1 . La diminuita funzionalità della lingua, l'atrofia della lingua, la disfagia e gli impedimenti di parlare sono anche manifestazioni comuni di condizioni myopatiche quali Parkinson 2 , Sclerosi laterale amyotrofica (ALS) 3 , Distrofia mioottonica (MD) 4 e altre miopatie.
I cambiamenti nella composizione muscolare associati a stati comuni di malattia influenzano le proprietà meccaniche e viscoelastiche della lingua. Ad esempio, l'analisi funzionale della forza della lingua ha scoperto cambiamenti nelle proprietà contrattuali associate all'invecchiamentoSs = "xref"> 5 , 6 , ipossia 7 , 8 e l'obesità 9 , 10 . Nel caso della distrofia muscolare, l'aumento della fibrosi porta ad una maggiore rigidità muscolare, che si traduce in una minore conformità alla deformazione quando viene applicato un protocollo di deformazione Lissajous 11 . Viceversa, i cambiamenti nel contenuto di grassi muscolari, come quelli documentati nei pazienti obesi, alterano entrambe le proprietà metaboliche 12 e le proprietà meccaniche dei muscoli scheletrici 13 e 14 e si prevede di aumentare la conformità muscolare alla deformazione. L'aumento del grasso della lingua è correlato anche allo sviluppo dell'apnea ostruttiva del sonno (OSA) negli esseri umani 17 aumentando il volume della lingua fino al punto di occlusione parziale delle vie aeree (apnea) 15 , 16 . SimIlarly all'uomo, l'infiltrazione di grasso della lingua è stata documentata negli obesi Zucker 10 , suggerendo che questo modello è uno strumento prezioso per studiare gli effetti dell'infiltrazione di grasso sulla fisiologia della lingua.
La forza della lingua di misura richiede tecniche delicate da chirurgia per isolare e stimolare bilateralmente i nervi ipoglossi 17 , 18 . Tali tecniche sono state precedentemente descritte nei ratti 5 , 17 , 19 , 20 , conigli 21 e umani 22 , 23 , ma con accessi visivi limitati per l'investigatore. A causa della sua natura altamente tecnica, la disponibilità di un protocollo dettagliato migliorerà in modo significativo l'accessibilità e la riproducibilità di questa tecnica. L'obiettivo del nostro paradigma sperimentale è quello di ammalarsiRealizzare una tecnica valida e affidabile per misurare la resistenza e le proprietà viscoelastiche della lingua in un modello di ratto. Per far ciò, il ratto viene anestetizzato, i nervi ipoglossi vengono esposti e la trachea è culminata per garantire l'accesso libero alla lingua dell'animale. Un anello di sutura quindi collega la punta della linguetta ad un trasduttore di forza, in grado di controllare sia la forza che la lunghezza, mentre due elettrodi bipolari stimolano i nervi ipoglossali per indurre la contrazione della lingua. Una volta completata la misurazione della forza, le capacità di controllo della lunghezza del trasduttore di forza vengono utilizzate per modificare rapidamente la lunghezza della lingua, secondo un protocollo sinusoidale con ampiezza fissa (curve Lissajous), durata e frequenza, consentendo di derivare Le sue proprietà viscoelastiche 11 , 24 . Il protocollo guida l'investigatore attraverso i passaggi di dissezione, il posizionamento dell'animale sul platfo sperimentaleRm, il posizionamento degli elettrodi e infine l'acquisizione e l'analisi dei dati di forza e viscoelasticità.
Protocollo
Tutte le procedure che comprendono soggetti animali sono stati approvati dal Comitato istituzionale per la cura e l'uso degli animali (IACUC) dell'Università della Pennsylvania (protocollo numero 805822). La procedura descritta è terminale e non richiede l'utilizzo di condizioni asettiche o di prodotti farmaceutici.
1. Procedure chirurgiche
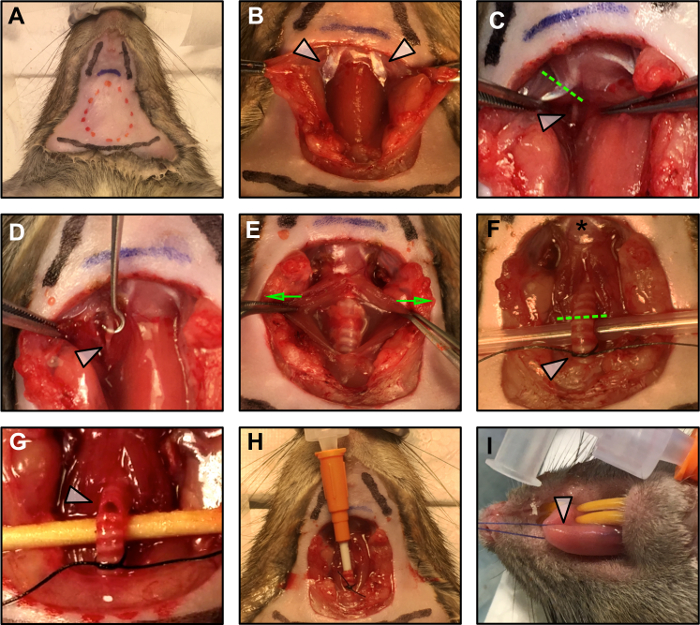
Figura 1: Procedure chirurgiche.
(A) demarcazione del piano chirurgico. La linea tratteggiata rossa indica l'area dell'incisione. Due linee nere indicano la posizione della mascella, mentre la linea nera inferiore segnala la posizione del torace. La linea blu indica l'osso ioide. (B) Esposizione del ventre posteriore del muscolo digastrico (frecce) dopo la dissezione veloce del tessuto grasso, il sublinguale e la sottomessilla Le ghiandole. (C) Riduzione del ventre posteriore del muscolo digastrico (linea verde tratteggiata) per esporre il nervo ipoglosso (freccia bianca). (D) Il nervo ipoglosso (freccia bianca) viene eliminato dalla fascia circostante. (E) La trachea è esposta facendo togliere delicatamente il muscolo liscio (le frecce verdi indicano la direzione della forza applicata) e sollevate (F) per prepararsi all'intubazione. La stella indica l'inserimento della lingua all'osso ioide. La linea verde tratteggiata segna il punto di incisione per l'intubazione. La freccia bianca indica il nodo sciolto preparato per assicurare la cannula in posizione una volta inserita. (G) Incisione della trachea per la cannulazione. (H) La cannula tracheale è inserita e fissata in posizione con un nodo quadrato. (I) Applicazione della sutura alla lingua.Target = "_ blank"> Fare clic qui per visualizzare una versione più grande di questa figura.
- Anestesia e preparazione alla chirurgia
- Posizionare il ratto nella camera di induzione con 4% di anestesia isoflurana.
- Posare l'animale supino su una fonte di calore e mantenere l'anestesia con il 1 - 3% di isoflurano da un nosecone, assicurando una velocità respiratoria di almeno 70 respiri al minuto.
- Rasare l'area del collo con una crema per tagliare l'aria e la rimozione dei peli. Quando si utilizza la crema per la rimozione dei capelli, spalmare la crema con un applicatore a cotone fino a quando la pelliccia viene rimossa. L'esposizione prolungata alla crema di rimozione dei peli può causare irritazione della pelle.
- Pulire il campo chirurgico con alcool al 70% ( Figura 1A ).
- Controllare il pattern respiratorio e i riflessi dell'animale (mancanza di un riflesso del pizzico) prima di procedere con l'incisione iniziale. Il monitoraggio continuo e la valutazione della profondità dell'anestesia è essenziale (reFrequenza respiratoria del cavo e mancanza di riflessi ogni 10 minuti); L'animale deve essere sottoposto ad un profondo piano chirurgico di anestesia durante l'intera procedura.
- Identificazione dei nervi ipoglossi
- Aprire il campo chirurgico con un paio di forbici operative ricoprendo e rimuovendo la pelle come indicato dalla linea rossa in figura 1A .
- Sbucciante sangue attraverso qualsiasi tessuto grasso, le ghiandole sublinguali e submaxillari e lo strato muscolare che circonda la trachea.
NOTA: Essere conservatori durante la dissezione. Usare una dissezione sbarrata quando possibile e fare attenzione a non danneggiare i vasi sanguigni del collo. - Identificare la pancia posteriore del muscolo digastrico (PD) lateralmente alla trachea ( Figura 1B - frecce bianche). Il nervo ipoglossale corre sotto questo muscolo ( Figura 1C - freccia bianca). Con l'elettrochirurgia, resetta la prox PDImale all'osso ioide ( Figura 1C - linea tratteggiata).
NOTA: Non lasciare che il nervo o il tessuto intorno a esso diventino asciutti. Aggiungere una goccia di olio minerale sul nervo per proteggerlo. Per evitare la contrazione muscolare dovuta alla propagazione del campo dello stimolo dagli elettrodi, attenta cauterizzazione del tessuto muscolare nei possibili siti di contatto attorno al nervo. - Usando un paio di pinze fine, dissect il nervo ipoglosso dalla fascia circostante. Con l'aiuto di un gancio, assicurarsi che almeno 3 mm di nervo siano disponibili per il collegamento dell'elettrodo bipolare ( Figura 1D ).
- Usando micro forzoni hemostatic, schiacciare il nervo ipoglossico distalmente dall'osso ioide ( figura 1D - freccia bianca) per evitare la propagazione retrograda dello stimolo. Schiacciare il nervo applicando la pressione su di esso con le pinze micro emostatiche per 5 s. Quando l'emostatico afferra il nervo, un breve tLa strega alla base della lingua dovrebbe essere visibile.
- Ripetere la procedura per l'altro lato.
- Intubazione tracheale
- Esporre la trachea separando delicatamente i muscoli lisci circostanti da una dissezione sbarrata ( Figura 1E - come indicato dalle frecce verdi).
NOTA: Essere conservatori e usare una dissezione preferenziale. Confronta il diametro della cannula con quello della trachea. La cannula dovrebbe essere inserita correttamente nella trachea e deve rimanere inserita in modo stabile dopo essere stata suturata come descritto nei punti da 1.3.2 a 1.3.5. - Sollevare delicatamente la trachea utilizzando un paio di pinze a sutura e passare una sutura da 4 a 0 sotto, vicino al torace. Lega un nodo iniziale allentato tra il 6 ° e il 7 ° anello dalla laringe ( figura 1F - freccia bianca). Questo nodo sarà chiuso una volta che la cannula viene inserita per mantenerla in posizione.
- Far scorrere lo stelo di unTrasferire pipetta (lubrificare la pipetta con olio minerale per facilitare l'inserimento) sotto la trachea per sollevarlo e facilitare l'inserimento della cannula (IV 14 gx 3.25 "cannula).
- Tagliare una piccola incisione tra il quarto e il quinto anello dalla laringe ( Figura 1G - freccia bianca). Dopo la prima incisione, l'apertura tende a diffondersi, perciò essere conservatori quando si fa il taglio iniziale per evitare la completa resezione della trachea.
NOTA: Prima di eseguire l'incisione della trachea, assicurarsi che la cannula sia pronta e che la consegna dell'anestesia sia attiva. - Avviare l'amministrazione dell'anestesia attraverso la cannula e inserirla delicatamente nell'incisione, avanzando delicatamente all'interno della trachea la lunghezza di circa 5 anelli. Fissare la cannula in posizione con la sutura, per creare una tenuta ermetica ( Figura 1H ).
NOTA: Assicurarsi che nessun fluido entri nella trachea nera per evitare il suffocation. Una volta incisiva la trachea, l'animale respirerà l'aria della stanza. È quindi importante inserire rapidamente la cannula in modo che la consegna dell'anestesia venga mantenuta. Quando / se si muove l'animale, controllare la posizione corretta della cannula nella trachea. - Rimuovere delicatamente l'animale dal nosecone.
NOTA: L'uso di anestetici iniettabili anziché isoflurano può semplificare la procedura eliminando la necessità di intubazione tracheale e di eliminare l'area di lavoro sperimentale dal tubo in eccesso.
- Esporre la trachea separando delicatamente i muscoli lisci circostanti da una dissezione sbarrata ( Figura 1E - come indicato dalle frecce verdi).
- Sutura delle lingue
- Immergere un pezzo di 5/0 di sutura di 20 cm (suggeriamo la seta, intrecciato nero) in PBS.
- Tenendo premuto la bocca del ratto, tenere delicatamente la punta della linguetta con la pinza a sutura.
- Passare la sutura medialmente attraverso la punta della lingua ( Figura 1I - freccia bianca) prestando attenzione a mantenere la lingua umida con salina per evitare potenziali tessutidanno.
- Un legame di circa 4 cm di larghezza (il diametro può cambiare in base alla distanza tra l'animale e il trasduttore di forza).
NOTA: Assicurarsi che la sutura e la linguetta siano bagnati per facilitare l'inserimento e per evitare lesioni inutili del tessuto.
2. Impostazione sperimentale
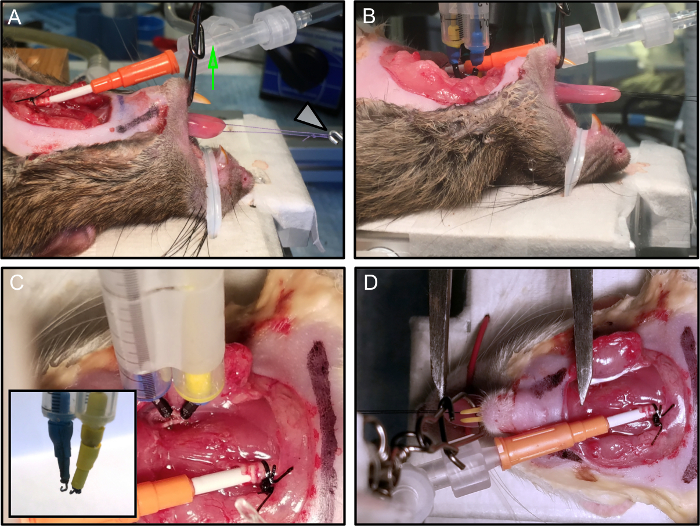
Figura 2: Posizionamento e fissaggio dell'animale.
(A) Il mouse è posizionato sulla piattaforma sperimentale. La mascella è protetta e la bocca rimane aperta dall'applicazione della tensione verticale (freccia verde). Il loop di sutura è collegato al trasduttore di forza (freccia bianca). (B) Gli elettrodi sono collegati. (C) Ogni elettrodo, montato su un micromanipolatore, è stabilmente collegato al nervo. L'intarsio mostra la terminazione di tLui eleva l'elettrodo. (D) La lunghezza ottimale della lingua è misurata con una pinza Vernier, dall'inserzione a livello dell'osso ioide fino alla punta della lingua. In questa immagine, gli elettrodi sono stati rimossi per chiarezza. Clicca qui per visualizzare una versione più grande di questa figura.
Nota: posizionare l'animale supino sul vassoio riscaldato dell'apparecchio, utilizzando le seguenti misure di sicurezza per evitare il movimento durante l'esperimento.
- Fissare il naso del ratto al vassoio con un tirante metallico rivestito di plastica direttamente collegato alla piattaforma riscaldata ( figura 2A , 2B ).
- Mantenere la bocca aperta aperta applicando una tensione verticale (utilizzare un giunto a 3 vie legato alla linea di monofilamento da 9 kg e tenere premuto con un bastone) ( Figura 2A - freccia verde).
NOTA: Un approccio alternativo per stabilizzare il ratto è quello di utilizzare una bocca di bocca rodente o una modifica personalizzata di esso. È essenziale che la bocca sia mantenuta aperta e stabile per evitare movimenti del collo che potrebbero compromettere la qualità delle misure. - Collegare il ciclo di sutura al trasduttore di forza ( Figura 2A - freccia bianca).
- Usando il nastro chirurgico, immobilizzare gli arti e l'addome del ratto per limitare i movimenti durante le stimolazioni.
- Applicare i due elettrodi bipolari a gancio stimolante ai nervi ipoglossici disseminati, in prossimità del sito di schiacciamento ( Figura 2C ).
- Utilizzare elettrodi bipolari stimolanti su misura da un paio di elettrodi ad ago a crosta di acciaio chirurgico, tenuti insieme ad una distanza di 2 mm l'uno dall'altro utilizzando un supporto in plastica (qui abbiamo usato due pipette serologiche da 1 ml insieme).
- Piegare le punte degli elettrodi ad ago ad una forma a gancioAbbastanza piccolo per formare un contatto stabile con il nervo (~ 1 mm di diametro) ( Figura 2C - intarsio).
- Collegare i due fili di ciascun elettrodo a un doppio attacco impilabile con jack jack BNC jack di banana e quindi collegare al modulo stimolatore di un sistema di test muscolare in situ (Tabella 3) utilizzando un divisore BNC.
NOTA: Assicurarsi che l'animale sia stabile e che il collo e la lingua siano allineati alla leva del trasduttore di forza. Continuare a monitorare la frequenza respiratoria e assicurare che i restrizioni non interferiscano con la respirazione.
3. Lunghezza ottimale (L 0 ) e massima determinazione forza isometrica
- Regolare la lunghezza della linguetta gradualmente e applicare stimolazioni isometriche di torsione fino a ottenere una forza massima.
- Definire L 0 come la lunghezza alla quale la forza di torsione isometrica ( Tabella 1 ) è massima e registrare per la successiva normalizzazione diLe misure della forza, come cambia per ogni animale. Utilizzando una pinza Vernier, misurare la lunghezza della linguetta dall'inserzione a livello dell'osso ioide ( figura 2D ) alla punta della lingua.
NOTA: il corretto posizionamento degli elettrodi è essenziale per garantire un contatto ottimale con i nervi. Il posizionamento ottimale dovrebbe esercitare forze simili e addizionali quando stimolano uno dei due nervi o entrambi, rispettivamente.
- Definire L 0 come la lunghezza alla quale la forza di torsione isometrica ( Tabella 1 ) è massima e registrare per la successiva normalizzazione diLe misure della forza, come cambia per ogni animale. Utilizzando una pinza Vernier, misurare la lunghezza della linguetta dall'inserzione a livello dell'osso ioide ( figura 2D ) alla punta della lingua.
- Prima di iniziare l'esperimento, collegare entrambi gli elettrodi allo stimolatore e somministrare una stimolazione tetanica di prova ( Tabella 1 ). Durante questa contrazione, monitorare l'animale per assicurare che la posizione sia stabile e controllare le contrazioni visibili indesiderate dei muscoli del collo.
- Misurare la forza isometrica applicando una torsione seguita dopo 20 secondi da una stimolazione tetanica. Ripetere le stimolazioni 3 volte permettendo il recupero di 4 minuti tra i cicli di stimolazione (un ciclo include una torsione e sopraStimolazione tetanica), e registrare le forze massime di torsione e tetanica.
- Mantenere la lingua bagnata in qualsiasi momento applicando alcune gocce di PBS tra le contrazioni.
NOTA: Se i muscoli del collo si contraggono, cambiare attentamente il posizionamento degli elettrodi in modo che non tocchino alcun tessuto muscolare circostante e, se necessario, cauterizzare il tessuto a contatto con gli elettrodi.
4. Determinazione delle proprietà viscoelastiche (curve Lissajous)
- Lasciare riposare la lingua per 3-5 minuti dopo la determinazione della forza isometrica. Eseguire le curve di Lissajous a partire da L 0 , quindi la posizione dell'animale e del trasduttore di forza non deve mai essere cambiata.
- Senza stimolare i nervi ipoglossali, applicare cicli di tratti passivi ( tabella 2 ) con un aumento dello spostamento (d) cioè 5, 10, 15, 20, 25, 30, 35, 40, 50% di L 0 (maggiori ampiezze possono richiedere un doppio Controller di modalità con higheR valori di escursione rispetto al 305C-LR). Ad esempio, un'ampiezza del 40% di L 0 provocherà la deformazione della lingua da + 20% L 0 a -20% L 0 .
- Utilizzare una frequenza fissa a 2 Hz con 10 ripetizioni in ogni ciclo, per una durata complessiva di 5 s ogni ciclo. Cambiamenti della frequenza sinusale sono stati usati in passato con tessuti come il diaframma 24 e potrebbero essere adottati per modificare il protocollo sperimentale.
- Lasciare 30 secondi tra ciascun ciclo e assicurarsi che la lingua sia bagnata durante tutta la procedura.
NOTA: tenere la lingua bagnata durante la procedura aggiungendo alcune gocce di PBS. Assicurarsi che il dispositivo di ritenuta che mantiene la mascella rimanga in posizione stabile durante i tratti, in particolare quando lo spostamento raggiunge il 40% o più.
- Subito dopo il completamento dell'esperimento, mentre l'animale è ancora sotto un profondo piano chirurgico di anestesia, eutanizza l'animale secondo il protettore animale IACUC approvatoocol. Dissect la lingua per ulteriore elaborazione ( cioè sezionamento congelato o stoccaggio per analisi biochimiche).
Risultati
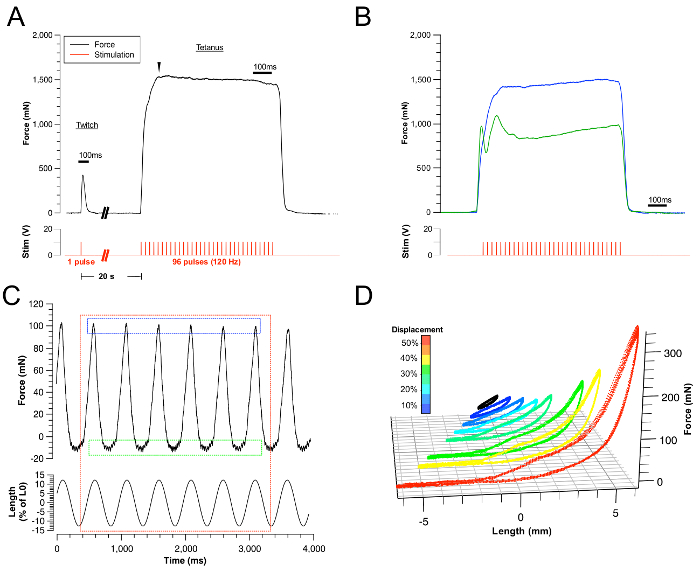
Figura 3: Risultati rappresentativi.
(A) Esempi di successo tracce di forza e torsione tetanica. La corrispondente stimolazione è rappresentata dalla traccia rossa. (B) Esempio di contrazione tetanica della lingua nonsufficiente dovuto alla contrazione submaximale (traccia blu) e stimolazione indiretta dei muscoli del collo. Entrambe le condiz...
Discussione
I cambiamenti nel metabolismo e / o nella composizione della lingua, ad esempio l'infiltrazione di grassi della lingua come conseguenza dell'obesità, sono preveduti per causare variazioni quantificabili dei parametri valutati dal nostro protocollo. La quantificazione della forza della lingua è di grande interesse in quanto uno squilibrio tra attività protrusiva e retrusiva o indebolimento della lingua generale può provocare l'occlusione della via aerea superiore 15 . Le t...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa indagine è stata sostenuta da due istituti nazionali di assistenza sanitaria: HL089447 ("Obesità e OSA: Comprendere l'importanza della tongue grasso e funzione metabolica") e HL094307 ("Comprendere la relazione tra obesità e grasso tongue")
Materiali
| Name | Company | Catalog Number | Comments |
| SurgiSuite (heated Surgical tray) | Kent Scientific | SurgiSuite-LG | Includes heated platform |
| LED Lighting and Magnification Kit | Kent Scientific | SURGI- 5003 | |
| RC2 Rodent Circuit Controller | VetEquip | 922100 | |
| Isoflurane | Butler Schein Animal Health Supply | 29405 | |
| Alcohol Prep | Webcol | 6818 | |
| Cotton-tipped applicators | MediChoice | WOD1002 | |
| Hair clipper | Conair | ||
| Hair remover lotion | Nair | ||
| Medical tape | Transpore | 3M | |
| D-PBS | Corning | 21-030-CM | |
| Operating Scissors | World Precision Instruments | 503717-12 | |
| Hemostatic Forceps | Merit | 97-458 | Any tissue forceps can be used instead |
| Microdissecting Forceps, Angled, Serrated, 10.2 cm, SS | World Precision Instruments | 504479 | |
| Suture Tying Forceps | Fine Science Tools | 18025-10 | |
| Blunt Micro Hook | Fine Science Tools | 10062-12 | |
| Microhemostat | Fine Science Tools | 12075-14 | |
| Thermal cautery | WPI | 501292 | Disposable cauteries are available at lower cost |
| IV 14g x 3.25" cannula | BD | B-D382268H | For tracheal cannulation |
| Braided silk non-absorbable suture size 4-0 | Harvard Apparatus | SP104 | For stabilization of the tracheal cannula |
| Braided non-absorbable silk 5/0 suture | Surgik LC, USA | ESILRC15387550 | For suturing the tongue |
| Plastic-coated metal twist-tie (or electrical wire) | For securing the rat's nose to the platform | ||
| Camera stick | |||
| 3 way-swivel and Trilene 9 Kg test monofilament line | Berkley | For securing the jaw and maintaining the mouth open | |
| Camera stick with adjustable angle | For supporting the 3 way-swivel and maintaining the mouth open. | ||
| in situ Muscle Test System | Aurora Scientific | 809C | This system is designed for mice and was modified by extending the platform. Alternatively the rat-specific 806D system can be used. |
| Dual-Mode Muscle lever (force transducer) | Aurora Scientific | 305C-LR | 309C offers higher excursion capabilities than 305C-LR. Link for more information and specifications: http://aurorascientific.com/products/muscle-physiology/dual-mode-muscle-levers/ |
| Needle Electrodes (surgical steel, 29 gauge) | AD Instruments | MLA1204 | 300C is recommended for use in mice. |
| Magnetic Stands | World Precision Instruments | M10 | Used for making the bipolar stimulating hook electrodes |
| Kite Manual Micromanipulator | World Precision Instruments | KITE-R and KITE-L | Require a steel plate |
| Stackable Double Binding Post with Banana Jack x BNC Jack | McMaster Carr | 6704K13 | |
| Carbon fiber composites digital caliper | VWR | 36934-152 |
Riferimenti
- Sanders, I., Mu, L. A three-dimensional atlas of human tongue muscles. Anat Rec (Hoboken). 296 (7), 1102-1114 (2013).
- Ciucci, M. R., et al. Tongue force and timing deficits in a rat model of Parkinson disease. Behav Brain Res. 222 (2), 315-320 (2011).
- Easterling, C., Antinoja, J., Cashin, S., Barkhaus, P. E. Changes in tongue pressure, pulmonary function, and salivary flow in patients with amyotrophic lateral sclerosis. Dysphagia. 28 (2), 217-225 (2013).
- Wang, Z. J., Huang, X. S. Images in clinical medicine. Myotonia of the tongue. N Engl J Med. 365 (15), e32 (2011).
- Ota, F., Connor, N. P., Konopacki, R. Alterations in contractile properties of tongue muscles in old rats. Ann Otol Rhinol Laryngol. 114 (10), 799-803 (2005).
- Schwarz, E. C., Thompson, J. M., Connor, N. P., Behan, M. The Effects of Aging on Hypoglossal Motoneurons in Rats. Dysphagia. 24 (1), 40 (2008).
- Pae, E. -. K., Wu, J., Nguyen, D., Monti, R., Harper, R. M. Geniohyoid muscle properties and myosin heavy chain composition are altered after short-term intermittent hypoxic exposure. J Appl Physiol. 98 (3), 889-894 (2005).
- Fuller, D. D., Fregosi, R. F. Fatiguing contractions of tongue protrudor and retractor muscles: influence of systemic hypoxia. J Appl Physiol. 88 (6), 2123-2130 (2000).
- Ray, A. D., Farkas, G. A., Pendergast, D. R. In-situ mechanical characteristics of the tongue are not altered in the obese Zucker rat. Sleep. 32 (7), 957 (2009).
- Brennick, M. J., et al. Tongue fat infiltration in obese versus lean Zucker rats. Sleep. 37 (6), 1095-1102 (2014).
- Stedman, H. H., Sweeney, H. L., Shrager, J. B., Maguire, H. C., Panettieri, R. A., Petrof, B., Narusawa, M., Leferovich, J. M., Sladky, J. T., Kelly, A. M. The mdx mouse diaphragm reproduces the degenerative changes of Duchenne muscular dystrophy. Nature. 352 (6335), 536-539 (1991).
- Goodpaster, B. H., Wolf, D. Skeletal muscle lipid accumulation in obesity, insulin resistance, and type 2 diabetes. Pediatr Diabetes. 5 (4), 219-226 (2004).
- Loro, E., et al. IL-15Rα is a determinant of muscle fuel utilization, and its loss protects against obesity. Am J Physiol Regul Integr Comp Physiol. 309 (8), R835-R844 (2015).
- Rahemi, H., Nigam, N., Wakeling, J. M. The effect of intramuscular fat on skeletal muscle mechanics: implications for the elderly and obese. J R Soc Interface. 12 (109), 20150365 (2015).
- Kim, A. M., et al. Tongue fat and its relationship to obstructive sleep apnea. Sleep. 37 (10), 1639-1648 (2014).
- Kim, A. M., et al. Metabolic activity of the tongue in obstructive sleep apnea. A novel application of FDG positron emission tomography imaging. Am J Respir Crit Care Med. 189 (11), 1416-1425 (2014).
- Gilliam, E. E., Goldberg, S. J. Contractile properties of the tongue muscles: effects of hypoglossal nerve and extracellular motoneuron stimulation in rat. J Neurophysiol. 74 (2), 547-555 (1995).
- Sokoloff, A. J. Localization and contractile properties of intrinsic longitudinal motor units of the rat tongue. J Neurophysiol. 84 (2), 827-835 (2000).
- Becker, B. J., Russell, J. A., Connor, N. P. Effects of aging on evoked retrusive tongue actions. Arch Oral Biol. 60 (6), 966-971 (2015).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle Nerve. 47 (2), 230-240 (2013).
- Seo, J., et al. Nerve cuff electrode using embedded magnets and its application to hypoglossal nerve stimulation. J Neural Eng. 13 (6), 066014 (2016).
- Friedman, M., et al. Targeted hypoglossal nerve stimulation for the treatment of obstructive sleep apnea: Six-month results. Laryngoscope. 126 (11), 2618-2623 (2016).
- Heiser, C., Maurer, J. T., Steffen, A. Functional outcome of tongue motions with selective hypoglossal nerve stimulation in patients with obstructive sleep apnea. Sleep Breath. 20 (2), 553-560 (2016).
- Syme, D. A. Passive viscoelastic work of isolated rat, Rattus norvegicus, diaphragm muscle. J Physiol. 424, 301-315 (1990).
- Connor, N. P., et al. Effect of tongue exercise on protrusive force and muscle fiber area in aging rats. J Speech Lang Hear Res. 52 (3), 732-744 (2009).
- Schaser, A. J., Stang, K., Connor, N. P., Behan, M. The effect of age and tongue exercise on BDNF and TrkB in the hypoglossal nucleus of rats. Behav Brain Res. 226 (1), 235-241 (2012).
- Puhan, M. A., et al. Didgeridoo playing as alternative treatment for obstructive sleep apnea syndrome: randomised controlled trial. BMJ. 332 (7536), 266-270 (2006).
- Guimarães, K. C., Drager, L. F., Genta, P. R., Marcondes, B. F., Lorenzi-Filho, G. Effects of oropharyngeal exercises on patients with moderate obstructive sleep apnea syndrome. Am J Respir Crit Care Med. 179 (10), 962-966 (2009).
- Ueda, H., Almeida, F. R., Chen, H., Lowe, A. A. Effect of 2 jaw exercises on occlusal function in patients with obstructive sleep apnea during oral appliance therapy: a randomized controlled trial. Am J Orthod Dentofacial Orthop. 135 (4), 430 (2009).
- Strollo, P. J., et al. Upper-airway stimulation for obstructive sleep apnea. N Engl J Med. 370 (2), 139-149 (2014).
- Perrier, P., Payan, Y., Zandipour, M., Perkell, J. Influences of tongue biomechanics on speech movements during the production of velar stop consonants: A modeling study. J Acoust Soc Am. 114 (3), 1582-1599 (2003).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle & nerve. 47 (2), 230-240 (2013).
- Brady, J. P., et al. AlphaB-crystallin in lens development and muscle integrity: a gene knockout approach. Invest Ophthalmol Vis Sci. 42 (12), 2924-2934 (2001).
- Spassov, A., et al. Differential expression of myosin heavy chain isoforms in the masticatory muscles of dystrophin-deficient mice. Eur J Orthod. , ciq113 (2010).
- Lever, T. E., et al. Videofluoroscopic Validation of a Translational Murine Model of Presbyphagia. Dysphagia. 30 (3), 328-342 (2015).
- Gantois, I., et al. Ablation of D1 dopamine receptor-expressing cells generates mice with seizures, dystonia, hyperactivity, and impaired oral behavior. Proc Natl Acad Sci. 104 (10), 4182-4187 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon