È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sintesi e test di sostanza solida Pt-Cu sostenuta Catalizzatori di nanoparticelle per la deidrogenazione del propano
In questo articolo
Riepilogo
Viene riportato un metodo conveniente per la sintesi di catalizzatori Pt-Cu a nanoparticelle bimetallici supportati da 2 nm per la deidrogenazione di propano. Le tecniche di radiografia in situ di sincrotrone permettono di determinare la struttura del catalizzatore, che è tipicamente non raggiungibile utilizzando strumenti di laboratorio.
Abstract
Qui viene illustrato un metodo conveniente per la sintesi di catalizzatori bimetallici Pt-Cu e test di prestazione per la deidrogenazione e la caratterizzazione del propano. Il catalizzatore forma una struttura di soluzione solida sostitutiva, con una piccola e uniforme dimensione delle particelle di circa 2 nm. Ciò è realizzato con un attento controllo sulle fasi di impregnazione, calcinazione e riduzione durante la preparazione del catalizzatore ed è identificato da tecniche avanzate di sincrotrone in situ . La prestazione di deidrogenazione del propano catalitico migliora continuamente con l'aumento del rapporto atomico Cu: Pt.
Introduzione
La deidrogenazione del propano (PDH) è una fase di trasformazione chiave nella produzione di propilene, avvalendosi del gas shale, la fonte di crescita più rapida del gas nel paese 1 . Questa reazione interrompe due legami CH in una molecola di propano per formare un propilene e un idrogeno molecolare. I catalizzatori di metalli nobili, comprese le nanoparticelle di Pd, presentano una scarsa selettività per il PDH, spezzando il legame CC per produrre metano ad elevata resa, con la produzione concomitante di coke, portando alla disattivazione del catalizzatore. Recenti rapporti hanno dimostrato che i catalizzatori selettivi di PDH potrebbero essere ottenuti con l'aggiunta di promotori come Zn o In a Pd 2 , 3 , 4 . I catalizzatori promossi sono vicini al 100% selettivi a PDH, a differenza di meno del 50% per nanoparticelle monometalliche Pd della stessa dimensione. Il grande miglioramento della selettività è stato attribuito alla formazione di composti intermetallici PdZn o PdIn(IMC) sulla superficie del catalizzatore. L'array ordinato di due diversi tipi di atomi nelle IMC geometricamente isolava i siti attivi Pd con Zn o At atomi non catalitici, che spense le reazioni laterali catalizzate da un gruppo (gruppo) dei siti attivi attivi Pd.
Il platino ha la più alta selettività intrinseca tra i metalli nobili per la deidrogenazione del propano, ma non è ancora soddisfacente per l'uso commerciale 1 . In genere, Sn, Zn, In o Ga è aggiunto come promotore per Pt 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 . Sulla base dell'idea che l'isolamento del sito attivo geometrico contribuisce ad alta selettività, qualsiasi elemento non catalitico che forma una legaStruttura con Pt, come Cu, dovrebbe anche potenzialmente promuovere le prestazioni del catalizzatore 14 . Alcuni studi precedenti hanno suggerito che l'aggiunta di Cu ha migliorato la selettività PDH dei catalizzatori Pt 15 , 16 , 17 , 18 . Tuttavia, non sono state riportate prove dirette per determinare se Pt e Cu formano nanoparticelle bimetalliche o strutture ordinate, cruciale per comprendere l'effetto promozionale di Cu. Nel diagramma di fase binario di Pt-Cu, sono possibili due tipi di struttura in un'ampia gamma di composizioni 16 , 18 : composto intermetallico in cui Pt e Cu ciascuno occupano siti cristallici specifici e solida soluzione in cui Cu sostituisce casualmente nel Reticolo Pt. Le IMC si formano a bassa temperatura e si trasformano in soluzione solida a circa 600-800 ° C per i materiali sfusi 14. Questa temperatura di trasformazione può essere inferiore per le nanoparticelle, vicino alla temperatura di reazione di PDH ( ossia 550 ° C). Pertanto è essenziale studiare l'ordine atomico di Pt-Cu in condizioni di reazione. Per le nanoparticelle supportate con piccole dimensioni di particelle, è molto difficile ottenere informazioni strutturali significative utilizzando strumenti di laboratorio 19 . La ripetizione limitata delle cellule unità porta a picchi di diffrazione molto ampi con intensità molto basse. A causa dell'elevata frazione di atomi superficiali delle nanoparticelle di dimensione da 1 a 3 nm che sono ossidate in aria, la diffrazione deve essere raccolta in situ utilizzando raggi X ad alto flusso, tipicamente disponibile con tecniche di sincrotrone.
I catalizzatori Pt-Cu PDH precedentemente riportati erano tutti superiori a 5 nm di dimensioni 15 , 16 , 17 , 18. Tuttavia, per i catalizzatori di nanoparticelle di metalli nobili, c'è sempre un forte desiderio di massimizzare l'attività catalitica per costo unitario, sintetizzando catalizzatori con elevate dispersioni (tipicamente circa o meno di 2 nm in dimensioni) 19 . Anche se la preparazione di nanoparticelle bimetalliche di questa dimensione è possibile mediante metodi standard di impregnazione, è necessario un controllo razionale sulle procedure. I precursori metallici, il pH della soluzione impregnante e il tipo di supporto devono essere controllati per ottimizzare l'ancoraggio delle specie metalliche su supporti di superficie ad alta superficie. I successivi trattamenti termici di calcinazione e riduzione dovrebbero anche essere attentamente controllati per sopprimere la crescita delle nanoparticelle metalliche.
Questo articolo riguarda il protocollo per la sintesi di catalizzatori bimetallici nanometriche a base di Pt-Cu da 2 nm e per la prova delle loro prestazioni di deidrogenazione del propano. La struttura dei catalizzatori è studiata da Scanning TLa microscopia elettronica di ransmission (STEM), la spettroscopia di assorbimento a raggi X in sincrotrone in situ , e la diffrazione a raggi X in sincrotrone in situ (XRD), che aiutano a chiarire la migliorata efficienza del catalizzatore dopo l'introduzione di Cu.
Protocollo
1. Sintesi dei catalizzatori nanomateriali bimetallici Pt-Cu supportati a 2 nm
- Preparazione della soluzione precursore metallica
- Sciogliere 0,125 g di triidrato di rame di nitrato (Cu (NO 3 ) 2 · 3H 2 O) in 1 ml di acqua per ottenere una soluzione di azzurro.
Attenzione: Usare guanti protettivi per la manipolazione di sostanze chimiche. - Aggiungere ammoniaca in goccia alla soluzione di nitrato di rame, formando precipitati blu scuro di idrossido di rame.
Attenzione: utilizzare una cappa per il trattamento delle basi e dei prodotti chimici volatili. - Continuare ad aggiungere ammoniaca fino a quando i precipitati azzurro scuro si dissolvono per formare una soluzione blu scuro e il pH> 10.
- Aggiungere 0,198 g di nitrato di tetraammine platino ((NH 3 ) 4 Pt (NO 3 ) 2 ) alla soluzione e all'acqua supplementare in modo che il volume totale della soluzione sia di 3,5 ml. Aggiungere ammoniaca supplementare se necessario per mantenere il pH della soluzione maggiore di 10.
- Scaldare la soluzione a 70 ° C fino a quando tutti i sali nitrati di tetraammino platino vengono sciolti nella soluzione. Lasciare raffreddare la soluzione a RT.
- Sciogliere 0,125 g di triidrato di rame di nitrato (Cu (NO 3 ) 2 · 3H 2 O) in 1 ml di acqua per ottenere una soluzione di azzurro.
- Coimpregnazione di soluzione precursore metallica
- Prima della preparazione del catalizzatore, determinare il volume di impregnazione dei pori del supporto di silice. Ponderate attentamente circa 5 g di silice secca in un piatto di pesatura. Mentre si mescola, aggiungere H 2 O in goccia fino a quando la silice è completamente umida, ma senza soluzione in eccesso. Reweigh la silice umida. Dividere i grammi di acqua aggiunta con i grammi di campione per calcolare il volume dei pori.
- Aggiungere una soluzione di precursore metallica disciolta a qualche goccia alla volta fino a 5 g di silice alta porosa (SiO 2 ) in un piatto di evaporazione ceramica e mescolare delicatamente per rompere le particelle che si attaccano per ottenere una distribuzione omogenea della soluzione.
NOTA: La silice bianca si trasformerà in blu scuro dopo aver adsorbito tutti i 3,5 ml di solutio precursore metallicon.- Assicurarsi che la trama delle particelle di silice rimanga come quella della sabbia secca. Evitare l'accumulo di soluzione in eccesso durante l'impregnazione.
- Posizionare il precursore catalitico Pt-0.7Cu / SiO 2 impregnato in un forno di essiccazione e asciugarlo a 125 ° CO / N.
- Calcina e riduzione
- Calcinare il catalizzatore in un forno a 250 ° C con una velocità di rampa di 5 ° C / min in aria per 3 ore.
NOTA: La calcinazione a temperature più alte generalmente porta a nanoparticelle di Pt maggiori. - Posizionare uno strato di lana di quarzo da 2 cm al centro di un reattore a tubo di quarzo da 1 "e caricare il catalizzatore Pt-0.7Cu / SiO 2 nel tubo attraverso un imbuto plastico. Posizionare il tubo in un forno a temperatura controllata.
- Dopo aver esaurito il tubo con N 2 per 5 minuti a RT, iniziare a fluire H 2 (a RT) alla stessa portata di N 2 (100 ccm) per ridurre il Pt-0.7Cu /SiO 2 catalizzatore.
- Aumentare la temperatura a 150 ° C con una rampa di 5 ° C / min e tenere premuto per 5 min.
- Avviare lento la rampa della temperatura a una velocità di 2,5 ° C / min a 250 ° C. Tenere la temperatura per 15 minuti ad ogni 25 ° C.
NOTA: Altri metalli potrebbero richiedere temperature di riduzione inferiori o superiori. La temperatura esatta può essere generalmente determinata esaminando i cambi di colore del catalizzatore ( ad esempio, dal blu al nero) per Pt-Cu. - Rampa a 550 ° C (o la temperatura di reazione, se superiore) a 10 ° C / min e rimanga per 30 minuti per completare la riduzione. Estrarre con N 2 e raffreddare a temperatura ambiente.
- Scaricare i catalizzatori Pt-0.7Cu / SiO2 e conservare in un flaconcino per uso futuro.
NOTA: ripetere procedure simili di sintesi utilizzando diverse quantità di Cu (NO 3 ) 2 · 3H 2 O e (NH 3 ) 4 Pt (NO 3 ) 2 per preparare l'altra Pt-X Cu / SiO 2 catalizzatori (X = 0,7, 2,3 e 7,3 e rappresenta rapporti atomici di Cu: Pt) e catalizzatori Pt / SiO2.
- Calcinare il catalizzatore in un forno a 250 ° C con una velocità di rampa di 5 ° C / min in aria per 3 ore.
2. Test di prestazione di propane-deidrogenazione
- Caricamento catalizzatore
- Prendere un reattore a tubo di quarzo da 3/8 "e mettere uno strato di lana di quarzo di 1 cm contro il fossetta nel mezzo.
Attenzione: Usare guanti protettivi per la manipolazione di lana di quarzo, in quanto gli aghi fini possono essere inseriti nella pelle. - Pesare 40 mg di catalizzatore Pt-0.7Cu / SiO 2 e 960 mg di silice per la diluizione. Mescolare le particelle (1 g di peso totale) in una fiala vuota.
- Utilizzare un imbuto di plastica per caricare tutta la miscela catalitica nel tubo di reazione. Pulire la parete esterna di entrambe le estremità del tubo con spugne senza peli per rimuovere la sporcizia per ottenere una buona tenuta con l'O-ring.
- Mettere i raccordi del tubo su entrambe le estremità del tubo del reattore al quarzo e fissarle al sistema del reattore dotato di forno a conchiglia.
- Prendere un reattore a tubo di quarzo da 3/8 "e mettere uno strato di lana di quarzo di 1 cm contro il fossetta nel mezzo.
- Prova di perdita e pretrattamento del catalizzatore
- Accendere 50 cm 3 / min N 2 attraverso il reattore del tubo. Dopo 1 minuto, chiudere la valvola a sfera sulla presa del reattore. Attendere che la pressione del sistema aumenta a 5 psig. Chiudere la valvola a sfera sulla linea di ingresso N 2 per fermare il flusso N 2 e sigillare il sistema del reattore.
- Attendere 1 min e registrare la pressione legata dal misuratore. Se la pressione scende, aprire la valvola a sfera sulla presa del reattore per rilasciare la pressione e ricollegare i raccordi. In caso contrario, aprire prima la valvola a sfera sulla presa del reattore per sbloccare la pressione prima di riavviare il flusso N 2 accendendo la valvola a sfera sulla linea di ingresso N 2 per spurgare il sistema per 1 minuto.
- Iniziare a scorrere 50 cm 3 / min di 5% H 2 / N 2 per la riduzione del catalizzatore prima di eseguire una reazione e arrestare il flusso N 2 . Avviare il riscaldamento del tubo alla temperatura di reazione di 550 ° C, con arMangiato di 10 ° C / min. Attendere 30 minuti dopo che il forno raggiunge il set point e consentire la temperatura del sistema a stabilizzarsi alla temperatura di destinazione.
- Prove di deidrogenazione propanica
- Avviare il gas cromatografo (GC) nel sistema del reattore e selezionare il metodo appropriato per l'analisi dei componenti del gas.
- Passare il flusso del gas del reattore ad una linea di by-pass. Flusso 100 cm 3 / min del 5% di propano / N 2 e 100 cm 3 / min di 5% di H 2 / N 2 . Attendere 1 min in modo che il flusso del propano si stabilizzi e inietta il flusso di bypass in GC come campione di riferimento.
- Riportare il flusso di gas alla linea del tubo del reattore per avviare la reazione e registrare il tempo.
- Dopo che la reazione corre per 4 minuti, iniettare il flusso del gas di uscita del reattore (un campione di GC) nel GC per ottenere le informazioni sul componente del gas di uscita. Iniettare i campioni ogni 4 minuti e eseguire il test fino a quando la conversione raggiunge sta stabile Te o la conversione è molto bassa.
- Utilizzare il software di analisi di picco corrispondente per analizzare ogni picco.
- Fare clic per selezionare i punti di inizio e fine del picco. Utilizza la funzione di integrazione per ottenere l'area di picco. Annotare l'area di picco per il propano (C 3 H 8) reagente; propilene (C 3 H 6) prodotto; ed i prodotti laterali, metano (CH 4), etano (C 2 H 4), e l'etilene (C 2 H 6).
NOTA: Per ogni iniezione viene ottenuto un modello GC con picchi multipli la cui area si riferisce al numero di moli di diverse specie di gas.
- Fare clic per selezionare i punti di inizio e fine del picco. Utilizza la funzione di integrazione per ottenere l'area di picco. Annotare l'area di picco per il propano (C 3 H 8) reagente; propilene (C 3 H 6) prodotto; ed i prodotti laterali, metano (CH 4), etano (C 2 H 4), e l'etilene (C 2 H 6).
- Convertire l'area di picco al numero di moli per ciascuna specie utilizzando il fattore di risposta. Determinare la conversione di propano e la selettività di propilene al momento per ogni campione secondo le seguenti formule:
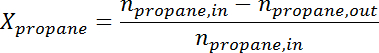
Ad / 56040 / 56040eq2.jpg "/>
dove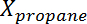 È la conversione del propano,
È la conversione del propano, 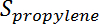 È la selettività del propilene,
È la selettività del propilene, 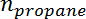 È il numero di moli di propano, e
È il numero di moli di propano, e 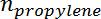 È il numero di moli di propilene.
È il numero di moli di propilene. - Ottieni il valore iniziale di conversione e selettività a t = 0 estrapolando la conversione misurata e la selettività rispetto al tempo sul flusso usando una misura esponenziale.
- Avviare il gas cromatografo (GC) nel sistema del reattore e selezionare il metodo appropriato per l'analisi dei componenti del gas.
- Post-reazione
- Smettere di riscaldare il reattore spegnendo il programma di temperatura. Accendere il flusso di gas a 10 cm 3 / min N 2 .
- Spostare il cromatografo gassoso in modalità di attesa per ridurre la portata del gas di trasporto.
- Scaricare il catalizzatore utilizzato dal reattore a base di letto al quarzo dopo il raffreddamentotemperatura ambiente. Raccogliere il peso del catalizzatore in una zona di smaltimento dei rifiuti.
3. Caratterizzazione dei campioni catalitici
- Scansione microscopia elettronica di trasmissione 4 , 20
- Caricare il catalizzatore in un mortaio e macinare in meno di 100 polvere maglia usando un pestello.
- Disperdere circa 30 mg di polvere di catalizzatore in circa 5 ml di alcool isopropilico in una piccola fiala. Agitare il flaconcino per la miscelazione completa e lasciare lasciare la fiala per 5 minuti per consentire la deposizione delle particelle relativamente grandi.
NOTA: la sospensione ottenuta dovrebbe contenere particelle molto piccole di catalizzatori supportati. - Mettere una griglia pronta per Au TEM su un piatto di evaporazione. Scaldare il piatto a 80 ° C su una piastra calda. Aggiungere tre gocce della sospensione del catalizzatore alla griglia.
NOTA: L'alcool isopropilico si evaporerà rapidamente e lascerà le particelle del catalizzatoreE griglia. - Caricare la griglia sul supporto di campionamento per l'esame del campione di microscopia elettronica.
- Spettroscopia di assorbimento a raggi X in situ 3 , 4 , 19 , 20
- Caricare il catalizzatore in un mortaio e macinare in polvere da meno di 100 polvere utilizzando un pestello. Caricare le polveri fini in un set di stampi e premere con le dita per formare una wafer autoportante.
- Caricare un campione di ~ 100 mg nel supporto del campione.
- Posizionare il contenitore del campione in un reattore di tubi di quarzo e pretrattare il campione riducendolo in 50 cm 3 / min 3% H 2 / He.
- Dopo il raffreddamento a RT, sigillare il tubo e trasferirlo sulla linea di sincrotrone per raccogliere i dati XAS.
- Diffrazione radiografica in situ 19 , 20
- LoAggiungete il catalizzatore in un mortaio e macinate in polvere di 100 mesh utilizzando un pestello.
- Premere un wafer sottile usando un set di dieci diametri standard di 7 mm.
NOTA: Il set di matrici contiene un pezzo femminile e pezzi maschi superiori e inferiori.- Fissare il pezzo maschio inferiore alla parte femminile. Caricare il campione sulla superficie lucidata della parte inferiore. Fissare il pezzo maschio superiore e trasferire il set di matrici nella fase di campionamento della pressa. Premere con forza appropriata.
- Scaricare la fetta e trasferirla nella tazza di ceramica dello stadio specializzato del campione (vedi tabella dei materiali ). Sigillare il palco e fissarlo sulla tabella di campionamento del beamline.
- Ridurre il campione scorrendo e portando la temperatura a 550 ° C. Raccogliere i dati in situ di diffrazione dei raggi X sotto il 3% H flusso di gas 2 / He a 550 ° C e dopo il raffreddamento a RT 20.
Risultati
La selettività del propilene rispetto al tempo per i catalizzatori di Pt e Pt-Cu misurati ad una conversione iniziale di propano di circa il 20% è riportata in figura 1A . Il catalizzatore Pt ha una selettività iniziale del 61%, che aumenta a circa l'82% con il tempo in corrente mentre il catalizzatore si disattiva per 1 ora. Il catalizzatore Pt-0.7Cu mostra una migliore selettività iniziale di propilene del 72%. Per i catalizzatori Pt-2.3Cu e Pt-7.3...
Discussione
I catalizzatori Pt-Cu preparati in questo lavoro contengono nanoparticelle uniformi di circa 2 nm, simili a catalizzatori eterogene qualificati per applicazioni industriali. Tutti i precursori Pt e Cu formano strutture bimetalliche, a differenza di particelle monometalliche separate. Questa interazione bimetallica e le piccole dimensioni delle particelle vengono realizzate con un attento controllo delle procedure di sintesi. Il processo di impregnazione utilizza il forte assorbimento elettrostatico (SEA) tra gli ioni me...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla School of Chemical Engineering, Purdue University. L'uso della Source Advanced Photon è stato sostenuto dal Dipartimento per l'Energia dell'Ufficio Ufficio delle Scienze Energetiche di base, con il contratto n. DE-AC02-06CH11357. Le operazioni di MRCAT, beamline 10-BM sono supportate dal Dipartimento dell'energia e dalle istituzioni membri di MRCAT. Gli autori riconoscono inoltre l'uso di beamline 11-ID-C. Ringraziamo Evan Wegener per l'assistenza sperimentale con la XAS.
Materiali
| Name | Company | Catalog Number | Comments |
| 1" quartz tube reactor | Quartz Scientific | Processed by glass blower | |
| drying oven | Fisher Scientific | ||
| calcination Furnace | Thermo Sciencfic | ||
| clam-shell temperature programmed furnace | Applied Test System | Custom made | |
| propane dehydorgenation performance evaluation system | Homemade | ||
| gas chromatography | Hewlett-Packard | Model 7890 | |
| TEM grid | TedPella | 01824G | |
| pellet press | International Crystal Lab | 0012-8211 | |
| die set | International Crystal Lab | 0012-189 | |
| Linkam Sample Stage | Linkam Scientific | Model TS1500 | |
| copper nitrate trihydrgate | Sigma Aldrich | 61197 | |
| tetraammineplatinum nitrate | Sigma Aldrich | 278726 | |
| ammonia | Sigma Aldrich | 294993 | |
| silica | Sigma Aldrich | 236802 | |
| isopropyl alcohol | Sigma Aldrich | ||
| balance | Denver Instrument Company | A-160 | |
| spatulas | VWR | ||
| ceramic and glass evaporating dishes, beakers | VWR | ||
| heating plate | |||
| kimwipe papers | |||
| mortar and pestle | |||
| quartz wool | |||
| Swagelok tube fittings |
Riferimenti
- Sattler, J. J., Ruiz-Martinez, J., Santillan-Jimenez, E., Weckhuysen, B. M. Catalytic dehydrogenation of light alkanes on metals and metal oxides. Chem. Rev. 114 (20), 10613-10653 (2014).
- Childers, D. J., et al. Modifying structure-sensitive reactions by addition of Zn to Pd. J Catal. 318, 75-84 (2014).
- Gallagher, J. R., et al. Structural evolution of an intermetallic Pd-Zn catalyst selective for propane dehydrogenation. Phys. Chem. Chem. Phys. 17, 28144-28153 (2015).
- Wu, Z., et al. Pd-In intermetallic alloy nanoparticles: highly selective ethane dehydrogenation catalysts. Catal Sci Technol. 6 (18), 6965-6976 (2016).
- Siddiqi, G., Sun, P., Galvita, V., Bell, A. T. Catalyst performance of novel Pt/Mg (Ga)(Al) O catalysts for alkane dehydrogenation. J Catal. 274 (2), 200-206 (2010).
- Passos, F. B., Aranda, D. A., Schmal, M. Characterization and catalytic activity of bimetallic Pt-In/Al 2 O 3 and Pt-Sn/Al 2 O 3 catalysts. J Catal. 178 (2), 478-488 (1998).
- Virnovskaia, A., Morandi, S., Rytter, E., Ghiotti, G., Olsbye, U. Characterization of Pt, Sn/Mg (Al) O catalysts for light alkane dehydrogenation by FT-IR spectroscopy and catalytic measurements. J Phys Chem C. 111 (40), 14732-14742 (2007).
- Jablonski, E., Castro, A., Scelza, O., De Miguel, S. Effect of Ga addition to Pt/Al 2 O 3 on the activity, selectivity and deactivation in the propane dehydrogenation. Appl Catal A. 183 (1), 189-198 (1999).
- Galvita, V., Siddiqi, G., Sun, P., Bell, A. T. Ethane dehydrogenation on Pt/Mg (Al) O and PtSn/Mg (Al) O catalysts. J Catal. 271 (2), 209-219 (2010).
- Shen, J., Hill, J. M., Watwe, R. M., Spiewak, B. E., Dumesic, J. A. Microcalorimetric, infrared spectroscopic, and DFT studies of ethylene adsorption on Pt/SiO2 and Pt-Sn/SiO2 catalysts. J Phys Chem B. 103 (19), 3923-3934 (1999).
- Silvestre-Albero, J., et al. Microcalorimetric, reaction kinetics and DFT studies of Pt–Zn/X-zeolite for isobutane dehydrogenation. Catal Lett. 74 (1-2), 17-25 (2001).
- Sun, P., Siddiqi, G., Vining, W. C., Chi, M., Bell, A. T. Novel Pt/Mg (In)(Al) O catalysts for ethane and propane dehydrogenation. J Catal. 282 (1), 165-174 (2011).
- Sun, P., Siddiqi, G., Chi, M., Bell, A. T. Synthesis and characterization of a new catalyst Pt/Mg (Ga)(Al) O for alkane dehydrogenation. J Catal. 274 (2), 192-199 (2010).
- Okamoto, H. . Phase diagrams for binary alloys. Desk handbook. , (2000).
- Hamid, S. B. D. -. A., Lambert, D., Derouane, E. G. Dehydroisomerisation of n-butane over (Pt, Cu)/H-TON catalysts. Catal Today. 63 (2), 237-247 (2000).
- Veldurthi, S., Shin, C. -. H., Joo, O. -. S., Jung, K. -. D. Promotional effects of Cu on Pt/Al 2 O 3 and Pd/Al 2 O 3 catalysts during n-butane dehydrogenation. Catal Today. 185 (1), 88-93 (2012).
- Han, Z., et al. Propane dehydrogenation over Pt-Cu bimetallic catalysts: the nature of coke deposition and the role of copper. Nanoscale. 6 (17), 10000-10008 (2014).
- Komatsu, T., Tamura, A. Pt 3 Co and PtCu intermetallic compounds: promising catalysts for preferential oxidation of CO in excess hydrogen. J Catal. 258 (2), 306-314 (2008).
- Gallagher, J. R., et al. In situ diffraction of highly dispersed supported platinum nanoparticles. Catal Sci Technol. 4 (9), 3053-3063 (2014).
- Ma, Z., Wu, Z., Miller, J. T. Effect of Cu content on the bimetallic Pt-Cu catalysts for propane dehydrogenation. Catal Struct React. 3 (1-2), 43-53 (2017).
- Richards, R. . Surface and nanomolecular catalysis. , (2006).
- Jiao, L., Regalbuto, J. R. The synthesis of highly dispersed noble and base metals on silica via strong electrostatic adsorption: I. Amorphous silica. J Catal. 260 (2), 329-341 (2008).
- Miller, J. T., Schreier, M., Kropf, A. J., Regalbuto, J. R. A fundamental study of platinum tetraammine impregnation of silica: 2. The effect of method of preparation, loading, and calcination temperature on (reduced) particle size. J Catal. 225 (1), 203-212 (2004).
- Wei, H., et al. Selective hydrogenation of acrolein on supported silver catalysts: A kinetics study of particle size effects. J Catal. 298, 18-26 (2013).
- Ertl, G., Knözinger, H., Schüth, F., Weitkamp, J. . Handbook of heterogeneous catalysis: 8 volumes. , (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon